
研究背景:
糖尿病慢性伤口常因高黏度渗出液流动性差,难以被传统敷料有效清除,导致伤口长期潮湿、炎症难消、感染频发,显著延迟愈合。现有敷料多针对低黏度液体设计,忽视生物流体黏度差异,且“自泵型”敷料存在排水效率低、结构不合理等问题,临床清创手段又易引发二次创伤。因此,亟需开发一种可高效单向排出高黏渗出液、减轻炎症并促进组织再生的新型敷料。

针对上述问题,中国科学院理化技术研究所王树涛和时连鑫团队提出了一种粘性生物流体自泵式有机水凝胶,旨在解决伤口上的粘稠生物体液流动性差、炎症持续、抗血管生成及伤口愈合延迟。通过三维模板润湿转移(3D-WET)聚合工艺制备的自泵式有机水凝胶敷料(SPD),其内部具有定向排列的水合水凝胶通道,可高效引流粘稠体液并加速糖尿病创面愈合。疏水-亲水层的不对称润湿性与有序排列的含水水凝胶通道,使粘稠液体能单向高效地从伤口排出,避免过度水化和炎症刺激。有机凝胶层可附着于伤口周边皮肤,从湿润伤口区域剥离,避免对新生组织造成二次损伤。以糖尿病大鼠模型为例,SPD可显著降低约70.8%的炎症反应,提升约14.3%的真皮重塑效率,并将伤口愈合时间缩短约三分之一(相较于商用敷料3M Tegaderm水胶体薄膜敷料)。本研究为开发针对粘稠性慢性创面的新一代功能性敷料提供了重要启示。该文章于2024年3月29日以《A Viscous-Biofluid Self-Pumping Organohydrogel Dressing to Accelerate Diabetic Wound Healing》为题发表于《Advanced Materials》(DOI: 10.1002/adma.202401539)。
(1)自泵式有机水凝胶敷料(SPD)具有取向水合水凝胶通道
本研究提出了一种三维润湿转移(3D-WET)策略,用于制备集成自泵式有机水凝胶敷料(SPD)。通过疏水玻璃盖板和超亲水铝基板构成的三维模板,诱导油包水乳液中的有机凝胶和水凝胶前驱体发生转移。有机凝胶前驱体通过疏水作用转移到玻璃盖板表面,形成致密平坦的疏水层(图1d、e);而水凝胶前驱体则通过亲水作用聚集在铝基板表面,形成粗糙多孔的亲水层。经过10 min诱导后,通过紫外光聚合固定前驱体层,最终形成由疏水有机凝胶层、亲水水凝胶层和排列整齐的含水水凝胶通道构成的SPD(图1a、c)。该SPD可单向高效排出不同粘度的粘稠渗出液,显著加速糖尿病创面愈合。不同粘度液体通过SPD时呈现三种状态:不通过、部分通过和完全通过(图1b)。
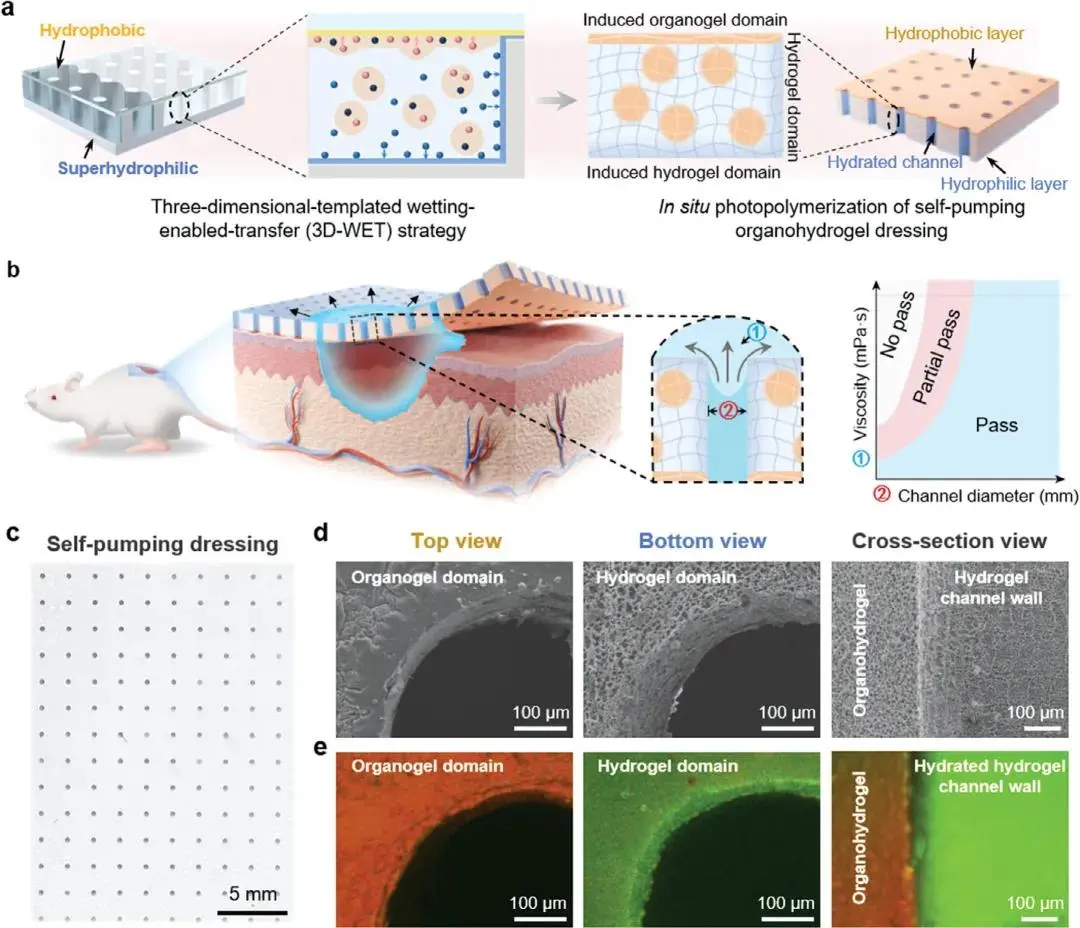
图1.具有定向水合水凝胶通道的自泵式有机水凝胶敷料(SPD)示意图,用于引流粘稠体液。a)采用一步法三维模板润湿转移(3D-WET)策略结合乳液界面聚合,制备具有定向水合水凝胶通道的SPD。b)示意图展示SPD如何通过排列有序的水合水凝胶通道引流粘稠生物体液并加速糖尿病创面愈合。c)具有取向水合水凝胶通道的SPD光学图像。d)SEM图像与e)CLSM图像展示脱水(d)/水合(e)状态SPD的表面结构
(2)SPD的快速单向排水性能
为了验证单向流体排水性能,建立了体外物理模型,通过紫外线监测染色水滴在含水或脱水通道的SPD有机凝胶层或水凝胶层中的动态排空过程。如图2a所示,当液滴接触有机凝胶层时,它被泵送至水凝胶层,并留下未润湿表面;而接触水凝胶层时,液滴沿水凝胶层迅速润湿,被有机凝胶层阻挡。对于脱水SPD,无论接触有机凝胶层或水凝胶层,液滴均无法被泵送(图2b)。进一步的动态接触角监测表明(图2c),水合SPD中,液滴在0.12秒内可完全穿透有机凝胶层,但在10秒内无法穿透水凝胶层;而脱水SPD中,液滴在10秒内无法穿透任何层。因此,含水合通道的SPD展示出显著的单向引流速度(41.67 μL·s⁻¹),远超所有双面自泵伤口敷料以及部分商用吸收敷料,如纱布13.16 μL·s⁻¹、泡沫0.20 μL·s⁻¹(图2d)。总之,水合通道的SPD表现出超越先前报道的自泵伤口敷料和商用吸收敷料的快速、单向、连续排水性能。
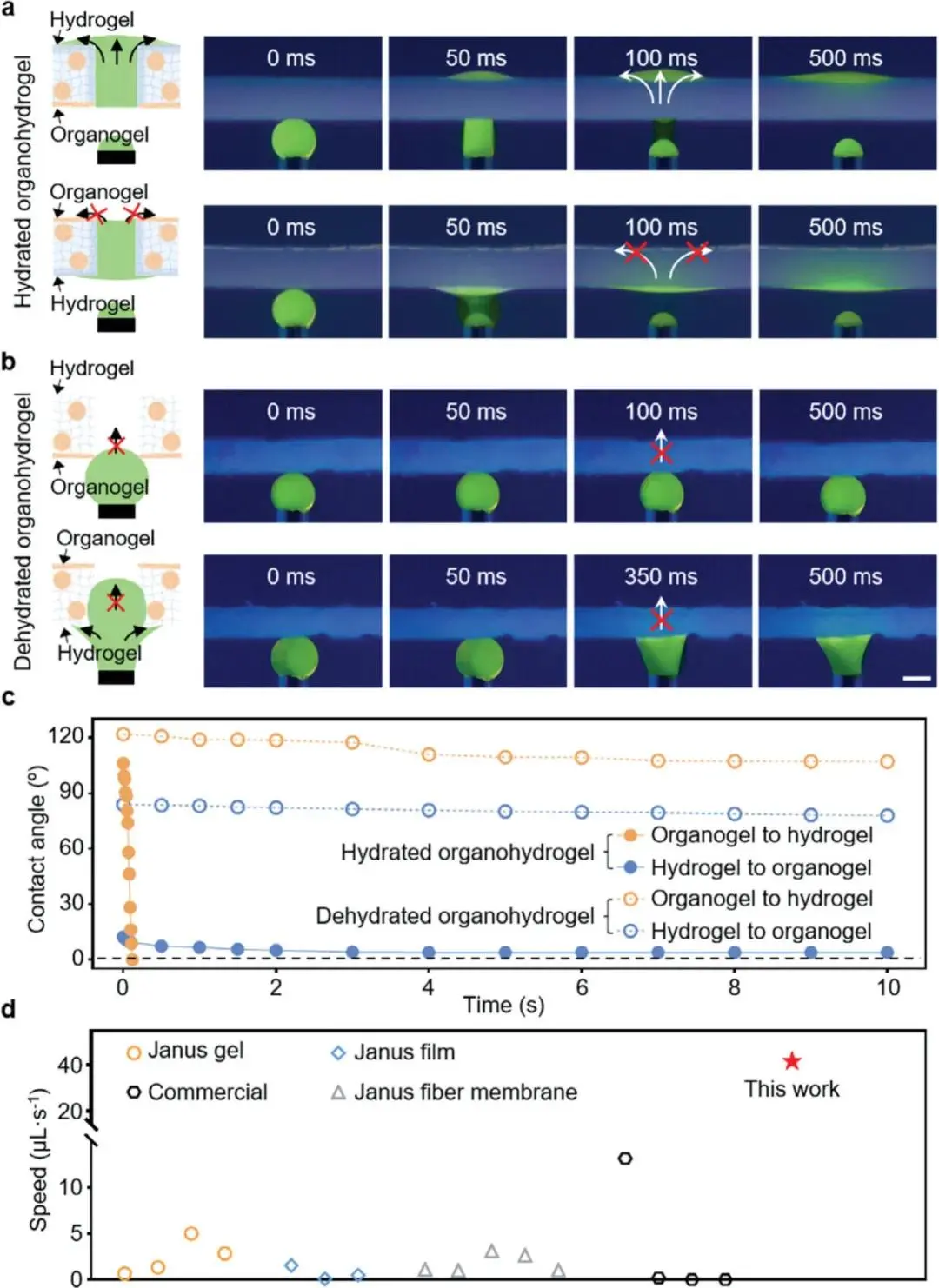
图2.SPD实现的快速单向流体引流。a)经紫外辐射作用下,水合SPD引流染色液滴(标记为1%荧光素钠)的示意图与实景图。b)染色液滴(标记为1%荧光素钠)与脱水SPD在紫外线照射下相互作用的示意图与实景图。白色箭头表示液滴在敷料中的流动方向。c)分别对应于水合SPD和脱水SPD中疏水性有机凝胶层与亲水性水凝胶层的动态水接触角。d)本研究与其他已报道的Janus伤口敷料及商用敷料在排水速度方面的对比
(3)SPD高效疏导粘性流体
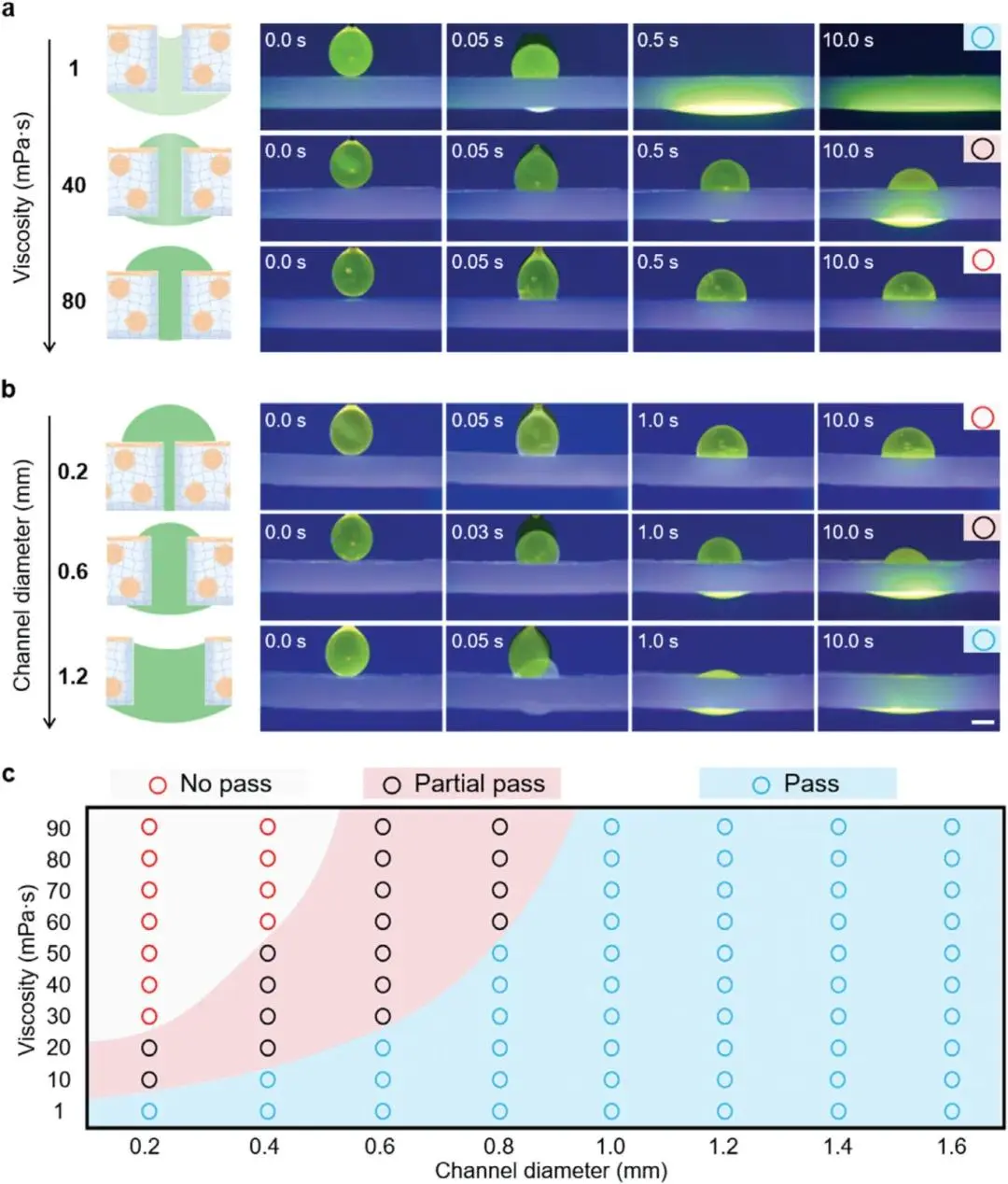
图3.不同通道直径的SPD排液装置在多种粘度下排出的粘性流体状态。粘性液滴(标记为1%荧光素钠)在a)1、40、80 m Pa·s粘度下的排水过程演示,以及b)直径为0.2、0.6、1.2 mm的含水通道SPD在紫外辐射下的排水过程。c) 不同粘度下粘性流体经不同通道直径SPD排液的三种状态总结
(4)SPD在干燥/湿润组织上的粘附特性
理想的伤口敷料应能在伤口周围皮肤上牢固粘附,并在更换时从新生组织上轻松剥离,避免二次创伤。实验中,干燥猪皮模拟伤口周围皮肤,湿润猪皮模拟新生组织。剪切测试中,SPD在干燥猪皮上的抗拉强度为1.92±0.31 kPa,约为湿润猪皮的48倍(图4a,b)。在90°剥离测试中,SPD在干燥猪皮上的剥离能(5.52±0.56 J·m⁻²)为湿润猪皮的5倍(图4c,d)。SPD在干燥猪皮上展现出强于湿润表面的抗剪切力与抗剥离力,确保在干燥皮肤上固定牢固,并可无痛剥离新生湿润组织(图4e)。此外,交替干湿模式的离体猪皮模型显示,剥离力在干燥区域较高,湿润区域时显著下降,随后在干燥区域再次增加(图4f)。因此,该材料能在干燥皮肤上稳定粘附,同时从湿润新生组织上轻松剥离,有效避免二次创伤。

图4.SPD在干燥/湿润组织上的粘附性能。a)干燥和湿润猪皮上SPD的代表性时间-应力曲线。b)剪切强度。c)分别展示干湿猪皮上SPD的代表性时间-应力曲线与剥离能。e)示意图说明敷料更换过程。f)展示交替干燥/湿润模式下猪皮上SPD的代表性时间-应力曲线
(5)SPD促进糖尿病大鼠模型伤口愈合的体内评估
为了评估SPD对粘稠液体排出及伤口愈合的影响,采用链脲佐菌素(STZ)诱导糖尿病大鼠,建立伤口模型,并分别使用SPD、HD、NT作为治疗组(图5a)。结果表明,第2天SPD组创面清洁,仅有少量透明渗出物,而HD、3M、NT组创面积聚黄色渗出物,导致伤口浸渍(图5b)。第8天,SPD组伤口面积已达到其他组第12天的水平,愈合时间缩短约1/3,且第12天开放性伤口面积显著小于其他组(图5c)。通过Masson三色染色法分析,SPD组在第6天和第12天的创面愈合状态最优,表现为创缘闭合、胶原密度增加、上皮化增强(图5d)。具体来看,第6天SPD组开放伤口率(29.8%)显著低于其他组(HD组,而SPD组再上皮化率(97.3%)显著高于其他组(HD组。SPD组的胶原沉积率(14.7%)也显著高于其他组(HD组。第12天,SPD组的开放伤口率(9.7%)明显低于其他组(HD组,且SPD组的胶原沉积率(28.8%)显著高于其他组(HD组(图5f)。这些结果表明,SPD能够加速糖尿病创面愈合,促进上皮化和胶原沉积,降低开放性创面率。
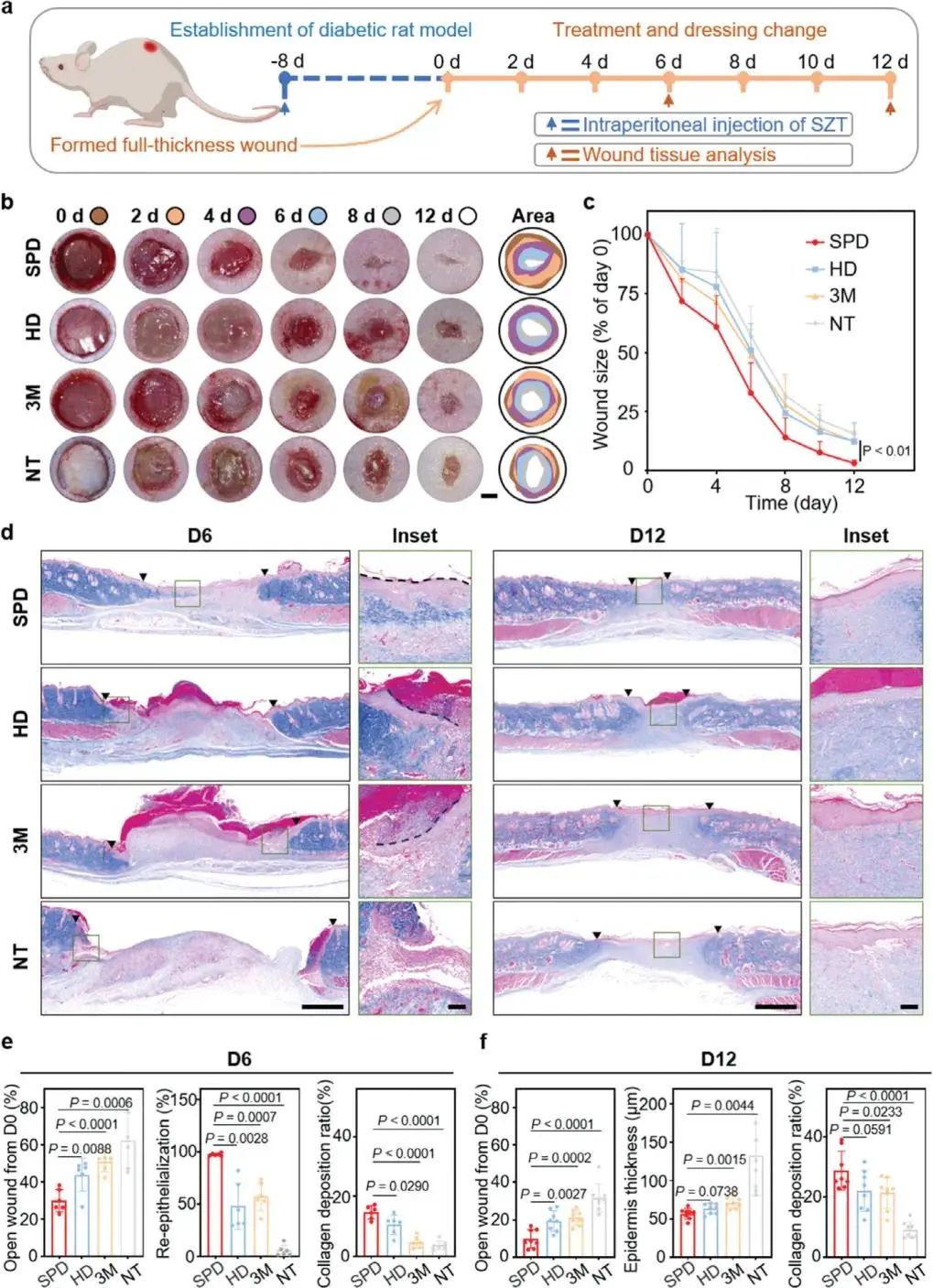
图5.SPD在体内促进糖尿病伤口愈合。a)评估不同敷料愈合性能的设计示意图。b)代表性光学图像:分别展示自泵式有机水凝胶敷料(SPD)、均质有机水凝胶敷料(HD)、3MTegaderm水胶体薄敷料(3M)及未处理组(NT)在12天治疗期间的伤口愈合过程。c)创伤后12天伤口尺寸统计分析。d)第6天(左)与第12天(右)Masson染色伤口样本代表性图像。e)伤口愈合量化指标:以伤口面积占初始伤口百分比表示(相对于第0天),上皮化百分比及第6天胶原沉积比值。f)创面闭合量化:以开放创面百分比表示相较于第0天的情况,以及第12天表皮厚度与胶原沉积比值
(6)SPD促进糖尿病创面愈合的机制研究
巨噬细胞在伤口愈合过程中起着重要作用,最初呈现促炎型(M1),随后转为抗炎型(M2)以促进修复。通过免疫荧光染色技术评估了第6天各组的M1型和M2型巨噬细胞表型(图6a)。SPD组的M1标志物iNOS阳性面积(4.3 ± 0.9%)显著低于其他组(HD组,而M2标志物Arg-1阳性面积(16.9 ± 3.9%)显著高于其他组(图6e,f)。在第12天,SPD组的白细胞介素-6(IL-6)阳性面积(0.8 ± 0.6%)显著低于其他组(图6g),而血小板内皮细胞粘附分子-1(CD31)阳性面积(1.0 ± 0.4%)显著高于其他组(HD组(图6h)。此外,SPD组毛囊数量显著增多,与未损伤皮肤相似,表现出较好的伤口上皮化和真皮重塑(图6d)。SPD组通过有效引流粘稠的生物液,促进巨噬细胞从M1型向M2型转化,缩短了炎症阶段,进一步加速了上皮化、胶原沉积和血管生成,从而加速糖尿病创面愈合(图6i)。

图6.糖尿病大鼠伤口的免疫荧光染色分析。a)第6天伤口的iNOS(红色)和Arg-1(绿色)免疫荧光染色。b–d)第12天伤口处IL-6(红色)、CD31(红色)和CK14(红色)的免疫荧光染色。e)iNOS与f)Arg-1相对阳性面积定量分析。g)IL-6与h)血管密度相对阳性面积定量分析。i)SPD加速糖尿病创面愈合机制示意图
本研究开发了一步式3D-WET聚合工艺,设计出具有定向水合水凝胶通道的自泵式有机水凝胶敷料(SPD)。该SPD具有快速单向排水特性(排水速率高达41.67 μL·s⁻¹),并能高效排出高粘度液体(粘度高达90 mPa·s),将液体从疏水性有机凝胶层导出至亲水性水凝胶层。该理性设计策略为清除棘手的粘稠渗出物、防止过度皮肤浸渍提供了有效途径,从而促进伤口愈合。此外,SPD的易剥离特性不会对新生组织造成二次损伤。高效引流伤口过量粘稠渗出物可促进巨噬细胞极化,进而加速上皮化、血管生成及胶原沉积,最终加速糖尿病伤口愈合进程。通过界面设计与液体管理相结合,为长期存在的临床伤口粘液问题提供了可行解决方案。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

