
糖尿病性骨病导致骨量持续流失、骨折风险增加和骨愈合延迟,严重影响患者生活质量。其根本原因在于高血糖诱导的慢性炎症、氧化应激和糖基化终产物积聚,破坏了免疫稳态,使巨噬细胞向促炎M1型极化,成骨与血管生成功能受损,传统植骨和人工支架无法逆转这一恶劣微环境,亟需能同时“抗炎+促骨”的新策略。

针对上述问题,北京大学刘燕、王存玉、中国科学院罗聃以及华中科技大学龚士强团队受生物矿化启发,在M2型巨噬细胞来源的小细胞外囊泡(M2EV)表面原位生长磷酸钙纳米晶体,构建M2EV@CaP纳米杂合体;该矿化层既充当物理屏障,显著提升囊泡储存、抗降解与循环稳定性,又提供钙磷离子库,可在炎症酸性微环境智能释放,协同M2EV的免疫调节信号,实现“抗炎-促骨”双重增效。体外实验证实其在高糖炎症条件下能显著抑制M1极化、促进干细胞成骨分化;进一步将M2EV@CaP载入水凝胶,用于糖尿病大鼠颅骨缺损,获得明显优于天然M2EV的骨再生疗效,为糖尿病骨缺损治疗提供了稳定、高效、可转化的新方案。该文章于2025年10月1日以《Calcium Phosphate Nanoparticle-Immobilized Macrophage-Derived Extracellular Vesicle Nanohybrid Facilitates Diabetic Bone Regeneration》为题发表于《Advanced Materials》上(DOI: 10.1002/adma.202509410)。
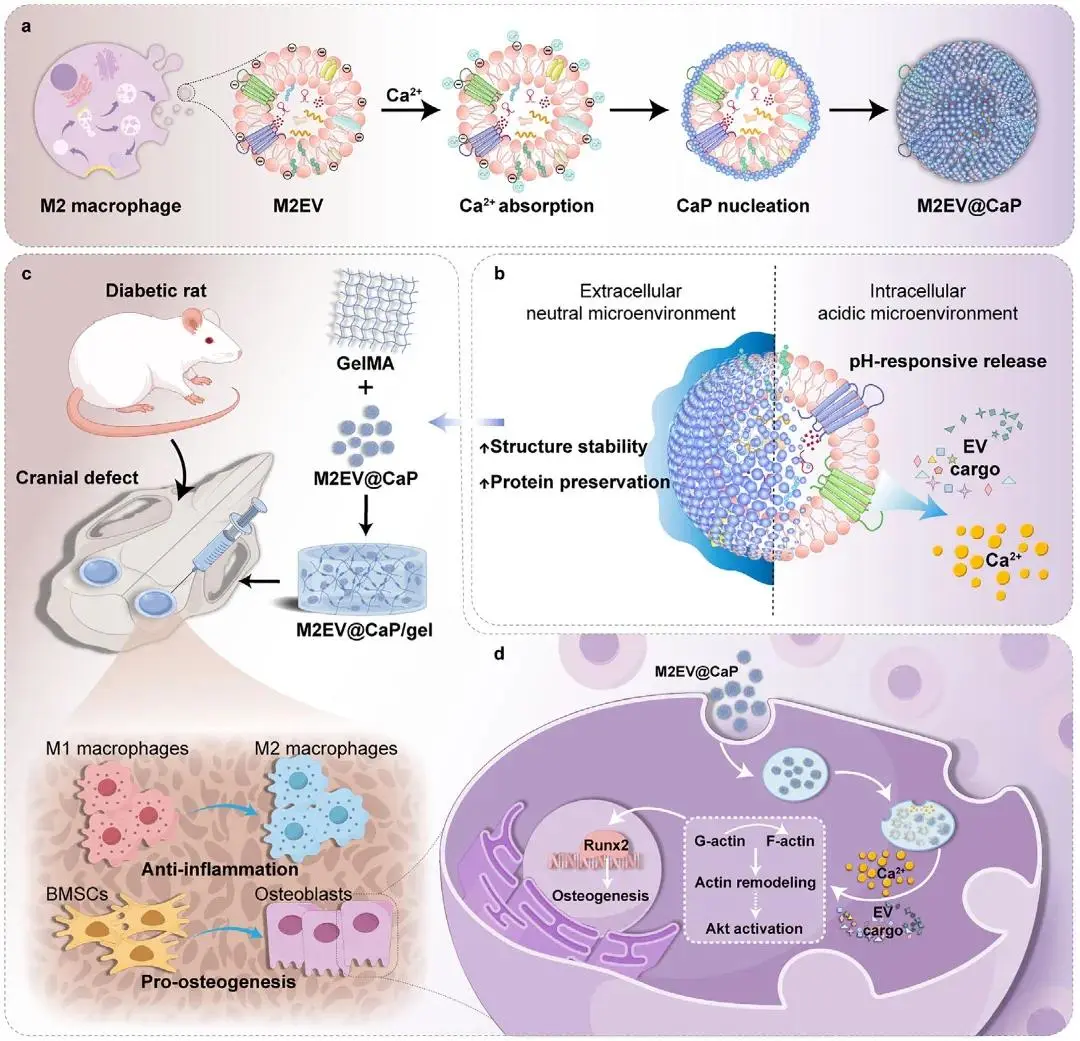
研究示意图
(1)M2EV@CaP的制备和表征
首先图1a 给出整体流程示意图:M2EV 在富钙 DMEM 中通过静电吸附触发原位矿化。随后图1b 的 TEM 显示,2 h 时囊泡仍保持典型杯状轮廓但表面明显粗糙;延长至 4 h 则因过度沉积出现聚集,故后续实验统一采用 2 h 方案。图1c 的 EDS 元素映射进一步验证,Ca、P、O 在囊泡表面均匀共存,Ca/P 原子比≈1:1,确证 CaP 壳层形成。与此对应,图1d 的 DLS 测得粒径由 130.6 ± 8.8 nm 增至 197.5 ± 13.2 nm;图1e 的 AFM 力曲线表明弹性模量从 1.85 GPa 跃升至 4.35 GPa,提示机械稳定性显著增强。图1f 的 Zeta 电位由 −23.8 mV 升至 −20.4 mV,反映表面电荷因矿化而改变。图1g 的 FTIR 在 500–600 与 1000–1100 cm⁻¹ 出现 P–O 振动峰,同时保留 1500–1600 cm⁻¹ 的 C–O 峰,TGA 测得有机质占比约 30%,共同证明有机-无机杂化结构。为评估储存稳定性,图1h–k 将样品于 4 °C 放置 7 d:TEM 显示 M2EV 膜破裂并聚集,DLS 出现 <100 nm 与 >1000 nm 双峰,平均粒径增至 241.2 ± 42.6 nm,且 EV 标志蛋白表达下降;而 M2EV@CaP 仍呈完整球形,粒径仅轻微增至 216.2 ± 15.6 nm,Alix、TSG101、CD63、CD9 水平与新鲜样品相当,表明矿化壳有效抑制降解。最后,图1l–n 在 pH 6.0、37 °C 条件下模拟酸触发:TEM 显示 16 h 矿化壳几乎完全消失,DLS 粒径回降至 117.0 ± 7.7 nm;钙离子释放曲线表明 4 h 内释放率 >90%,而中性 pH 下不足 10%,从而证实 M2EV@CaP 具备优异的储存稳定性与酸响应控释性能。
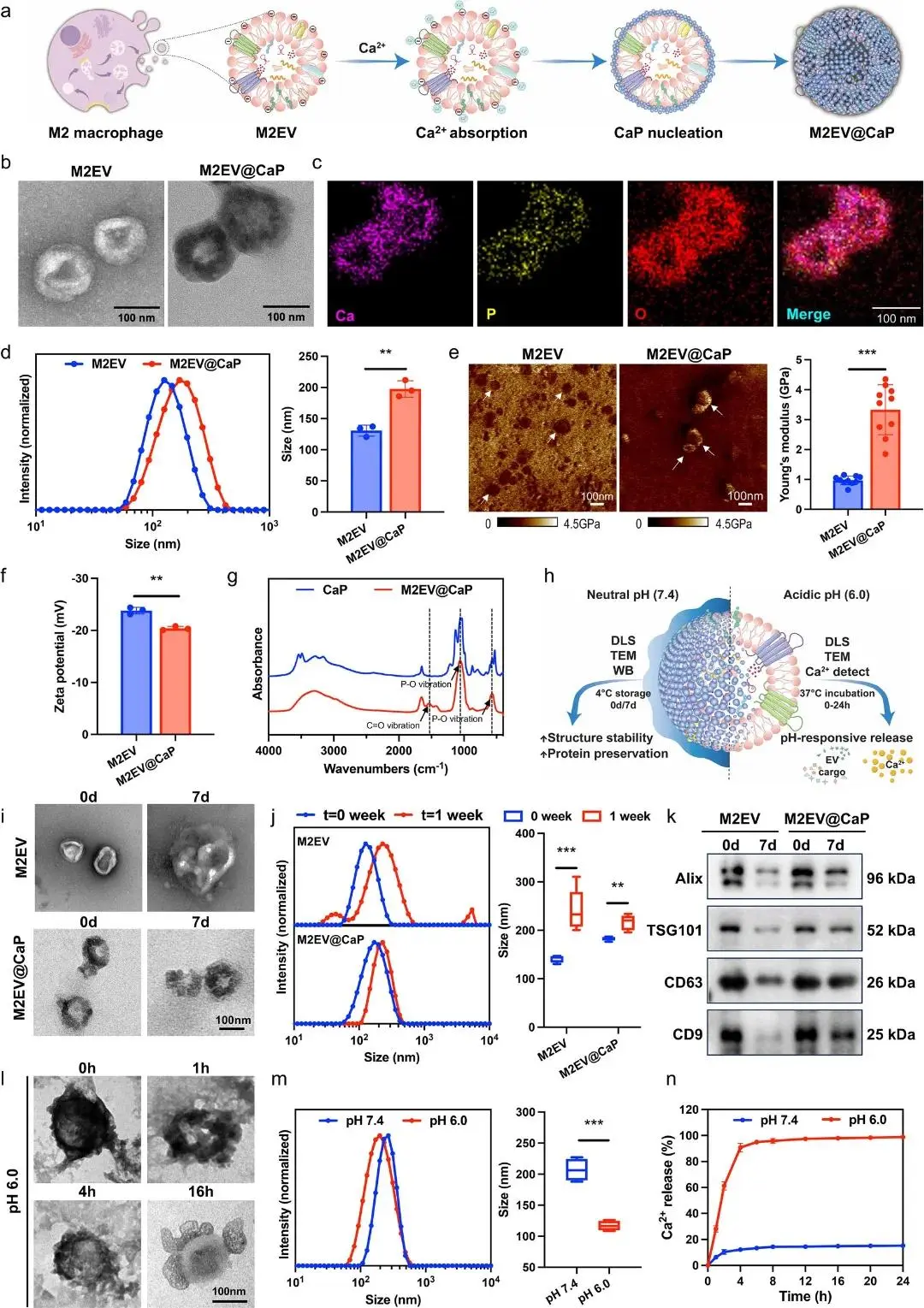
图1. M2EV@CaP的制备和表征。a)M2EV@CaP的合成过程的示意图;;b)M2EV(阴性染色)和M2EV@CaP(未染色)的代表性TEM图像;c)M2EV@CaP的元素图谱分析; d)显示M2EV和M2EV@CaP的粒度分布(左)和平均直径(右)的DLS;E)M2EV和M2EV@CaP的杨氏模量图和半定量比较;f)M2EV和M2EV@CaP的Zeta电位;g)CaP和M2EV@CaP的FTIR光谱; h)用于评估M2EV@CaP的稳定性和pH响应性释放行为的实验设计的示意图;i) 在4 ℃下储存一周之前和之后的M2EV(负染色)和M2EV@CaP(未染色)的代表性TEM图像;j)在4 ℃下储存一周之前和之后M2EV(上)和M2EV@CaP(下)的DLS曲线和平均粒度;k)细胞外囊泡标记蛋白的表达水平;I)在pH 6.0的PBS中孵育不同时间点的M2EV@CaP的代表性TEM图像。m)不同pH条件下M2EV@CaP的粒度分布(左)和平均直径(右)的DLS分析;n)在不同pH值下M2EV@CaP在PBS中的累积Ca2+释放曲线
(2)M2EV@CaP的生物相容性和细胞内转运
图2a的活/死荧光图像显示各组几乎全为绿色活细胞,定量存活率>95%,表明M2EV@CaP无急性毒性;图2b的CCK-8曲线呈时间依赖性上升,7天时与Control、M2EV差异无统计学意义,确认长期增殖活性不受抑制;图2c的共定位分析表明PKH26信号与Lyso-Tracker高度重叠,与Mito-Tracker极少重叠。证实溶酶体为主要转运终点且呈时间依赖性成熟;图2d的TEM低倍可见多处质膜内陷(白色箭头),高倍确认内含电子致密球体(蓝色箭头),提示网格蛋白介导的内吞是主要入口;图2e的EDS面扫显示胞质黑色颗粒Ca、P、O原子比约1:1:4,与无定型磷酸钙特征谱一致,且颗粒周围可见胶原纤维沉积,预示早期生物矿化。综上,M2EV@CaP兼具良好生物相容性与溶酶体依赖的酸响应降解能力,在释放囊泡内容物的同时诱导矿化颗粒形成,为其后续促成骨应用奠定基础。
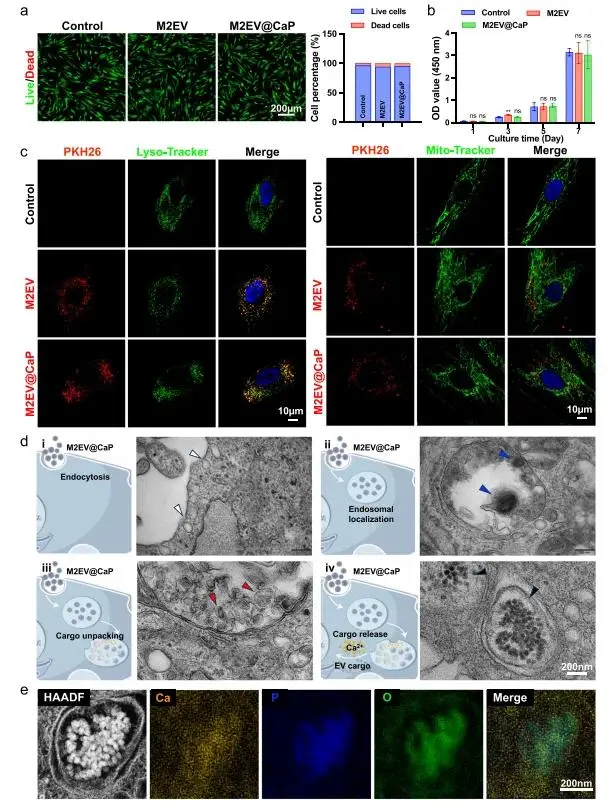
图2.M2EV@CaP的生物相容性和细胞内转运。a)用不同组处理24小时后BMSC的代表性活/死染色图像(左)(对照、M2 EV和M2EV@CaP)及相应的半定量分析(右)。b)CCK-8测定,评估用各组处理后BMSC的增殖;c)用PKH 26标记的M2EV@CaP或M2 EV(红色)孵育6小时后BMSC的代表性荧光图像;)d) M2EV@CaP在BMSC中的细胞内转运的表性的TEM图像;e)用M2EV@CaP处理的BMSC分泌的电子致密颗粒的高角度环形暗场扫描透射电子显微镜(HAADF-STEM)和元素图谱
(3)M2EV@CaP高糖炎症免疫调节与促成骨
图3a示意HG+LPS模拟糖尿病炎症环境,明确后续实验背景。图3b RT-qPCR显示,与单纯HG+LPS刺激相比,M2EV与M2EV@CaP均显著下调IL-6、CCL2、IL-1β mRNA水平,两组间转录差异无统计学意义,提示基础抗炎基因表达趋势一致。图3c Western blot进一步揭示,M2EV@CaP对NOS2、IL-1β、TNF-α、IL-6蛋白的抑制幅度明显大于M2EV,表明矿化外壳在翻译后水平增强抗炎效力。图3d免疫荧光共标NOS2/CD68显示,M2EV@CaP组NOS2阳性信号面积显著缩小,半定量结果与Western趋势吻合,直观证实其更有效地阻断M1表型。图3e流程图示意成骨诱导实验设计,突出炎症-成骨双重压力。图3f qPCR结果表明,M2EV@CaP处理7 d后BMP2、RUNX2、SP7 mRNA表达量约为对照的2.5–3倍,显著优于M2EV组,提示转录层面成骨程序被充分激活。图3g Western blot显示,对应蛋白水平随基因上调而同步升高,且矿化组增幅最大,说明CaP壳协同EV信号放大成骨蛋白合成。图3h ALP染色7 d呈深紫色,ARS染色14 d出现广泛红褐色钙结节,积分光密度定量分别提高2.8倍与3.4倍,直观反映M2EV@CaP在早期酶活与晚期矿化沉积的双重优势。综上,图3a–3h共同证明M2EV@CaP在糖尿病样炎症环境中兼具抑制M1极化与强力促成骨的双重功能。

图3 M2EV@CaP高糖炎症免疫调节与促成骨。a) 高糖下M2EV@CaP调控巨噬极化示意;b) 12 h炎症基因(IL-6、CCL2、IL-1β)表达;c) 24 h M1蛋白Western与定量;d) NOS2/CD68免疫荧光及半定量;e) 成骨高糖炎症下M2EV@CaP促BMSCs成骨示意;f) 7天成骨基因(BMP2、RUNX2、SP7)表达;g) 7天成骨蛋白Western与定量;h) 7 d ALP与14 d ARS染色及半定量
(4)M2EV@CaP通过Ca 2 +-Akt信号调节BMSC成骨分化
图4a以流程图形式概述研究策略:在HG+LPS模拟的糖尿病炎症环境中,系统解析M2EV@CaP促进BMSCs成骨的分子机制,为转录组测序和信号轴验证奠定框架。图4b火山图直观呈现差异基因分布:与M2EV相比,M2EV@CaP组119个基因显著上调(红色)、119个基因下调(蓝色),差异对称且远离中线,提示CaP外壳显著重塑转录谱。图4c KEGG气泡图进一步指出富集最显著的前10条通路,其中PI3K/Akt、黏附、肌动蛋白骨架及钙信号气泡直径最大、颜色最深,表明其与成骨高度相关。图4d共聚焦Fluo-4 AM显示,M2EV@CaP组胞内绿色荧光强度较Control与M2EV提高约2倍,直观证实游离Ca²⁺水平显著升高;图4e流式定量结果与共聚焦一致,平均荧光强度峰值右移,证明Ca²⁺负载具有群体一致性。图4f免疫荧光中,Phalloidin标记的F-肌动蛋白(红色)与ITGA5(绿色)在M2EV@CaP组丝束粗壮、共定位增多,加入BAPTA后荧光明显减弱,表明Ca²⁺可调控骨架重塑与整合素表达;图4h Western blot量化F/G-actin比值由0.45升至0.82,BAPTA回降至0.50,证实肌动蛋白聚合依赖Ca²⁺。图4i显示p-Akt/Akt比值在M2EV@CaP组升高3.1倍,BAPTA预处理将其降至基线,明确Ca²⁺位于Akt上游;图4j PI3K抑制剂LY294002实验表明,BMP2、OCN蛋白显著下调,证明Akt活性是成骨蛋白表达的必要条件。图4k qPCR同步显示BMP2与RUNX2 mRNA在抑制条件下分别下降60%与55%,与蛋白水平一致,验证转录依赖关系;图4l ALP染色可见M2EV@CaP组蓝紫色最深,LY294002处理后染色明显变浅,积分光密度下降50%,进一步说明PI3K/Akt轴介导早期成骨活性。综上,图4a–4l共同构建“Ca²⁺-Akt-骨架重塑-成骨基因”完整证据链,阐明M2EV@CaP通过释放钙离子激活PI3K/Akt信号,从而增强BMSCs成骨分化的核心机制。
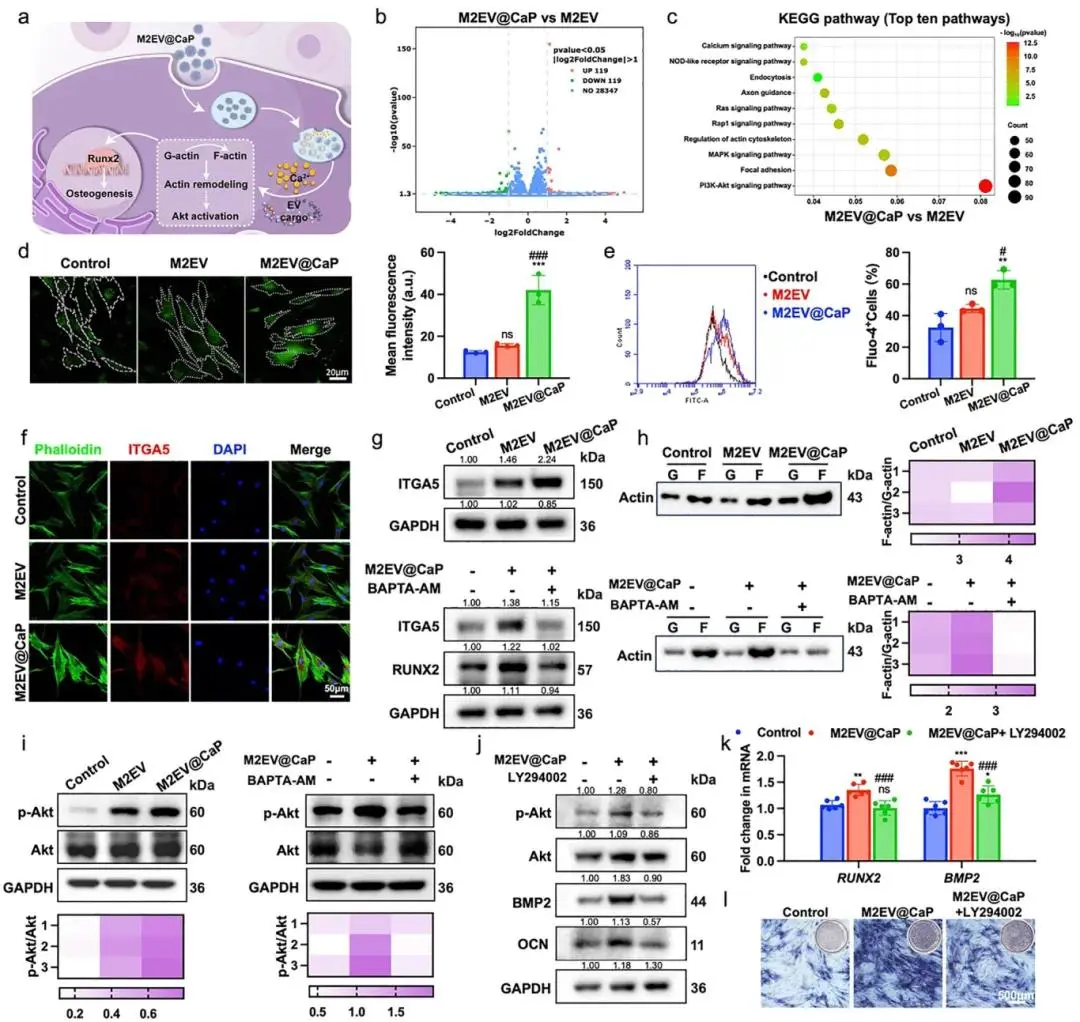
图4 M2EV@CaP通过Ca 2 +-Akt信号调节BMSC成骨分化。a)M2EV@CaP促进BMSC成骨分化的机制的示意图;b)M2EV@CaP和M2 EV组之间差异表达基因的火山图;c)KEGG富集分析,鉴定了M2EV@CaP和M2 EV组之间差异激活的前10个信号通路;d)不同处理3天后BMSC中Fluo-4 AM染色(绿色)的代表性荧光图像和半定量分析;e)不同处理3天后BMSC中Fluo-4 AM荧光的代表性流式细胞术结果和半定量分析;f)F-肌动蛋白的代表性免疫荧光图像(鬼笔环肽,绿色)和ITGA 5(红色)。细胞核用DAPI(蓝色)染色;g)不同处理3天后BMSC中ITGA 5表达的Western印迹分析,以及用或不用M2EV@CaP和BAPTA-AM处理的BMSC中ITGA 5和RUNX 2的表达。h)通差异超离心进行不同处理3天后,以及在用或不用M2EV@CaP和BAPTA-AM处理的BMSC中,肌动蛋白的蛋白质印迹分析;i)不同处理3天后BMSC中p-Akt和总Akt表达的蛋白质印迹和半定量热图;j)用或不用M2EV@CaP和BAPTA-AM处理的BMSC中的成骨相关蛋白表达的Western印迹分析;k)成骨标志物的相对mRNA表达水;l)用或不用M2EV@CaP和LY 294002处理的BMSC的代表性ALP染色图像
(5)用于糖尿病大鼠颅骨缺损修复的M2EV@CaP/凝胶复合材料的工程设计和评价
图5a通过流程图展示了整体策略,其将M2EV@CaP均匀分散于GelMA溶液后,经405 nm紫外光交联,从而形成可注射且原位固化的复合水凝胶,并为后续局部递送奠定技术路线。图5b的SEM低倍图像呈现贯通大孔结构,孔径约为100–200 μm,高倍视野可见矿化囊泡紧密贴附孔壁,由此直观证实粒子成功载入且多孔微结构保持完整。图5c利用PKH26共聚焦三维重构显示,红色荧光均匀布满整个凝胶基质,未见聚集或沉降,该结果说明囊泡在三维网络中稳定分散,并可保障长期均匀释放。图5d的元素分布图表明,Ca信号仅出现在M2EV@CaP/gel组,与C、P重叠良好,EDS谱出现Ca-P特征峰,从而定量验证矿化壳完整保留。图5e的压缩力学测试显示,三组应力-应变曲线几乎重叠,Young’s模量约为8 kPa,表明粒子加入未削弱凝胶本体强度,可满足缺损区早期机械需求。图5f的流变结果表明,存储模量G′全程高于损耗模量Gʺ,且随频率平稳上升,呈现典型弹性固体行为,为血管长入和细胞驻留提供稳定支架。图5g通过时间轴展示,高糖高脂联合低剂量STZ诱导糖尿病,血糖高于16.7 mmol·L⁻¹后行双侧5 mm颅骨缺损,随后原位注射材料,并在4周与8周取样,由此形成完整疗效评价周期。图5h的micro-CT 3D重建可见,8周时M2EV@CaP/gel组缺损区几乎闭合,骨桥连续,而对照组仍见明显孔洞,直观展示修复优势。图5i提供的定量分析指出,BV/TV在4周达到37%,8周升至77%,显著高于M2EV/gel的45%,且Tb.N与BMD同步提升,为疗效提供统计学依据;同期组织学HE显示新生骨板成熟,Masson胶原蓝染致密排列,血管区丰富,证实基质重塑与骨成熟度最优。综上,图5a至图5i形成从凝胶制备、力学性能到糖尿病缺损修复的完整证据链,表明M2EV@CaP/gel兼具缓释、力学稳定与免疫-成骨双功能,显著加速临界骨缺损再生。
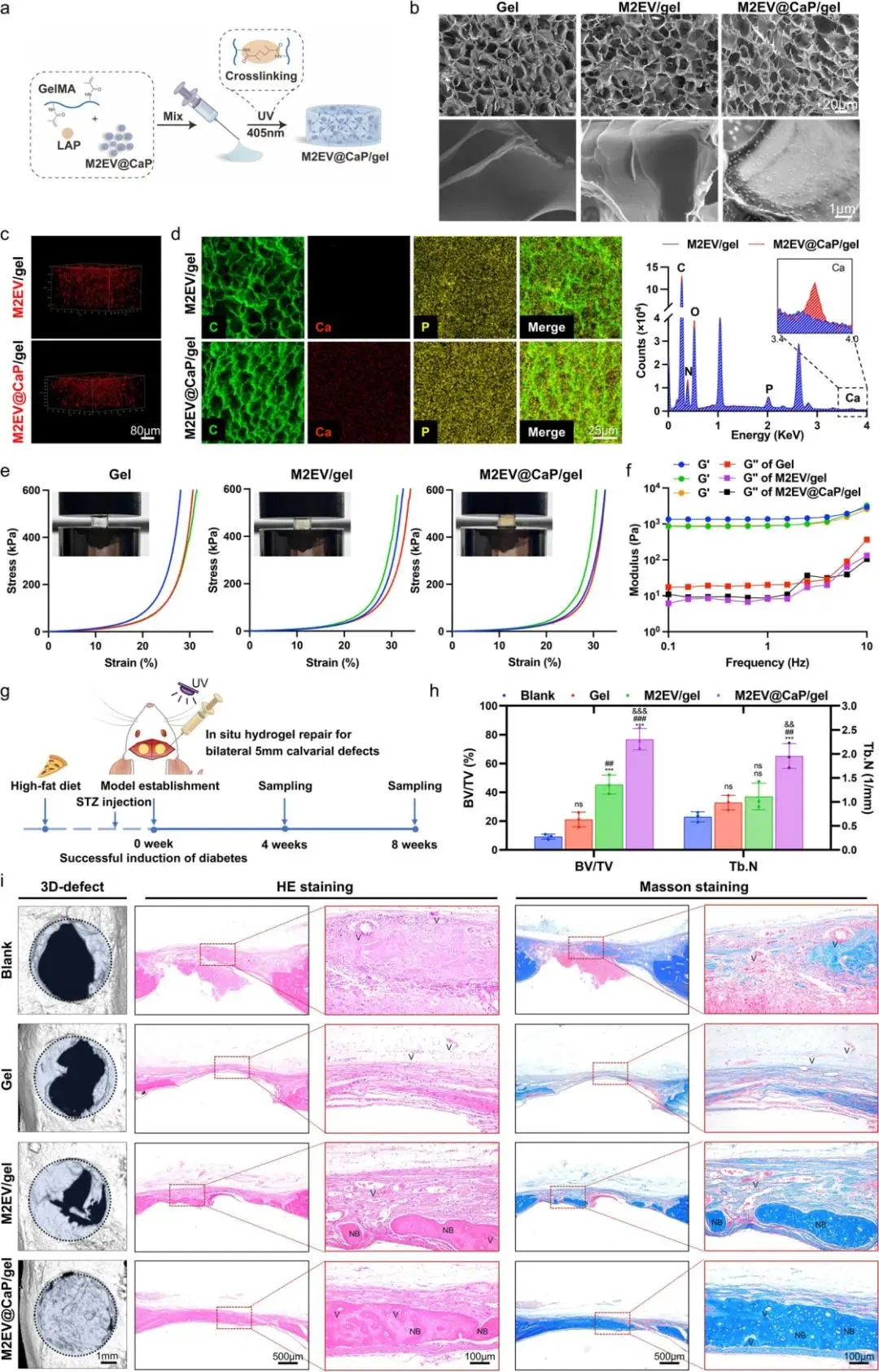
图5 用于糖尿病大鼠颅骨缺损修复的M2EV@CaP/凝胶复合材料的工程设计和评价。a)通过UV交联制备M2EV@CaP/凝胶的示意图;b)凝胶、M2 EV/凝胶和M2EV@CaP/凝胶在不同放大倍数下的SEM图;c)显示PKH 26标记的M2 EV和M2EV@CaP在水凝胶中的分布的3D共聚焦图像。d)显示C、Ca和P元素在M2 EV/凝胶和M2EV@CaP/凝胶中的分布的元素作图,以及相应的EDS光谱e)来自凝胶、M2 EV/凝胶和M2EV@CaP/凝胶的压缩测试的代表性应力-应变曲线。f)流变学分析,显示水凝胶在不同频率下的储能模量(G′)和损耗模量(G ′);g)在糖尿病大鼠中建立颅骨骨缺损模型的实验程序的示意图。h)在8周时基于骨体积分数(BV/TV%)和骨小梁数目(Tb.N)的骨再生的定量分析;ii)代表性的显微CT、HE和Masson三色染色图像显示了术后8周时各组(空白、凝胶、M2 EV/凝胶和M2EV@CaP/凝胶)中的骨再生代表性的显微CT、HE和Masson三色染色图
(6)M2巨噬细胞极化和成骨增强糖尿病性骨再生
图6a 流式检测显示,术后10天各组CD86⁺CD11b⁺ M1比例无统计学差异,20天M2EV@CaP/gel降至23.7%,显著低于M2EV/gel的75.9%,表明其随时间推移持续抑制促炎表型。图6b与图6d定量结果指出,4周RUNX2⁺与ALP⁺细胞在M2EV@CaP/gel组分别达到82%与57%,8周OCN⁺与BMP2⁺面积升至70%与60%,均显著高于其余各组,体现成骨-矿化全程优势。图6c与图6d免疫荧光显示,4周缺损内p-Akt⁺CD90⁺细胞数在M2EV@CaP/gel为51,较M2EV/gel的30进一步提升,表明Akt激活是体内促成骨的关键机制。综上,图6a至图6d共同构建“M1→M2极化-Akt激活-成骨基因上调”完整证据链,阐明M2EV@CaP/gel通过免疫-成骨双重调控显著加速糖尿病骨缺损修复。
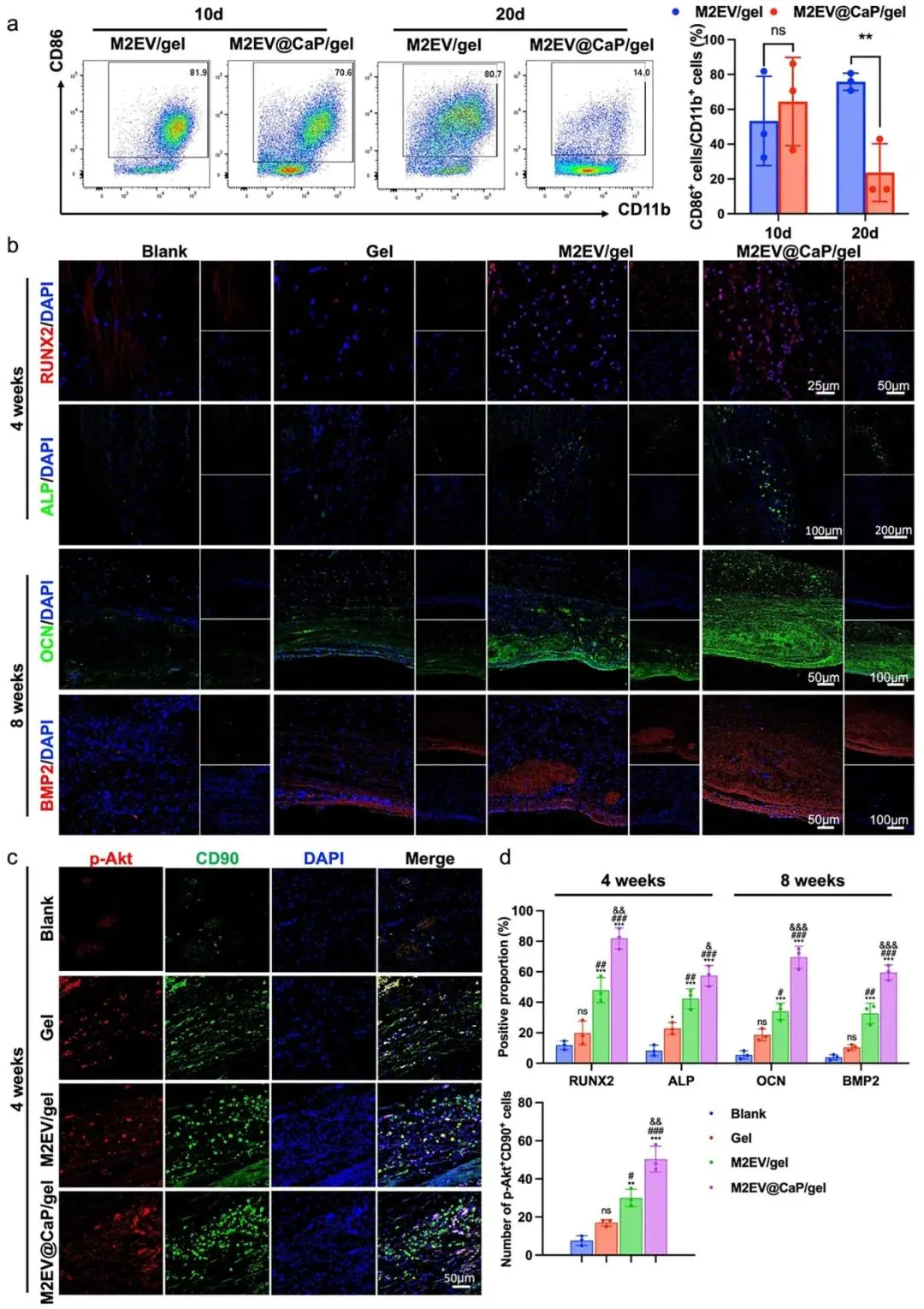
图6 M2EV@CaP通过M2巨噬细胞极化和成骨增强糖尿病性骨再生。a) )在植入后10和20天,对颅骨缺损区域中的CD 86 + CD 11b+细胞进行流式细胞术定量。;b)植入后4周时在颅骨缺损区域中RUNX 2(红色)和ALP(绿色)以及在植入后8周后OCN(绿色)和BMP 2(红色的表达免疫荧光染色图像;c)植入后4周时在颅骨缺损区域中RUNX 2(红色)和ALP(绿色)以及植入后8周OCN(绿色)和BMP 2(红色)的表达免疫荧光染色图像;d)免疫荧光结果的半定量分析
本研究通过模拟自然生物矿化,在M2型巨噬细胞小胞外囊泡(M2EV)表面原位生长磷酸钙纳米晶,构建出稳定性高、可pH响应的M2EV@CaP纳米杂合体。体外高糖炎症模型显示,该杂合体经Ca²⁺–Akt轴信号显著抑制巨噬细胞M1极化并增强骨髓间充质干细胞成骨分化;将其载入水凝胶后,可在糖尿病大鼠颅骨缺损处同步重塑免疫微环境并大幅促进骨再生,为糖尿病骨缺损治疗提供了可转化的胞外囊泡功能化新策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

