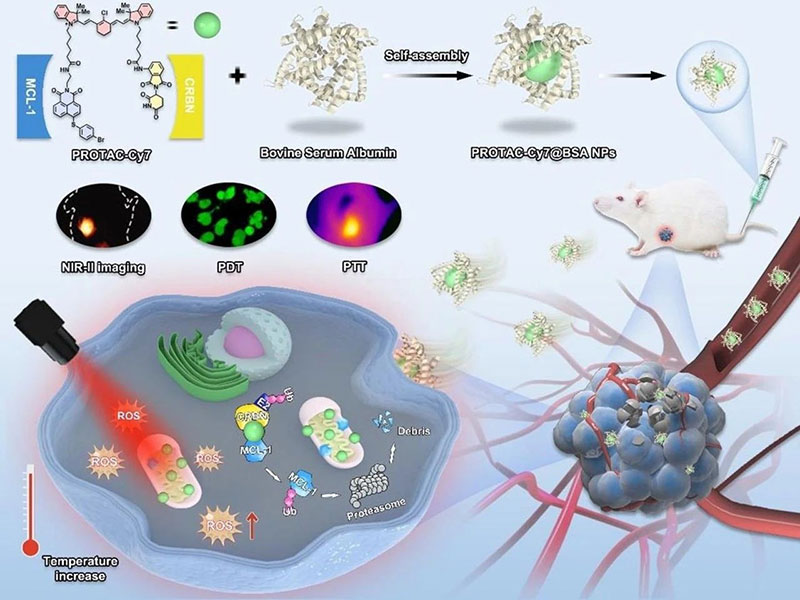
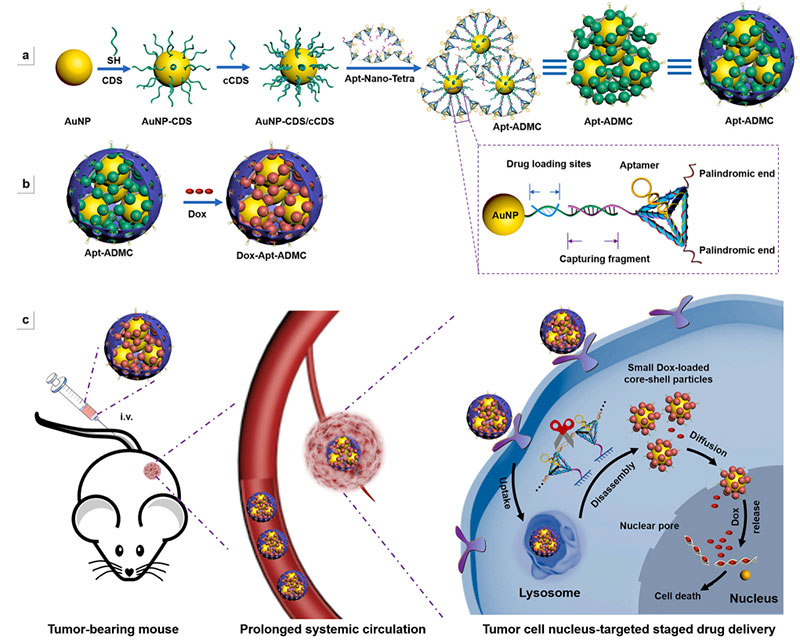
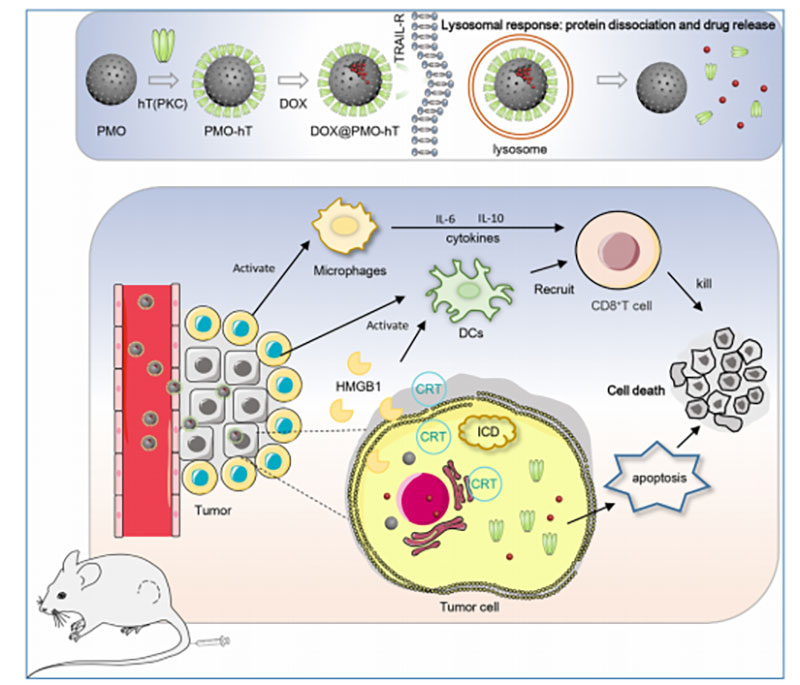
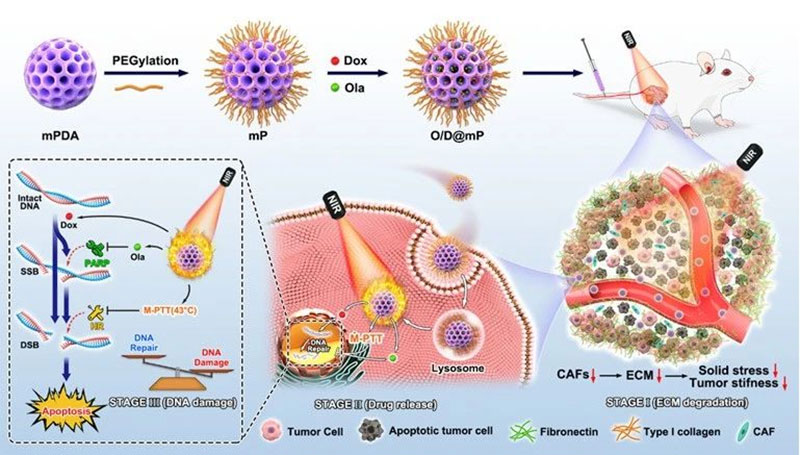
医学纳米材料是一种应用于纳米科技生物医学领域的新型材料,其通过调控纳米级结构和功能,能够在医学领域发挥独特的作用。生物医学纳米材料具有较大的比表面积和可调控的生物相容性、生物可降解性,可以应用于组织工程、药物传递、生物传感和疾病诊断等方面。
-
诊疗—体纳米材料
-
药物载体纳米材料

背景介绍
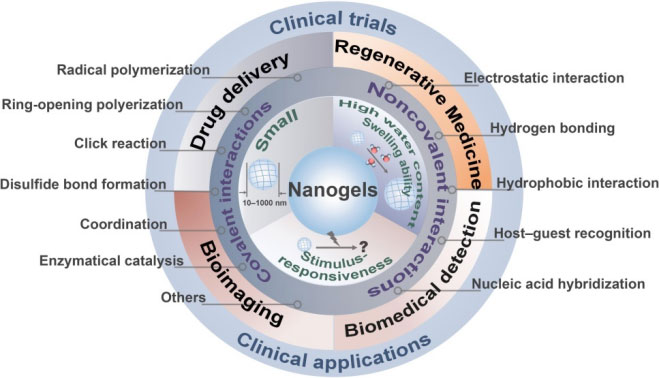
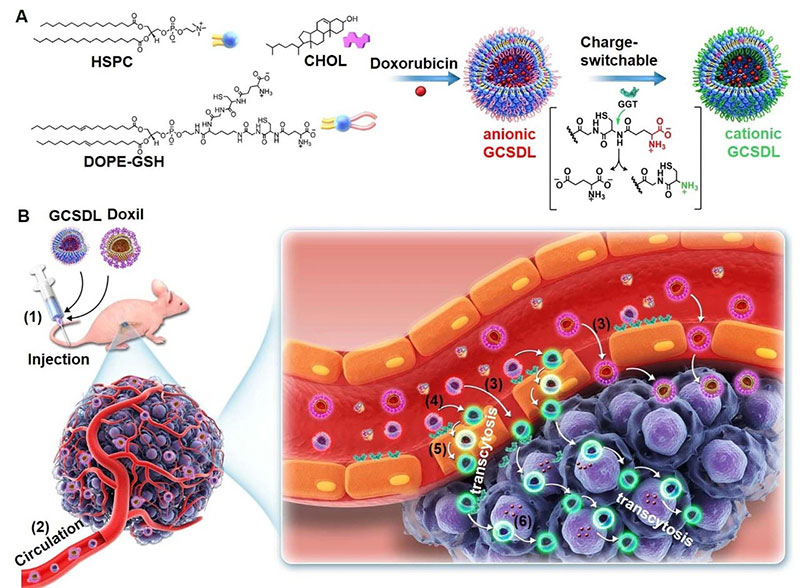
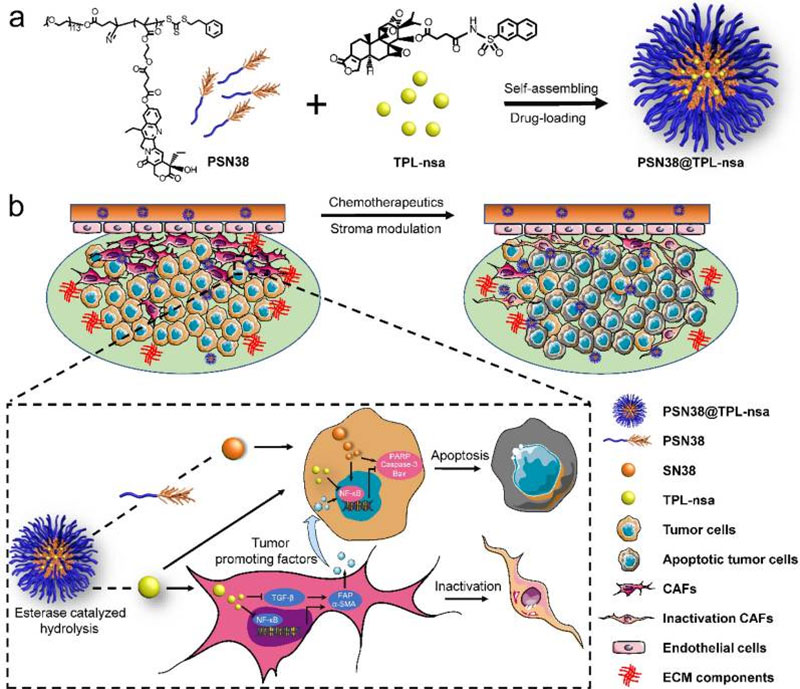
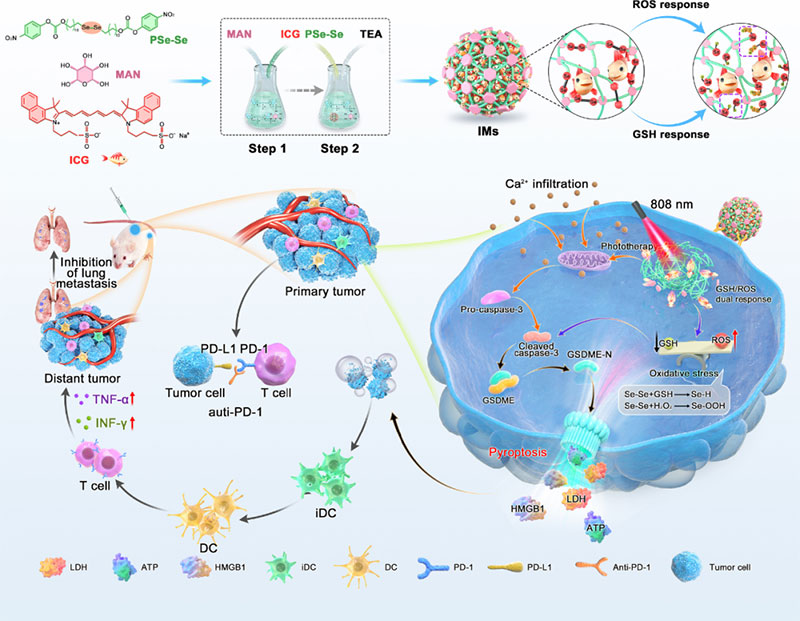
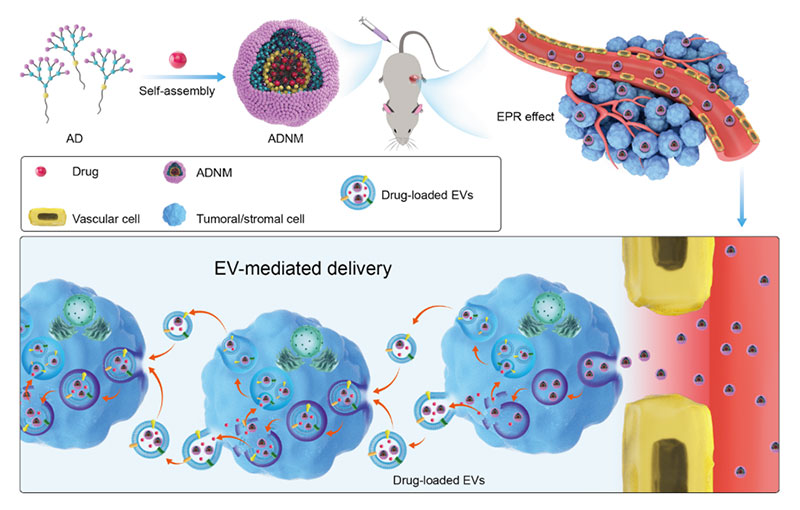
纳米药物载体是指粒径在10~1000nm的一类新型载体,通常由天然或合成高分子材料制成。 其粒径比毛细血管通路远远要小,且具有降低药物毒副作用、提高药物稳定性、缓释控释药物和药物靶向释放等优点。

应用实例
量子点
量子点是具有量子特性的无机半导体纳米晶体,其具有独特的优势: 发光波长范围窄、Stocks 位移大、量子产率高、荧光寿命长、光化学稳定性好、体内循环时间长, 对肿瘤具有很好的被动靶向效果。
1. 作为药物载体, 可以实时跟踪药物在生物体内代谢过程及代谢的具体路径。
2. 与药物共定位, 在药物起作用的位点通过活体成像的方式显示病变部位, 方便实时监测与实现影像引导的治疗。
金/银纳米颗粒
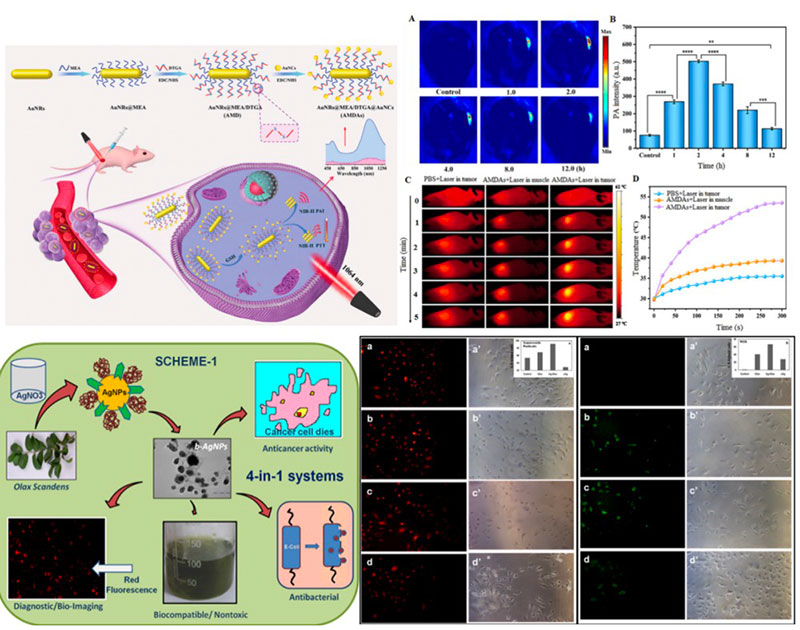
纳米金/银的SERS以及局部表面等离子共振效应性质使其能够高效地区分骨骼和其他组织, 再结合光热/光动力治疗, 易于实现纳米金/银的诊疗一体化。
1. 纳米金能很好地吸收近红外光,并将之转化为热能或者产生单线态氧,是一种优良的光热/光动力试剂。
2. 纳米银可以结合自身的细胞毒性应用于抗肿瘤治疗。
3. 可作为抗肿瘤药物的载体。
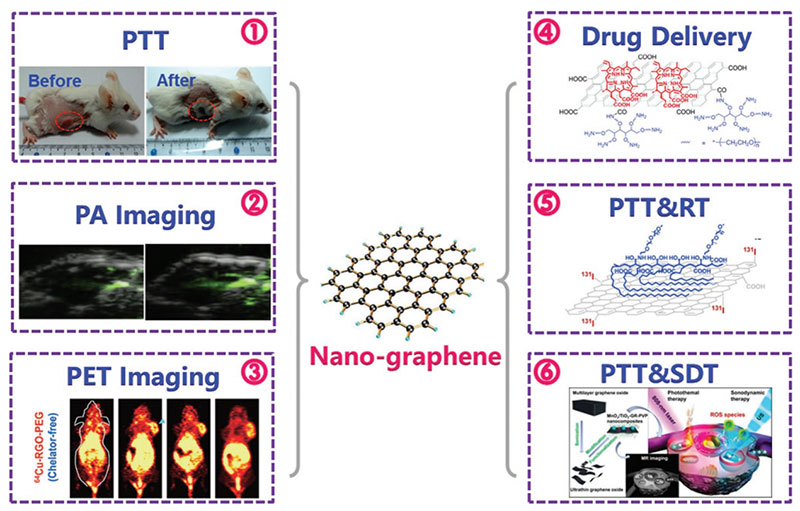
碳纳米管/石墨烯
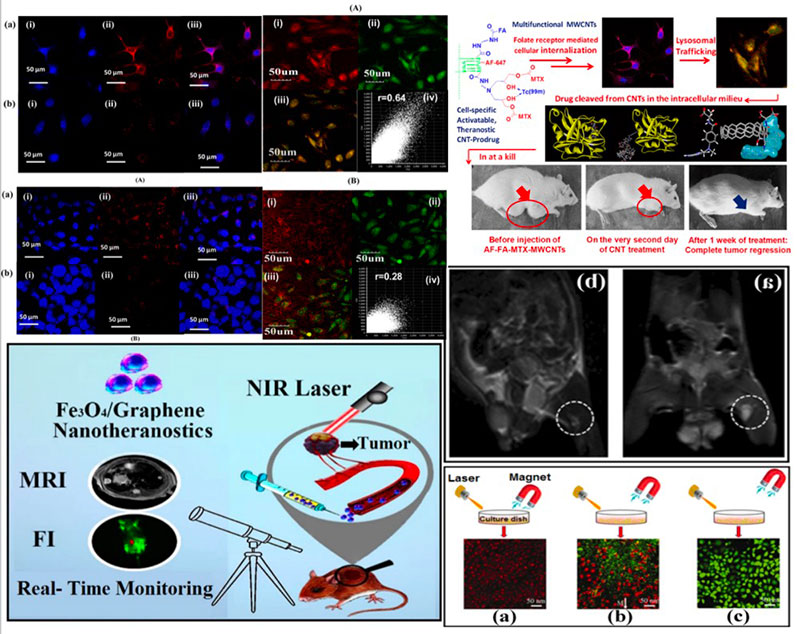
碳纳米管为微管多孔结构,石墨烯为片层结构。这些结构使得碳纳米材料具有优异的电化学及表面化学特性、较高的灵敏度、更宽的温度适应范围及更短的响应时间。
1. 碳纳米管的中空结构能用来包载药物,石墨烯的片层表面有很强的电荷亲和力,也可以负载多种药物。
2. 能高效吸收近红外光,将之转化为热能或传递给周围的 O2 形成 ROS,从而将成像和光热/光动力治疗结合设计成诊疗一体化体系。
介孔纳米材料
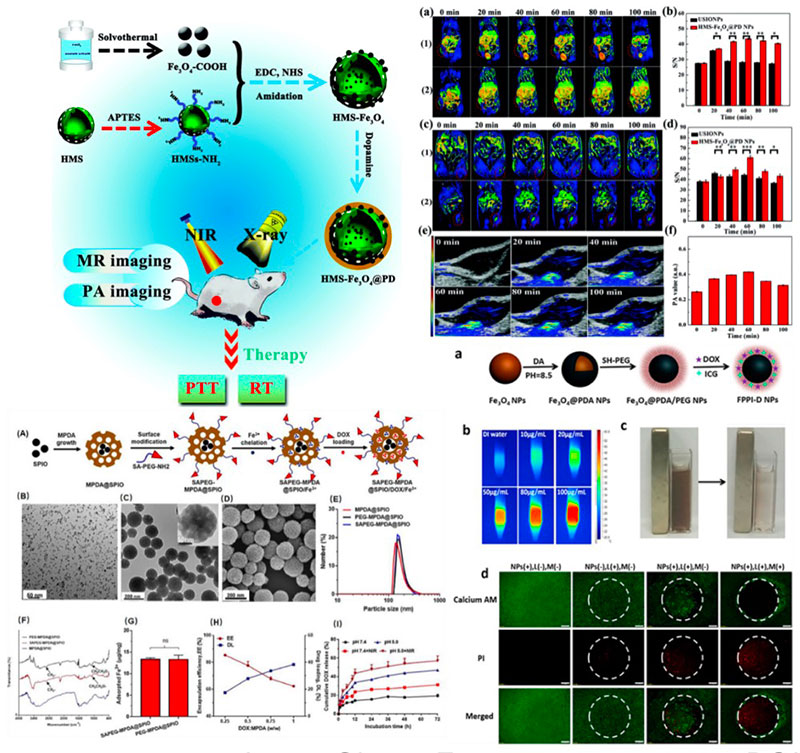
介孔纳米材料是一类多孔中空的纳米颗粒,具有巨大的比表面积和三维孔道结构。多孔中空结构使介孔纳米材料具有较强的物质连通性,各种原子、离子和分子不仅能够与材料表面发生接触,更能深入到材料内部。
1. 介孔硅类纳米颗粒作为诊疗药物的载体具有优良的生物相容性和可降解性,同时也易于同其他功能材料复合。
2. 非硅类介孔纳米材料主要包括过渡金属及其氧化物、硫化物和磷酸盐材料等。部分非硅类材料除了可进行成像示踪功能,还具备良好的药物控释与治疗功能。
纳米脂质体
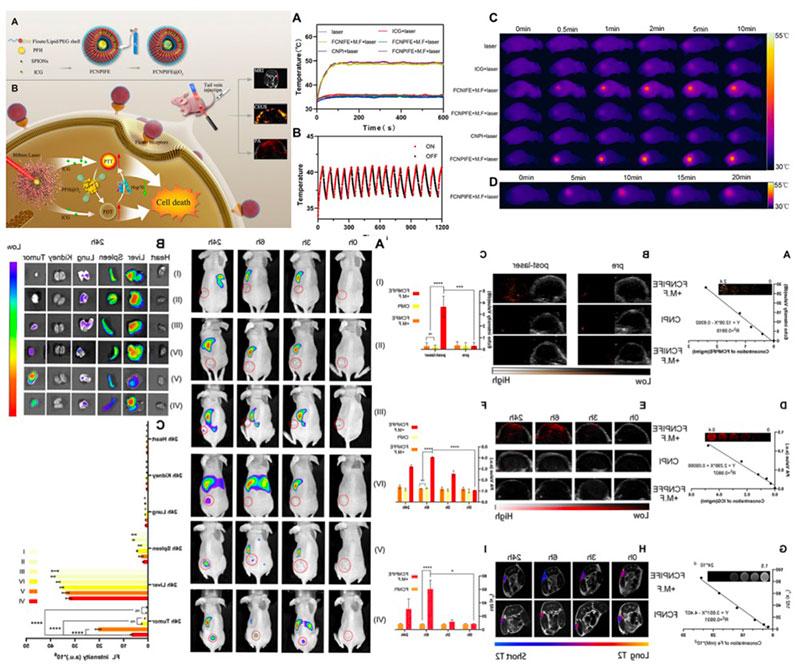
纳米脂质体具有无毒副作用、生物相容性好、制备工艺简单等优点,被广泛应用于基因转染、药物呈递和活体成像等领域。
1. 脂质体是磷脂或胆固醇双分子层所形成的封闭囊泡,具高选择性、低毒性、无免疫原性、易于在生物体内降解等优点。
2. 可在适当的靶点控释药物,有效保护药物稳定性,避免药物被快速降解,显著提高药物治疗指数并降低不良反应。
聚合物胶束
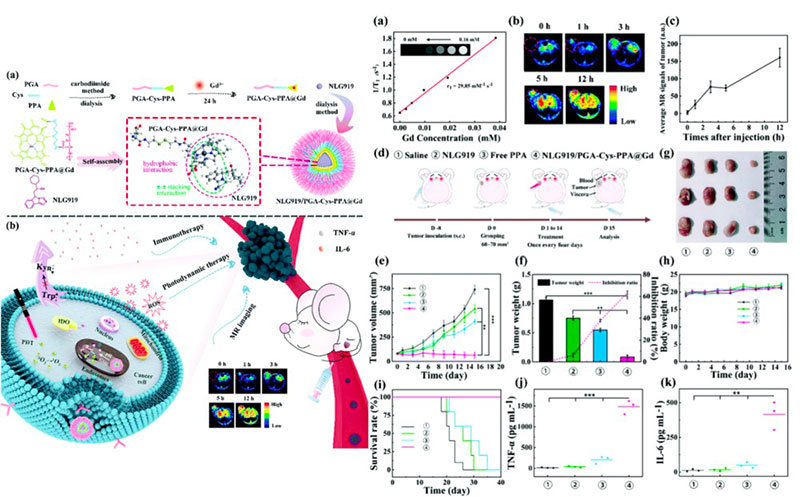
聚合物胶束由两亲性嵌段(疏水和亲水片段)共聚物组成,在水中形成具有内核-外壳的球形共聚物胶束。
1. 自组装形成的具有亲水核心和疏水外层的纳米球,保护亲水性药物递送物并改善其稳定性。
2. 聚合物胶束可以装载各种类型的治疗药物,例如小分子、蛋白质,并已经在临床试验中用于递送癌症治疗药物。
纳米凝胶
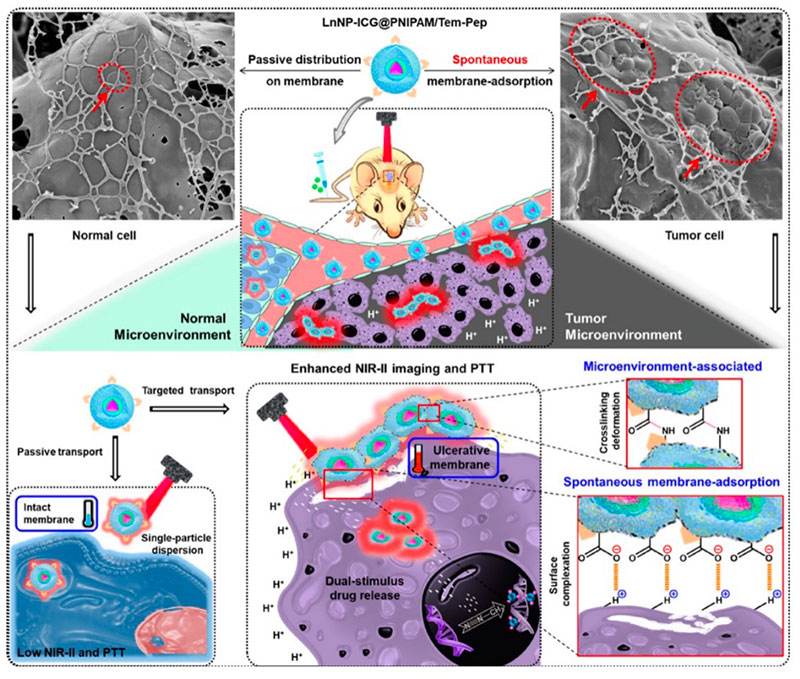
纳米凝胶具有体积小、易于细胞内穿透、血液循环稳定性高、在各种医疗应用中具有良好的生物相容性等优点。
1. 可以封装各种生物活性化合物,如亲水性和亲脂性药物、DNA序列、siRNA、多肽和蛋白质。
2. 根据纳米凝胶的结构和药物之间的相互作用,药物可以通过破坏化学键或降解纳米凝胶基质来释放。
树状大分子
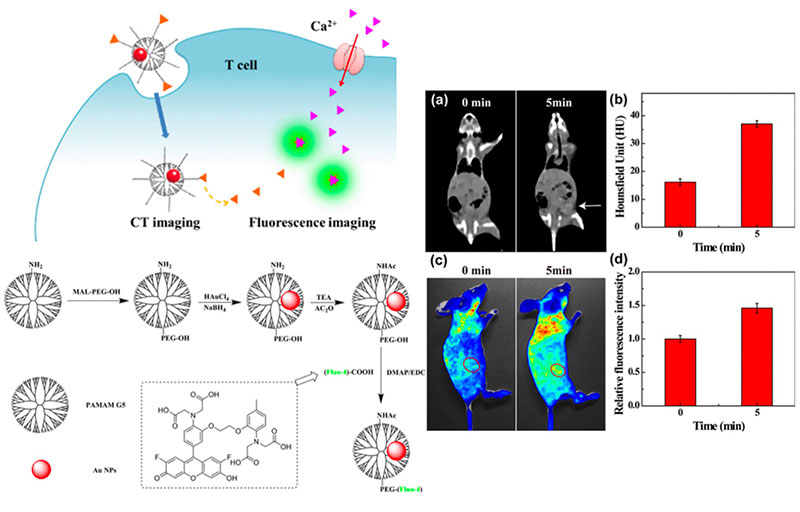
树枝状大分子是一种具有复杂三维结构的超支化聚合物,其质量、尺寸、形状以及表面特性都可以在合成中进行控制。
1. 表面的活性官能团可以将生物分子或荧光基团连接到表面,而药物等有机小分子则可以在内部包裹负载。
2. 其内部空腔结构可以包裹并且稳定金属纳米颗粒及分子药物用于肿瘤成像和肿瘤治疗。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|