
研究背景:
金属离子稳态失衡是癌症治疗的潜在靶点,铜和铁作为关键过渡金属,其异常累积可分别诱发铜死亡和铁死亡两种新型细胞死亡方式。这两种死亡途径依赖氧化应激和金属离子代谢紊乱,与传统细胞死亡机制不同,具有克服肿瘤耐药性和提高治疗选择性的潜力,如何同时激活多条金属依赖死亡通路并精准递送金属离子仍是肿瘤治疗领域亟待突破的关键瓶颈。

针对上述问题,中南大学武明花教授团队设计出一种pH响应型铜基金属-有机框架纳米颗粒Cu-MOF@DPCPX,可在酸性肿瘤微环境中降解释放Cu²⁺。释放的铜离子一方面耗竭谷胱甘肽、诱导脂酰化蛋白聚集和Fe-S簇丢失,触发铜死亡;另一方面通过类芬顿反应产生羟基自由基并下调GPX4,诱导铁死亡;同时引发的线粒体损伤激活线粒体自噬,进一步释放被隔离的铜,形成自我放大的死亡级联。该纳米平台在乳腺癌、肺癌、胰腺癌及胶质瘤等多种小鼠模型中显著抑制肿瘤生长,并重编程免疫微环境(增加CD8⁺T细胞浸润、促进M1型巨噬细胞极化),为基于金属离子的多模式肿瘤治疗提供了新范式。该文章于2025年11月6日以《A Functional Nanocomposite Tri-Activates Cuproptosis,Ferroptosis,and Mitophagy Death Pathway to Oppose Malignancies》为题发表于《Advanced Healthcare Materials》(DOI:10.1002/adhm.202503530)。
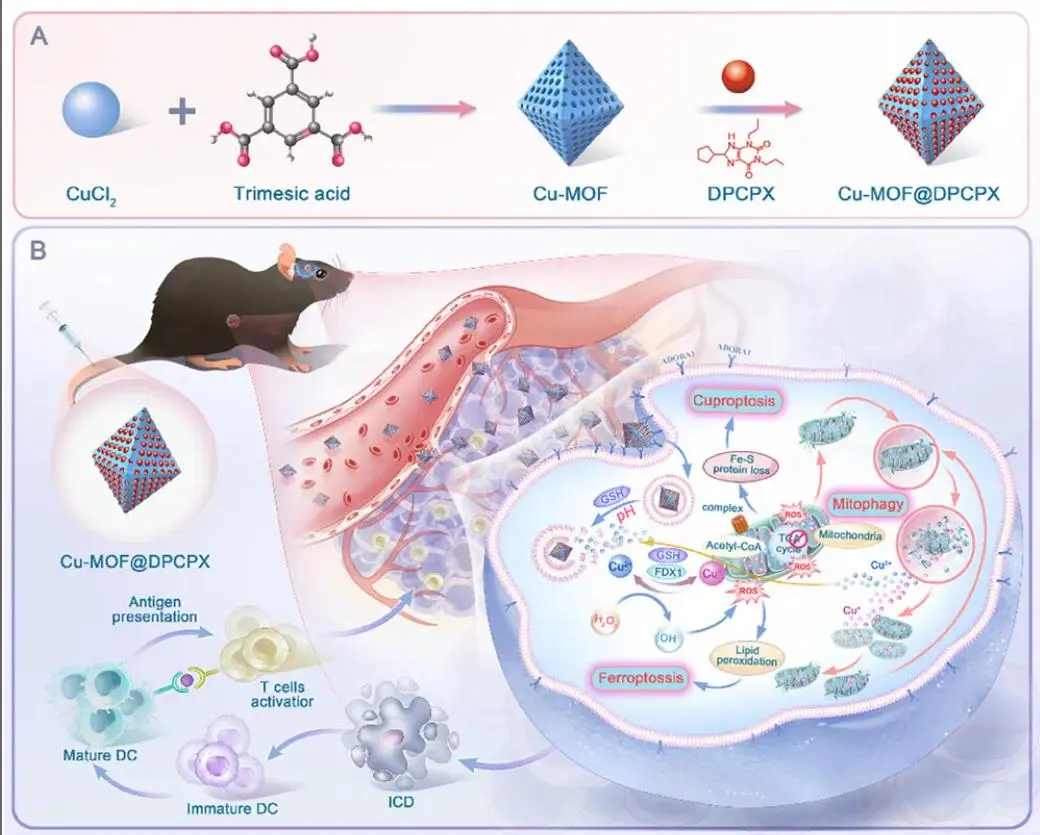
图1.Cu- MOF @ DPCPX 的合成过程示意图及其针对TME激活癌症治疗的三重路径激活策略
(1)Cu-MOF@DPCPX的制备与表征
Cu-MOF@DPCPX呈八面体,TEM测得粒径35.6 nm,PXRD证实DPCPX负载后晶体结构完整;Zeta电位由+30.4 mV降至+19.8 mV,DLS尺寸由35.6 nm微增至38.9 nm(图2B–E)。FTIR在1710、1650 cm⁻¹出现DPCPX的C=O新峰,UV-Vis在276 nm出现DPCPX吸收且蓝移,元素mapping显示Cu、C、N、O均匀分布(图1F–H)。XPS给出Cu 2p、N 1s特征峰,Cu⁺/Cu²⁺面积比40.9/59.1%,N 1s分峰证实C–N与N–H配置,载药量30.7%(图1I–K)。酸响应实验:pH 7.4的PBS中48 h Cu²⁺释放仅15.7%,DPCPX释放64.7%,颗粒保持完整;pH 5.5或pH 5.5+10 mM GSH中24 h骨架碎裂,48 h Cu²⁺释放飙升至90.2%,水合粒径由30.4 nm降至3.1 nm,证实肿瘤微环境特异性崩解与药物释放(图3B–E)。

图2.Cu-MOF@DPCPX表征。(A)合成示意图;(B)TEM图像;(C)PXRD谱图;(D)Zeta电位;(E)水合粒径;(F)FTIR光谱;(G)UV-Vis吸收光谱;(H)元素分布图;(I)XPS全谱;(J)Cu 2p高分辨谱;(K)N 1s高分辨谱
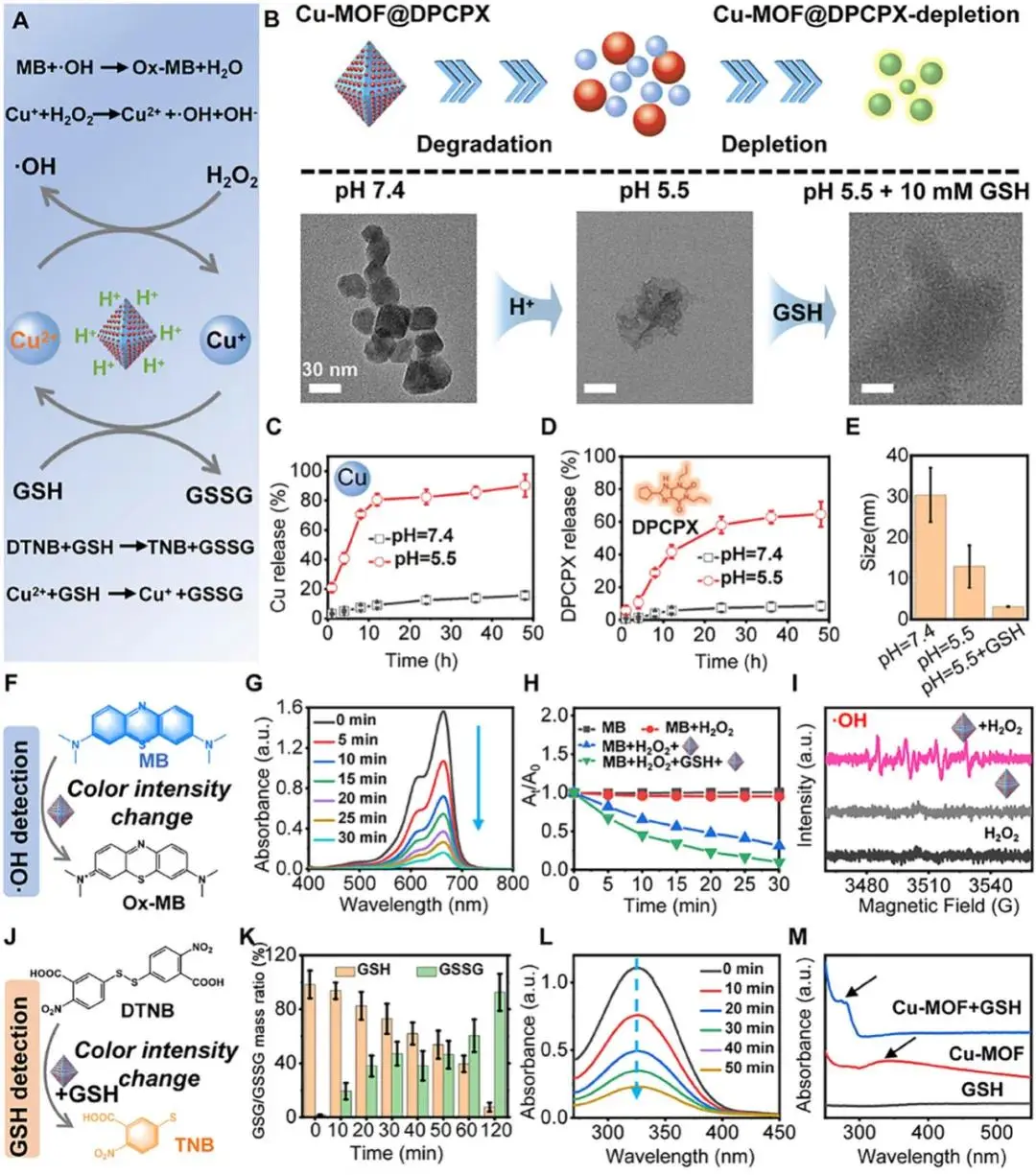
图3.Cu-MOF@DPCPX催化性能。(A)催化机制示意图;(B)pH响应降解及GSH钝化示意图与TEM;(C)Cu释放曲线;(D)DPCPX释放曲线;(E)24 h水合粒径变化;(F)•OH检测示意图;(G)MB吸光度时间曲线;(H)MB对比;(I)DMPO-ESR谱;(J)DTNB-GSH反应示意;(K)GSH/GSSG变化;(L)GSH消耗;(M)UV-Vis谱
(2)Cu-MOF@DPCPX的ROS生成能力
Cu-MOF@DPCPX在GSH与H₂O₂共存下催化亚甲蓝(MB)氧化为oxMB,661 nm吸光度下降,提示·OH生成(图3F);GSH进一步加剧吸光度降低,表明其增强芬顿效应(图3G)。ESR捕获实验(5,6-DMPO)在Cu-MOF@DPCPX+H₂O₂+GSH体系中呈现1:2:2:1特征信号,确证·OH自由基存在(图3I)。DTNB检测显示,327 nm处TNB生成峰随时间递减(图3J、3L),同步出现GSSG(图3K),表明GSH被氧化为GSSG;Cu-MOF自身341 nm吸收峰消失并在276 nm出现新峰(图3D),佐证框架内Cu²⁺/Cu⁺循环介导的GSH耗竭。上述结果共同说明Cu-MOF@DPCPX通过GSH消耗-铜离子级联芬顿反应放大ROS生成。
(3)Cu-MOF@DPCPX的细胞毒性
四种肿瘤细胞系(4T1、LLC、GL261、PAN02)经Cu-MOF@DPCPX处理24 h后,IC₅₀依次为48.634 nM、66.588 nM、144.896 nM、127.014 nM,均低于同浓度Cu-MOF或DPCPX单药组(图4A)。EdU掺入与细胞计数显示DNA合成率下降,证实增殖受抑(图4B、4C)。Transwell及伤口愈合实验表明迁移与侵袭细胞数减少(图4D、4E);集落形成实验显示克隆数目显著降低(图4F)。
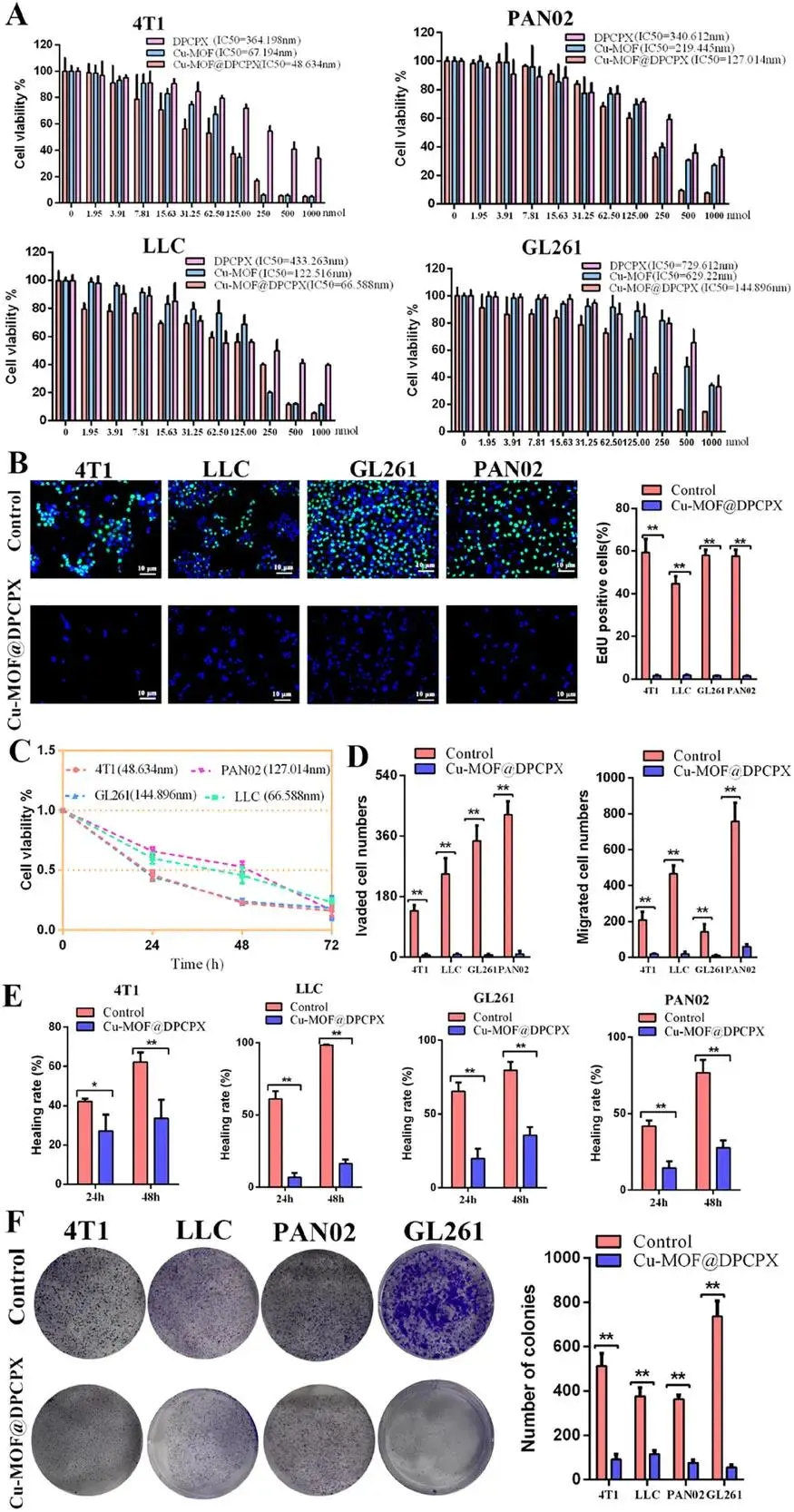
图4 Cu-MOF@DPCPX的细胞毒性。(A)不同浓度DPCPX、Cu-MOF及Cu-MOF@DPCPX处理肿瘤细胞24 h后的细胞活力;(B)Cu-MOF@DPCPX处理24 h后肿瘤细胞的EdU阳性细胞数量;(C)Cu-MOF@DPCPX在不同时间梯度下对肿瘤细胞活性的影响;(D–E)Cu-MOF@DPCPX显著减少肿瘤细胞的侵袭数、迁移数及划痕愈合率;(F)Cu-MOF@DPCPX有效抑制肿瘤细胞克隆形成。数据以均值±SD表示(n=3),单因素方差分析,*p<0.05,**p<0.01
(4)Cu-MOF@DPCPX靶向线粒体损伤
在正常生理条件下,铜由特异性递送蛋白分送至胞质、线粒体、高尔基体及细胞核;线粒体可在过量时储存铜,缺乏时再释放以维持稳态。过载时,线粒体积聚的铜破坏功能并触发铜死亡(图5A)。Cu-MOF@DPCPX处理使肿瘤细胞内铜含量高于Cu-MOF组(图5B)。FITC标记的Cu-MOF@DPCPX与MitoTracker Red共定位重叠显著,且与LysoTracker无交叉,表明其特异性富集于线粒体(图5C)。透射电镜显示处理组线粒体嵴数量减少(图5D)。
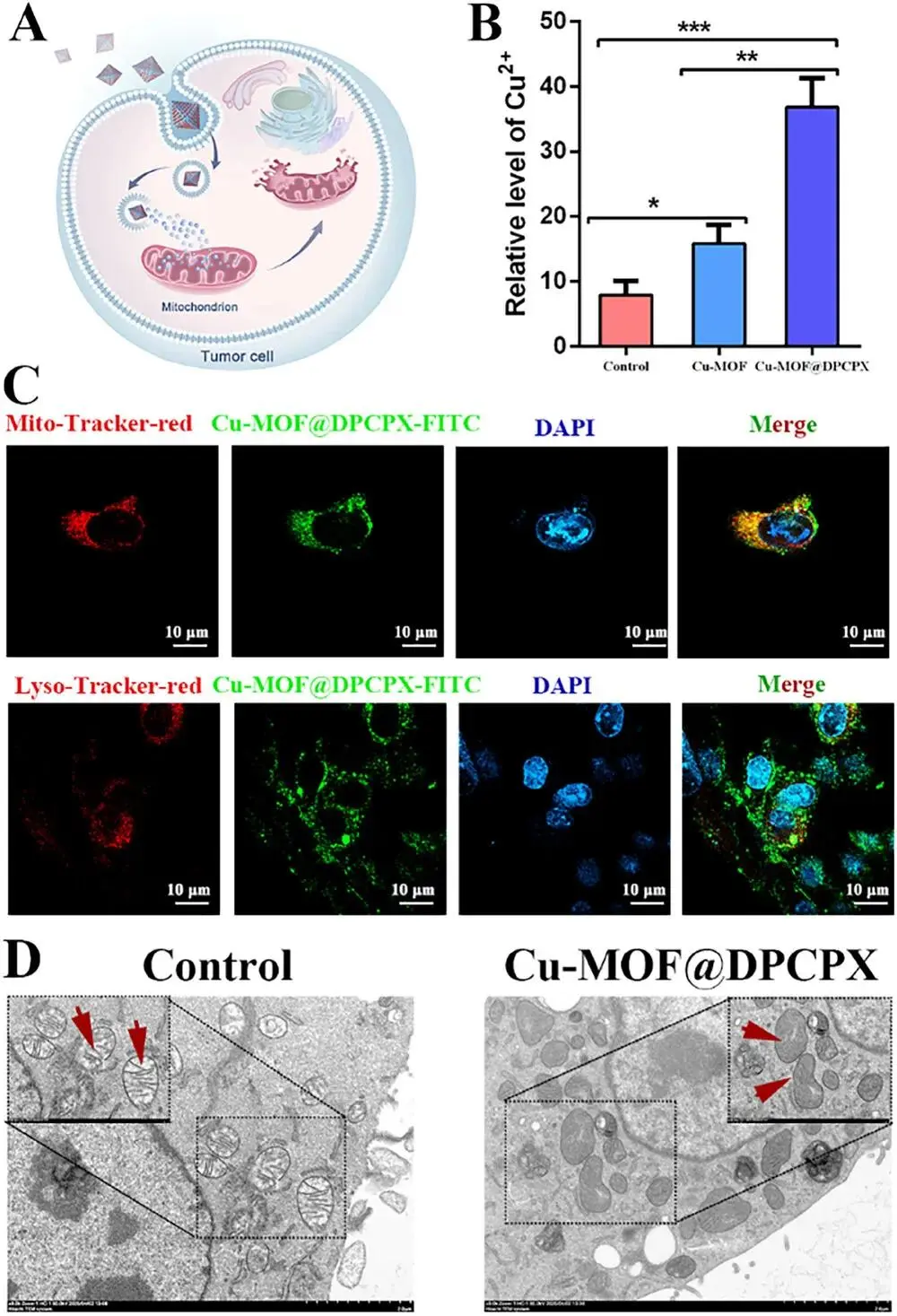
图5.Cu-MOF@DPCPX靶向线粒体损伤。(A)示意图说明Cu-MOF@DPCPX靶向线粒体损伤。(B)肿瘤细胞在用Cu-MOF和Cu-MOF@DPCPX处理后的铜离子水平。(C)免疫荧光检测显示Cu-MOF@DPCPX在线粒体中表现出主要聚集,而不是在溶酶体中。(D)透射电子显微镜显示肿瘤细胞在用Cu-MOF@DPCPX处理后线粒体嵴数量减少。数据以均值±标准差表示(n=3)
(5)Cu-MOF@DPCPX三重激活细胞铜死亡、铁死亡和线粒体自噬
金属依赖性细胞死亡,例如细胞铜死亡和铁死亡,是由金属离子稳态失衡触发的。此外,最近的研究表明,线粒体自噬在一定程度上可以放大金属依赖性细胞死亡。为了研究铜过载是否触发涉及细胞铜死亡、铁死亡和线粒体自噬的级联反应,对用或不用Cu-MOF@DPCPX处理的肿瘤细胞进行了RNA测序分析。在Cu-MOF@DPCPX处理组与对照组的比较中,根据|log2FC|>1和p<0.05的标准,检测到5690个差异表达基因(DEGs)。其中,3026个基因上调,2664个基因下调(图6A)。值得注意的是,编码热休克70 kDa蛋白1B的Hspa1b基因和编码热休克70 kDa蛋白1A的Hspa1a基因均显著上调。热休克70 kDa蛋白(HSP70)的上调也是细胞铜死亡的一个显著标志。活性评分分析显示,显著差异表达的基因揭示Cu-MOF@DPCPX诱导的细胞死亡主要涉及铜死亡、铁死亡和线粒体自噬(图6B)。Cu-MOF@DPCPX诱导的细胞死亡通路相关的差异表达基因如图6C所示。
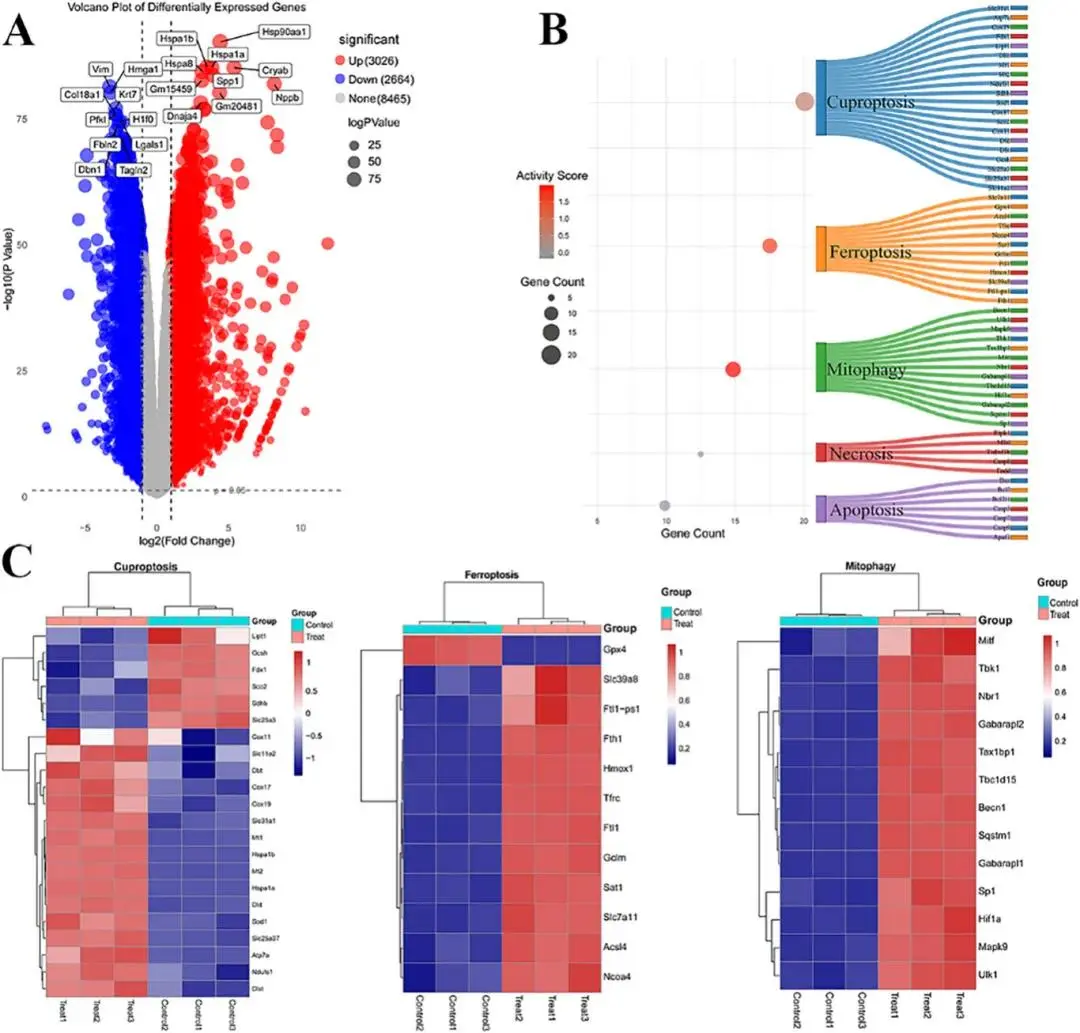
图6.用Cu-MOF@DPCPX处理的肿瘤细胞的转录组学分析。(A)火山图显示空白组和Cu-MOF@DPCPX处理组之间的差异表达基因(DEG)。(B)显示基于空白和Cu-MOF@DPCPX处理的肿瘤细胞的DEG的KEGG富集分析的桑基图。(C)描述与Cu-MOF@DPCPX诱导的细胞死亡途径相关的DEG的热图
铁死亡是由细胞膜上脂质过氧化物的积累所引发,这依赖于芬顿反应。铜离子已知是驱动芬顿反应的关键催化剂(Cu+H₂O→Cu+·OH+OH⁻)。与此机制一致,研究发现Cu-MOF@DPCPX处理显著增加了脂质过氧化速率(LPO)(图7A)。此外,通过蛋白质印迹法检测了铁死亡关键介质(GPX4和SLC7A11)和铜死亡(FDX1和HSP70)的表达。结果表明,Cu-MOF@DPCPX降低了GPX4、SLC7A11和FDX1的表达,但增加了HSP70的表达(图7B)。铜死亡和铁死亡的启动会激活线粒体自噬以清除受损的线粒体。然而,这个过程意外地释放了从降解细胞器中隔离的铜和铁离子,形成了一个自我维持的循环,加剧了这两种类型的调节性细胞死亡。为了定量评估线粒体自噬活性,进行了Mt-Keima测定。Cu-MOF@DPCPX处理后的细胞中红荧光强度升高,表明线粒体溶酶体形成增加,自噬通量增强(图7C)。透射电镜进一步证实了Cu-MOF@DPCPX引起的线粒体自噬增强,与对照组相比,Cu-MOF@DPCPX处理组的细胞中可见更多的线粒体自噬体和自噬溶酶体(图7D)。
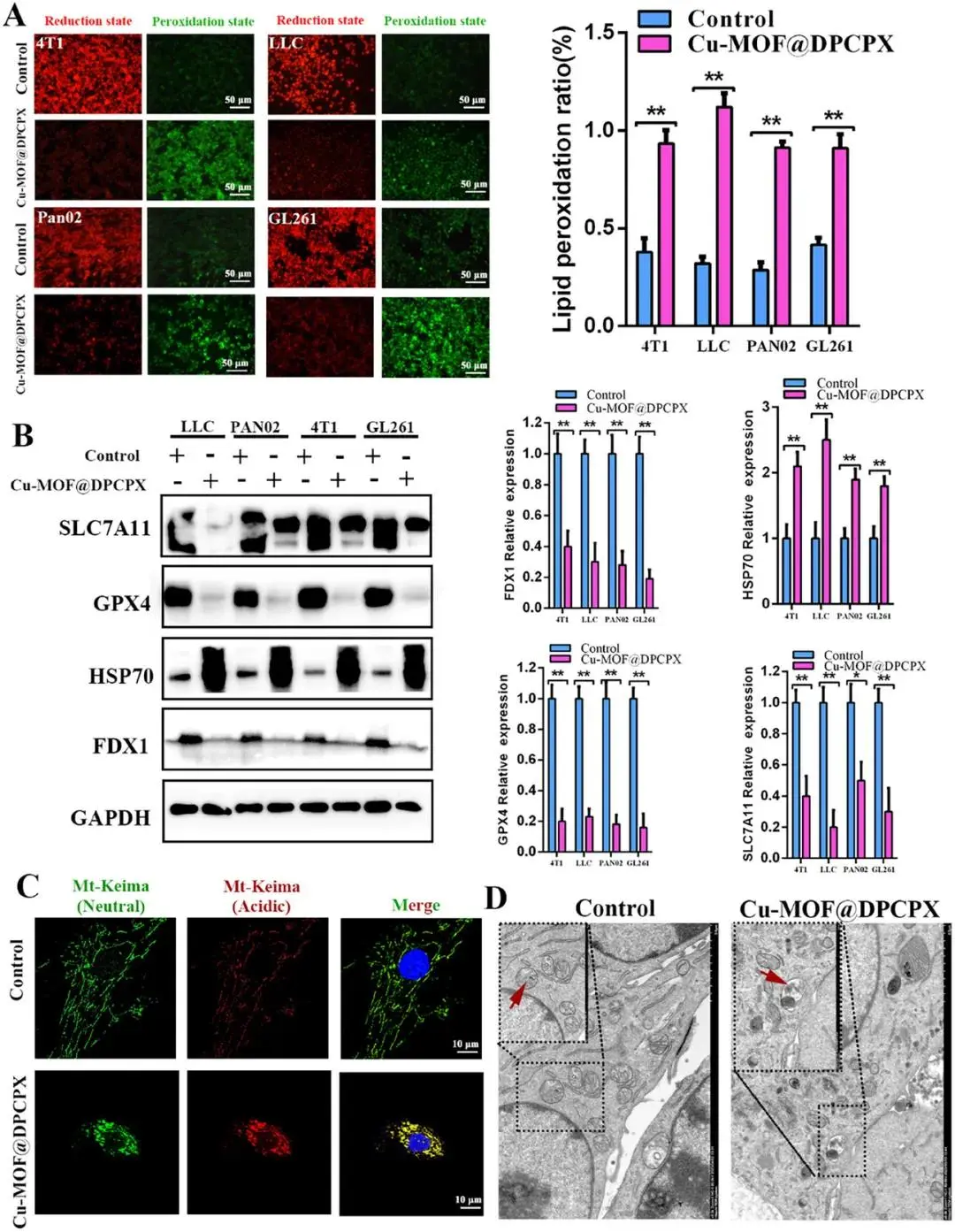
图7.Cu-MOF@DPCPX三重激活Cuproptosis、Ferroptosis和Mitophagy。(A)Cu-MOF@DPCPX增加肿瘤细胞中的脂质过氧化(LPO)。(B)Western blot实验检测Cu-MOF@DPCPX处理组肿瘤细胞的铁死亡和Cuproptosis通路。(C)Cu-MOF@DPCPX处理组肿瘤细胞mt-Keima测定中线粒体自噬活性的代表性荧光图像。(D)Cu-MOF@DPCPX处理组肿瘤细胞线粒体自噬的代表性电子显微镜图像。LPO:脂质过氧化率。数据以均值±标准差表示。数据以均值±标准差表示(n=3)
综上所述,这些发现表明,由Cu-MOF@DPCPX引发的细胞内铜超载不仅会导致铜死亡,还会导致铁死亡和线粒体自噬。铜死亡和铁死亡均可导致线粒体损伤,受损线粒体通过线粒体自噬途径被降解,然而,在线粒体自噬过程中,受损线粒体中的铜离子再次被释放,这反过来加剧了铜死亡和铁死亡,同时损害了剩余的健康线粒体。
(6)Cu-MOF@DPCPX是肿瘤的潜在治疗药物
在4种同源小鼠模型(皮下4T1、LLC、PAN02及原位GL261)中,尾静脉注射Cu-MOF@DPCPX(2.56 mg/kg,隔天给药,共7次)后:ICG标记显示制剂注射2 h即在脑肿瘤区域富集,证实其跨血脑屏障靶向能力(图8B);活体成像肿瘤荧光信号较PBS组显著减弱(图8C、8D)。LLC肿瘤H&E与免疫组化显示,处理组出现大片坏死,Ki67下降,COX2(铁死亡标志)及HSP70(铜死亡标志)上调(图8E)。免疫荧光示肿瘤内CD14⁺单核细胞及CD8⁺ T细胞浸润增加(图8F);流式结果证实F4/80⁺CD86⁺ M1型巨噬细胞比例升高,CD8⁺ T细胞增多,CD4⁺ Treg比例降低,提示免疫抑制微环境被重编程。
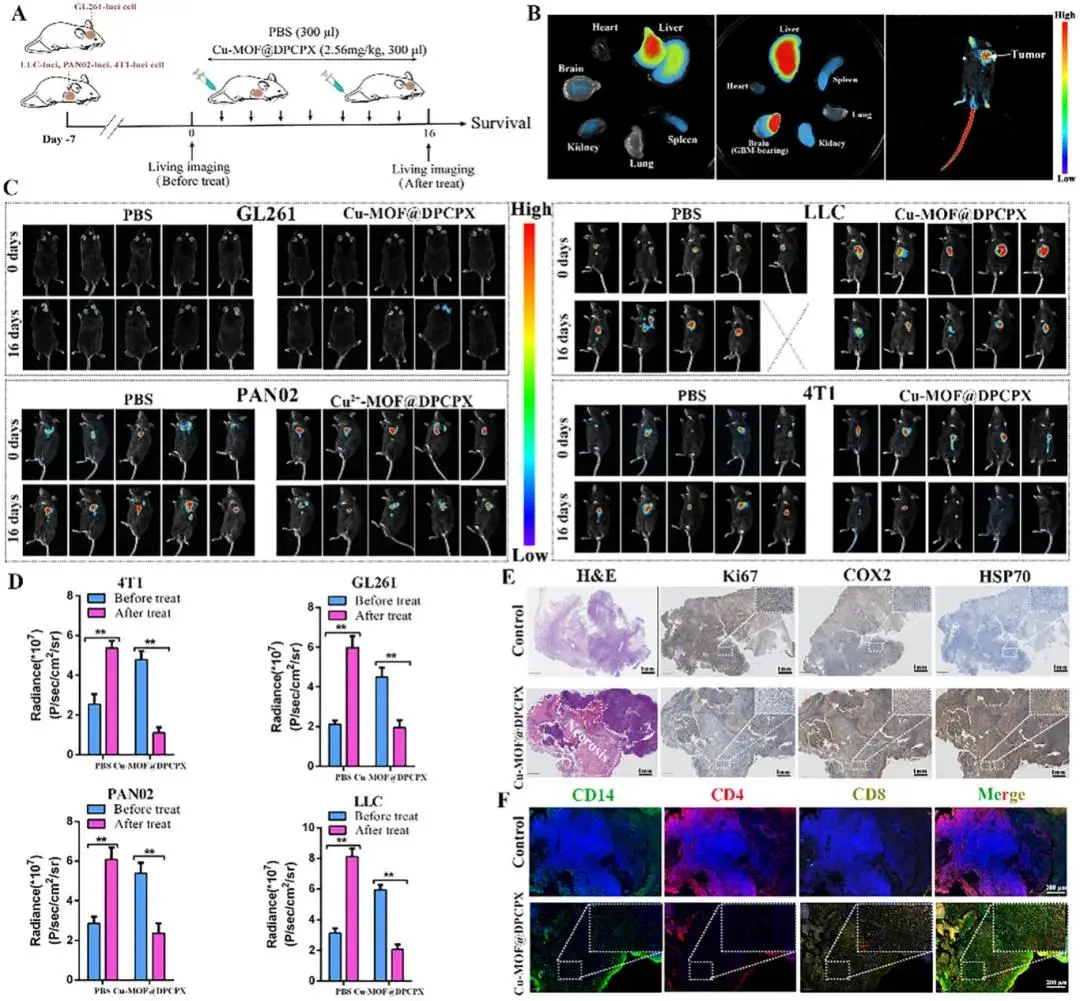
图8.Cu-MOF@DPCPX体内级联治疗效应。(a)治疗时间轴:经尾静脉给予Cu-MOF@DPCPX(2.56 mg kg⁻¹,300 μL),隔日一次,共7次;(b)ICG标记的Cu-MOF@DPCPX在原位胶质瘤小鼠主要器官(心、肝、脾、肺、肾、脑)及皮下瘤的离体/活体荧光成像,显示肿瘤区域高富集;(c)Luciferase标记的胶质瘤小鼠在Day 0与Day 16的生物发光图,Cu-MOF@DPCPX组信号显著低于PBS组;(d)定量生物发光强度,Cu-MOF@DPCPX抑制率达82.4 %(n=5);(e)H&E与免疫组化显示Cu-MOF@DPCPX组肿瘤细胞坏死区扩大,Ki-67下调,铁死亡驱动基因COX2上调,HSP70下调;(f)免疫荧光显示Cu-MOF@DPCPX组瘤内CD14⁺巨噬细胞浸润增加,CD4⁺与CD8⁺T细胞共浸润显著,提示免疫微环境重塑。数据以均值±SD表示(n=3),单因素方差分析,*p<0.05,**p<0.01
本研究构建的Cu-MOF@DPCPX凭借酸性降解、GSH耗竭与Cu⁺/Cu²⁺价态循环,在肿瘤微环境内同步放大铜死亡、铁死亡和线粒体自噬,并借线粒体自噬释放铜离子形成正反馈;其双重催化活性显著抑制肿瘤生长,同时重塑免疫微环境,实现“冷”转“热”肿瘤,为金属离子驱动的多模式协同治疗提供了可扩展的范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

