
糖尿病已成为全球公共卫生危机,成年患病率逾10%,其并发的骨折风险比常人高70%。持续高血糖伴随剧烈血糖波动,引发线粒体功能障碍与活性氧(ROS)持久过量,形成氧化-炎症-衰老恶性循环,使骨前体细胞功能衰竭,缺损修复能力极低。现有干预多仅短暂清除ROS,无法逆转已陷入衰老的微环境,亟需能在糖尿病病理场景下“重塑”再生生态的新型生物材料。

针对上述问题,武汉大学生物工程学院的李景峰团队设计了一种可响应糖尿病微环境的HPA智能水凝胶:将降糖药二甲双胍(Met)直接分散于透明质酸-苯硼酸/聚乙烯醇网络,实现早期快速释放;把成骨肽PTHrP-1锚定于聚多巴胺包覆的ZIF-8纳米载体(P1@PZIF-8),实现后续持续释放。Met先清除ROS、恢复自噬、抑制细胞衰老;PTHrP-1与Zn2+协同促进Wnt/β-catenin成骨信号和血管生成。转录组证实该体系通过PI3K-AKT-mTOR通路逆转骨髓间充质干细胞衰老,在糖尿病大鼠颅骨缺损模型中实现高效骨再生,为“重编程”氧化应激微环境提供了可临床转化的自主型组织工程新策略。该文章于2025年10月28日以《Versatile smart hydrogels for spatiotemporal drug delivery to orchestrate diabetic bone regeneration》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2025.09.049)。

研究示意图
(1) PZIF-8的制备与表征
PZIF-8由ZIF-8与多巴胺60 °C竞争配位-聚合制得,呈平均直径200 nm、壳厚16.8 nm的中空结构(图1A-B);EDS确认含C、Zn、N、O,无外来毒性元素(图1C)。PDA外壳使PZIF-8在pH 7.4、37 °C下7天仍保持Tyndall效应及缓慢Zn²⁺释放,而ZIF-8迅速降解(图1D)。DLS结果显示,PZIF-8的水合半径为250 nm,并且在不同溶液中该半径保持相对不变(图1E)。FTIR出现PDA特征峰1725、1494、1260 cm-1,XRD晶体峰消失,XPS Zn²⁺–N配位减弱并出现新峰,证实ZIF-8解构并被PDA包覆(图1F–I)。N₂吸附呈介孔回线,主孔径5.5 nm。PTHrP-1经物理浸渍载入,包封率85.4%,高于ZIF-8的63.2%(图1K);FTIR证明药物位于空腔而非表面(图1J)。P1@PZIF-8含C 69.5%、N 14.77%、O 3.36%、Zn 14.41%(图1L)。
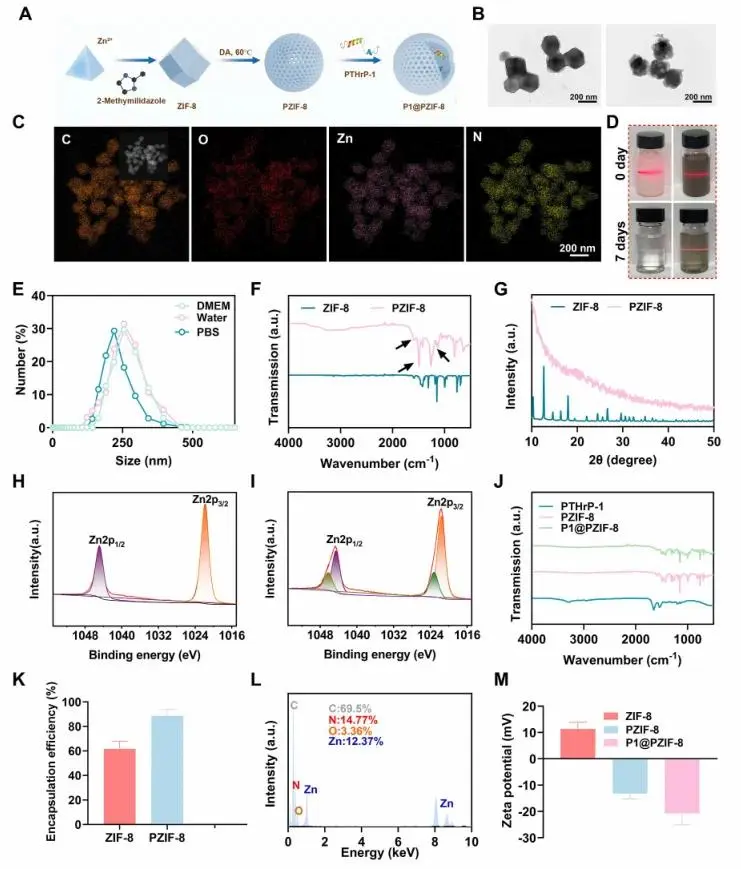
图1. (A) P1@PZIF-8的示意图;(B) ZIF-8和PZIF-8的TEM图像;(C) PZIF-8的SEM-EDX元素映射;(D) ZIF-8和PZIF-8在0天和7天时在去离子水中观察到的丁达尔效应;(E) PZIF-8在生理溶液(水、PBS和DMEM)中的粒径分布;(F) ZIF-8和PZIF-8的FTIR光谱;(G) ZIF-8和PZIF-8的XRD光谱;(H) ZIF-8的XPS光谱;(I) PZIF-8的XPS光谱;(J) P1、PZIF-8和P1@PZIF-8的FTIR光谱;(K) ZIF-8和PZIF-8对PTHrP-1的包封效率;(L) P1@PZIF-8的EDS分析;(M) ZIF-8、PZIF-8和P1@PZIF-8的zeta电位
(2)水凝胶的制备与表征
通过形成硼酸酯键并与Zn²⁺离子交联,构建了一个由PVA和HPA水凝胶组成的复合水凝胶(图2A)。如图2B所示,PBA的1H NMR谱图显示了在7到8 ppm之间的特征芳香质子信号,分配给苯环上的氢原子(δ = 7.58,m,4H,A),以及在δ = 1.89 ppm处的一个单峰信号(3H,B),对应于甲基基团。HPA水凝胶由HA-PBA与PVA通过苯硼酸酯键交联并引入Zn²⁺构建,室温凝胶时间48±2.5 s,掺PZIF-8后缩短至35.3±2.1 s(图2C)。¹H NMR和FTIR在7–8 ppm及1340 cm⁻¹处检出PBA特征信号,确认接枝成功(图2B)。SEM显示五组水凝胶平均孔径≈85 μm,PZIF-8均匀嵌于孔壁并引入皱纹,EDX映射证实C、N、O、Zn均匀分布(图2D–F)。振荡频率扫描中复合水凝胶G′较HPA提高约10倍,拉伸强度33.8±1.6 kPa、为HPA的1.35倍;循环压缩5次无滞后(图2G–I)。应变192%时G′/G″相交,250%破坏后0.5%应变下模量瞬时可逆恢复;切断拼接后自愈样条模量41.7±4.6 kPa,远高于破损样11.1±2.7 kPa(图2K)。体外降解:P-HPA 7天剩余77.2%,HPA仅63.5%;28天PBS失重73.1%,25 mM葡萄糖+1 mM H₂O₂失重90.7%(图2L);皮下植入2周保留62.5%。双药释放:Met 12天累计释放82.3%,28天87.9%;PTHrP-1持续释放,28天达88.2%(图2M–N)。
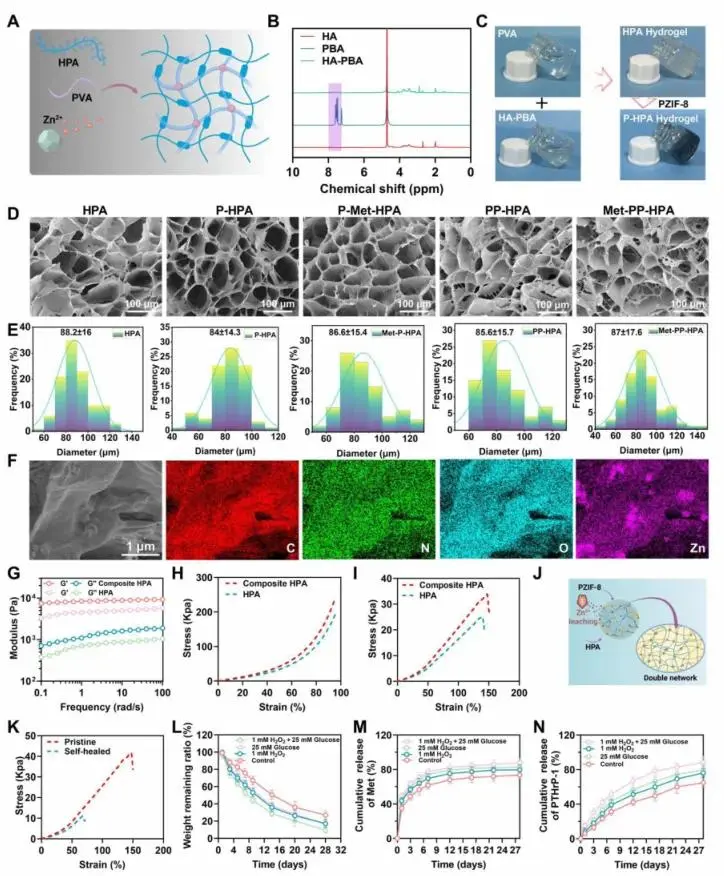
图2. (A) HPA水凝胶交联的示意图;(B) HA、PBA和HA–PBA的¹H NMR谱图;(C) PVA溶液、HA–PBA溶液和PZIF-8,在混合后迅速形成水凝胶;(D) HPA、P-HPA、P-Met-HPA、PP-HPA和Met-PP-HPA复合水凝胶的SEM图像;(E) 孔径分布的统计分析;(F) Met-PP-HPA水凝胶的SEM-EDX元素映射;(G) 振荡频率扫描,显示HPA和复合HPA水凝胶的存储模量和损失模量与频率的关系;(H) 压缩应力–应变曲线;(I) 不同水凝胶在恒定应变速率下的拉伸应力–应变曲线;(J) Zn²⁺增强的HPA双网络水凝胶示意图;(K) 原始和自愈合二元复合水凝胶的拉伸应力–应变曲线;(L) 复合水凝胶在28天内经过不同处理后的残留重量比;(M) 复合水凝胶在28天内在不同条件下的Met累积释放;(N) 复合水凝胶在不同处理后的PTHrP-1累积释放
(3)体外释放与颅骨缺损留存
为了研究PTHrP-1从HPA水凝胶中的释放行为,Cy5.5标记的PTHrP-1被包裹在PZIF-8中并融入水凝胶中。通过体外和体内荧光成像监测释放过程。结果显示,过氧化氢和葡萄糖共同存在时,荧光强度显著增强,PTHrP-1(1 wt%)负载的水凝胶对病理微环境的荧光反应最强(图3B)。在PBS中的PTHrP-1累积释放结果与IVIS结果一致(图3C),表明HPA水凝胶具有智能响应糖尿病微环境的能力,适合按需药物递送。此外,在大鼠颅骨缺损模型中,评估了Cy5.5标记的PTHrP-1在HPA水凝胶中的体内荧光保持情况。PP-HPA水凝胶组的信号衰减明显慢于PTHrP-1/HPA水凝胶组,后者信号在第12天后无法检测到(图3D和3E)。这些结果表明,PZIF-8锚定的PTHrP-1结合HPA水凝胶后,可以在骨缺损部位实现长时间、稳定的药物保持,具有长期治疗应用的潜力。
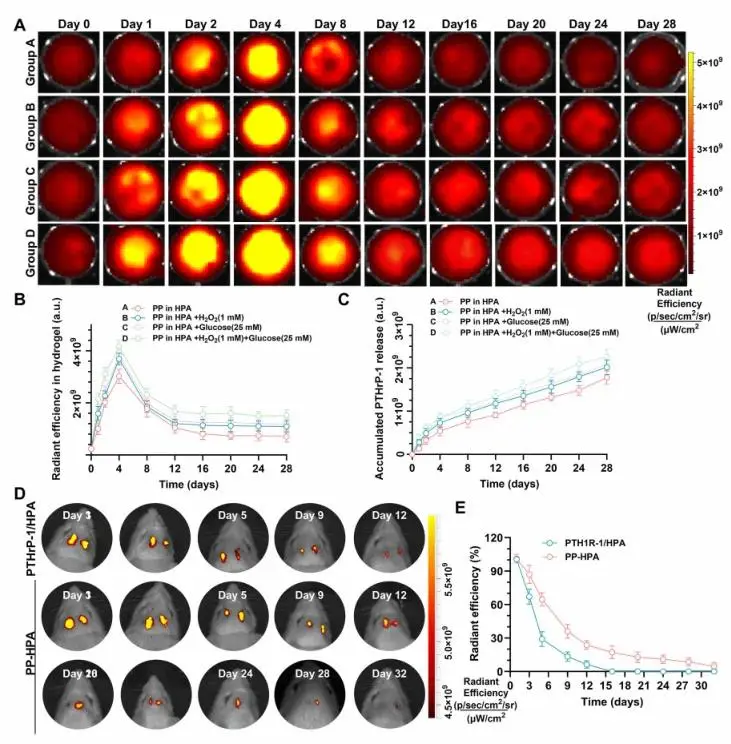
图3. (A) 评估在不同条件下(PBS、H₂O₂(1 mM)、葡萄糖(25 mM)以及H₂O₂(1 mM)与葡萄糖(25 mM)组合)的HPA水凝胶中PTHrP-1的释放曲线,利用IVIS成像进行详细分析;(B) 通过将水凝胶浸泡在不同溶液中,测定PTHrP-1的累积释放曲线;(C) 根据不同溶液浸泡情况计算的PTHrP-1的总释放曲线;(D) 小鼠随时间变化的代表性IVIS图像,展示了PTHrP-1直接融合到HPA水凝胶中,以及PZIF-8锚定的PTHrP-1在植入大鼠颅骨缺损后的整合情况;(E) 使用IVIS成像测量的植入大鼠颅骨缺损后的样本的辐射效率和辐射保持比率
(4)高糖微环境中复合水凝胶的抗氧化性能
高葡萄糖(HG)使ROS水平升至(图4A),正常葡萄糖下ROS保持低值(图4B)。P-Met-HPA、PP-HPA、Met-PP-HPA依次降低ROS,Met-PP-HPA降幅最大;流式细胞术显示该组ROS标记BMSCs峰位左移(图4C)。qRT-PCR示HG抑制抗氧化基因,Met-PP-HPA将其上调至最高(图4D)。JC-1染色表明Met-PP-HPA使线粒体膜电位恢复至近正常水平(图4E、F),ATP产量同步回升(图4G);SOD活性与MDA水平亦被逆转(图4H、I)。MitoSox Red证实Met-PP-HPA清除线粒体ROS(图4J、K)。γH2A.X信号在Met-PP-HPA组显著减弱,提示DNA损伤减轻(图4L、M)。该水凝胶通过速释Met及持续释放PTHrP-1与Zn²⁺,抑制ROS、修复线粒体形态与功能,促进BMSC在高糖环境存活、成骨并延缓衰老(图4O)。
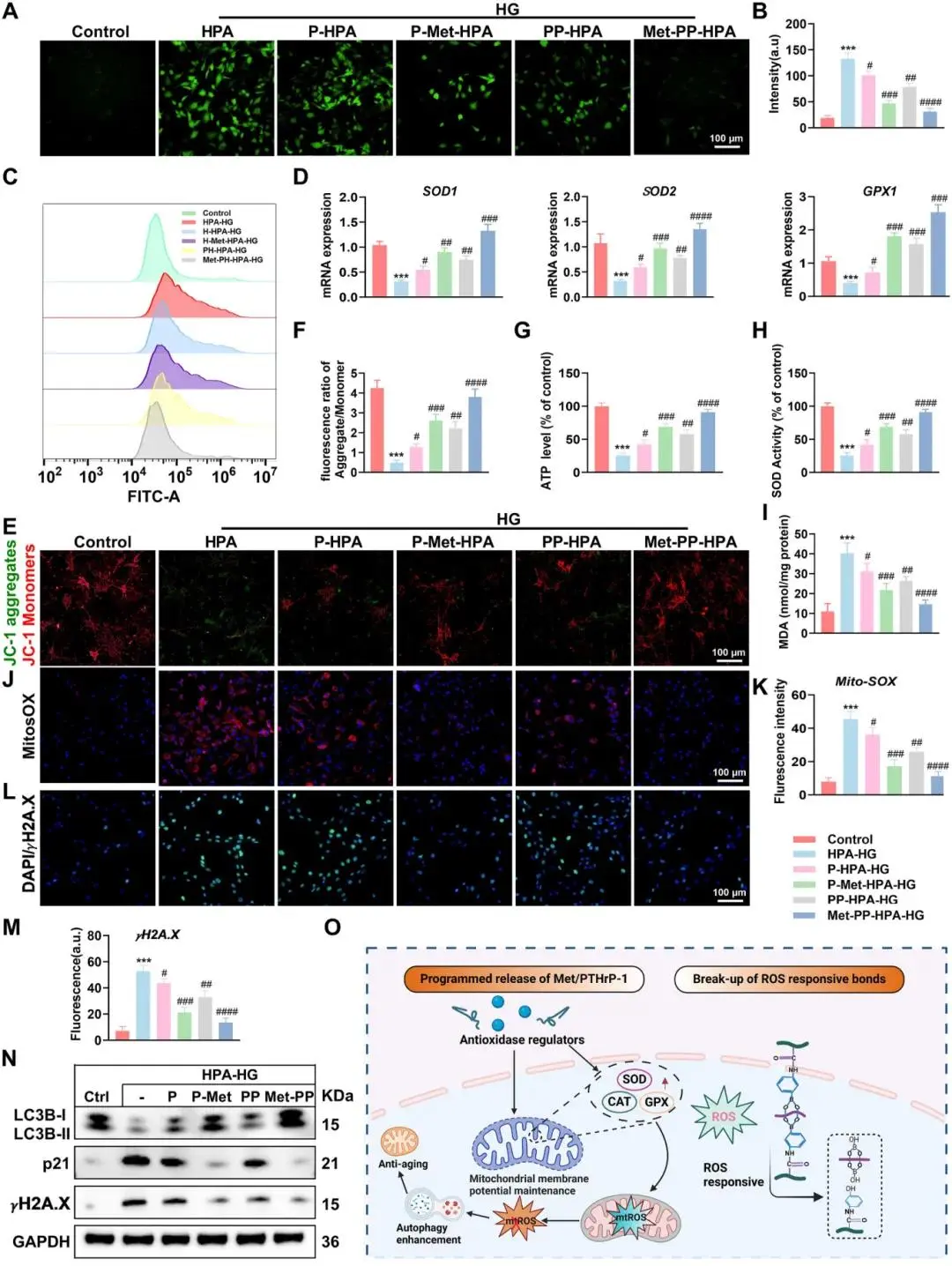
图4. (A) 使用DCFH-DA染色荧光图像测量细胞内ROS水平;(B) 荧光强度的定量评估;(C) 通过流式细胞术(FCM)使用DCFH-DA作为指示剂评估细胞内ROS水平;(D) BMSCs中抗氧化基因表达的qRT-PCR定量分析;(E) 使用JC-1荧光染色评估BMSCs的线粒体膜电位;(F) JC-1聚合物和JC-1单体之间的荧光比率的定量测量;(G, H, I) 不同处理下BMSCs中的ATP、SOD和MDA水平;(J) 代表性荧光图像及MitoSOX染色线粒体ROS的定量分析,(K) 对应的MitoSOX染色定量分析;(L) γH2A.X的代表性荧光显微镜图像,(M) γH2A.X免疫荧光的定量分析;(N) 使用水凝胶处理的BMSCs中LC3B、p21和γH2A.X蛋白表达水平;(O) 描述BMSCs内ROS调节的潜在机制的示意图
(5)水凝胶可缓解高糖微环境下骨髓间充质干细胞的细胞衰老并增强其成骨能力
在高葡萄糖条件下,复合水凝胶通过Met和PTHrP-1的协同作用,抑制了氧化应激(OS)加速干细胞衰老的效应(图5A、B)。Met-PP-HPA组显示出最强的抗衰老效果,降低了衰老相关基因和SASP标志物的表达(图5C、D、E)。Zn2+增强了BMSCs的粘附和增殖,PTHrP-1和Met促进了BMSCs的迁移。Transwell实验显示,Met-PP-HPA组显著提高了BMSCs迁移能力(图5F、G)。此外,Met-PP-HPA组也显著提高了碱性磷酸酶(ALP)和茜素红S(ARS)染色的强度,表现出最强的成骨效果(图5H、I)。免疫荧光染色和RT-PCR分析进一步证实,Met-PP-HPA水凝胶显著上调了成骨相关基因的表达(图5J、K、L)。Met的快速释放调节了ROS水平,延缓了BMSCs衰老,而PTHrP-1的持续释放促进了成骨细胞的增殖和分化。Zn2+则通过促进胶原合成和矿物沉积,进一步支持了成骨过程。
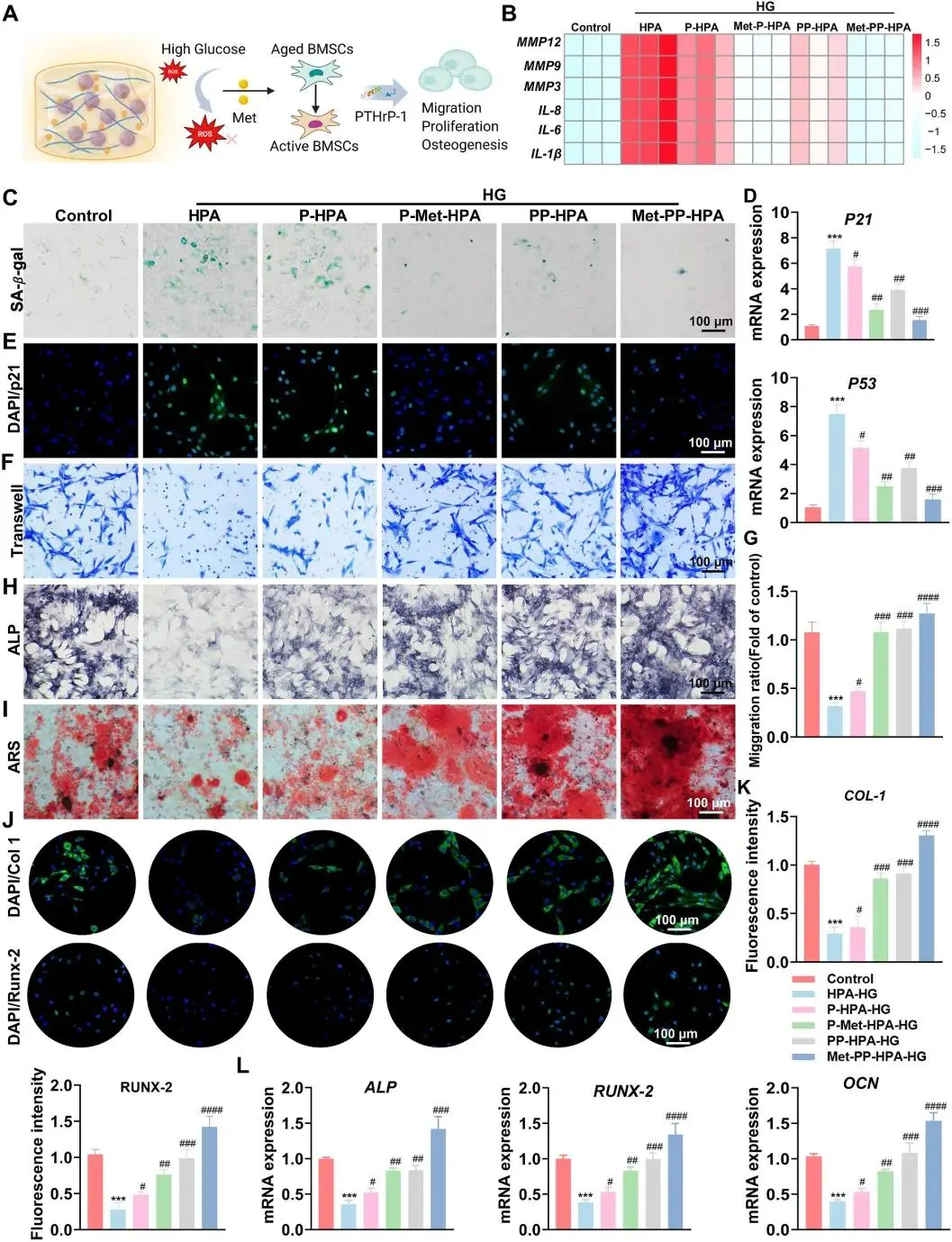
图5. (A) 水凝胶程序化药物释放示意图,用于调节衰老BMSCs并促进其成骨分化;(B) 水凝胶处理3天后BMSCs中SASP因子的qRT-PCR分析;(C) BMSCs的SA-β-gal染色;(D) 水凝胶处理3天后BMSCs中p21和p53表达的qRT-PCR分析;(E) p21的代表性免疫荧光图像;(F) 水凝胶处理3天后BMSCs的Transwell迁移实验;(G) 迁移的定量分析;(H) 第7天的ALP染色;(I) 第21天的ARS染色;(J, L) BMSCs中Col-1和RUNX-2的免疫荧光染色;(K, M) Col-1和RUNX-2荧光强度的定量分析;(N) BMSCs中ALP、RUNX-2和OCN mRNA表达的qRT-PCR分析
(6)复合水凝胶治疗效果的RNA测序分析
PCA 将 Met-PP-HPA 组与 HG 组分离(图 6A);DESeq2 筛得 2093 个上调基因与1019 个下调基因(图 6C)。GO 注释富集于 DNA 转录、细胞周期、氧化应激应答及 Wnt 信号;KEGG 指向 SASP、Wnt 与 AGE–RAGE 通路(图 6E)。GSEA 显示 PI3K–Akt、TCA 循环与 DNA 复制基因集同步变化(图 6F)。Western blot 定量表明 Met-PP-HPA 提升 p-PI3K、p-AKT、p-mTOR(图 6G);LY294002 逆转该效应并升高 p16、p21(图 6H、I)。Wnt3a、β-catenin、RUNX-2 与 Col-1 同步上调,XAV939 阻断后成骨蛋白回落(图 6J、K)。药物控释维持自噬流量(图 4N),经 PI3K–AKT–mTOR 轴削减 ROS、延缓衰老,并经 Wnt/β-catenin 轴驱动成骨分化(图 6L)。
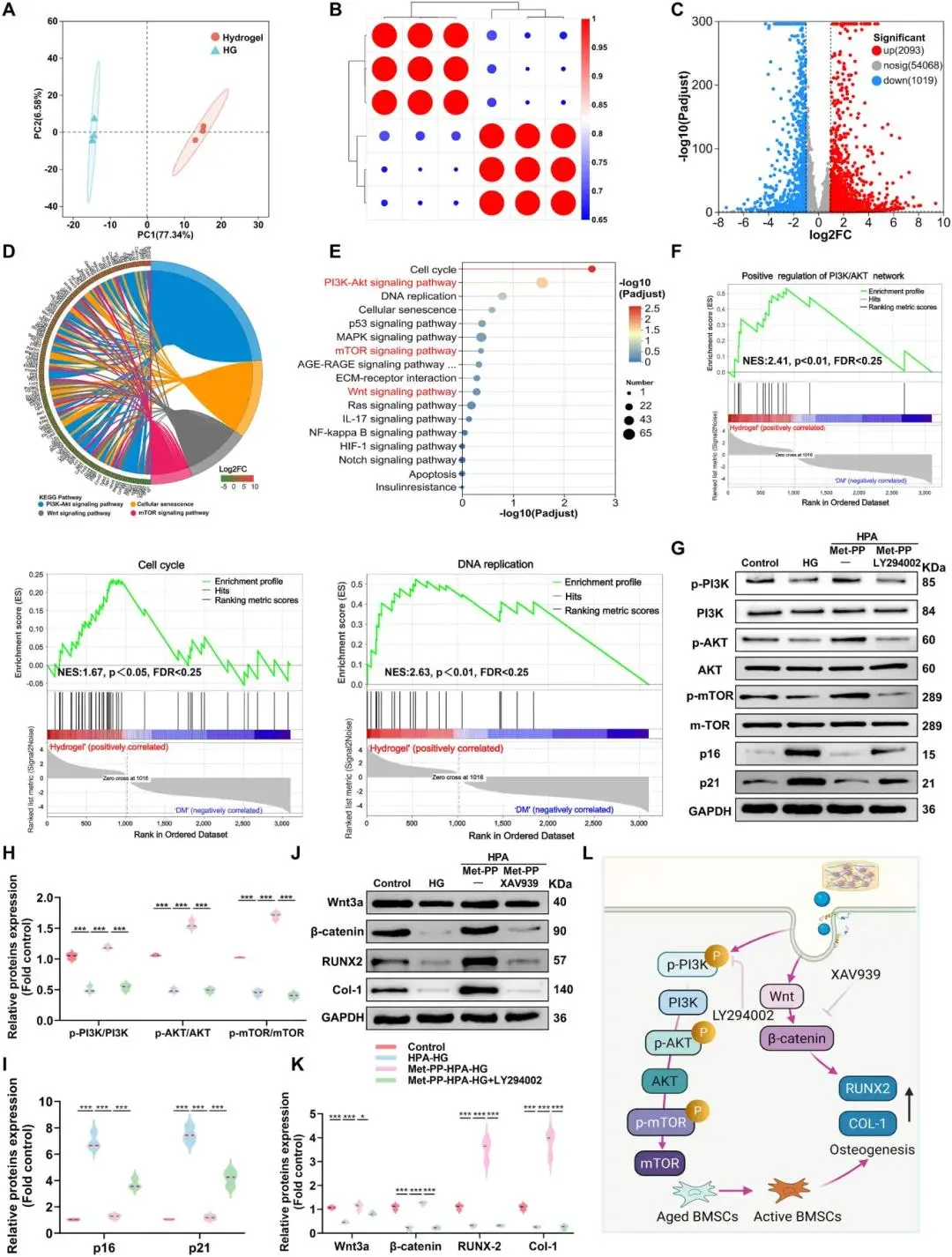
图6. (A) 来自HG组和复合水凝胶组样品的PCA分析;(B) 差异基因表达分析及样本间相关性评估;(D, E) 代表性的和弦图,展示HG组和Met-PP-HPA水凝胶组之间显著差异表达基因(DEGs)相关的KEGG通路;(F) 基因集富集分析(GSEA)图,显示三羧酸(TCA)循环、细胞周期和DNA复制通路的富集情况;(G) 进行Western blot分析,评估PI3K/AKT/mTOR信号通路以及衰老相关蛋白(如p16和p21)的表达;(H, I) p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、p16和p21的表达比值定量比较;(J) Western blot分析Wnt/β-连环蛋白信号通路及与成骨相关的蛋白(如RUNX-2和Col-1);(K) Wnt3a、β-连环蛋白、RUNX-2和Col-1的表达定量分析;(L) 复合水凝胶激活的信号通路示意图
(7)复合水凝胶可减轻高糖微环境下人脐静脉内皮细胞(HUVECs)的衰老并促进其血管生成
为评估复合水凝胶的抗衰老和促血管生成作用,我们分析了高葡萄糖条件下HUVECs的衰老情况。结果显示,Met-PP-HPA水凝胶显著降低了衰老相关基因(p16、p53)的表达(图7A和B),SA-β-gal染色也确认了Met-PP-HPA组衰老活性的显著减少(图7C)。免疫荧光分析表明,Met-PP-HPA组p21表达减少(图7D和E),进一步验证了其抗衰老效果。Transwell实验显示Met-PP-HPA水凝胶显著提高了HUVEC的迁移能力,远高于其他组(图7F)。Matrigel管道形成实验表明,Met-PP-HPA组形成了最多且连续的血管网络(图7H和I)。Met-PP-HPA组中HUVEC的血管生成基因(CD31、HIF-1α、VEGF)表达显著上升,分别比HPA组高3.7倍、3.4倍和3.9倍(图7J)。免疫荧光和Western blot进一步确认了这些结果,显示Met-PP-HPA组中CD31、VEGF和HIF-1α蛋白显著升高(图7K、L、M和N)。这些结果表明,Met-PP-HPA水凝胶在高葡萄糖条件下有效缓解细胞衰老,并显著促进血管生成。
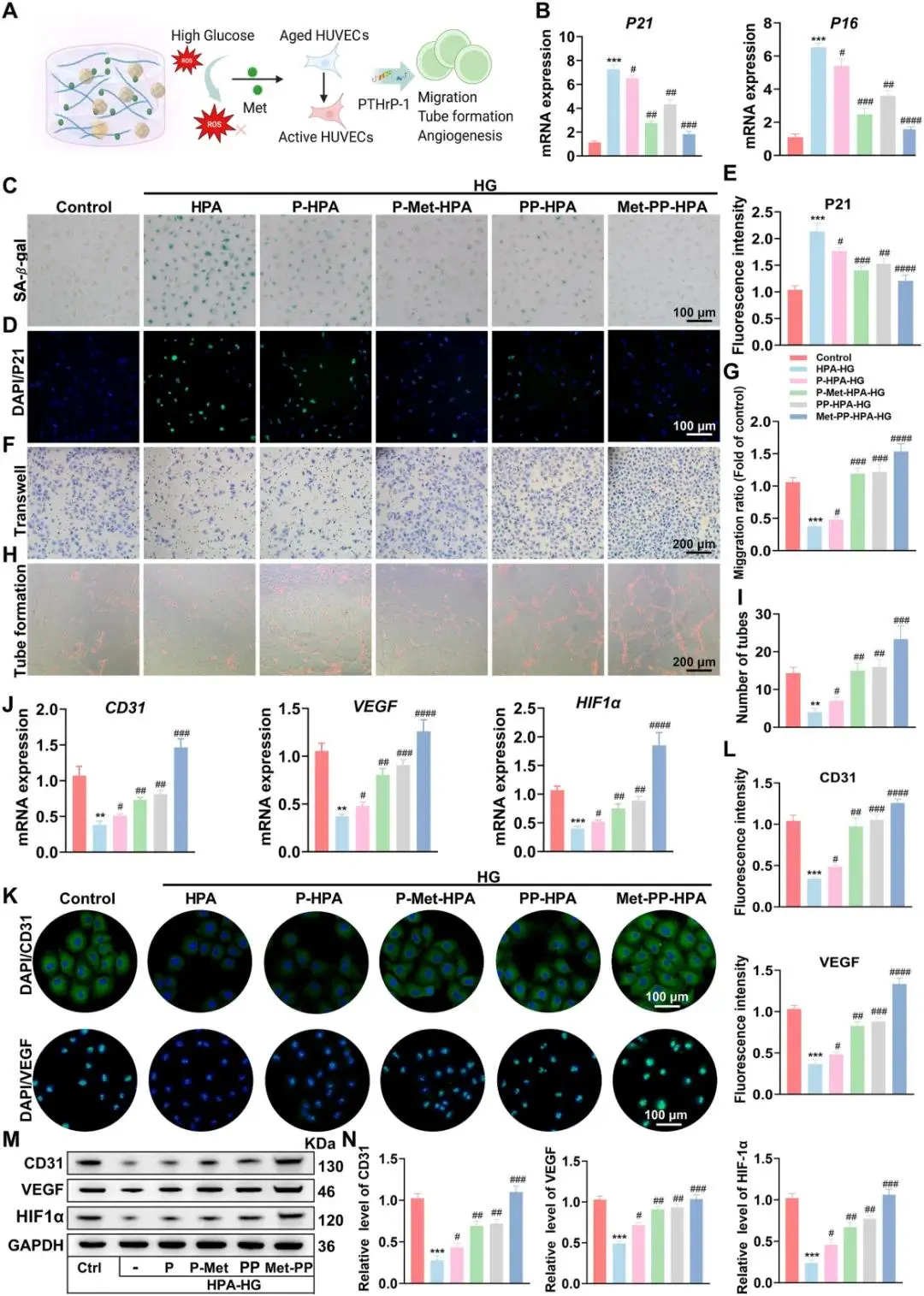
图7. (A) 水凝胶介导的程序性药物释放示意图,用于调节衰老的HUVECs并促进血管生成;(B) 采用qRT-PCR分析水凝胶处理3天后HUVECs中SASP因子的表达;(C) HUVECs的SA-β-gal染色;(D) p21表达的代表性免疫荧光图像,(E) 相应的荧光强度定量分析;(F) 第3天HUVECs的Transwell迁移实验,(G) 迁移细胞的定量分析;(H) HUVECs的管腔形成实验,(I) 水凝胶处理后形成的管腔数量定量;(J) 水凝胶培养的HUVECs中血管生成相关基因(CD31、VEGF、HIF-1α)表达的qRT-PCR分析;(K) CD31和VEGF的免疫荧光染色,(L) 其荧光强度的定量分析;(M) 水凝胶培养的HUVECs中CD31、VEGF和HIF-1α蛋白表达的Western blot分析,(N) 相应的定量结果
(8)复合水凝胶促进糖尿病性骨缺损的体内再生修复
STZ诱导糖尿病大鼠颅骨5mm缺损后植入水凝胶(图 8A),血糖监测 5–7 d 确认模型;P-Met-HPA 与 Met-PP-HPA 组血糖略低于其余组。8周微 CT 示 HPA 组仅边缘少量成骨,Met-PP-HPA 组缺损区被连续骨桥封闭(图 8B);定量指标 BV、BV/TV、Tb.N、BMD 均最高(图 8C)。HE 与 Masson 三色显示 Met-PP-HPA 组 4 周、8 周新生骨层厚且结构完整,其余组以纤维组织为主(图 8D、E)。全程心、肝、肾、脾未见病理改变或炎症,证实该水凝胶通过时空释药(Met+PTHrP-1+Zn²⁺)在糖尿病微环境中安全促成骨。
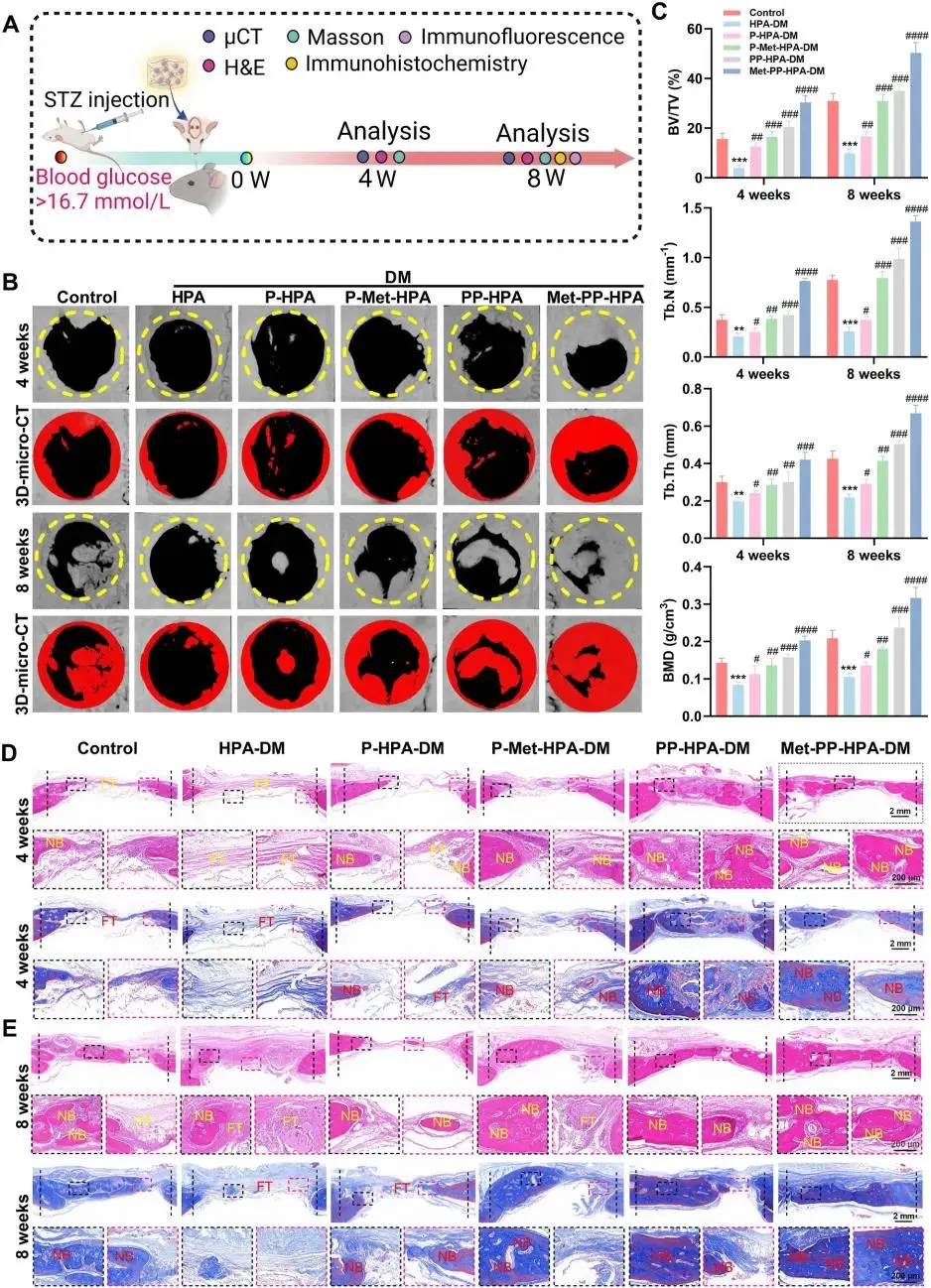
图8. (A) 建模和动物实验程序示意图;(B) 不同水凝胶治疗的大鼠颅骨缺损部位的代表性3D重建MicroCT图像;(C) 对MicroCT结果进行定量分析,涵盖参数如BV/TV、Tb.N、Tb.Th和BMD;(D, E) 4周和8周后缺损部位新生骨组织的H&E和Masson三色染色。(FT:纤维组织,NB:新形成的骨组织)
(9)复合水凝胶促进糖尿病性骨缺损的体内再生修复
DHE 荧光强度在 Met-PP-HPA 组降至 29.37 %±10.95 %,对照组维持 83.13 %±9.40 %(图 9A、B)。8 周缺损区免疫荧光显示,p16⁺/LepR⁺ 衰老 BMSC 比例在 Met-PP-HPA 组为 6.21 %±1.82 %,HPA 组 35.56 %±1.37 %(图 9C、D)。RUNX-2 与 Col-1 免疫组化信号在同一区域最高(图 9E、F)。TRAP 阳性破骨细胞数于 Met-PP-HPA 组最少(图 9G、H),CD34⁺/CD31⁺ 新生血管网密度则最高(图 9I、J)。时空释出的 Met、Zn²⁺ 与 PTHrP-1 通过清除 ROS、抑制破骨、恢复自噬、延缓 HUVEC 衰老及促血管-成骨耦合,将糖尿病骨缺损微环境转为再生状态(图 9K)。
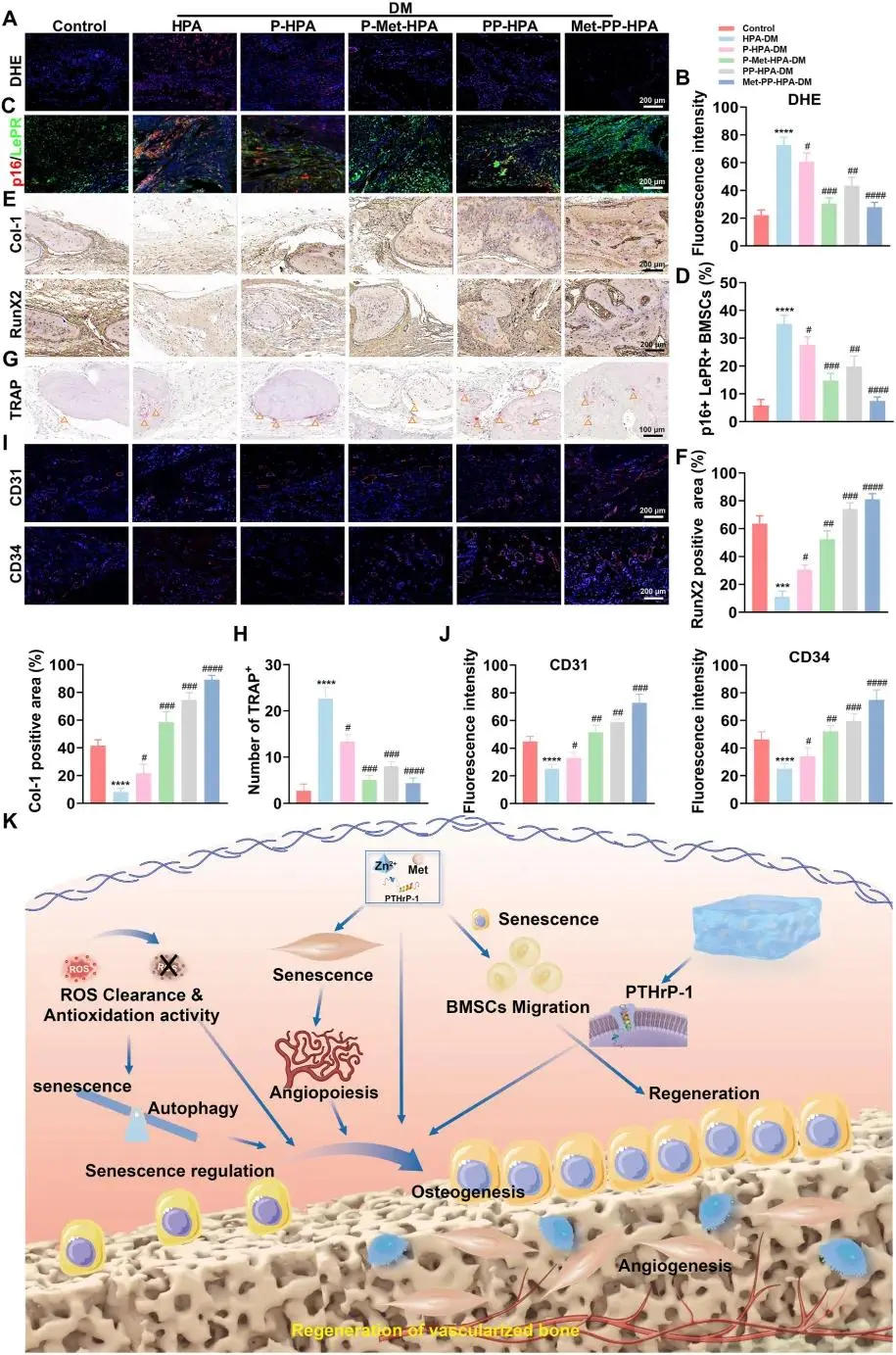
图9. (A) 使用DHE染色法定量骨组织内局部ROS水平的荧光图像,比例尺:200 μm;(B) DHE荧光强度的定量分析;(C) 显示糖尿病条件下骨缺损区域LepR⁺细胞中p16表达的免疫荧光图像,绿色荧光表示p16阳性(p16⁺)细胞,红色荧光表示LepR阳性(LepR⁺)细胞, (D) LepR⁺细胞中p16表达的荧光强度定量分析;(E) 使用免疫组化染色法检测缺损区域Col-1和RUNX-2的表达;(F) Col-1和RUNX-2的阳性区域定量分析;(G) 在8周时对缺损部位进行TRAP染色;(H) TRAP阳性细胞计数的定量分析。(I) 使用免疫荧光染色法分析缺损区域CD31和CD34的表达;(J) CD31和CD34荧光强度的定量分析;(K) 示意图展示Met-PP-HPA水凝胶在促进糖尿病骨再生中的作用。
本研究针对糖尿病骨缺损中ROS蓄积致细胞衰老、修复困难的瓶颈,构建可感知高糖高氧化微环境的苯硼酸酯键HPA水凝胶。通过“先快后慢”的时空程序释放二甲双胍与PZIF-8锚定的PTHrP-1,并伴随Zn2+持续析出,实现12天内>80%Met快速清除ROS、28天持续PTHrP-1促成骨与血管新生。该体系激活PI3K-AKT-mTOR通路抑制BMSC衰老,并通过Wnt/β-catenin增强成骨,同时在体内显著促进糖尿病大鼠骨缺损再生,为微环境响应型智能支架在代谢异常性骨修复中的应用提供了新范式。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

