
慢性难愈合伤口的管理,尤其是那些伴有顽固细菌感染或代谢紊乱(如糖尿病)的伤口,仍然是临床实践中的一个巨大挑战。这些伤口通常表现为持续的炎症反应、受损的血管生成和纤维化瘢痕形成。传统的治疗方法在面对这些复杂伤口时效果有限,因此开发新的治疗策略以实现快速、无瘢痕的伤口愈合具有重要意义。

针对上述问题,温州医科大学肖健、李正林与哈尔滨工业大学于淼团队合作,开发了一种光液化水凝胶敷料(PCS凝胶),用于快速、无瘢痕地修复难愈性感染创面。该凝胶通过温和产热强效杀菌、清除耐药生物膜,并调节氧化还原稳态、缓解过度炎症,推动炎症期向增殖期快速转变,营造促再生微环境。进一步地,PCS凝胶抑制CD36受体,阻断成纤维细胞向瘢痕方向分化,从而防止真皮纤维化。在小鼠急/慢性感染创面及兔耳增生性瘢痕模型中,该凝胶均实现快速上皮化、无瘢痕愈合,展现出免疫-成纤维细胞双重调控的抗瘢痕再生修复潜力。该文章于2025年10月18日以“Immunomodulation and Fibroblast Subtype Regulation by a Photoliquefiable Hydrogel Realize Anti-Scar Skin Regeneration of Refractory Infected Wounds”为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202521060)。
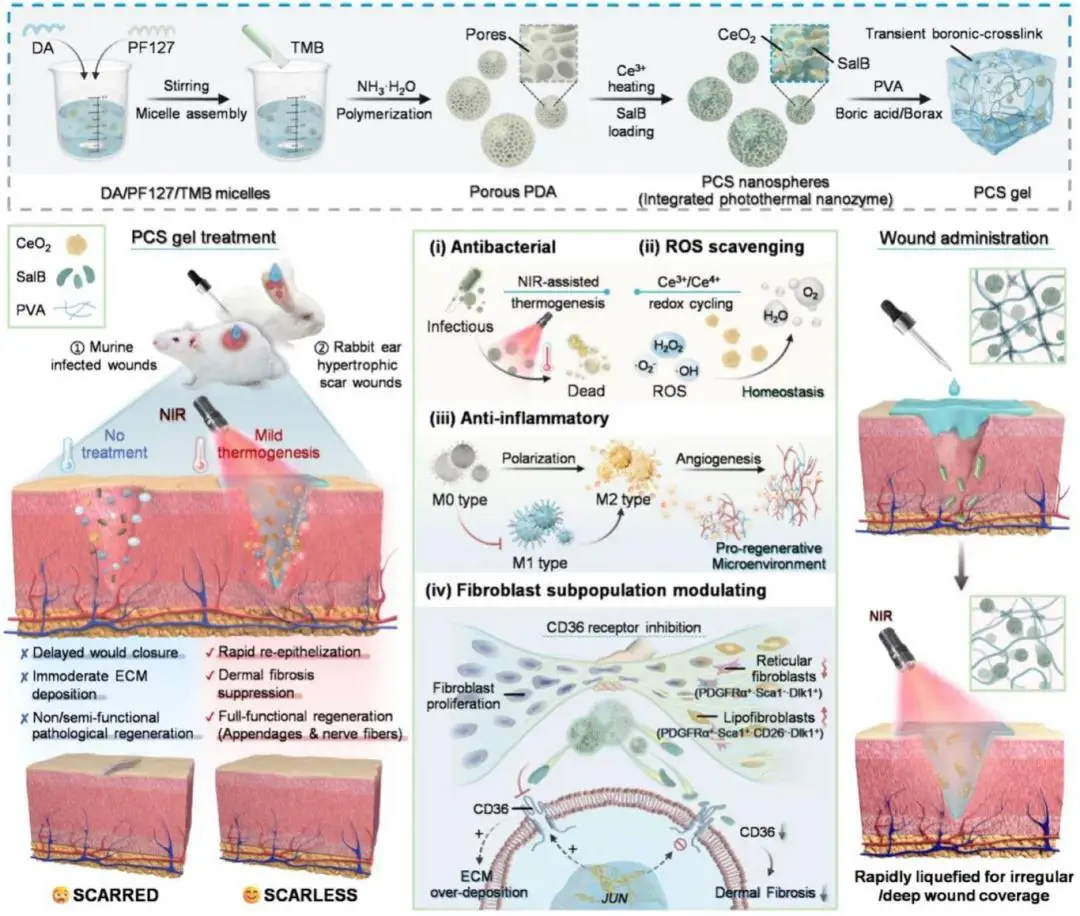
图1 PCS gel制备工艺示意图及其调控快速抗瘢痕创面愈合功能
(1)PCS gel的制备与表征
PCS为在多孔PDA纳米球表面沉积超小氧化铈晶体并负载SalB的复合纳米球。TEM与SEM显示其保持有序介孔结构(图2b);元素面分布中C、N、O均匀,Ce略呈离散(图2c)。ζ电位在氧化铈沉积后负值减小,SalB负载后恢复高负值(图2d)。DLS证实PDA、PC、PCS的水合粒径无显著差异(图2e)。UV-vis出现SalB特征吸收峰,证实药物负载(图2f)。XPS测得Ce³⁺/Ce⁴⁺=28.4:71.6(图2g)。TGA给出氧化铈负载量2.5%,SalB负载量10.1%。PCS分散于PVA/硼砂水凝胶得PCS凝胶,SEM显示凝胶孔隙率未因纳米球引入而改变(图2h);凝胶可自注射器连续挤出并保持形状。流变学表明,应变<80%时网络完整;应变>80%后G′与G″交叉,凝胶转为溶液态。相比空白PVA,PCS凝胶的G′、G″均升高。1%–200%交替应变下凝胶可逆固-液切换;粘度随剪切速率升高而下降,呈剪切稀化。裂纹自愈及与组织牢固粘附分别于图2i、2j示出。生理溶液中凝胶溶胀至原重3.3倍。PCS的光热转换效率使凝胶在NIR照射下升温(图2k-l),温度升高触发凝胶由粘弹性固态变为粘性液态(图2m),并加速水媒介中的溶解。凝胶涂覆于不规则凹槽后,NIR照射使其覆盖率升至99.1%,验证光液化特性(图2n-o)。
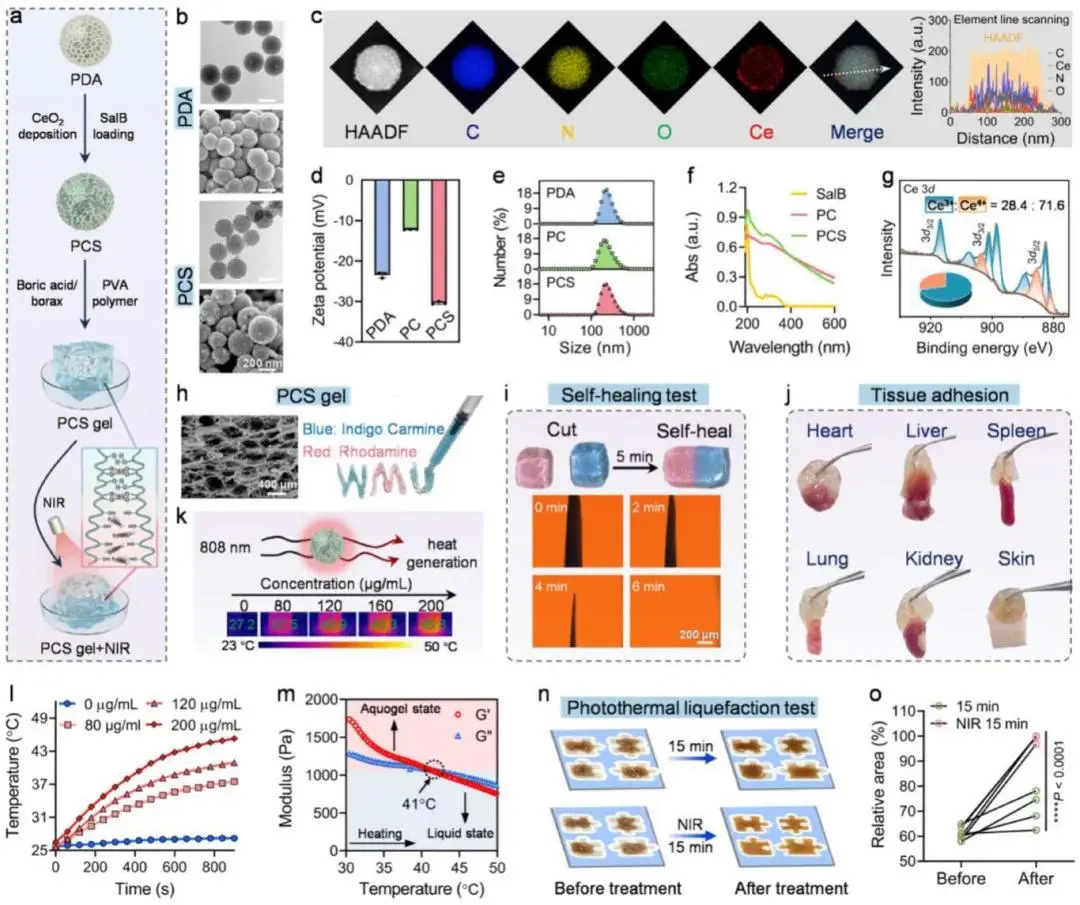
图2 PCS gel的制备与表征。(a)PCS凝胶制备及光触变示意图;(b)F/R凝胶SEM形貌与元素分布;(c)PCS纳米球HAADF-TEM及元素面扫;(d)Zeta电位(n=3);(e)DLS粒径;(f)UV–vis吸收光谱;(g)PCS纳米球Ce 3d高分辨XPS;(h)PCS凝胶SEM与可注射测试;(i)PCS凝胶自修复过程照片及荧光图;(j)组织黏附实验;(k)红外热像与(l)光热升温曲线(浓度为PCS掺杂量);(m)PCS凝胶温度依赖G′/G″模量,相变温度≈41 °C;(n)光热增强形状适应演示及(o)覆盖面积分析(n=4)。数据以mean±SD表示,*p<0.05,**p<0.01,***p<0.001,****p<0.0001
(2)光热抗菌与抗生物膜性能
PCS凝胶在近红外照射下对浮游大肠杆菌、金黄色葡萄球菌及MRSA均具抗菌活性(图3a)。活/死染色与平板计数显示,PCS+NIR组死菌比例最高,红色荧光信号最强(图3b);红外测温证实同步光热升温(图3c)。菌落计数给出抑制率:革兰阴性菌97.6%、革兰阳性菌99.3%、MRSA 94.3%(图3d)。结晶紫染色表明,PCS+NIR处理后三种菌株生物膜形成量显著下降(图3e),对应OD570定量亦降低(图3f)。共聚焦活/死图像显示,生物膜整体呈红色荧光,存活菌量及膜厚度减少,致密结构瓦解并出现空腔(图3g);表面粗糙度统计结果一致证实膜结构破坏。
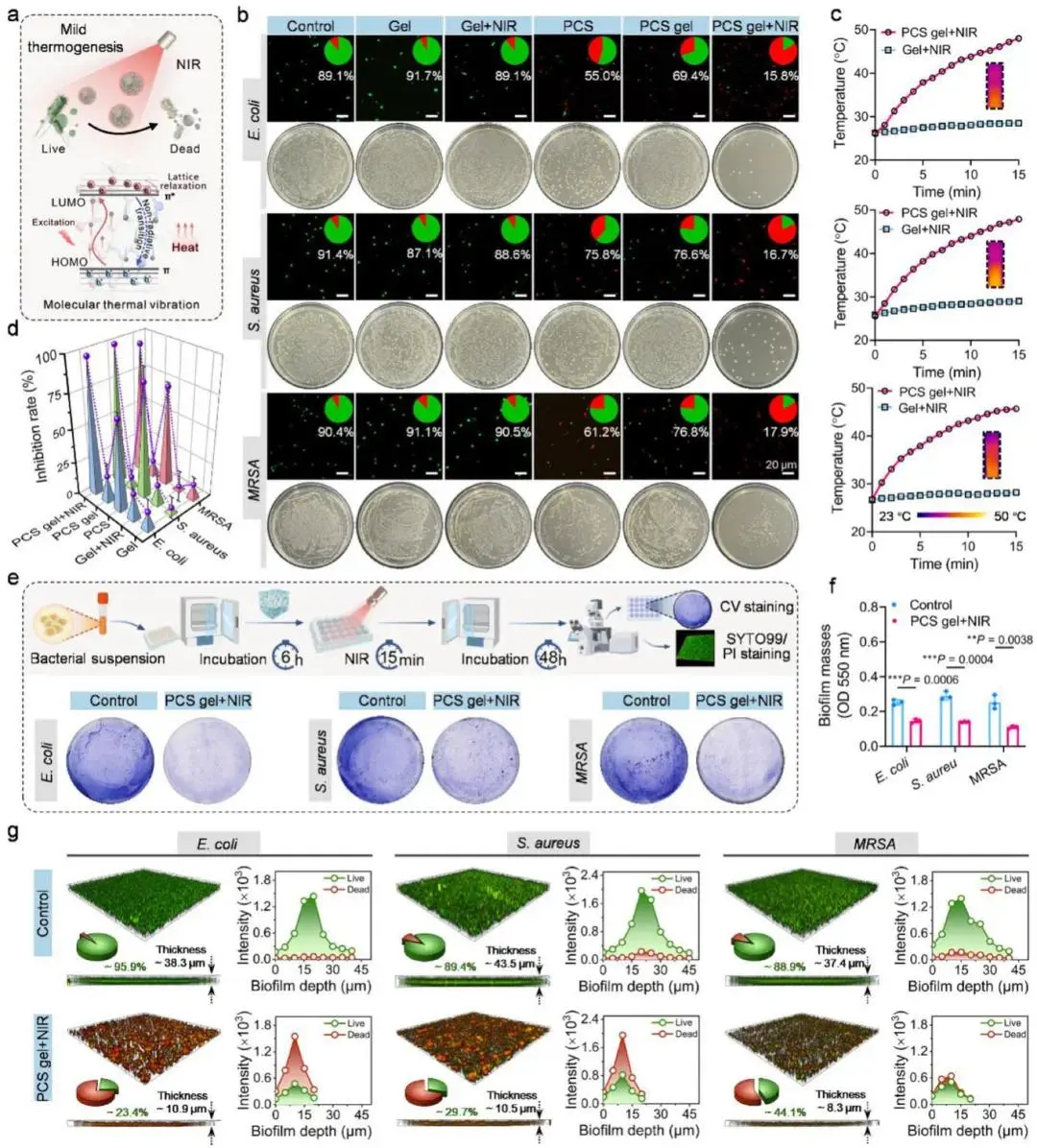
图3 光热抗菌与抗生物膜性能。(a)PCS凝胶光热杀菌示意图;(b)不同处理后活/死菌染色及菌落照片;(c)图b中Gel+NIR与PCS gel+NIR组光热升温曲线,附PCS gel+NIR红外热像;(d)对E. coli、S. aureus、MRSA的抑菌率统计(n=3);(e)生物膜抑制实验示意及结晶紫染色图像;(f)生物膜质量量化(n=3);(g)成熟生物膜内细菌活/死染色图及沿深度荧光强度定量
(3)PCS凝胶体外抗氧化及调控巨噬细胞极化
PCS纳米球具备Ce³⁺/Ce⁴⁺氧化还原偶与邻苯二酚/醌可逆转换双重活性,呈类纳米酶ROS清除能力(图4a-b)。ABTS与DPPH测定显示其自由基清除率随浓度升高而递增,且略优于PC纳米球;对·OH与O₂⁻·的清除趋势一致(图4c)。100 µg·mL⁻¹浓度下,·OH清除率53.0%,O₂⁻·清除率58.8%(图4d)。该纳米球同时呈现类过氧化氢酶活性,可在H₂O₂存在下持续释氧。tBHP诱导的氧化应激模型中,PCS纳米球、PCS凝胶及PCS凝胶+NIR均显著降低HUVECs与3T3细胞内的ROS荧光强度(图4e);共聚焦成像证实,PCS纳米球单用即可清除胞内ROS,经凝胶包裹后效率略降,NIR照射后恢复至接近单用水平(图4f)。流式检测表明,LPS刺激使巨噬细胞向M1极化,PCS凝胶+NIR干预逆转该趋势,M2占比升至62%,M1阳性率下降3.5倍,M2阳性率升高19.0倍(图4g)。
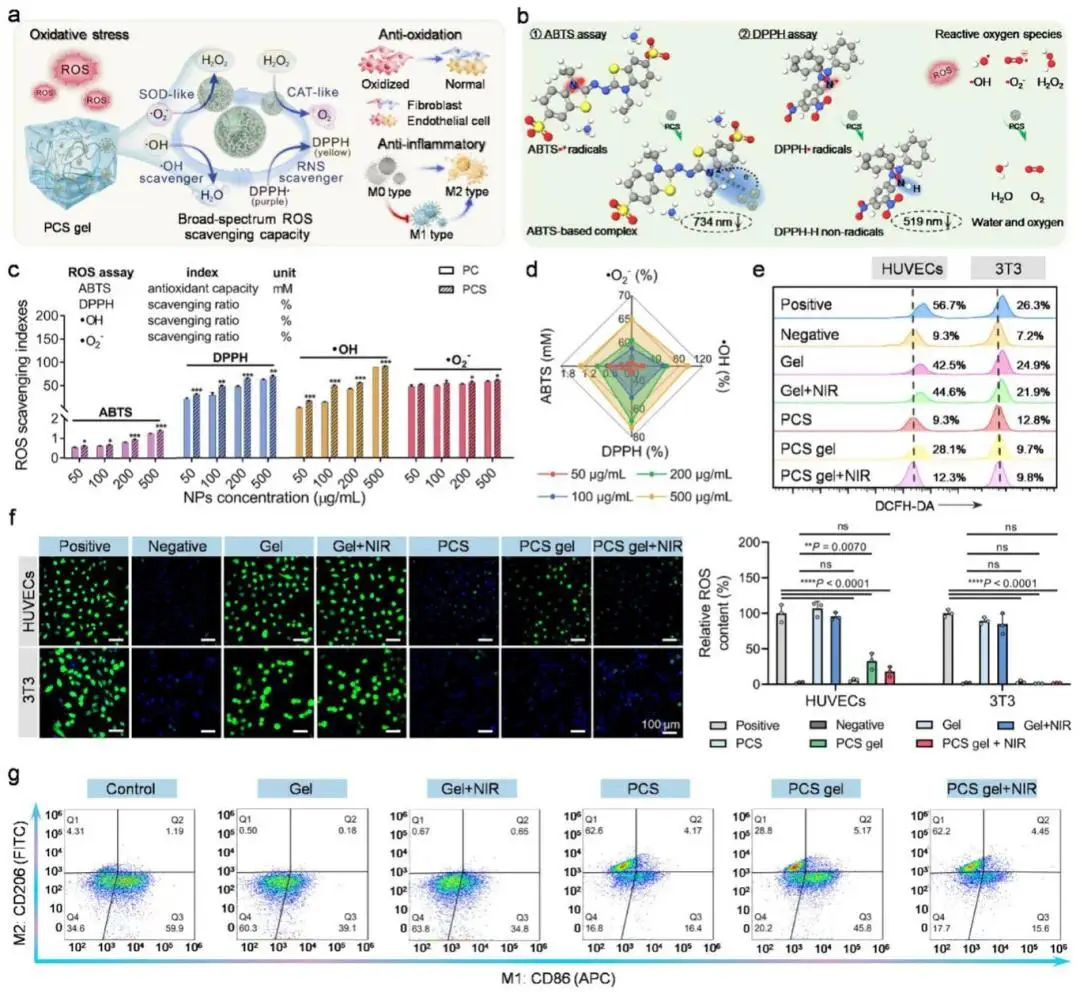
图4 PCS凝胶体外抗氧化及调控巨噬细胞极化。(a)凝胶清除ROS与抗炎机制示意图;(b)PCS纳米球对多种自由基的清除路径;(c)ABTS+•、DPPH•、•OH、O₂⁻清除率测定(n=3);(d)各自由基清除效率雷达图;(e)HUVEC与3T3胞内ROS流式分析;(f)DCFH-DA荧光CLSM图像及统计(n=3);(g)不同处理后M1/M2巨噬细胞比例流式分析
(4)药物释放、CD36抑制及生物相容性评价
SalB释放速率随pH降低而升高,且可在NIR照射下进一步加快并呈脉冲式释放(图5a–c)。PCS纳米球、PCS凝胶及PCS凝胶+NIR均下调3T3细胞CD36表达,游离SalB阳性对照结果一致,空白凝胶无影响(图5d,e)。活/死染色显示PCS凝胶对HUVECs与3T3细胞无毒性(图5f);CCK-8检测表明PCS纳米球≤400 µg·mL⁻¹时细胞活性无显著变化(图5g)。溶血实验表明PCS凝胶上清澄清,红细胞完整,溶血率<2%(图5h,i)。小鼠皮下植入荧光标记凝胶后,荧光2 d内迅速衰减,9 d完全消失,提示完全降解(图5j,k);28 d取材局部皮肤无炎症、无溃疡,H&E染色未见异常(图5l)。
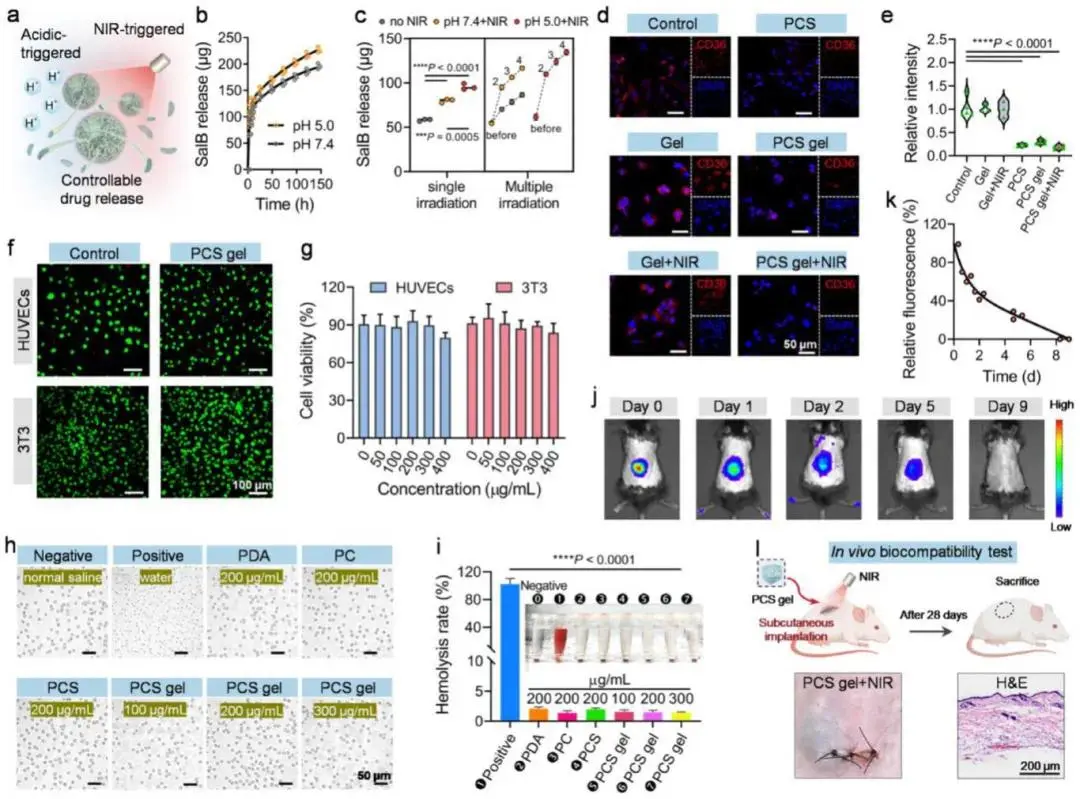
图5 药物释放、CD36抑制及生物相容性评价。(a)PCS纳米球酸/NIR触发释药示意图;(b)不同pH±NIR下SalB释放曲线(n=3);(c)累积释药量统计(n=3);(d)3T3细胞CD36免疫荧光图及(e)定量分析;(f)HUVEC/3T3活死染色与(g)24 h CCK-8活力(n=6);(h)红细胞显微图及(i)溶血率(n=3);(j)小鼠背部植入后9 d活体荧光成像与(k)相对荧光强度;(l)皮下植入实验流程及皮肤H&E切片
(5)PCS凝胶促小鼠急性感染创面快速抗疤愈合
MRSA感染全层缺损模型中,PCS凝胶+NIR组创面愈合最快:第4、7、14天未愈合面积依次降至40.4%、9.0%、1.1%,愈合率98.9%(图6a,c,d(i),e);NIR照射期间创面温度维持≈42 °C(图6b)。第28天,该组新生表皮连续平整,瘢痕色素指数接近正常,无增生性瘢痕(图6c,d(ii),f)。第7天,组织学见炎症浸润减少,CD31荧光强度升高(图6h,i);第14天Ki67下降,提示进入重塑期(图6h,i)。Masson染色显示该组第14天胶原面积最高,第28天低于其余各组,且胶原排列呈多孔微结构(图6g)。免疫荧光定量表明,PCS凝胶+NIR下调胶原I、上调胶原III,胶原III/I比值升高;β3-Tubulin与CK19荧光强度增加,显示神经与毛囊再生潜能;CD36及TGF-β在第14、28天均下调。血液与主要脏器指标未见异常,证实治疗安全性。
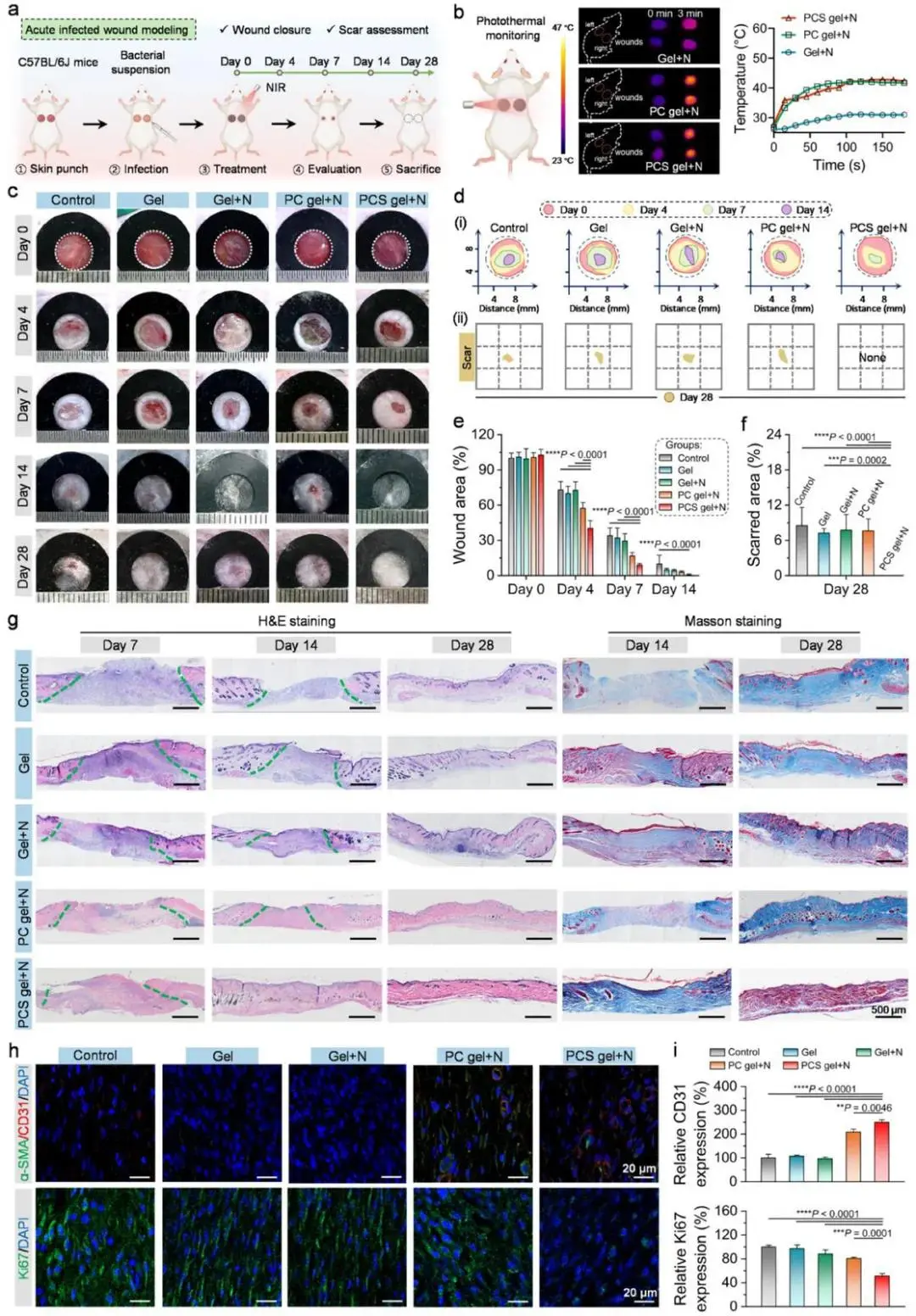
图6 PCS凝胶促小鼠急性感染创面快速抗疤愈合。(a)急性感染创面实验流程;(b)NIR处理时创面红外热像及温度变化;(c)第0–28天创面愈合照片;(d)第0–14天创面面积变化模拟图(上)及第28天疤痕面积(下);(e)第0–14天创面面积统计(n≈5–10);(f)第28天疤痕面积量化(n=5);(g)第7、14、28天创面H&E与Masson染色,虚线示未愈合区;(h)第7天CD31/α-SMA与第14天Ki67免疫荧光图;(i)CD31、Ki67荧光强度定量(n=3)
(6)PCS凝胶加速糖尿病慢性感染创面愈合并减轻瘢痕
STZ诱导糖尿病小鼠血糖维持>16.7 mM,慢性创面经PCS凝胶+NIR处理后愈合最快:第4天剩余创面45.1%,第7天降至15.3%,显著低于对照组85.9%(图7a,e,f)。照射阶段创面温度升高至≈42 °C(图7c,d)。第14天该组完成上皮化,第28天新生表皮与周围皮肤色差为零,表面平整,瘢痕面积≈0%(图7f,g)。感染评估显示,第4天PCS凝胶+NIR组细菌负荷已降至最低;第7天87.5%的该组创面进入增殖期;第28天全部创面无可视瘢痕,而PC凝胶+NIR组80%仍留瘢痕(图7h)。雷达图综合评分表明,PCS凝胶+NIR在感染控制、炎症消退、创面闭合及瘢痕抑制四项指标均居首(图7i)。
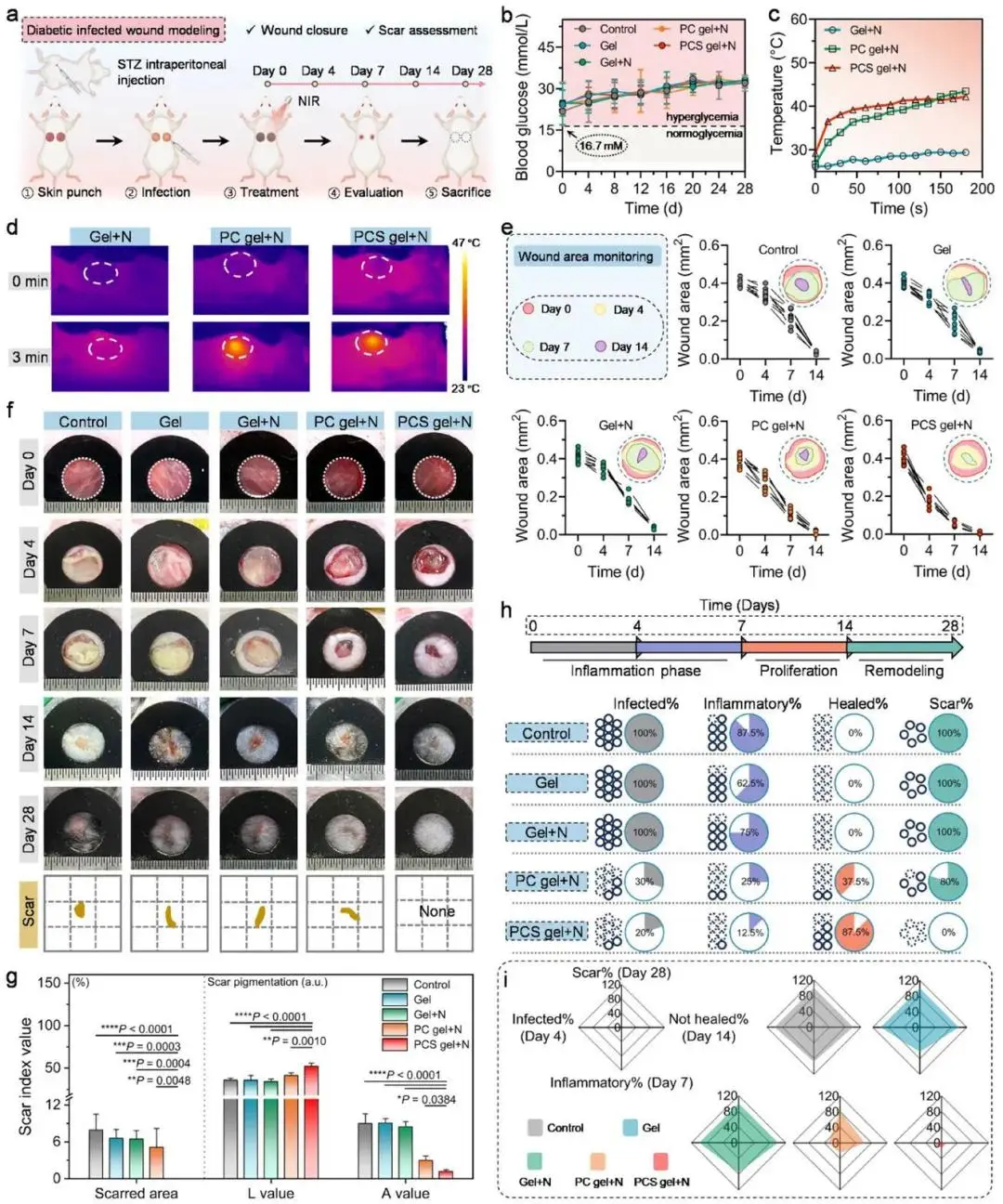
图7 PCS凝胶促进糖尿病小鼠感染创面快速抗疤愈合。(a)糖尿病感染创面实验流程;(b)28天血糖监测;(c)NIR处理时创面温度变化及(d)红外热像;(e)第0–14天创面面积模拟图与曲线;(f)第0–28天愈合照片及第28天疤区模拟图;(g)第28天疤面积与色度统计(n=5,L值越高越白,A值越高越红);(h)第4、7、14、28天四节点细节对比,实圆=是,虚圆=否;(i)各组修复效应系统比较
(7) PCS凝胶加速糖尿病慢性感染创面愈合并减轻瘢痕
PCS凝胶+NIR组在糖尿病慢性创面第2、4天渗出液细菌培养阴性,体内抗菌效率与PC凝胶+NIR组相当(图8a,b(i))。第7天H&E显示该组炎症浸润最轻,对照组密集炎细胞聚集(图8a,b(ii))。第14天再生区毛囊与皮脂腺数量高于其余各组,CK10免疫荧光示完整表皮层,CK10/CK19共标显示毛囊结构已重建(图8a,c)。第28天该组表皮厚度最低,组织学表现接近正常皮肤(图8a,b(iv))。Masson染色定量表明,第14天胶原面积分数最高,第28天降至最低,分形维数减小、孔隙率升高,胶原排列呈规则多孔网(图8a,d);β3-Tubulin荧光强度显著升高,证实微神经再分布(图8a,c)。免疫荧光时序分析:第4天DHE信号几乎消失,CD86⁺M1巨噬细胞减少,CD206⁺M2细胞增多,M1/M2比值下降(图8e,f),qRT-PCR同步验证iNOS下调、Arg1上调。第7天CD31/α-SMA共定位面积最大,FGF2荧光强度峰值出现,提示血管新生活跃(图8e,f)。第14天Ki67⁺细胞比例最低,表明增殖关闭;胶原I荧光减弱而胶原III增强,Col1a1 mRNA下降约55%,Col3a1升高4.9倍(图8e,f)。肝、肾、脾及血常规、体重曲线均无统计学差异,提示系统毒性缺失。
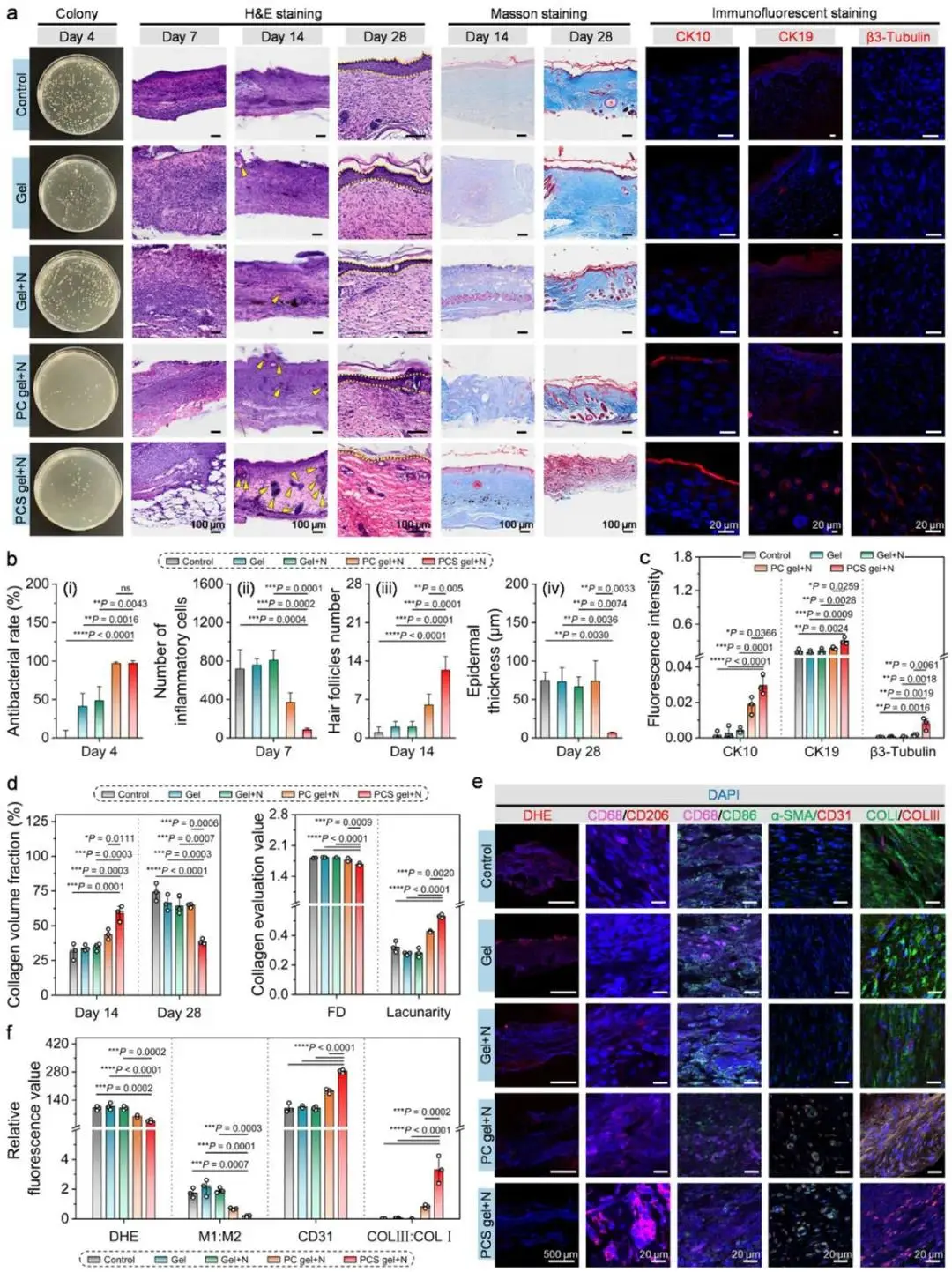
图8 PCS凝胶加速糖尿病慢性感染创面愈合并减轻瘢痕。(a)第4天创面渗出液菌落、第7/14/28天H&E、第14/28天Masson及第14天CK10/CK19/β3-Tubulin免疫荧光图,黄色三角示新生附件,虚线标表皮厚度;(b)抑菌率、炎细胞数、毛囊数、表皮厚度统计(n=3);(c)CK10/CK19/β3-Tubulin荧光强度定量(n=3);(d)第14/28天胶原沉积、第28天胶原分形维数与孔隙率分析(n=3);(e-f)第4天ROS(DHE)、M1/M2巨噬(CD68/CD206/CD86)、第7天新生血管(CD31/α-SMA)及第14天胶原分型(COLI/COLIII)免疫荧光与定量(n=3)
(8)AG-gel的体内和体外生物安全性评估
SalB经PCS凝胶递送后持续拮抗CD36,体外已验证其抑制3T3细胞CD36过表达(图5d,e)。体内时序显示,第14天对照、Gel、Gel+N及PC gel+N组创面CD36荧光强度维持高位,PCS凝胶+NIR组信号显著降低,qRT-PCR同步证实mRNA下调,且该优势保持至第28天(图9a,b)。伴随CD36下降,TGF-β表达同步减少,提示二者协同抑制真皮纤维化。流式鉴定成纤维细胞亚群:第7天PCS凝胶+NIR组网状成纤维细胞比例下降,脂质成纤维细胞比例升高;至第28天亚群分布与正常皮肤趋近(图9c-f)。RNA-seq主成分分析将PCS凝胶+NIR组与对照组完全分离(图9g),火山图检出945个差异基因(509下调、436上调),促炎及纤维化基因显著抑制,皮肤附件与神经发生相关基因上调(图9h)。GO富集显示“皮肤发育”“毛囊发育”被正向激活,氧化应激与免疫应答过程被抑制(图9i)。转录因子JUN表达降低最为突出(图9j)。GSEA与KEGG共同表明TGF-β信号通路及炎症相关通路被显著抑制(图9k,l)。蛋白互作网络证实CD36关联节点全部下调。综上,PCS凝胶通过光控释放SalB阻断CD36,协同NIR光热抑制JUN介导的炎症与纤维化级联,重塑免疫-基质微环境,实现快速愈合与抗瘢痕修复。
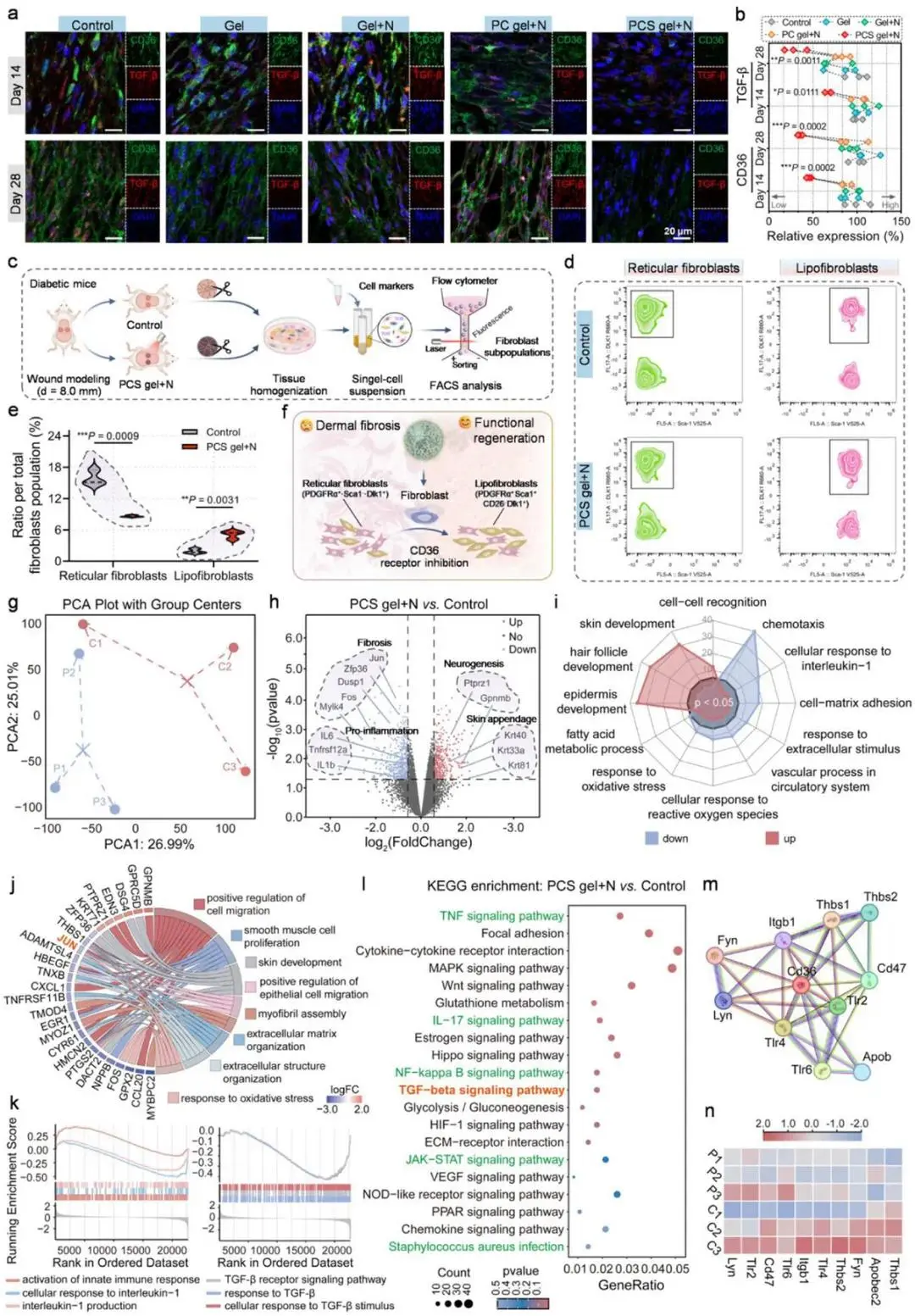
图9 PCS凝胶通过抑制CD36调控成纤维细胞亚群与转录组减轻纤维化。(a)第14/28天创面CD36(绿)与TGF-β(红)免疫荧光及(b)相对表达量;(c)FACS分离成纤维细胞亚群示意(n=3);(d)网状成纤维细胞与脂成纤维细胞流式图及(e)PCS凝胶+NIR后亚群变化(n=3);(f)CD36抑制调控亚群模式图;(g)RNA-seq PCA(C1-3:对照,P1-3:PCS凝胶+NIR);(h)差异基因火山图标注纤维化/炎症/附件/神经相关基因;(i)GO富集雷达图;(j)GO通路差异基因弦图;(k)GSEA炎症(左)与纤维化(右)通路;(l)Top20 KEGG通路;(m)CD36相关蛋白互作网络及(n)表达热图(n=3)
(9)PCS凝胶抑制兔耳增生性疤痕
兔耳增生性瘢痕模型中,PCS凝胶+NIR组第14天创面完全闭合,其余组延迟至第21天(图10a–c(i),d)。第21天瘢痕面积占初始创面比例降至71.2%,显著低于对照组89.7%;第30天再生皮肤颜色、平整度及弹性与周边正常皮肤最接近(图10b,c(ii),d)。超声成像显示该组真皮界面平整规则(图10e)。H&E表明表皮厚度减小且表面连续规整(图10e),瘢痕指数、皮肤厚度及凸起角度均最低(图10f,g)。Masson染色可见胶原沉积致密有序,纤维取向分布集中于0°附近,呈高度定向排列,与其他组无序分布形成对比(图10e,h(i)–(vi));象限百分比分析亦证实胶原排列集中规整。
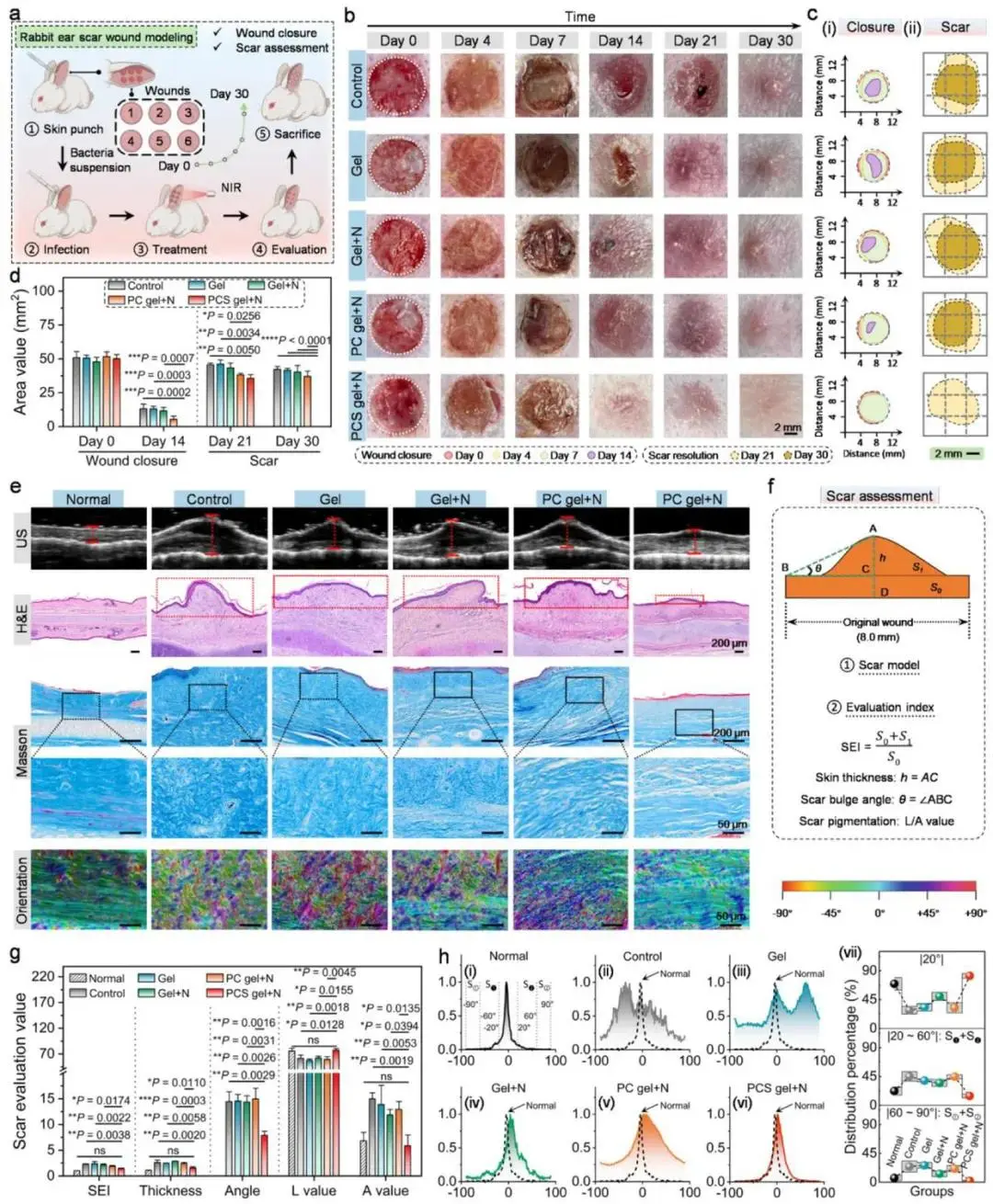
图10 PCS凝胶抑制兔耳增生性疤痕。(a)兔耳细菌感染创面建模流程;(b)第0–30天创面照片;(c)第0–14天闭合模拟(左)及第21–30天疤痕面积模拟(右,标尺2 mm);(d)创面/疤痕面积统计(n=3);(e)超声(红线示厚度)、H&E(红框示隆起)、Masson及胶原排列图;(f)增生组织疤痕评价指标示意;(g)第30天SEI、厚度、隆起角度、色度统计(n=3);(h)Masson胶原取向分布曲线(i–vi)及∣20°∣、∣20–60°∣、∣60–90°∣三区间占比(vii,n=3)
本研究开发了一种光液化PCS凝胶,通过整合免疫调节和成纤维细胞亚型调控功能,实现了感染性难愈合伤口的快速无疤痕修复。该凝胶通过协同光热抗菌、纳米酶维持氧化还原稳态以及持续抑制CD36调控成纤维细胞亚型,在小鼠和兔耳伤口模型中均显著加速愈合并抑制疤痕形成,其效果优于对照组。研究证实抑制CD36过度表达可调节成纤维细胞活化,揭示了靶向CD36在实现安全无疤痕愈合中的抗纤维化潜力。这一策略为平衡组织再生与病理性纤维化提供了新思路,展现了材料科学与分子生物学协同调控病理愈合轨迹的优越性。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

