
研究背景:
创伤性脑损伤(TBI)是全球致死致残的首位外伤性疾病,原发损伤不可逆,继发损伤又缺乏有效拦截手段;加之患者损伤异质极大,现行药物、手术及康复均无“通用型”方案。近年来,神经干细胞外泌体(NSC-Exo)虽显示神经修复潜力,却受限于来源稀缺、伦理争议和规模化瓶颈。我们前期由体细胞重编程获得的诱导神经干细胞外泌体(iNSC-Exo)已证实安全有效,但能否用于TBI、如何兼顾轻-中-重不同临床场景并突破“肝脾截留、脑内寡聚”的递送难题,仍是空白。

针对上述问题,同济大学医学院附属上海市第四人民医院郑加麟/谈扉团队受临床术式与药物靶向递送启发,构建了一种“双模”iNSC-Exo治疗平台:对需开颅的重型TBI,将外泌体载入3秒可注射、28天缓释的羧甲基壳聚糖/海藻酸钠水凝胶(iNSC-Exo@Gel),实现损伤腔原位91%持续释放;对轻中型TBI,则用狂犬病毒糖蛋白RVG修饰外泌体,静脉给药后脑内富集度提高2倍。单细胞测序显示,两种途径均激活小胶质细胞亚群Microglia_Nrg3/Rarb的NRXN-Nlgn1轴,重建神经元-小胶质突触连接,从而统一解释跨场景疗效,为TBI提供兼顾手术与非手术患者的“通用型”外泌体精准治疗新范式。该文章于2025年9月24日以《Clinically Inspired Multimodal Treatment Using Induced Neural Stem Cells-Derived Exosomes Promotes Recovery of Traumatic Brain Injury through Microglial Modulation》为题发表于《Advanced Science》(DOI: 10.1002/advs.202508574)。
(1)神经球和外泌体的表征表明 iNSC-Exo 和 NSC-Exo 之间具有很强的相似性
为了评估外泌体对 TBI 恢复的治疗效果,分离了 NSC-Exo 和 iNSC-Exo 用于临床前研究(图 1A)。在悬浮培养中,NSC 和 iNSC 产生的神经球都表现出球形形态(图 1B)。这些神经球对神经干细胞标志物 Nestin(红色)和 SOX2(绿色)呈阳性(图 1C)。NSC-Exo 与 iNSC-Exo 均呈典型杯状/椭圆形态,粒径分别为 102 nm 与 150 nm(图 1D-E);神经球 Nestin/SOX2 双阳性(图 1C)。CD81、CD63、CD9 高表达。PKH26 标记显示两种外泌体均可被 BV2(图 1F)及 PC12有效摄取,胞浆内荧光均匀分布;iNSC-Exo 摄取量与剂量呈正相关。
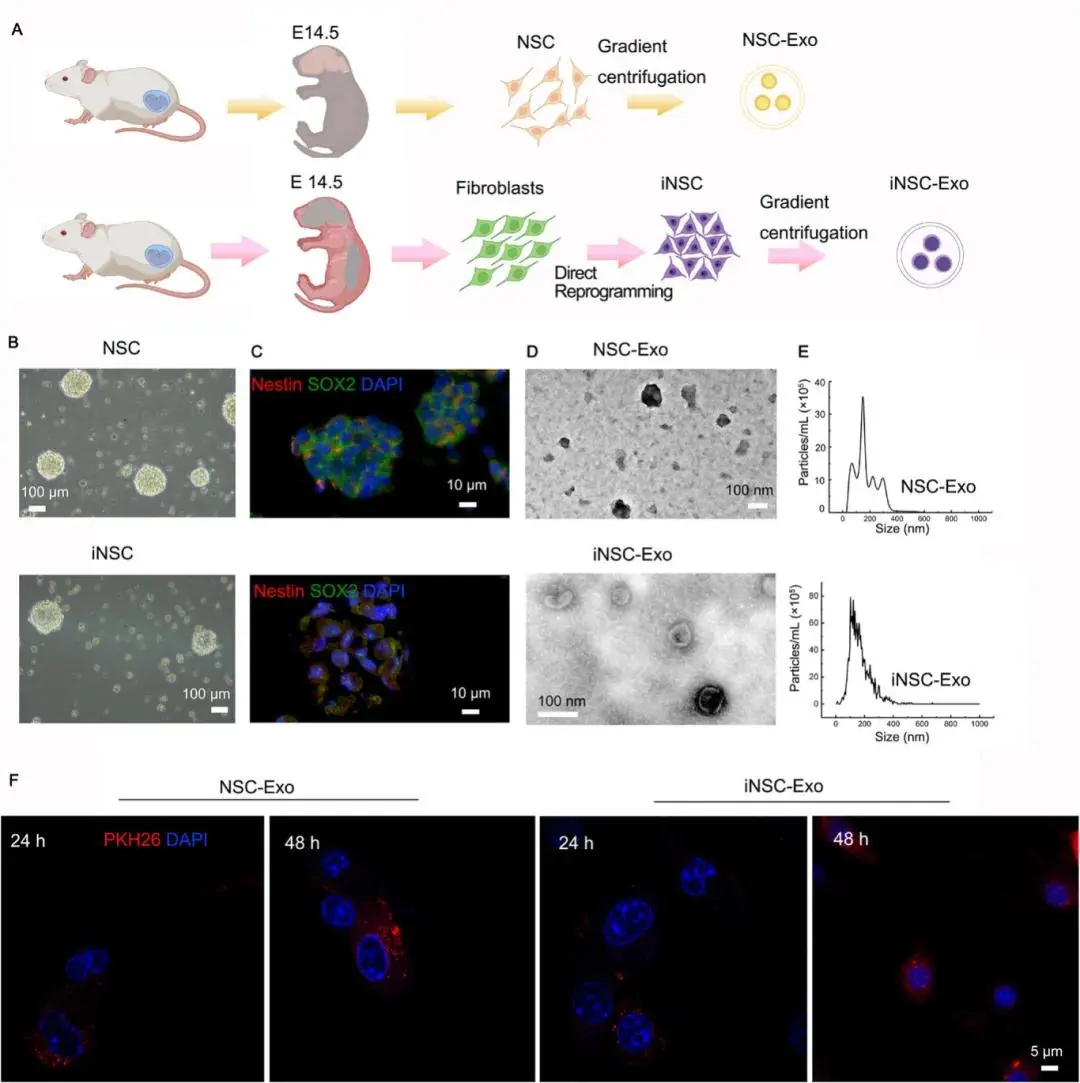
图1 神经球与外泌体的表征。(a) NSC-Exo与iNSC-Exo分离流程示意图;(b) 增殖条件下NSC与iNSC形成神经球的明场照片;(c) NSC与iNSC中SOX2和Nestin免疫荧光共标;(d) TEM显示NSC-Exo与iNSC-Exo呈杯状或椭圆形态;(e) NSC-Exo与iNSC-Exo的粒径分布;(f) PKH26标记的NSC-Exo及iNSC-Exo(红色)被BV2细胞摄取,DAPI染核(蓝色)
(2)iNSC-Exo 和 NSC-Exo 均抑制神经炎症并改善体外轴突生长
LPS刺激使BV2细胞M1标志物(CD86、TNF-α、iNOS)升高、M2标志物(CD206、TGF-β、IL4)降低;NSC-Exo与iNSC-Exo共培养后M1下调、M2上调,TNF-α蛋白减少、IL4增加(图2B-C)。划痕损伤PC12细胞中,NSC-Exo及iNSC-Exo均提升Nestin、NF-200、GAP-43转录水平并显著延长神经突长度,二者促轴突再生效应相当(图2E-G)。
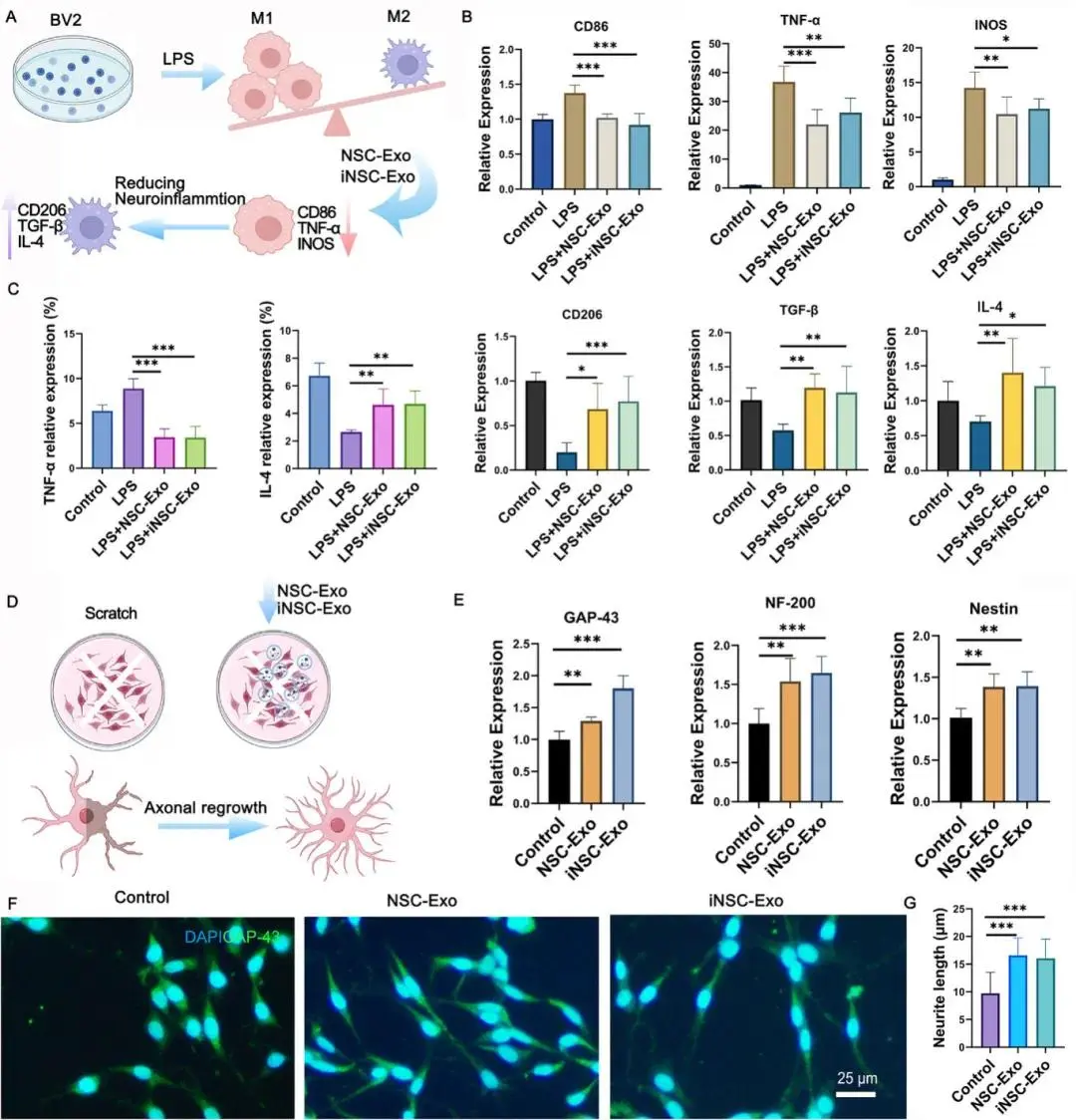
图2 NSC-Exo与iNSC-Exo体外抑制神经炎症并促进轴突生长。(a) BV2细胞实验流程示意图;(b) Q-PCR检测M1/M2标志物CD86、TNF-α、iNOS、CD206、TGF-β、IL-4表达(n=6);(c) 流式细胞术定量TNF-α与IL-4蛋白水平(n=6);(d) PC12细胞划痕实验示意图;(e) Q-PCR检测GAP-43、NF-200、Nestin转录水平(n=6);(f) GAP-43免疫荧光代表图及(g)神经突长度量化(n=50)
(3)开颅手术后并使用可注射水凝胶可以实现外泌体局部递送至 TBI 缺损
CMCS/SA/GDL 水凝胶 20 °C 下 547±98 s 完成原位成胶,孔隙互通,CMCS 氨基与 SA 羧基形成 3D 网络;初始分解温度 175 °C,4 周内脑内完全降解且无炎症反应。载外泌体 28 d 累计释放 91.45±16.27%,植入组荧光信号持续至第 21 天,显著优于单纯注射组,实现外泌体长效滞留。
(4)局部递送 iNSC-Exo 可保护小鼠 TBI 后血脑屏障,减少脑水肿,促进功能恢复
为了全面验证使用注射水凝胶(iNSC-Exo@Gel)局部递送的 iNSC-Exo 的治疗效果,进行了一系列神经学实验(图 3A)。术后第7天,iNSC-Exo@Gel与NSC-Exo@Gel均降低EB渗出量并减少脑水含量,H&E显示损伤面积缩小(图3B–E、H)。平衡木与转棒实验示,两治疗组错步率持续下降,转棒停留时间升至TBI组的1.5倍(图3F–G)。Iba-1、GFAP表达下调,GAP-43、DCX上调,提示炎症抑制与轴突再生;肝肾功能指标及主要脏器组织学无异常。
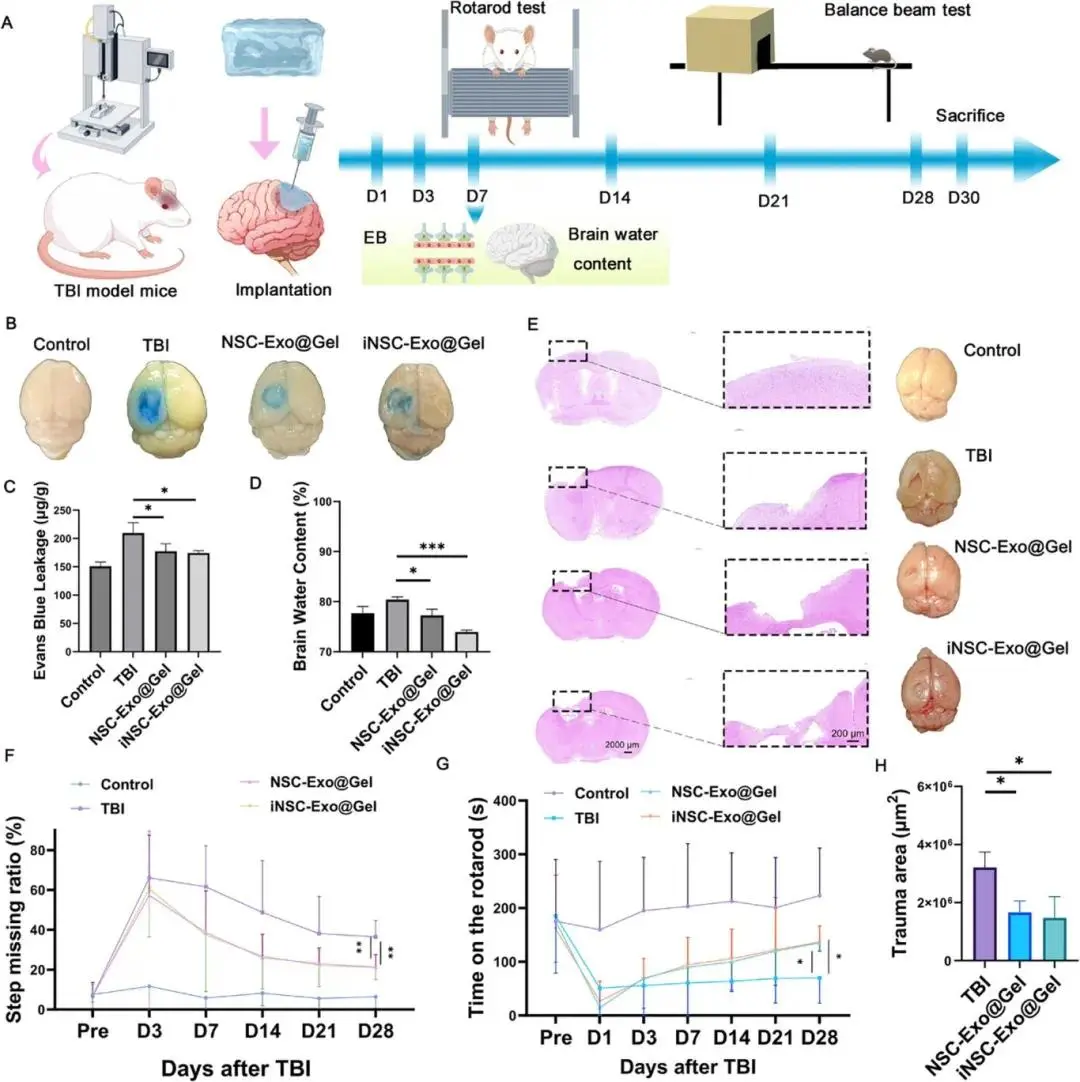
图3 开颅注射水凝胶递送外泌体。(a) 建模-给药-行为测试流程;(b) 术后7天EB渗出代表图及(c) 定量(n=3);(d) 脑水含量(n=3);(e) 28天H&E缺损区;(f) 平衡木错步率(n=6-9);(g) 转棒停留时间(n=6-9);(h) 损伤面积量化(n=3)
(5)RVG 改良策略通过体内 TBI 小鼠大脑的全身给药增强 iNSC-Exo 富集
静脉注射后,RVG-iNSC-Exo在脑内荧光信号强度于各时间点均高于未修饰iNSC-Exo,24与48 h离体脑半定量显示其脑蓄积量提升约2倍(图4A-D);主要外周分布仍为肝、脾、肺(图4E-G)。DiD/FITC双标结果显示RVG-iNSC-Exo与Iba-1阳性微胶质细胞共定位,证实其被脑内微胶质细胞摄取(图4H)。

图4 RVG修饰提升iNSC-Exo脑富集。(a) 静脉注射后0.5–96 h活体脑DiD荧光;(b) 离体脑及主要器官24、48、96 h荧光图;(c) 脑荧光强度量化(n=5);(d) 脑离体半定量(n=3);肝、脾、肺等器官24 h (e)、48 h (f)、96 h (g)荧光强度;(h) Iba-1(红)共定位显示RVG-iNSC-Exo-FITC(绿)/DiD(黄)被微胶质细胞摄取
(6)全身给予 RVG 修饰的 iNSC-Exo 可改善小鼠 TBI 后运动功能,增加认知能力,增强认知恢复
RVG-iNSC-Exo组转棒停留时间及握力评分均高于未修饰组与TBI组(图5B–C)。Morris水迷宫5日训练中,RVG-iNSC-Exo组逃避潜伏期最短,空间策略占比提高,第6天探查试验目标象限停留时间与平台穿越次数均优于TBI组(图5D–H)。海马LFP显示,RVG-iNSC-Exo恢复θ、γ波段功率至对照水平(图5I–K)。组织学:RVG-iNSC-Exo组 lesion 面积缩小,组织结构完整,主要脏器无毒性改变。
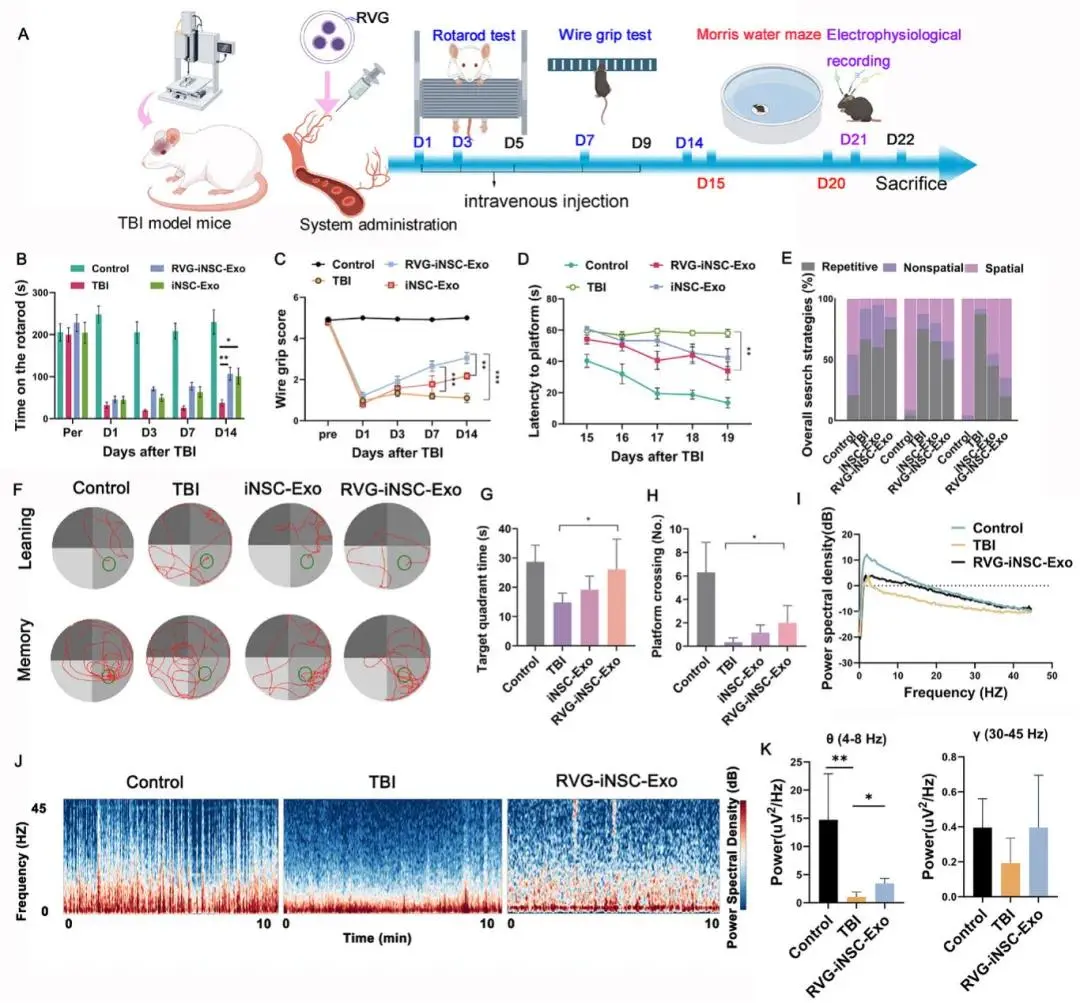
图5 RVG-iNSC-Exo静脉给药提升TBI小鼠运动与认知恢复。(a) 实验时间轴;(b) 转棒成绩(n=6–9);(c) 握力评分(n=6–9);(d) 水迷宫学习期逃避潜伏期(n=6–9);(e) 搜索策略分布;(f) 游泳轨迹图;(g) 目标象限停留时间与(h) 平台穿越次数(n=6–9);(i) 海马LFP功率谱;(j) 时频图;(k) θ、γ波段功率量化(n=3)
(7)单细胞测序显示,小胶质细胞是 TBI 小鼠大脑中受 iNSC-Exo 治疗影响的主要细胞类型
损伤后第30天皮层-海马snRNA-seq共获113 802个细胞,分11型,iNSC-Exo组神经再生、学习记忆相关通路在三群神经元中显著上调(图6A-C)。细胞比例显示iNSC-Exo提高微胶质、少突胶质与星形胶质占比,Augur确定微胶质变化最显著(图6D-E;图S13)。微胶质进一步划分为Microglia_Nrg3、Mbp、Rarb、Atp1a2、Trem2五群,特征基因表达见UMAP(图6F-G)。

图6 单核测序显示iNSC-Exo主要影响微胶质。(a) UMAP展示11种细胞类群(n=9,3组各3例);(b) 各型标记基因点图;(c) GSVA示3群神经元再生/学习记忆通路活性;(d) 细胞类型比例柱状图;(e) Augur AUC值棒棒糖图突出微胶质变化最大;(f) 五色UMAP划分5个微胶质亚群;(g) 各亚群特征基因表达UMAP图
(8)分化状态降低的Microglia_Nrg3 和Microglia_Rarb 亚群通过 iNSC-Exo 治疗介导神经修复功能
伪时序分析显示Microglia_Nrg3与Microglia_Rarb位于分化轨迹起始端,TBI组该两群密度增高而iNSC-Exo组恢复至对照水平(图7A-C)。CytoTRACE得分最高证实其低分化特性(图7E),差异表达分析亦显示该两群变化最显著(图7F)。GO/KEGG富集表明cluster 1基因集中于突触与轴突信号通路,相关基因在伪时序早期高表达(图7G-H)。

图7 低分化Microglia_Nrg3/Rarb介导iNSC-Exo修复。(a) Monocle伪时序轨迹(上:亚群,下:时间);(b) 三组微胶质密度galaxy图;(c) 轨迹分组;(d) 伪时序基因表达ridge图及四簇热图;(e) CytoTRACE分化状态;(f) iNSC-Exo vs TBI差异基因;(g) cluster 1 GO/KEGG气泡图;(h) 突触/轴突基因表达动力学
(9)iNSC-Exo 治疗可通过激活 NRXN 信号通路改善小胶质细胞与神经元之间的突触连接
CellChat显示iNSC-Exo组微胶质-神经元互作数最高,Microglia_Nrg3/Rarb为主要信号发送者,传递强度优于TBI组(图8A–B)。NRXN-Nlgn1与NRG-Erbb4通路在TBI后减弱、iNSC-Exo后增强,信号流差异显著(图8C–E)。配体-受体互作图证实Microglia_Nrg3/Rarb通过Nrxn1-3及Nrg1-3与神经元突触蛋白结合,作用强度回升(图8F)。GSVA示该两群神经再生、发育及自噬功能上调;SCENIC鉴定Bclaf1、Foxp2转录因子调控NRXN/NRG,其regulon活性在iNSC-Exo组显著升高(图8G–H)。

图8 iNSC-Exo激活NRXN通路增强微胶质-神经元突触连接。(a) 细胞互作数差异热图;(b) 信号收发强度变化;(c) Microglia_Nrg3/Rarb信号差异;(d) NRXN与NRG互作网络;(e) 三组通路信号流堆叠图;(f) Microglia_Nrg3→神经元分子 dot 图;(g) GSVA 示三群神经元通路活性;(h) SCENIC 构建 NRXN/NRG 转录调控网络
本研究构建了一种具备可注射性和原位成胶能力的羧甲基壳聚糖/海藻酸钠/D-葡萄糖酸-δ-内酯水凝胶,兼具优异的热稳定性与脑内生物相容性,4周内可完全降解且无炎症反应。该水凝胶通过扩散-溶蚀双重机制实现外泌体持续释放,28天内累计释放率达91%,显著延长了外泌体在损伤部位的滞留时间。在创伤性脑损伤(TBI)模型中,负载诱导神经干细胞源外泌体(iNSC-Exo)的水凝胶能有效修复血脑屏障、减轻脑水肿并促进运动与认知功能恢复。同时,经RVG修饰的iNSC-Exo通过静脉注射可实现跨血脑屏障高效富集,进一步提升神经功能修复效果。单细胞测序结果显示,iNSC-Exo通过调控特定小胶质细胞亚群,增强突触连接并激活神经再生相关通路。综上,该水凝胶-外泌体一体化平台整合局部持续释放与系统靶向给药双重策略,为TBI的精准治疗提供了创新且具转化潜力的解决方案。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

