
种植体周围炎是威胁口腔种植体长期成功的首要并发症,患者级患病率高达19.83%,5年种植体级累积并发症率更达43.9%;其病理核心为“细菌感染-炎症浸润-氧化应激”三重打击,导致支持骨不可逆吸收。现行机械清创与脱蛋白牛骨基质联用方案无法彻底清除螺纹深部病原,亦缺乏对高ROS环境的主动调控,成骨效果受限,且氧化应激水平与骨破坏呈正相关却未被针对性干预。

针对上述问题,武汉大学口腔医院吴涛团队开发了一种名为Bonyzymes的多功能智能骨修复材料。该材料创新性地将介孔羟基磷灰石(MHA)三维支架与CeO₂-Cu异质结纳米酶相复合,利用界面电荷转移机制将纳米酶的CAT与SOD活性提升一个数量级,从而同步实现高效ROS清除、广谱抗菌(尤其对牙龈卟啉单胞菌近乎灭菌)及增强骨诱导的三重功能。这种"材料-生物"一体化策略为种植体周围炎提供了"抗炎-抗菌-成骨"协同治疗的新范式。该文章于2025年6月25日以《Bonyzymes: Efficient Anti-Inflammatory, Antibacterial and Osteogenic Agents for Peri-Implantitis Reconstruction Treatment》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202503585)。
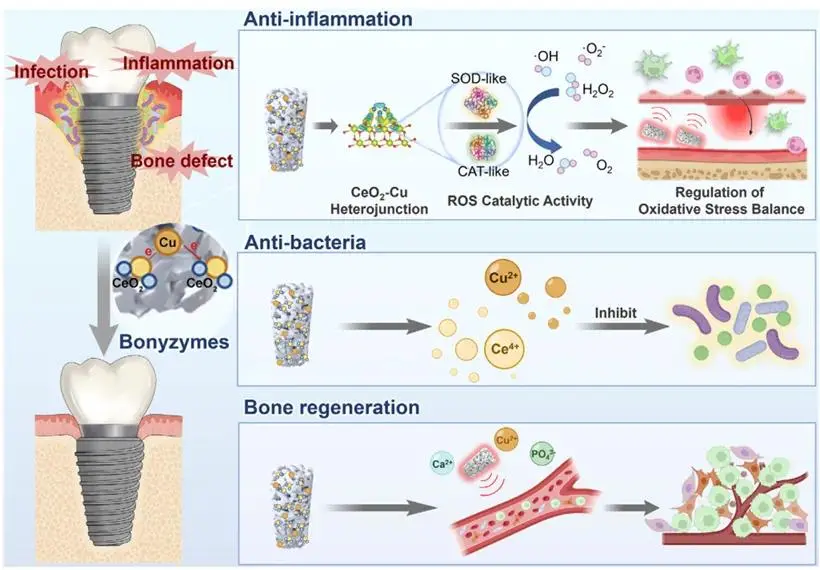
Bonyzymes治疗种植体周围炎的示意图:通过CeO₂-Cu异质结高效清除ROS、释放Cu²⁺杀菌、促进骨再生
(1)Bonyzymes的合成策略与结构表征
MHA载体由水热水合法制备后,经原位矿化-化学还原两步获得CeO₂-Cu异质结:MHA表面磷酸基团静电吸附Ce³⁺并原位生成CeO₂,再以水合肼还原锚定Cu纳米颗粒,形成稳定界面。FESEM与TEM(图1B,C)表明MHA呈棒状聚集体,CeO₂与Cu纳米颗粒均匀分布于基质及介孔;HRTEM(图1D)给出0.28 nm(HAp 211)、0.31 nm(CeO₂ 111)和0.21 nm(Cu 111)三组晶格条纹,证实三相共存。EDS面扫(图1E)显示Ca、P、O、Ce、Cu元素共分布。XRD(图1F)中,MHA仅出现Ca₅(PO₄)₃(OH)峰,引入CeO₂后方铈矿相峰出现,三元材料进一步呈现Cu(111)峰。XPS全谱(图1G)确认表面含Ca、P、O、Ce、Cu;高分辨Ce 3d(图1H,I)显示Cu负载后Ce³⁺峰强度显著上升,表面Ce³⁺比例由34.56%增至39.94%,Ce⁴⁺相应降低。
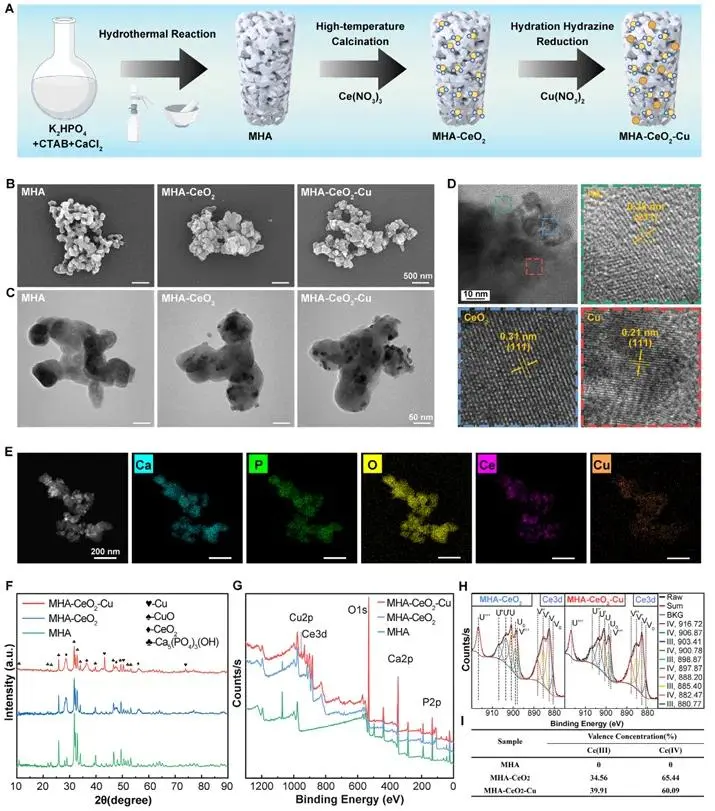
图1 MHA-CeO₂-Cu的表征:(A)合成示意图;(B)SEM图像;(C)TEM图像;(D)HRTEM晶格分析;(E)元素分布;(F)XRD图谱;(G)XPS全谱;(H)Ce 3d高分辨XPS;(I)Ce价态分析
(2)抗氧化性能的深度解析与催化机制阐明
图2A-D显示,MHA-CeO₂-Cu的CAT活性为158.6 U mg⁻¹,较MHA-CeO₂提高约12倍;SOD活性89.4 U mg⁻¹,提高近8倍;总抗氧化能力提高约100倍。DFT构建CeO₂(111)与CeO₂-Cu模型,Bader电荷分析表明Cu向CeO₂转移1.27 e⁻;差分电荷密度图(图2I)示Cu区耗尽、CeO₂表面氧位点积聚。该调制使SOD决速步能垒由0.9945 eV降至0.654 eV,CAT由2.4917 eV降至1.2451 eV(图2G,H)。DOS(图2J)表明Cu-3d与Ce-4f杂化,增强界面电子传输。级联反应将·O₂⁻→H₂O₂→H₂O+O₂(图2K),通过阻断ROS-NF-κB-破骨分化通路为骨再生提供低ROS微环境。
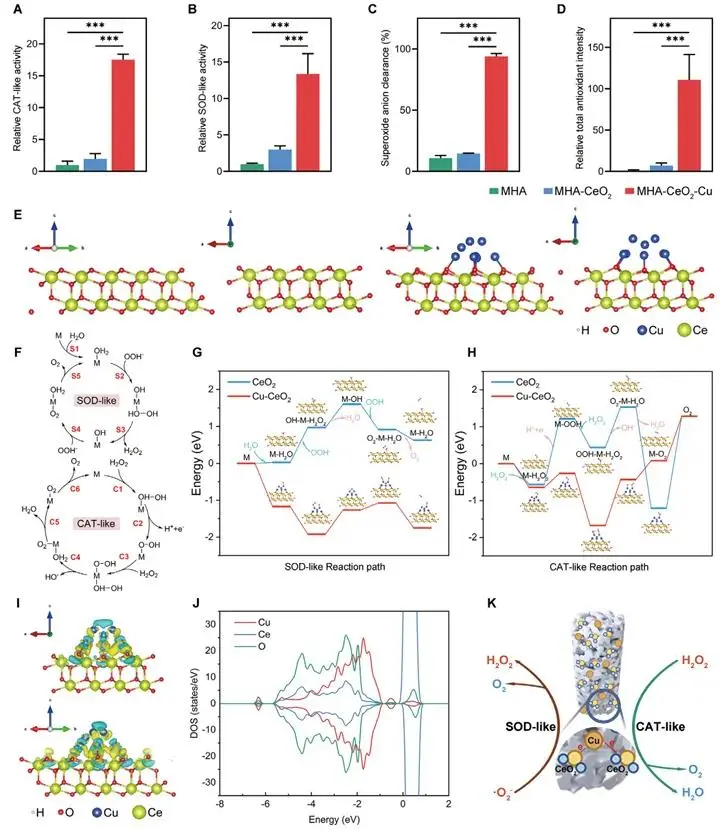
图2 抗氧化性能与机制:(A-D)CAT、SOD、超氧阴离子清除和总抗氧化能力(n=5);(E)DFT计算模型;(F)反应路径;(G,H)SOD/CAT反应能垒;(I)差分电荷密度;(J)态密度分析;(K)抗氧化机制示意图
(3)体外生物相容性系统评价
大鼠骨髓间充质干细胞(BMSCs)在0.1、0.2 mg/mL Bonyzymes浸提液中培养5天后,活/死染色及F-actin骨架图像(图3A)显示细胞呈星形或纺锤形,肌动蛋白纤维完整,无毒性征象;CCK-8测定(图3B)表明各组活力无统计学差异,0.2 mg/mL MHA-CeO₂-Cu组第5天OD450值略高。据此,后续实验以0.2 mg/mL为工作浓度,该剂量兼顾生物相容性与纳米酶/活性离子释放需求。
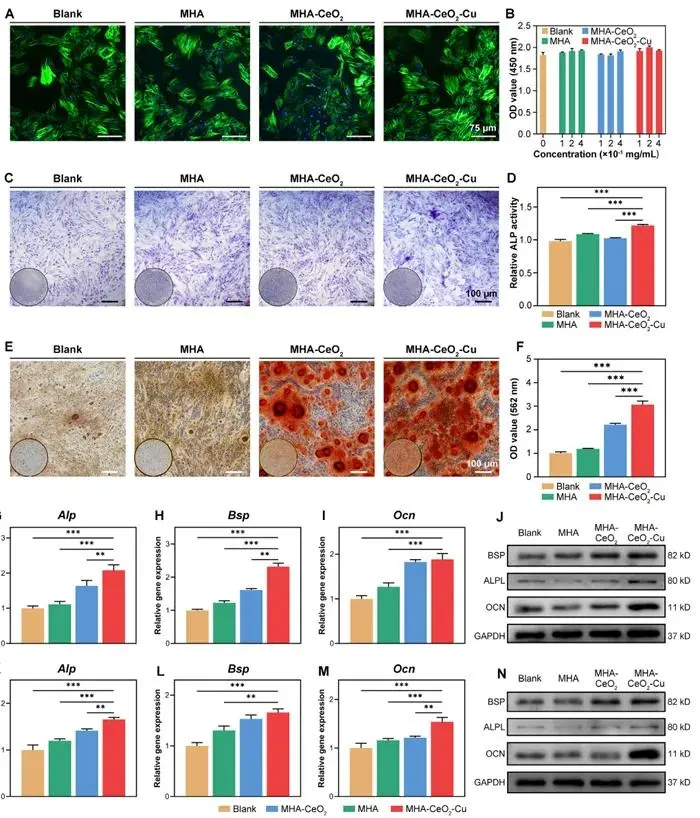
图3 生物相容性:(A)BMSCs细胞骨架染色;(B)CCK-8细胞活力检测;(C,D)第7天ALP染色与活性定量(n=3);(E,F)第21天茜素红染色与半定量(n=3);(G-I)第7天成骨基因表达;(J)第7天成骨蛋白表达;(K-M)第14天成骨基因表达;(N)第14天成骨蛋白表达
(4)体外成骨分化潜能的多维度验证
成骨诱导7 d,ALP染色(图3C)及定量(图3D)显示MHA-CeO₂-Cu组活性为空白对照的2.3倍;21 d茜素红(图3E)钙结节覆盖38.6%,高于MHA组的12.4%(图3F)。qRT-PCR(图3G-I, K-M)示Alp、Bsp、Ocn在第7、14天显著上调,其中Ocn第7天达空白组4.8倍;Western blot(图3J,N)同步验证ALPL、BSP、OCN蛋白增强。结果提示Cu²⁺缓释与表面微环境调控在保留MHA骨传导基础上进一步提升骨诱导。
(5)抗菌活性与免疫调控功能的协同效应
CFU计数(图4A-F)表明,200 μg/mL MHA-CeO₂-Cu对S. aureus、E. coli抑菌率为78.3%与82.1%,对P. gingivalis菌落降至检测下限,近乎灭菌。LPS刺激的RAW264.7模型中,该组Il-1β、Tnf-α mRNA较LPS组下降89%、76%,Il-10升高5.2倍(图4G-J);ELISA测得IL-10蛋白156.3 pg mL⁻¹,TNF-α抑制85%(图4K,L),提示M2极化。RNA-Seq PCA(图5A)将LPS+MHA-CeO₂-Cu组独立聚类;差异基因共352个上调、148个下调,Hmox1增12.6倍,Mt1/Mt2增8–10倍(图5B,C)。GO(图5D,E)富集于氧化应激响应及辅因子代谢,PPI网络(图5F)呈紧密模块,KEGG(图5G)锁定FoxO、MAPK通路,表明材料通过激活内源性抗氧化体系与重编程炎症网络实现免疫微环境重塑。
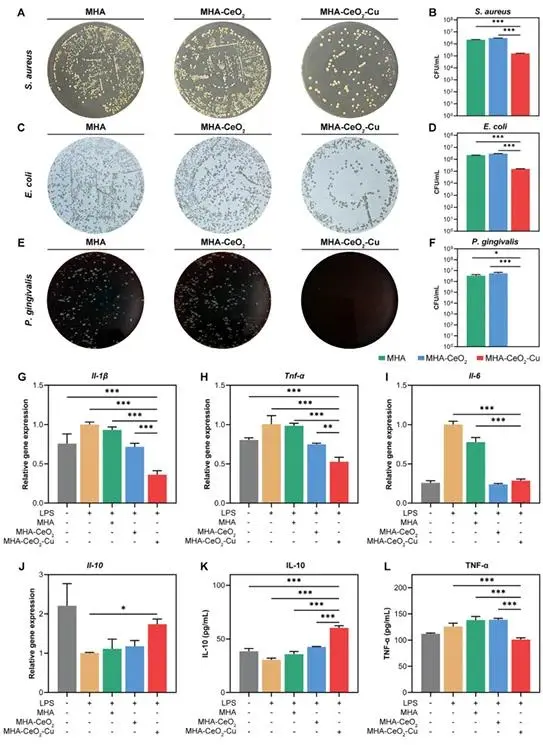
图4(A)金黄色葡萄球菌培养照片;(B)金葡菌活菌计数;(C) 大肠杆菌培养照片;(D) 大肠杆菌活菌计数;(E) 牙龈卟啉单胞菌培养照片;(F) 牙龈卟啉单胞菌活菌计数;(G-J) RAW264.7巨噬细胞的炎症相关基因表达水平;(K,L) 巨噬细胞炎症因子蛋白水平检测
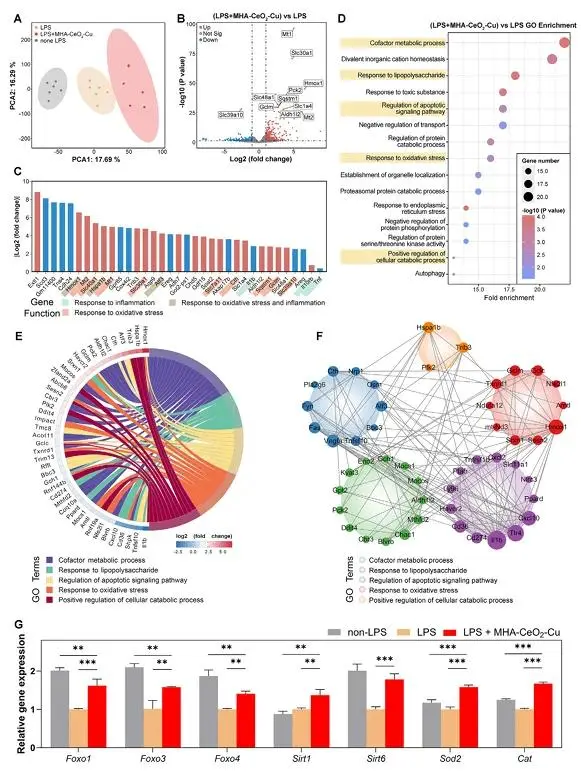
图5 (A) 不同处理组巨噬细胞转录组PCA分析;(B) 差异表达基因火山图;(C) 前27个显著差异基因热图;(D) 差异基因GO功能富集分析;(E) 炎症氧化应激相关功能弦图;(F) 蛋白互作网络;(G) 关键抗氧化基因表达验证
(6)体内治疗效应的系统性评价
大鼠上颌第一磨牙拔除4周后植入钛种植体,3个月以丝线结扎+S. aureus/P. gingivalis(各5×10⁸ CFU mL⁻¹)感染1个月建立种植体周围炎模型(图6A,B)。清创后植入MHA-CeO₂-Cu+Bio-Oss混合物,8周Micro-CT(图6C-H)示未治疗组垂直骨丧失0.82±0.11 mm,MHA-CeO₂-Cu组降至0.21±0.05 mm,骨高度恢复74.3%;BV/TV达42.6%,高于其余各组(图6I)。H&E(图7A)示该组炎性浸润减少,破骨细胞数下降>80%;甲苯胺蓝(图7B)见骨边缘深蓝带提示新骨形成。双荧光标记(图7C-E)第7周xylenol orange红荧光强度为calcein绿荧光的3.2倍,表明后期矿化沉积速率显著加快。
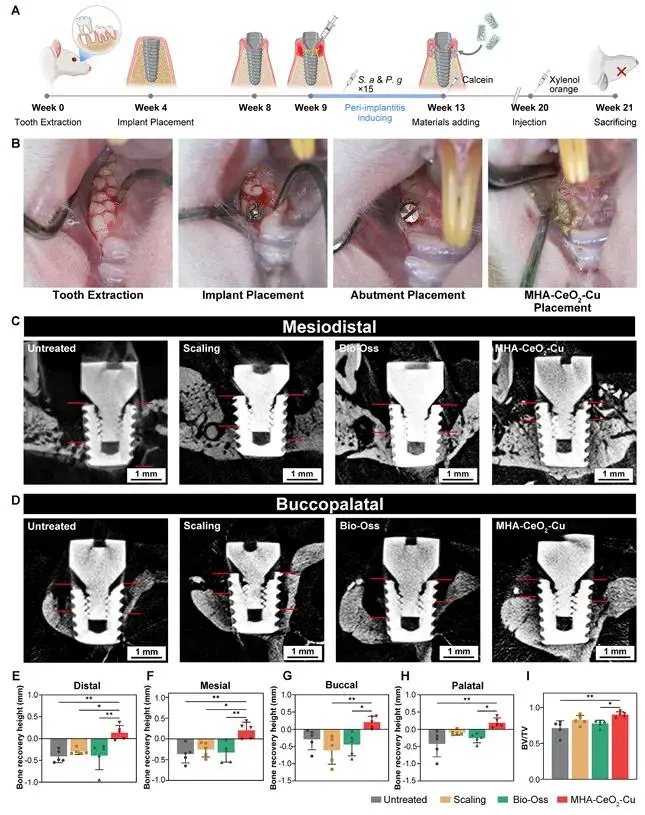
图6 (A) 动物实验流程图(建模与治疗);(B) 大鼠口内照片显示种植体周围炎建模与治疗过程;(C) Micro-CT矢状面图像(8周后);(D) Micro-CT冠状面图像(8周后);E-H) 种植体周围骨高度恢复定量分析;(I) 骨体积/组织体积比(BV/TV)分析(n=5)
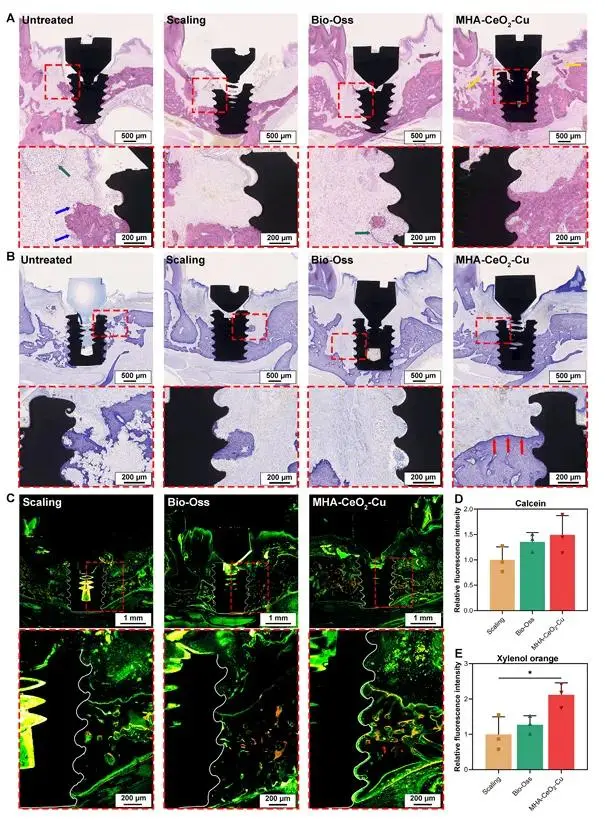
图7 (A) 种植体周围骨组织H&E染色(绿箭头:炎症细胞簇;蓝箭头:破骨细胞;黄箭头:残留材料);(B) 甲苯胺蓝染色(红箭头:深染新骨形成区);(C) 双荧光标记(绿色:钙黄绿素;红色:二甲酚橙);(D) 绿色荧光强度定量;(E) 红色荧光强度定量
本研究成功开发了一种名为Bonyzymes的新型智能骨修复材料。Bonyzymes通过MHA支架与CeO₂-Cu异质结纳米酶一体化设计,把CAT、SOD活性提高一个数量级,实现ROS高效清除、P. gingivalis近灭菌级抗菌并保留MHA骨传导-骨诱导性能,完成“抗炎-抗菌-成骨”协同调控;体内外验证其安全有效,为种植体周围炎提供新策略。后续需优化Ce³⁺/Ce⁴⁺比例与Cu²⁺释放动力学,阐明血管生成机制及长期降解行为,开发可注射凝胶或3D打印个性化支架,并推进大动物与临床试验。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

