
糖尿病慢性伤口是临床常见且治疗困难的并发症,其愈合过程受持续性炎症和血管生成障碍双重阻碍。高血糖环境抑制巨噬细胞向抗炎、促修复的M2型极化,导致伤口长期处于炎症状态,难以进入组织修复阶段。传统治疗手段效果有限,因此亟需开发能够重塑免疫微环境、促进血管生成的新型治疗策略。

针对上述问题,西北有色金属研究院周文昊/袁萍耘团队联合西安组织工程与再生医学研究所王向东团队、西安交通大学第二附属医院刘涛团队构建了一种基于乳酸杆菌来源细胞外囊泡(Lac-EVs)的多功能水凝胶(PCPH@Lac-EVs),结合血红蛋白供氧和聚多巴胺介导的温和光热效应,用于糖尿病慢性伤口治疗。该水凝胶通过持续释放Lac-EVs,促进巨噬细胞向M2型极化,减轻炎症,同时增强血管生成。在小鼠糖尿病模型中,该联合治疗在13天内实现99.3%的伤口愈合率,显著优于对照组,展现出良好的生物相容性和治疗潜力。该文章于2025年8月14日以《Lactobacillus extracellular vesicle-driven oxygen-releasing photothermal hydrogel reprograms macrophages and promotes angiogenesis to accelerate diabetic wound healing》为题发表于《Bioactive Materials》(DOI: 10.1016/j.bioactmat.2025.08.010)。
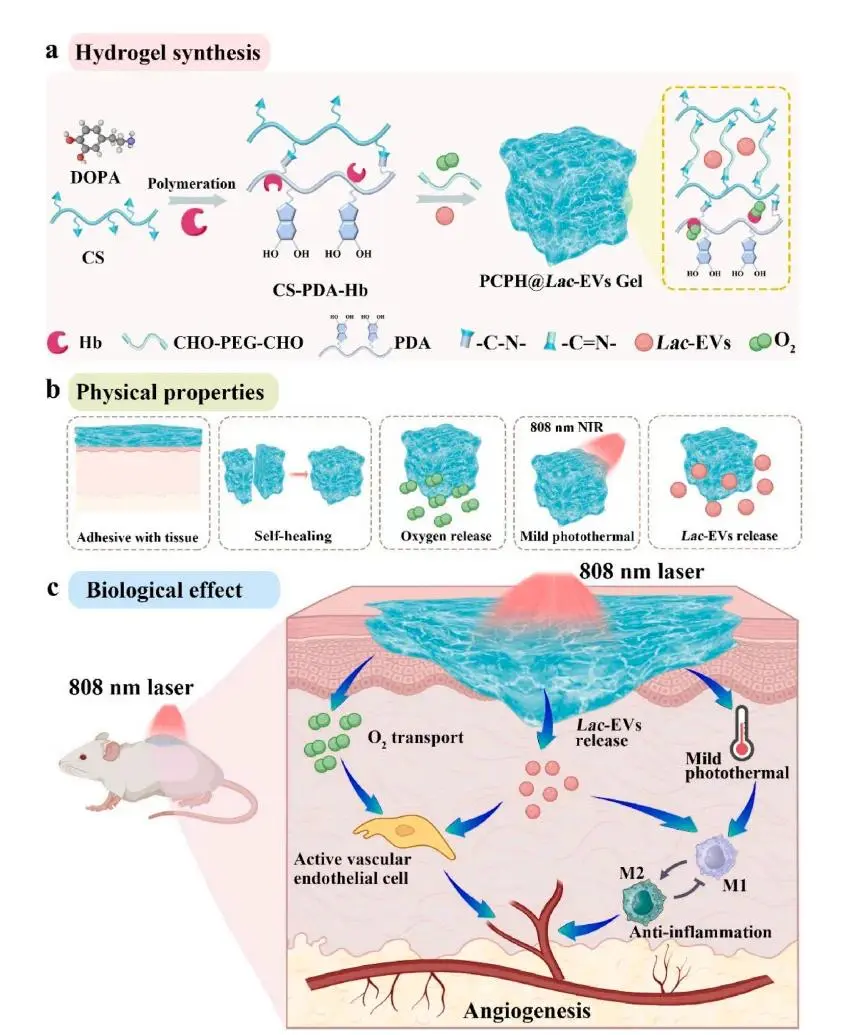
方案1.(a) 可注射PCPH@Lac-EVs水凝胶的合成示意图。(b) PCPH@Lac-EVs水凝胶的物理性能展示。(c) PCPH@Lac-EVs水凝胶通过供氧、缓慢释放Lac-EVs以及产生温和光热效应促进糖尿病伤口愈合的机制示意图
(1)乳酸菌外泌体的提取及功能评价
从MRS平板可见圆形、湿润、边缘整齐的菌落,革兰染色为短杆状、革兰阳性细菌(图1a-b),确认菌株为保加利亚乳杆菌。透射电镜观察到双层膜囊泡结构,纳米颗粒跟踪分析呈单一峰分布(图1c-d),证实Lac-EVs形态完整、粒径均一、纯度高。人脐静脉内皮细胞实验显示,10.5 μg/mL Lac-EVs对细胞迁移(图1e,g)和成管(图1f,h-i)的促进作用最强。RAW264.7巨噬细胞经相同浓度处理后,TNF-α显著下降,IL-10明显上升(图1j-k);qRT-PCR和Western blot进一步表明,该剂量可最大幅度抑制LPS诱导的TLR-4和NF-κB表达,并降低p-NF-κB/NF-κB比值。因此,10.5 μg/mL被确定为Lac-EVs体外功能评价及后续实验的最佳浓度。
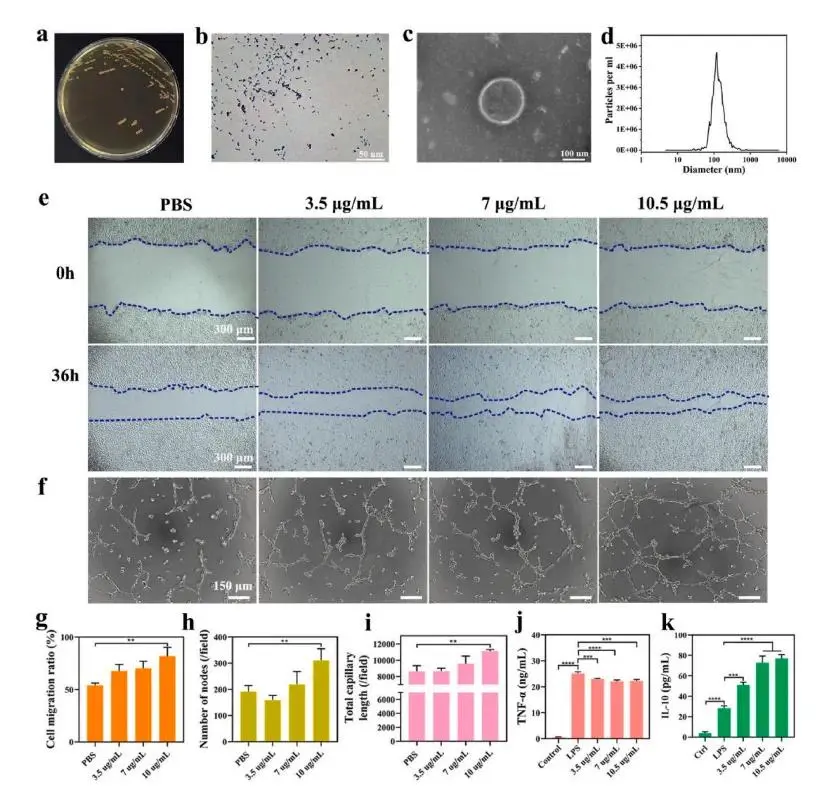
图1.Lac-EVs的生物学特性表征。(a)MRS琼脂培养基上的菌落形态;(b)革兰氏染色结果;(c)TEM观察Lac-EVs微观形貌;(d)NTA粒径分布;(e)不同浓度Lac-EVs处理36 h后HUVEC划痕迁移图像;(f)不同浓度Lac-EVs处理后的HUVEC成管实验;(g)迁移率定量;(h)成管节点数及(i)总血管长度统计;(j)巨噬细胞TNF-α与(k)IL-10表达水平
(2)PCPH@Lac-EVs 水凝胶的合成与表征
研究者首先通过多巴胺自聚-迈克尔加成反应将PDA与Hb共价固定于壳聚糖链段,再与CHO-PEG-CHO经席夫碱交联,构建出PEG-CS-PDA-Hb(PCPH)凝胶;IR谱中同时出现1541 cm⁻¹酰胺、1693 cm⁻¹ CH₂及1655 cm⁻¹席夫碱峰,UV–Vis在406 nm处保留Hb特征吸收,¹H NMR与XPS进一步证实PDA和Hb成功接入且形成C=N键(图2a)。随后,研究团队在交联过程中引入Lac-EVs,制得PCPH@Lac-EVs,测得包封率为74.9%,SEM显示多孔三维骨架且表面因囊泡负载而粗糙,PKH26荧光图像表明囊泡均匀分布(图2b–d)。该凝胶可连续挤出书写“NIN”图案,40 min内达到溶胀平衡,14天体外降解曲线显示含囊泡组初期失重更快(图2e–g)。
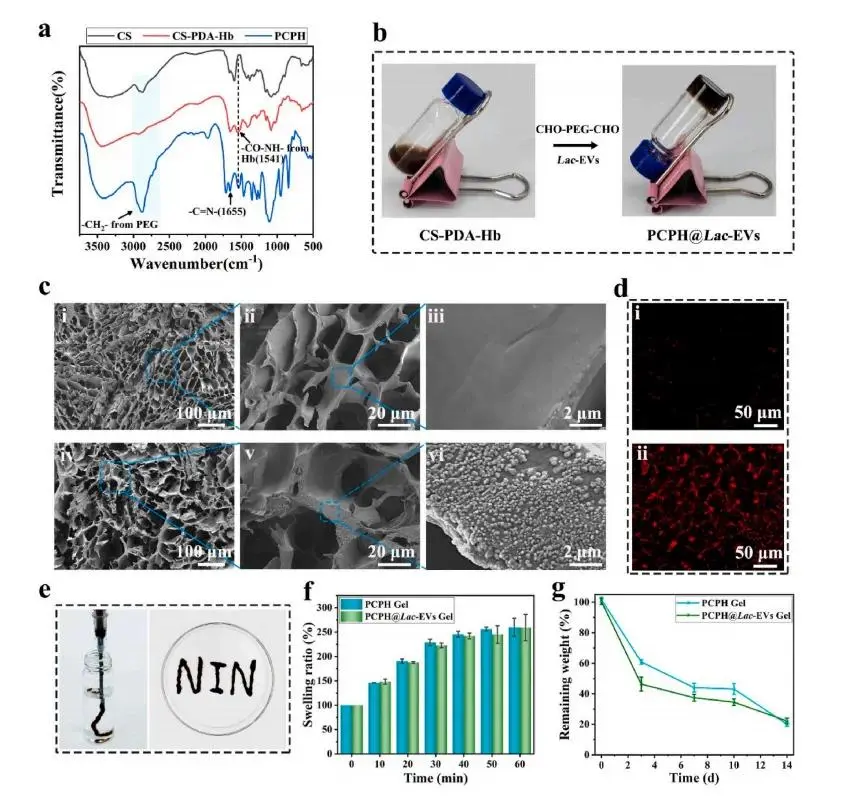
图2. (a) 壳聚糖(CS)、CS-聚多巴胺-血红蛋白(CS-PDA-Hb)及PCPH的红外光谱图。(b) PCPH@Lac-EVs水凝胶发生凝胶-溶胶转变过程的照片。(c) 不同放大倍数下,PCPH水凝胶(i-iii)与PCPH@Lac-EVs水凝胶(iv-vi)的扫描电镜(SEM)图像。(d) 荧光显微镜照片:(i) PCPH水凝胶;(ii) 含有PKH26标记的Lac-EVs的PCPH水凝胶。(e) PCPH@Lac-EVs水凝胶的可注射性演示。(f) PCPH水凝胶与PCPH@Lac-EVs水凝胶的溶胀率。(g) PCPH水凝胶与PCPH@Lac-EVs水凝胶的降解行为
(3)PCPH@Lac-EVs 水凝胶的性能研究
动态席夫碱键赋予PCPH及PCPH@Lac-EVs水凝胶自修复能力:应变扫描显示临界应变分别为1276%与994%,随后在高-低应变循环中,两种凝胶均能在1500%剪切下呈溶胶态,并于5%应变迅速恢复凝胶态,多次循环可逆(图3a–c);宏观切面实验进一步验证其自愈现象(图3e)。邻苯二酚/醌基团使水凝胶通过氢键和共价作用与组织结合,原位凝胶化后即使经受弯曲、扭转、拉伸和PBS冲洗仍牢固贴附于猪肌肉表面(图3f–g)。释放实验表明,无论是否施加NIR,Lac-EVs均可连续释出7天且最终释放率超过80%(图3h);脱氧PBS测试中,PCPH@Lac-EVs的溶解氧浓度升至约5 mg/L,与游离Hb相当,NIR照射未影响携氧能力(图3i)。808 nm NIR辐照5 min使凝胶升温约10°C,功率由0.7 W/cm²增至1.2 W/cm²对应温升8.1–21.8°C,经五次开关循环仍保持恒定加热,故0.7 W/cm²被选为安全照射参数(图3j–l)。
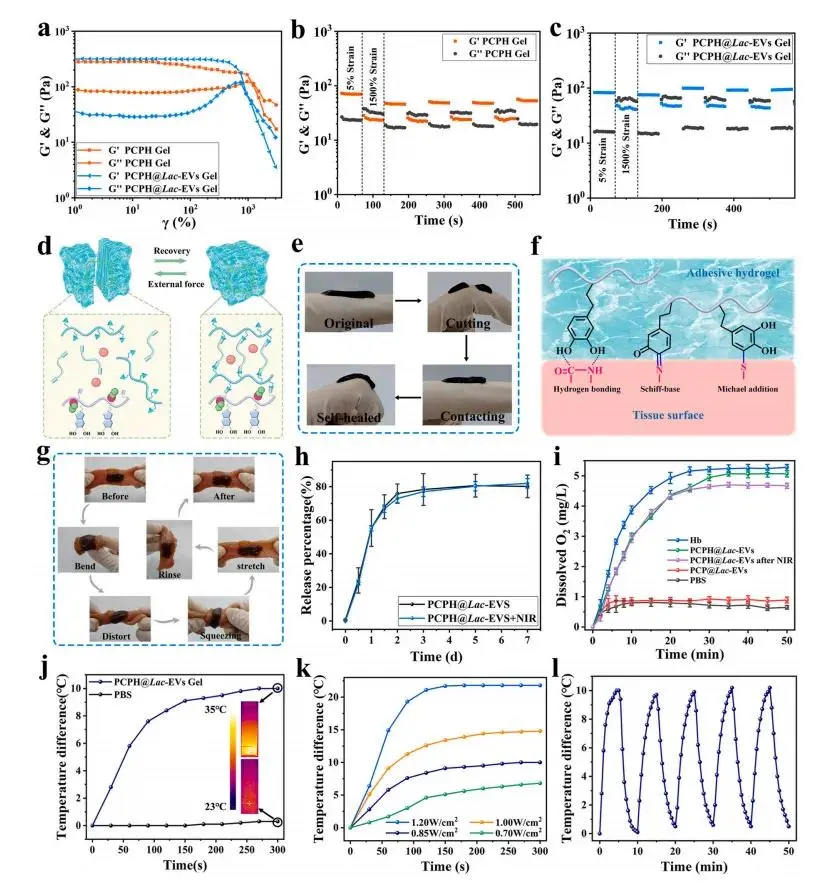
图3.(a) PCPH与PCPH@Lac-EVs水凝胶在5 %–1500 %应变范围内的应变扫描。(b–c) PCPH (b) 与PCPH@Lac-EVs水凝胶 (c) 在5 %与1500 %应变间循环5次的流变时间扫描。(d) PCPH@Lac-EVs水凝胶自愈合过程示意图。(e) PCPH@Lac-EVs水凝胶自愈合效果的宏观观察。(f) PCPH@Lac-EVs水凝胶在组织表面的黏附机制示意图。(g) PCPH@Lac-EVs水凝胶贴合猪组织后,经弯曲、扭曲、挤压、拉伸及PBS冲洗仍保持黏附的照片。(h) 模拟生理条件下,PCPH@Lac-EVs水凝胶及经光热处理的PCPH@Lac-EVs水凝·胶的Lac-EVs释放曲线。(i) 以氧饱和PBS中氧浓度升高为指标,测定纯Hb、PCP@Lac-EVs、PCPH@Lac-EVs水凝胶及NIR照射后PCPH@Lac-EVs水凝胶的供氧能力(Hb量相同)。(j) PCPH@Lac-EVs水凝胶与PBS在NIR照射下的温度-时间变化曲线及对应红外热像图。(k) PCPH@Lac-EVs水凝胶在不同功率NIR照射下的温度-时间曲线。(l) PCPH@Lac-EVs水凝胶经5次NIR开-关循环后的光热稳定性
(4)PCPH@Lac-EVs 水凝胶的体外再生及抗炎效果评估
实验首先验证NIR安全性:单独照射或PCPH@Lac-EVs+NIR(≈42°C)均未对HUVEC、RAW264.7及HFB细胞产生毒性,反而促进增殖,确认照射条件安全(图4a)。随后,所有水凝胶组均支持HUVEC生长,降解产物亦无毒性,奠定生物相容基础。PKH26标记显示,水凝胶可有效递送Lac-EVs并被HaCaT细胞内化,即使施加NIR亦不例外(图4b)。迁移实验表明,Hb-PCPH已显著加速细胞迁移,PCPH@Lac-EVs作用更强,而PCPH@Lac-EVs+NIR获得最大迁移响应(图4c);成管实验同步显示该组血管网络最密集,节点密度与分支复杂度均优于对照(图4d–g),提示氧合、Lac-EVs与温和光热协同优化再生微环境。免疫调节评估进一步表明,持续释放的Lac-EVs与光热协同显著增强M2极化:PCPH@Lac-EVs+NIR组CD86表达最低、CD206表达最高(图5a–d),流式与荧光一致证实M2优势。细胞因子检测同步显示TNF-α、IL-1β、IL-6下调,IL-10与Arg-1上调(图5e–j),整体证实氧-光热协同可放大Lac-EVs的免疫重编程效应,为糖尿病慢性伤口治疗提供有效策略。
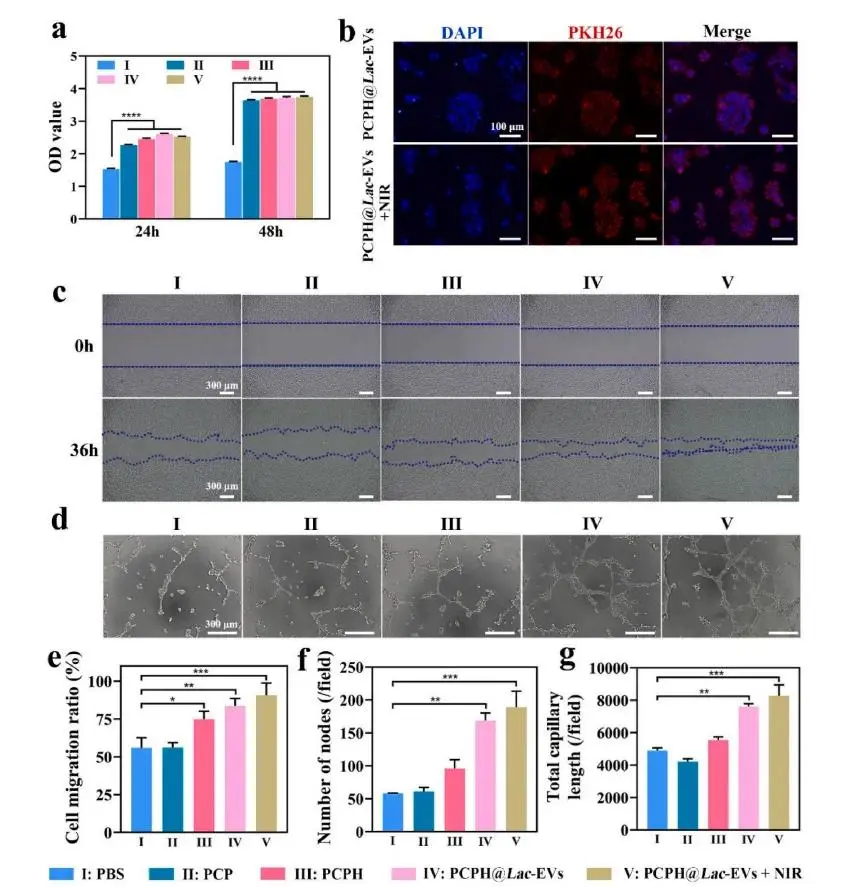
图4.水凝胶体外活性与血管生成能力。(a)各组HUVEC培养24 h与48 h的细胞活力;(b)PKH26标记的Lac-EVs被HaCaT细胞摄取;(c)36 h划痕实验观察HUVEC迁移;(d)不同处理组的HUVEC体外成管形态;(e)迁移率定量;(f)成管节点数及(g)总血管长度统计
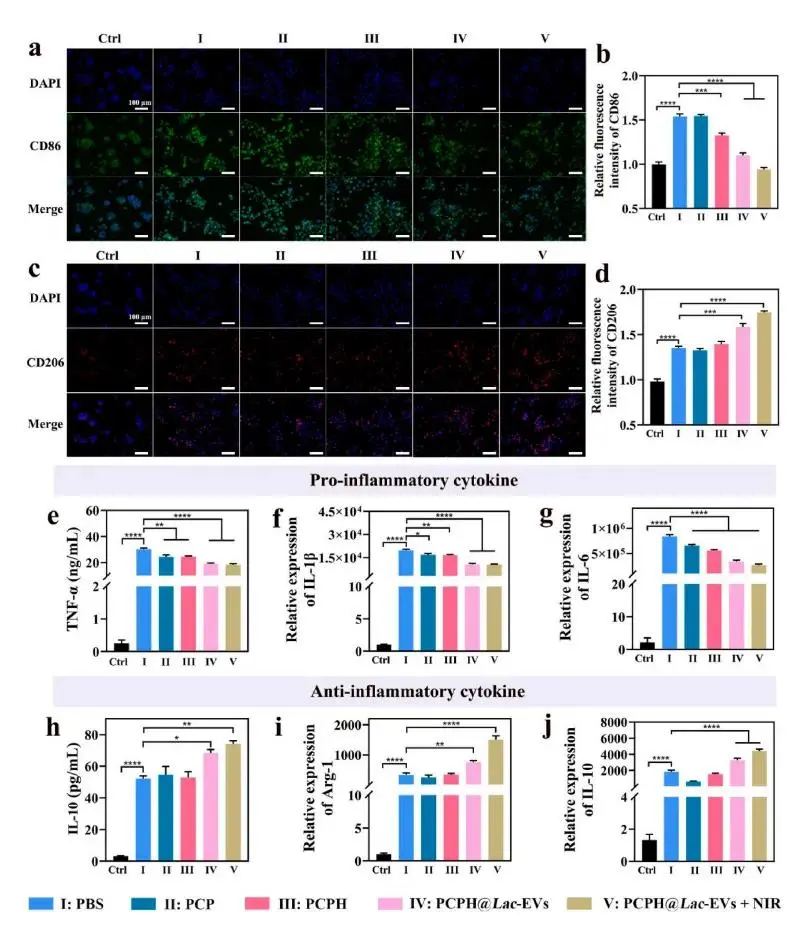
图5.水凝胶免疫调节性能。(a–b)CD86促炎蛋白免疫荧光图像及定量;(c–d)CD206抗炎蛋白免疫荧光图像及定量;(e)ELISA检测TNF-α表达;(f–g)qRT-PCR测定IL-1β与IL-6 mRNA水平;(h)ELISA检测IL-10表达;(i–j)qRT-PCR测定Arg-1与IL-10 mRNA水平
(5)PCPH@Lac-EVs 胶体加速了糖尿病患者的伤口愈合过程老鼠
研究者在1 cm全层缺损伤糖尿病小鼠上设置PBS、PCP、PCPH、PCPH@Lac-EVs及PCPH@Lac-EVs+NIR五组,并按图6a所示时间点取样。热成像显示,照射后PCPH@Lac-EVs水凝胶创面温度稳定在约42 °C,证实其光热转换性能良好(图6b)。动态拍照与面积追踪结果显示,PCPH@Lac-EVs+NIR组第3日即达68.0%闭合,第13日实现接近完全愈合(99.3%),显著优于PBS(72.3%)及单一治疗组(图6c–e)。第13日H&E切片显示该组表皮致密、真皮结构完整,真皮缝隙最窄,表皮厚度均匀,且再生毛囊数达66个,为PBS三倍(图6f–i),提示氧合-光热-Lac-EVs协同加速再上皮化与附属器重建。Masson三色染色显示PCPH@Lac-EVs+NIR组胶原沉积量最高,免疫荧光进一步表明其胶原Ⅰ表达上调、胶原Ⅲ下调,提示基质成熟且瘢痕风险降低(图7a–e)。α-SMA免疫染色揭示该组新生血管最丰富,与愈合速率提升一致(图7f–g)。同时,Hb持续供氧降低HIF-1α水平,解除创面缺氧(图7h–i)。CD86/CD206荧光显示PCPH@Lac-EVs+NIR组M2标志最高、M1标志最低,TNF-α下降而TGF-β升高,证实氧-光热协同强化Lac-EVs介导的抗炎-促血管免疫调节(图8a–f)。
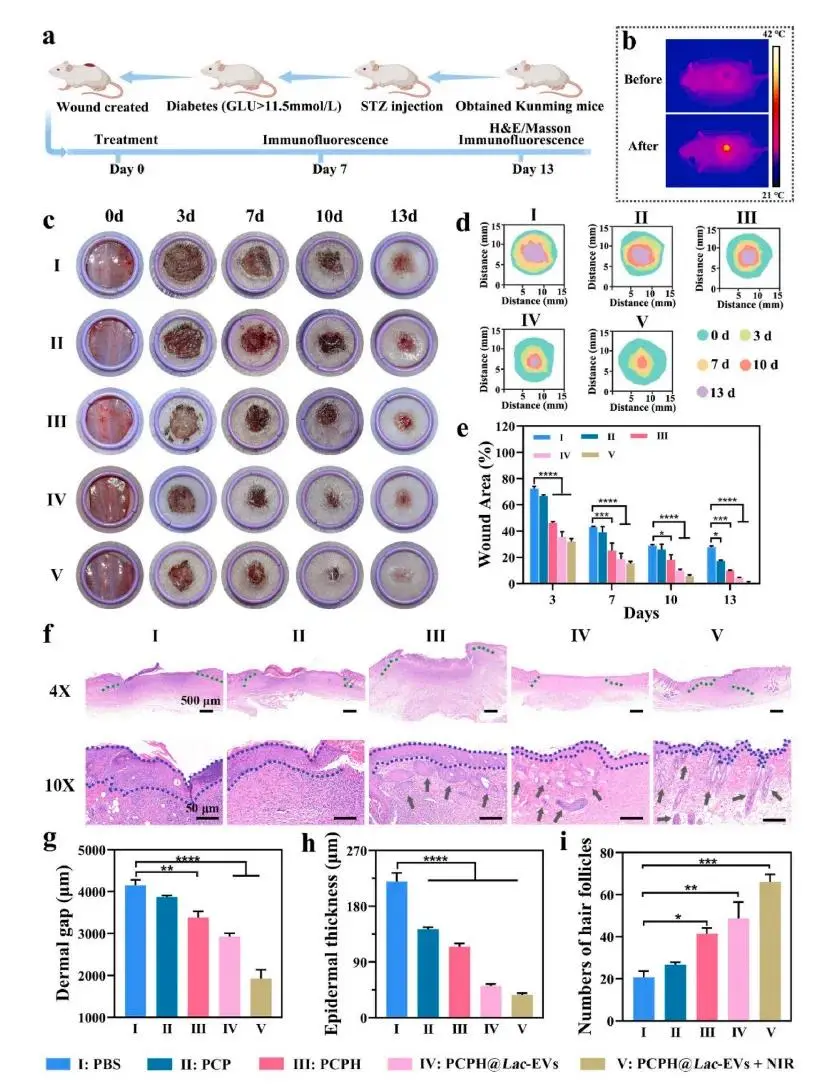
图6.水凝胶促进糖尿病小鼠创面修复效果。(a)动物实验时间轴示意图;(b)PCPH@Lac-EVs水凝胶经808 nm照射后的创面红外热像;(c)各组创面在0、3、7、10、13 d的代表照片;(d)对应时间点创面轮廓追踪;(e)各组创面面积随时间变化曲线;(f)第13 d创面H&E染色,低倍与高倍视野;(g–i)第13 d真皮缝隙宽度、表皮厚度及再生毛囊数比较
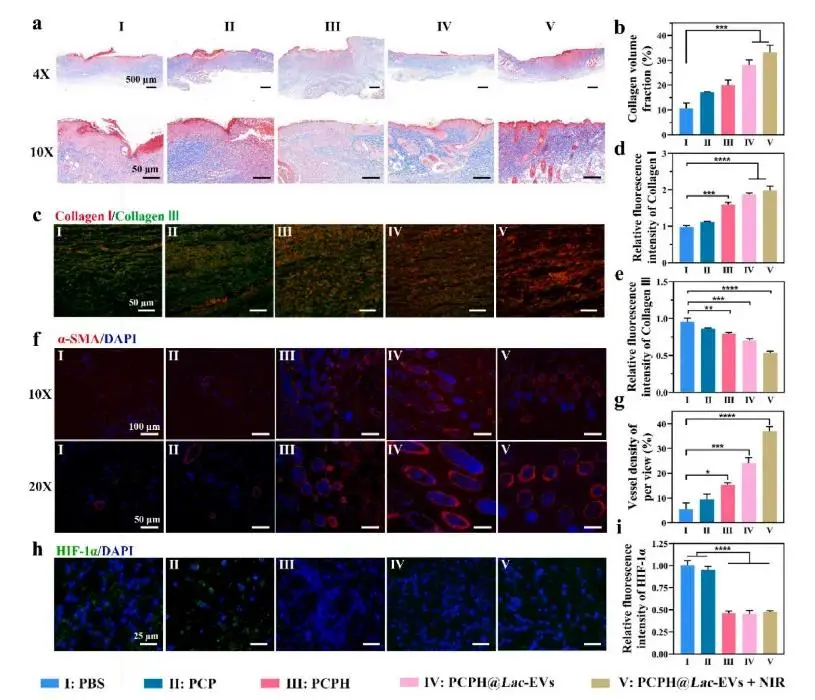
图7.创面组织学与免疫学分析。(a)第13 d各组创面Masson三色染色;(b)胶原体积分数定量;(c)第14 d胶原I(红)与胶原III(绿)免疫荧光染色;(d–e)胶原I及胶原III表达量统计;(f)第7 d各组α-SMA(绿)/DAPI(蓝)血管免疫荧光染色;(g)血管密度定量;(h)第13 d各组HIF-1α(绿)/DAPI(蓝)免疫荧光染色;(i)HIF-1α表达量统计
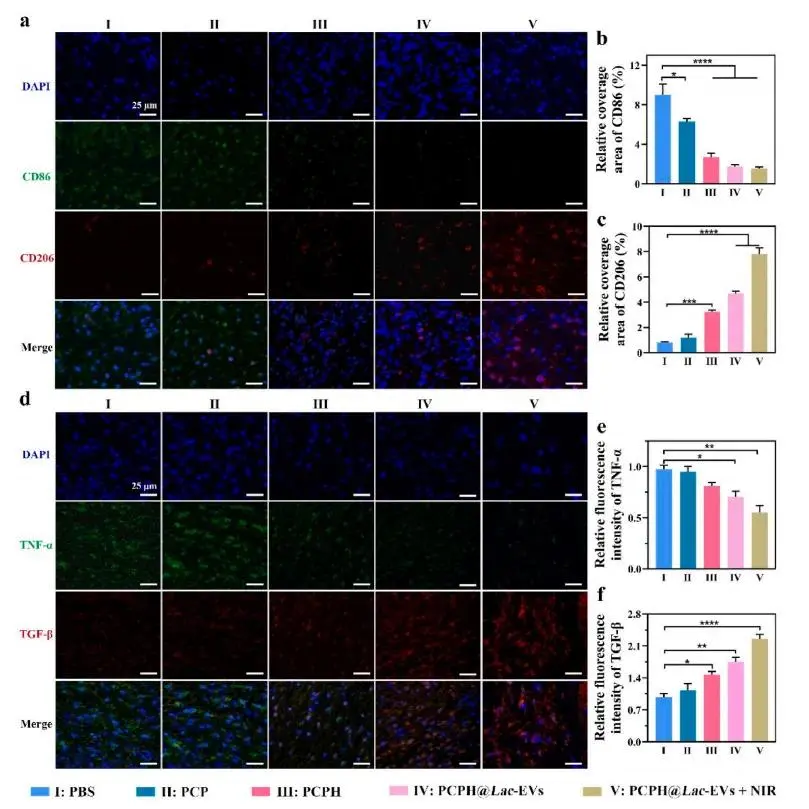
图8 创面免疫微环境分析。(a)第7天各组CD86(绿)与CD206(红)免疫荧光染色;(b–c)CD86及CD206表达量统计;(d)第7天各组TNF-α(绿)与TGF-β(红)免疫荧光染色;(e–f)TNF-α及TGF-β表达量统计
本研究构建了一种可注射的乳酸杆菌细胞外囊泡(Lac-EVs)递送水凝胶(PCPH@Lac-EVs),集氧释放、温和光热和免疫调节于一体,用于糖尿病慢性伤口治疗。该水凝胶通过动态席夫碱交联实现自修复与组织粘附,能持续释放Lac-EVs并局部供氧;在808 nm近红外照射下,聚多巴胺介导的温和光热(≈42 °C)进一步协同促进血管内皮细胞迁移与成管,同时增强巨噬细胞向抗炎M2型极化。糖尿病小鼠全层皮肤缺损伤口实验显示,PCPH@Lac-EVs联合照射组在13天内实现近完全愈合(99.3%),显著优于对照(72.3%),并表现出更完善的表皮-真皮重建、胶原重塑、新生血管及毛囊再生。该策略以Lac-EVs为核心,通过氧合与光热协同放大免疫调控和促血管生成效应,为慢性糖尿病伤口提供了一种安全、高效且可转化的新方案。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

