
牙周炎是一种由细菌感染引起的慢性炎症性疾病,其特征是局部活性氧(ROS)过度积累,导致炎症反应、牙周支持组织破坏及牙槽骨吸收。当前主要疗法为刮治和根面平整(SRP),但难以彻底清除细菌,且局部炎症和骨再生能力有限。抗生素局部给药存在释放过快、保留时间短等问题。因此,开发一种能快速抗菌、缓解炎症并促进骨再生的智能给药系统具有重要意义。

针对上述问题,西南医科大学陶刚、黎春晖、蔡蕊团队开发了一种ROS响应的可注射水凝胶系统(HP-PVA@MH/Fe-Que),用于协同递载抗菌药物盐酸米诺环素(MH)与抗炎纳米颗粒铁-槲皮素(Fe-Que NPs),实现牙周微环境触发释药与多重治疗。该文章于2025年3月12日以《Injectable hydrogels with ROS-triggered drug release enable the co-delivery of antibacterial agent and anti-inflammatory nanoparticle for periodontitis treatment》为题发表于《Journal of Nanobiotechnology》(DOI: 10.1186/s12951-025-03275-4)。
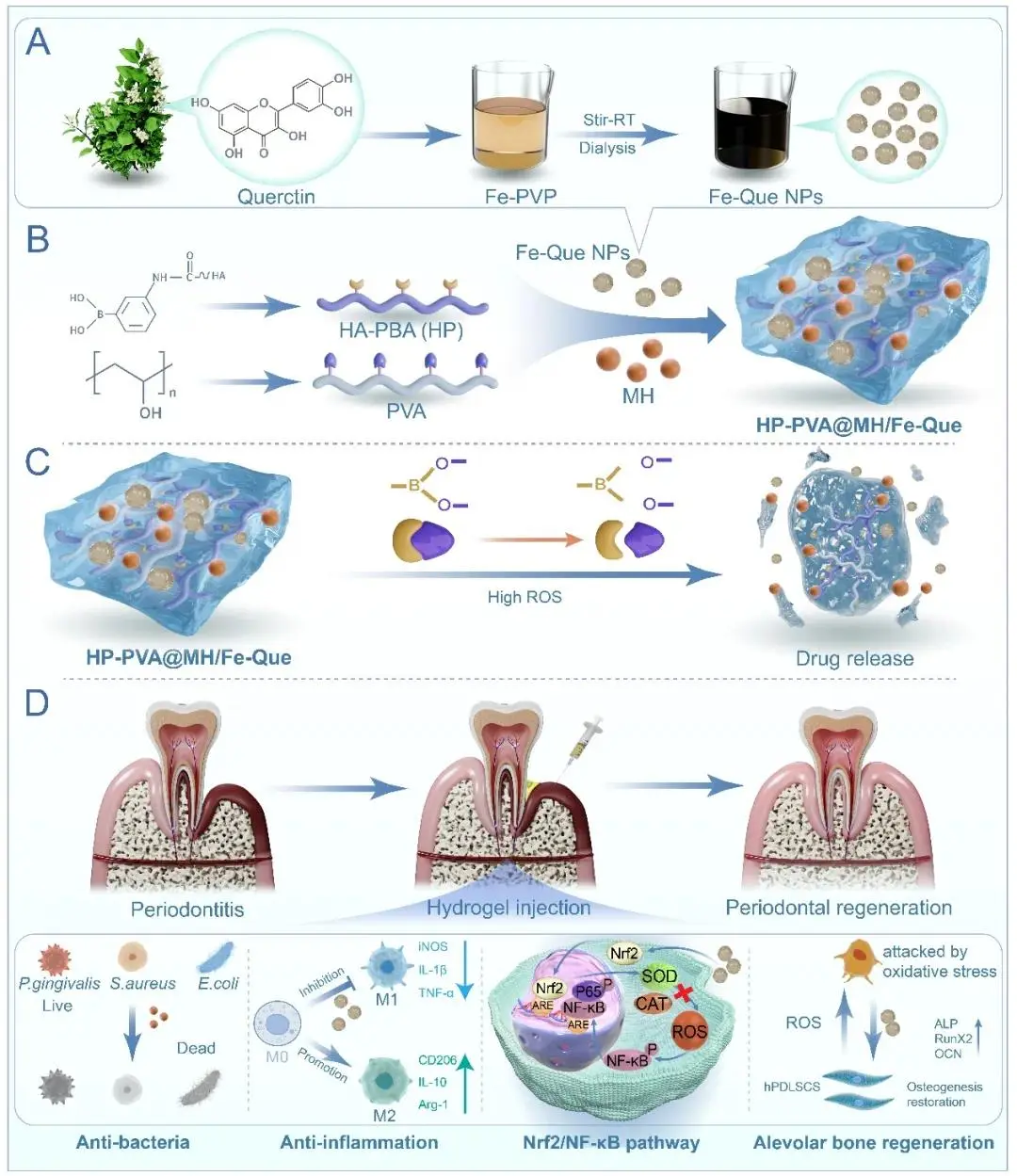
研究示意图
(1)Fe-Que NPs 与 HP 的成功合成与表征
通过多种表征手段证实了关键组分的成功制备:图1A-H:Fe-Que NPs 呈均匀球形,粒径小于10 nm;UV-vis、FTIR 和 XPS 谱图均证实铁离子与槲皮素成功配位。图1I-K:HP 的 UV-vis、FTIR 和 ¹H NMR 谱图显示苯硼酸特征峰出现,证明 PBA 被成功接枝到透明质酸上,取代度约为15%。
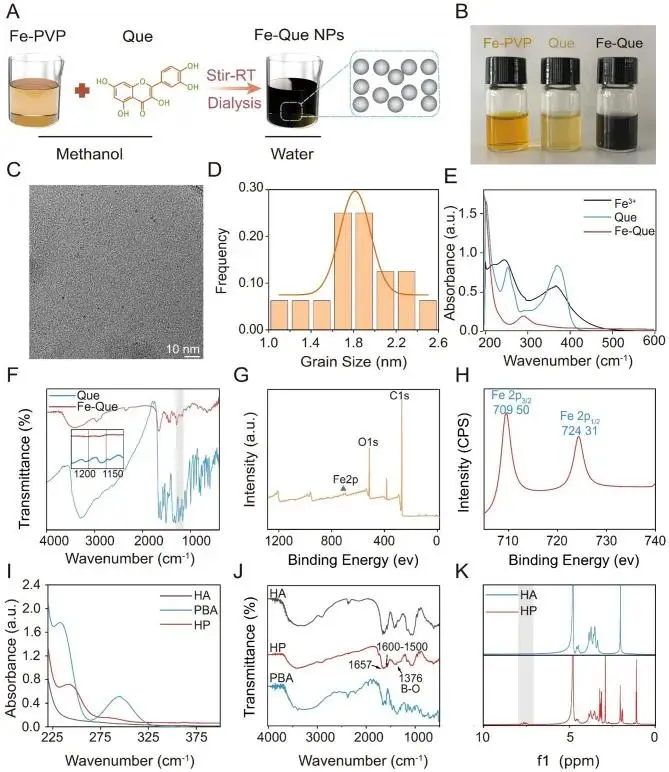
图1 Fe-Que NPs 和 HP 的合成与表征。(A) Fe-Que NPs 合成示意图。(B) 合成材料照片,包括 Fe-PVP、Que 和 Fe-Que NPs。(C) Fe-Que NPs 的 TEM 图。(D) Fe-Que NPs 的粒径分布图。(E) FeCl₃·6H₂O、Que 和 Fe-Que NPs 的紫外-可见吸收光谱。(F) Que 和 Fe-Que NPs 的 FTIR 光谱。(G) Fe-Que NPs 的 XPS 全谱。(H) Fe-Que NPs 中铁离子的高分辨率 XPS 谱图。(I) HA、PBA 和 HP 的紫外-可见吸收光谱。(J) HA、PBA 和 HP 的 FTIR 光谱。(K) HA 和 HP 的 ¹H NMR 谱图
(2)HP-PVA@MH/Fe-Que 水凝胶的构建与功能化性能
成功构建了具有多种临床应用优势的ROS响应性水凝胶:图2A-D:水凝胶通过硼酸酯键交联,形成均匀多孔的三维结构;EDS图谱证实Fe元素均匀分布,说明Fe-Que NPs成功负载。图2E-H:水凝胶表现出优异的可注射性、形状适应性、组织粘附性和快速自愈合能力,能满足牙周袋内复杂环境的应用需求。
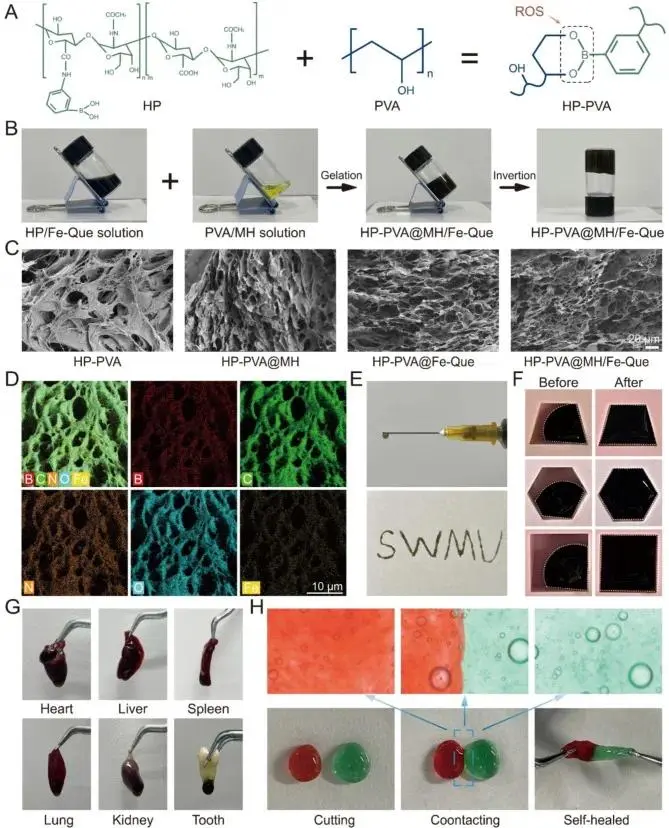
图2 HP-PVA@MH/Fe-Que 水凝胶的制备与表征。水凝胶合成示意图。(B) HP-PVA@MH/Fe-Que 水凝胶凝胶化前(左)后(右)的照片。(C) 不同水凝胶的 SEM 图像。(D) HP-PVA@MH/Fe-Que 水凝胶的 EDS 元素分布图。(E) HP-PVA@MH/Fe-Que 水凝胶的可注射性照片。(F) HP-PVA@MH/Fe-Que 水凝胶的形状适应性照片。(G) HP-PVA@MH/Fe-Que 水凝胶的粘附性照片。(H) HP-PVA 水凝胶自修复性能的照片
(3)水凝胶具备高效且广谱的抗菌能力
体外抗菌实验证明其能有效清除牙周致病菌:图3A-D:菌落形成实验显示,加载了MH的水凝胶组对金黄色葡萄球菌、大肠杆菌和牙龈卟啉单胞菌均表现出极强的杀菌效果,菌落数量显著减少。图3E-H:细菌活/死染色图像中可见大量红色荧光(死菌),进一步直观证实了其高效的抗菌率。
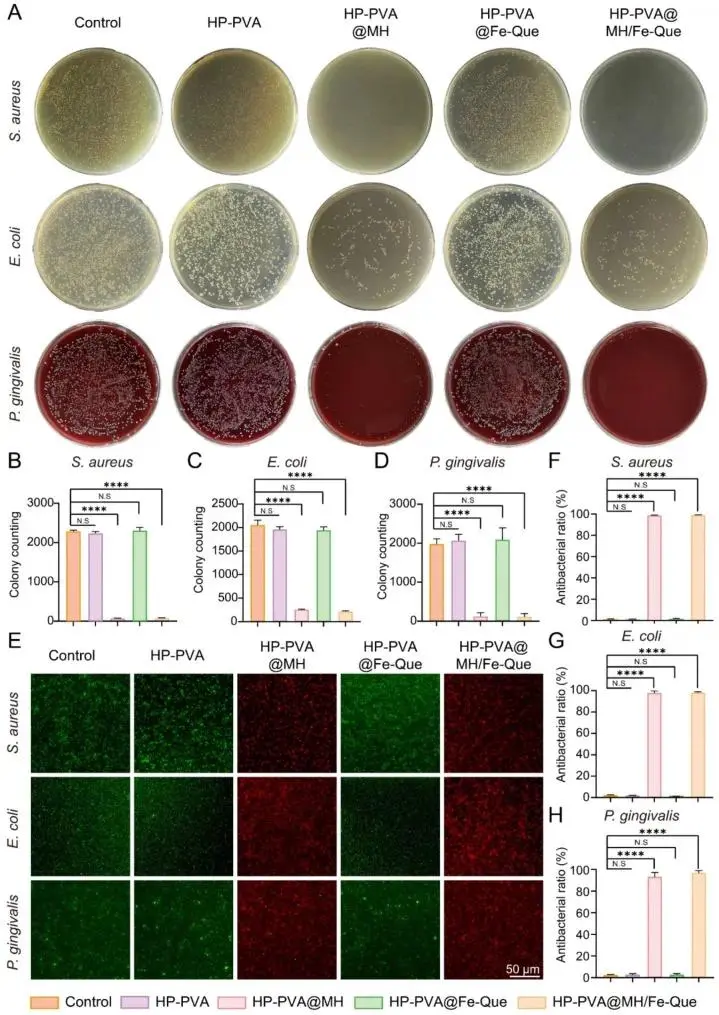
图3 HP-PVA@MH/Fe-Que 水凝胶的体外抗菌活性。金黄色葡萄球菌、大肠杆菌和牙龈卟啉单胞菌菌落形成单位的代表性图像。 (B) 金黄色葡萄球菌、(C) 大肠杆菌和 (D) 牙龈卟啉单胞菌的菌落定量统计图。(E) 金黄色葡萄球菌、大肠杆菌和牙龈卟啉单胞菌的活/死染色图像。(F-H) (F) 金黄色葡萄球菌、(G) 大肠杆菌和 (H) 牙龈卟啉单胞菌的抗菌率统计
(4)水凝胶展现出优异的生物相容性与血液相容性
细胞与血液实验证明其作为生物材料的良好安全性:图4A-D:与hPDLSCs、RAW264.7等多种细胞共培养后,活/死染色与CCK-8结果均显示细胞活性高且增殖良好,无显著毒性。图4E:溶血实验表明水凝胶的溶血率低于3%,符合生物材料血液相容性标准。
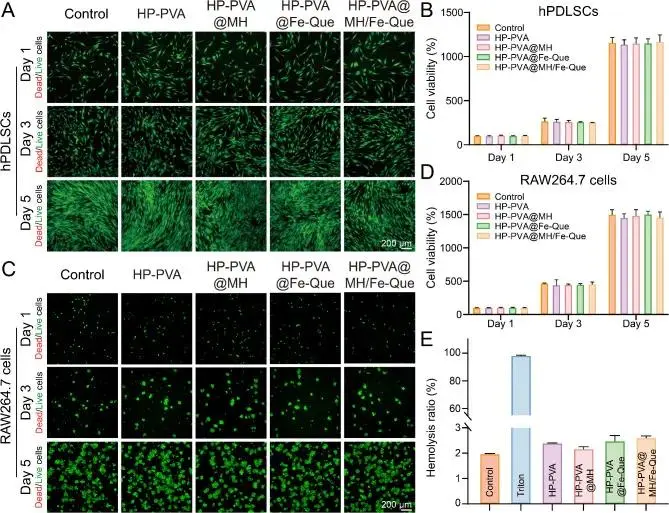
图4 HP-PVA@MH/Fe-Que 水凝胶的生物相容性。(A) hPDLSCs 在第 1、3、5 天的活/死染色图像。(B) hPDLSCs 在第 1、3、5 天的 CCK-8 检测结果。(C) RAW264.7 细胞在第 1、3、5 天的活/死染色图像。(D) RAW264.7 细胞在第 1、3、5 天的 CCK-8 检测结果。(E) 与水凝胶孵育后红细胞的溶血率
(5)水凝胶具有强大的自由基清除与抗氧化能力
通过化学与细胞水平实验验证其抗氧化功效:图5A-F:DPPH与ABTS自由基清除实验表明,含Fe-Que NPs的水凝胶具有与维生素C相近的强自由基清除能力。图5G-J:在H₂O₂诱导的氧化应激模型中,该水凝胶能有效清除细胞内ROS,恢复细胞活力,显著减少细胞死亡。
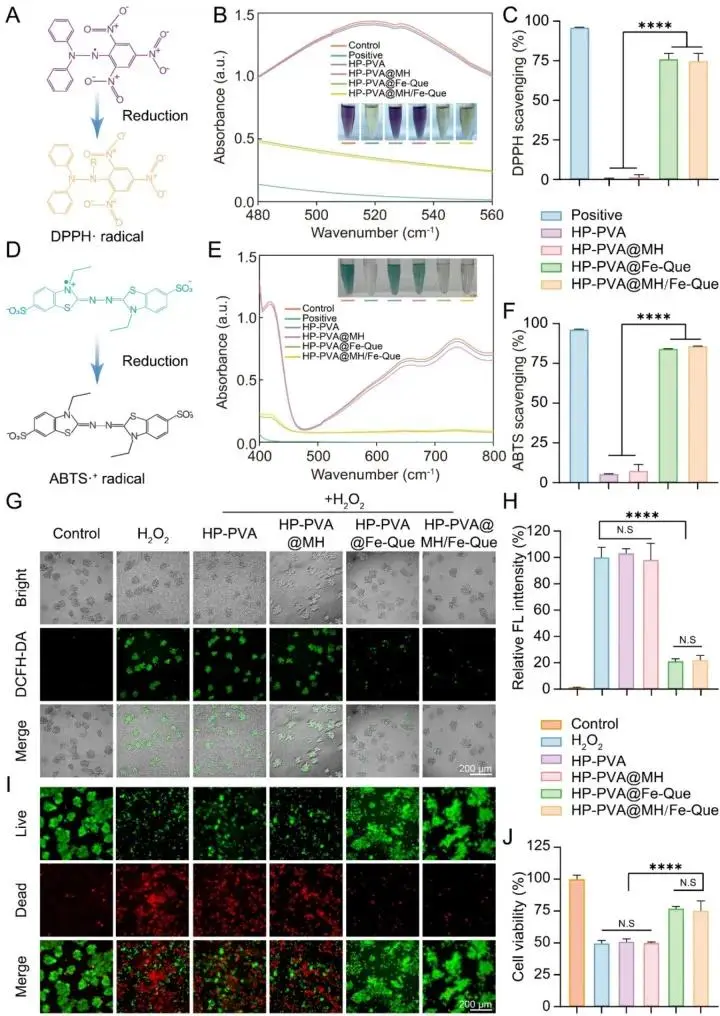
图5 氧化应激环境下 HP-PVA@MH/Fe-Que 水凝胶的自由基清除能力和抗氧化能力。(A) DPPH 自由基清除实验示意图。(B) 不同水凝胶的吸光度及照片。(C) 不同水凝胶的 DPPH 清除率。(D) ABTS 自由基清除实验示意图。(E) 不同水凝胶的吸光度及照片。(F) 不同水凝胶的 ABTS 清除率。(G) DCFH-DA 染色。(H) 荧光定量结果。(I) 活/死染色。RAW264.7 细胞的 CCK-8 实验
(6)水凝胶可调控巨噬细胞极化以改善免疫微环境
证实其能将促炎的M1表型逆转为抗炎的M2表型:图6A-F:免疫荧光与流式细胞术分析显示,水凝胶处理能显著降低M1标志物(iNOS/CD86)表达,同时提升M2标志物(CD206)表达,有效调节免疫平衡。
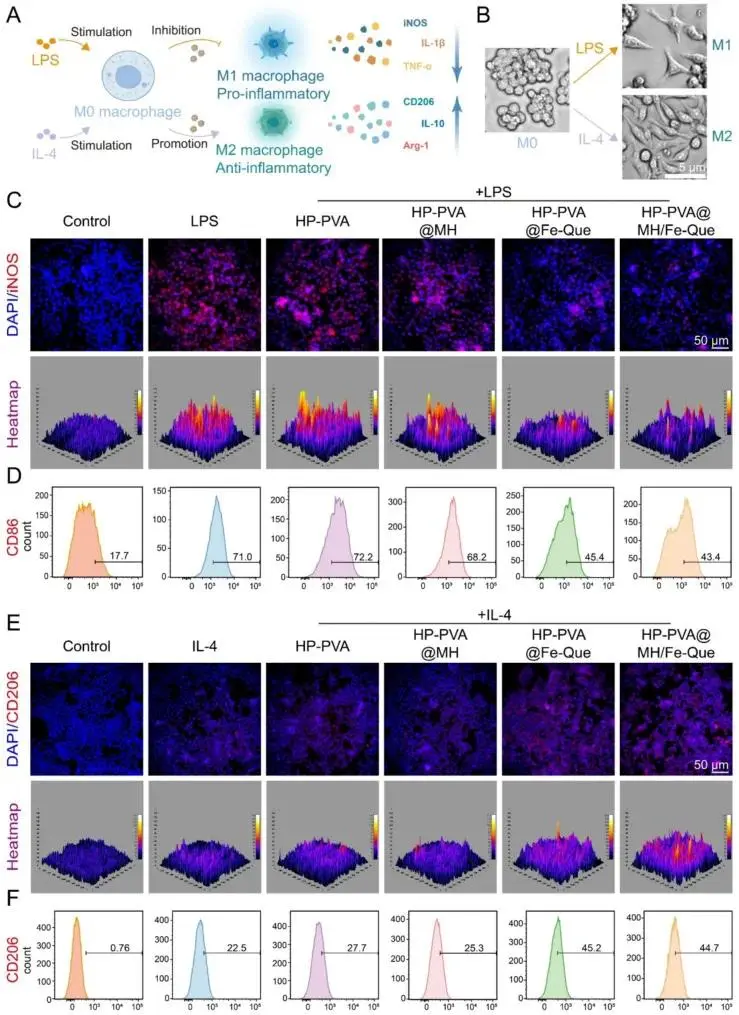
图6. HP-PVA@MH/Fe-Que 水凝胶抑制巨噬细胞向 M1 表型极化并促进其向 M2 表型极化。(A) HP-PVA@MH/Fe-Que 水凝胶对巨噬细胞极化影响的示意图。(B) 巨噬细胞的显微镜视图。(C) M1 (iNOS) 和 (E) M2 (CD206) 巨噬细胞标志物的免疫荧光图像。(D) M1 (CD86) 和 (F) M2 (CD206) 巨噬细胞标志物的流式细胞术分析
(7)激活保护通路,促进成骨恢复
激活抗氧化核心因子Nrf2,抑制促炎关键蛋白NF-κB表达(图7A、B、I)。ALP和ARS染色显示成骨活性显著恢复(图8C)。成骨标志蛋白Runx2和OCN表达明显增强(图8D),有效挽救氧化应激下的骨再生功能图。
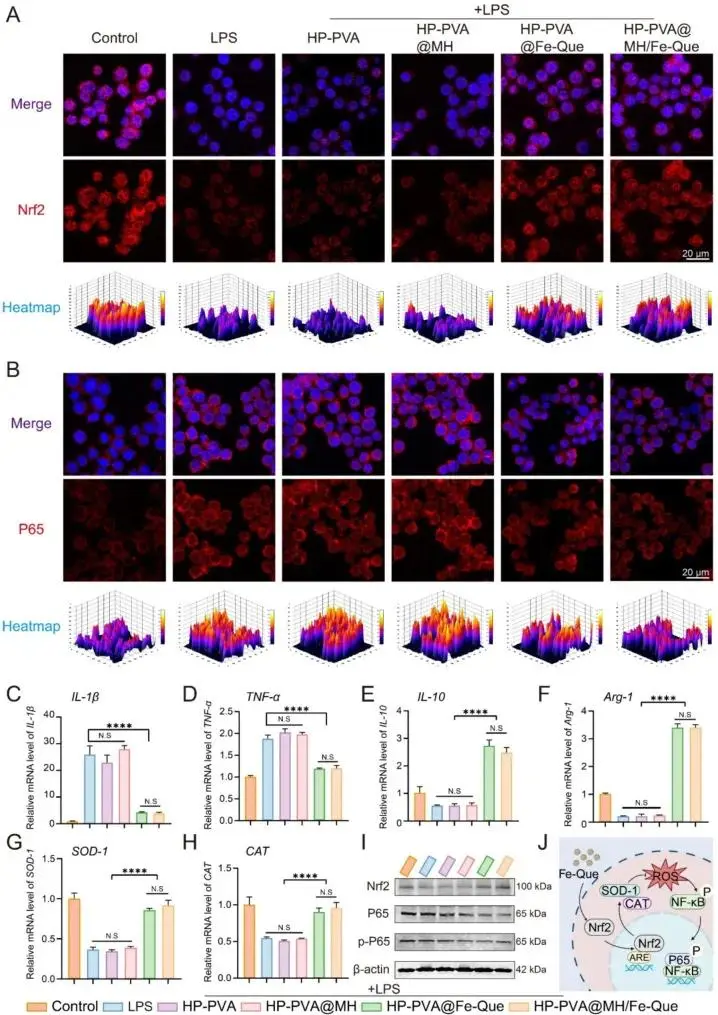
图7. HP-PVA@MH/Fe-Que 水凝胶在体外通过调节 Nrf2/NF-κB 通路发挥抗氧化和抗炎作用。(A) RAW264.7 细胞中 Nrf2 和 (B) NF-κB 的免疫荧光图像。(C, D) 促炎基因 IL-1β, TNF-α 和 (E, F) 抗炎基因 IL-10, Arg-1 以及 (G, H) 抗氧化酶基因 SOD-1, CAT 的相对 mRNA 水平的 qRT-PCR 分析。(I) Nrf2、P65 和 p-P65 的蛋白质印迹检测,β-肌动蛋白作为内参。(J) HP-PVA@MH/Fe-Que 水凝胶的抗氧化和抗炎机制示意图

图8 . HP-PVA@MH/Fe-Que 水凝胶在氧化微环境中保护 hPDLSCs 免受 ROS 攻击并促进其成骨分化。(A) HP-PVA@MH/Fe-Que 在氧化应激条件下对 hPDLSCs 成骨分化潜能影响的示意图。(B) 氧化应激条件下 hPDLSCs 的细胞形态。(C) hPDLSCs 在第 7 天的 ALP 染色和第 21 天的 ARS 染色。(D) hPDLSCs 中 Runx2 和 OCN 的免疫荧光染色图像
(8)动物实验证实,有效遏制骨流失
Micro-CT显示水凝胶治疗组牙槽骨吸收得到显著遏制(图9B、C)。骨丧失高度的定量统计证明其疗效显著优于各对照组(图9D-G)。在体实验最终验证其治疗牙周炎的实际效果。

图9. HP-PVA@MH/Fe-Que 水凝胶在大鼠牙周炎模型中减轻牙槽骨流失。(A) 体内研究的治疗流程示意图。(B) 第 2 周时牙槽骨的三维重建、矢状图像(上虚线:CEJ,下虚线:ABC,红线:骨丧失)。(C) 植入后第 4 周拍摄的三维重建图像和二维矢状视图。(D) 第 2 周颊侧骨丧失高度和 (E) 矢状面骨丧失的定量评估。(F) 第 4 周颊侧骨丧失高度和 (G) 矢状面骨丧失的定量评估
本研究构建了一种ROS响应的可注射水凝胶,实现抗菌药物与抗炎纳米颗粒的协同递送与按需释放。该系统具备良好的生物相容性、抗菌性、抗氧化与抗炎能力,并通过调控Nrf2/NF-κB信号通路促进巨噬细胞M2极化与人牙周膜干细胞的成骨分化,在牙周炎治疗与牙周组织再生方面展现出良好的应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

