
牙周炎是一种由牙周病原菌引发的慢性炎症性疾病,常导致牙周组织,尤其是牙槽骨的进行性破坏。在慢性牙周炎环境中,细菌生物膜持续存在于深牙周袋和发炎的牙龈中,诱发过度免疫反应,导致牙槽骨吸收和牙齿松动。传统临床治疗方法包括清洁、刮治、根面平整和再生手术等,但难以彻底清除深层细菌,且骨再生效果不稳定,常因血管生成不足而失败。抗生素虽可辅助杀菌,但易导致耐药和菌群失衡。因此,亟需一种能同时实现深度杀菌和有效促进骨再生的治疗策略。

针对上述问题,青岛大学附属医院口腔科与康复大学材料修复与康复工程学院联合团队,设计并构建了一种硫化壳聚糖修饰的硫化铜纳米团簇(CuS@MSN-SCS),用于实现牙周炎治疗中同步杀菌与骨再生的双重功能。该纳米制剂通过将CuS纳米颗粒包覆于介孔二氧化硅(MSN)中,并进一步引入氨基和硫酸化壳聚糖(SCS)进行表面修饰,形成具有良好生物相容性和多功能响应能力的核壳结构。CuS@MSN-SCS不仅可通过Cu²⁺介导的类芬顿反应诱导ROS生成,有效杀灭核梭菌(Fusobacterium nucleatum)等牙周炎关键致病菌,还能通过Cu²⁺促进血管生成、SCS诱导骨形成,显著促进牙槽骨再生与组织修复。该文章于2024年5月20日以《Sulfated Chitosan-Modified CuS Nanocluster: A Versatile Nanoformulation for Simultaneous Antibacterial and Bone Regenerative Therapy in Periodontitis》为题发表于《ACS Nano》(DOI:10.1021/acsnano.4c00137)。
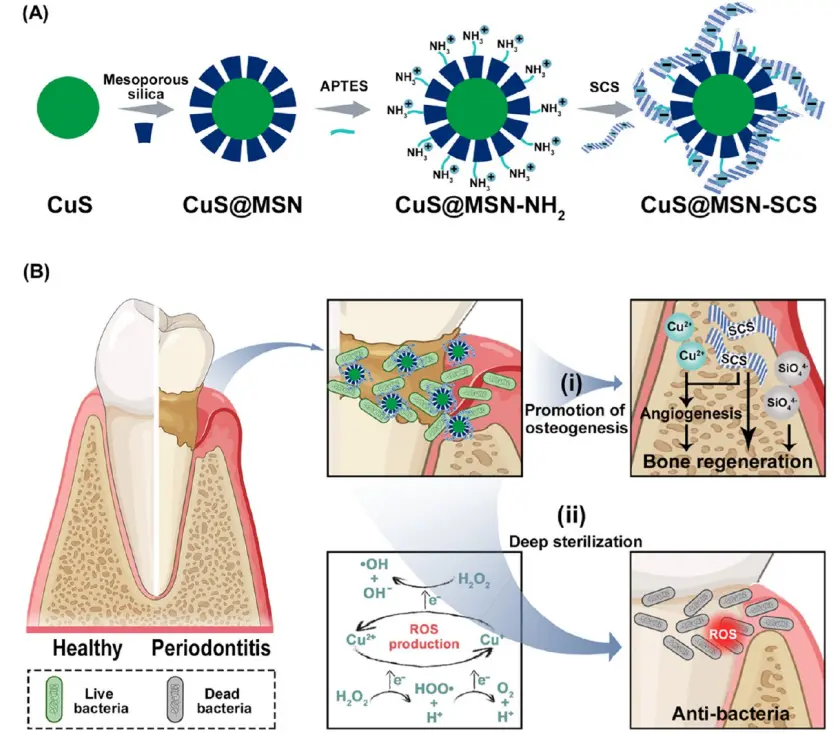
图1 用于牙周炎治疗的CuS@MSN-SCS的制备:(A)CuS@MSN-SCS的合成;(B)CuS@MSN-SCS在牙周炎治疗中的深度灭菌和骨再生机制
(1)CuS@MSN-SCS 的制备过程
首先,该CS纳米颗粒采用软模板法合成核壳结构。因柠檬酸钠配体包覆,CuS纳米颗粒带负电(图2A)。为克服TEOS水解产物亦带负电、难以直接包覆的问题,先以CTAB为软模板,通过静电/疏水作用在CuS表面形成阳离子双层,使其转为正电;再在碱性条件下TEOS水解缩合,经CTAB-硅酸盐静电作用生成CuS@MSN/CTAB。乙醇去除CTAB后,用APTES引入氨基得CuS@MSN-NH₂,再与带负电的SCS静电结合,最终得到CuS@MSN-SCS。TEM与FE-SEM显示各步修饰后粒径递增,核壳结构清晰(图2B-D);Cu、S、O、N等元素映射证实材料的组成(图2E)。
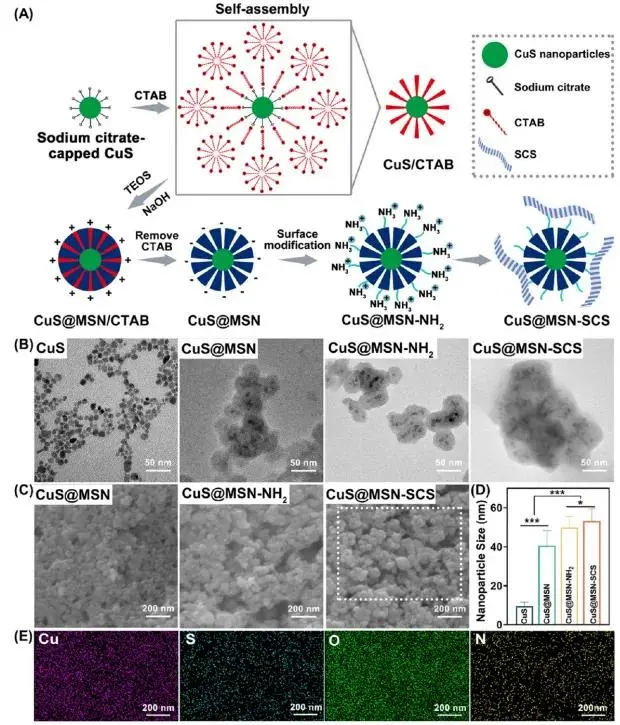
图2 CuS@MSN-SCS的表征:(A)CuS@MSN-SCS合成示意图;(B)TEM图像;(C)FE-SEM图像(白色虚线框表示元素映射区域);(D)纳米颗粒尺寸定量;(E)CuS@MSN-SCS的元素映射(Cu、S、O和N)
(2)CuS@MSN-SCS 成功制备的相关验证
FTIR(图3A)中1070cm⁻¹Si-O-Si对称/非对称伸缩振动峰证实MSN框架形成;CuS@MSN-NH₂在3450cm⁻¹出现-NH₂伸缩振动峰;SCS修饰后1203cm⁻¹出现S=O峰,且Si-O-Si与-NH₂峰分别蓝移至994与3310cm⁻¹,表明SCS以非共价方式结合。XPS总谱(图3B)可见Cu2p、O1s、C1s、Si2s/2p;CuS@MSN-NH₂出现~400eVN1s峰;CuS@MSN-SCS在~168eV新增S2p峰。高分辨谱(图3C)中Cu2p₃/₂与Cu2p₁/₂分别位于932.7与952.5eV,证实Cu(II)存在;S2p除CuS的S²⁻峰外,新增168.8/169.8eV-SO₃⁻峰;N1s中可见-NH₂、C-N及401.9eV-NHSO₃⁻峰(占26.7%),定量给出CuS/-SO₃⁻摩尔比约1:4.5,确证SCS修饰。XRD(图3E)保留CuS六方相特征峰(~48°)及23°非晶SiO₂宽峰,表明晶体结构部分保持。ζ电位(图2F)由-10.4 mV经CTAB、APTES、SCS逐步调节至10.6mV,证实了CuS@MSN-SCS的成功合成。
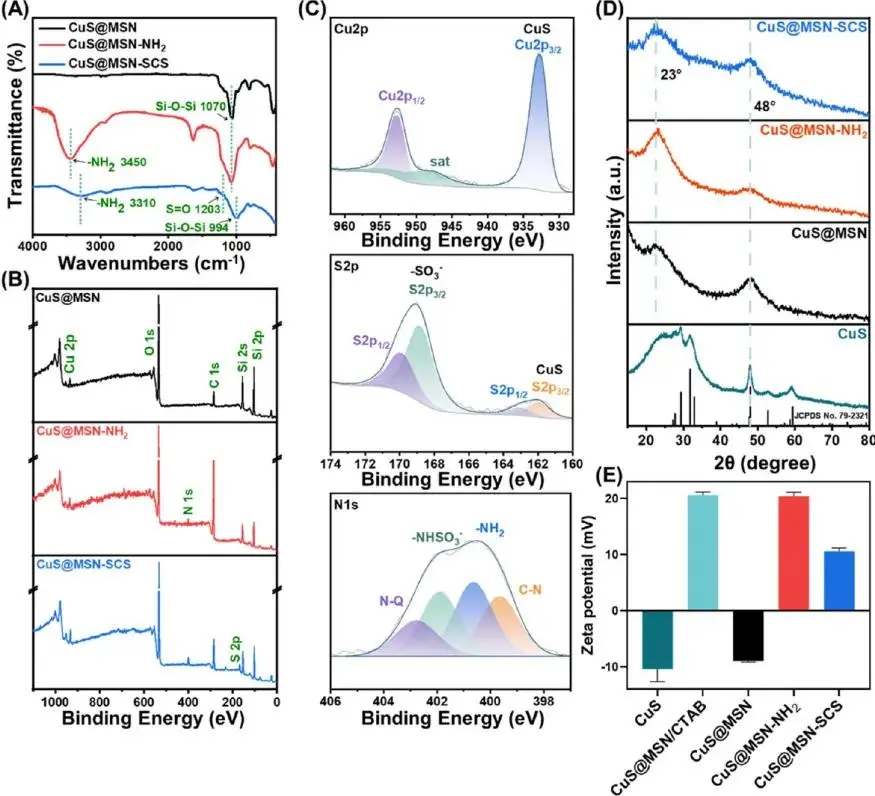
图3 CuS@MSN-SCS的表面物理化学性质:(A)FTIR光谱;(B,C)XPS光谱及Cu2p、S2p和N1s峰的解卷积;(D)XRD图谱;(E)Zeta电位
(3)CuS@MSN-SCS 抑制核梭菌生长与生物膜形成的评估
研究人员评估了CuS@MSN-SCS对牙菌斑生物膜形成与成熟的关键菌种核梭菌的抗菌效果。如图4A所示,50μg/mL CuS@MSN-SCS反而轻微促进细菌生长,归因于低浓度Cu²⁺作为应激信号刺激细菌代谢;当浓度升至100–300μg/mL时,菌落数随剂量增加而显著减少,250与300μg/mL组抑菌率均超95%(图 4B)。结晶紫染色(图4A)显示,对照与50μg/mL组呈深紫色,表明生物膜生物量高;200–300μg/mL 组OD₅₉₀值较对照下降约50%(图4C),提示高浓度CuS@MSN-SCS具显著抗生物膜活性。活/死染色(图4A)进一步证实,高浓度处理后生物膜厚度明显变薄,死菌比例升高(图4D)。进一步经过ROS检测(图4E)可知,50–150μg/mL时胞内ROS无显著变化;浓度≥200μg/mL时,ROS水平随剂量升高而显著增加。机制上,CuS@MSN-SCS释放的Cu²⁺被H₂O₂还原为Cu⁺,随后与H₂O₂发生类芬顿反应,生成•OH并循环再生Cu²⁺,诱发氧化应激(图S6)。过量ROS通过DNA损伤、蛋白质氧化及脂质过氧化诱导细菌凋亡,从而抑制生物膜形成。
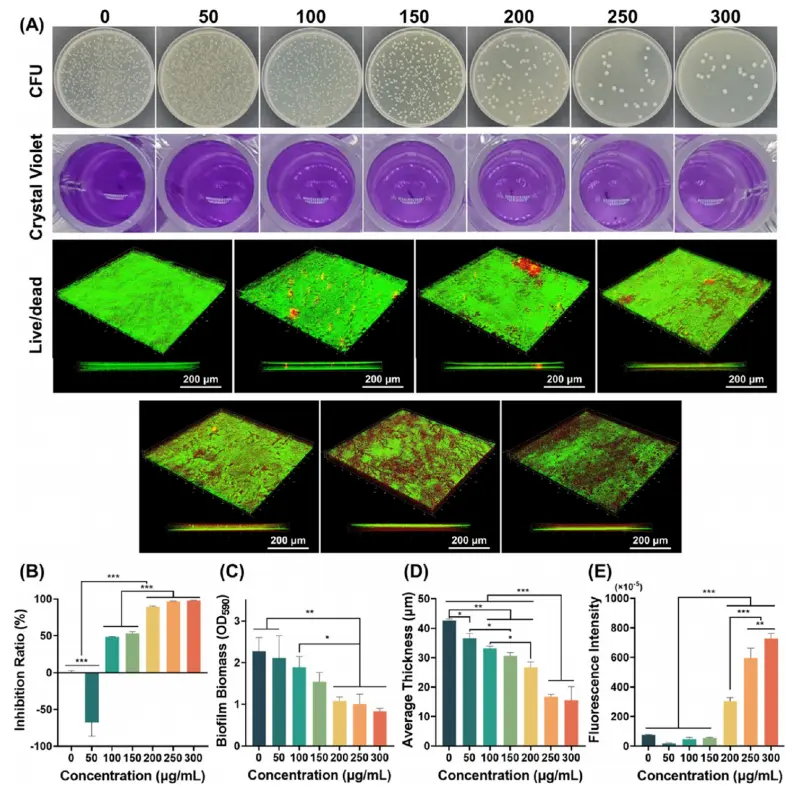
图4 不同浓度下CuS@MSN-SCS的抗菌能力:(A)核梭菌的菌落照片、结晶紫染色和活/死荧光染色;(B)抑菌率定量;(C)生物膜生物量(OD590)定量;(D)生物膜平均厚度定量;(E)核梭菌胞内ROS表达
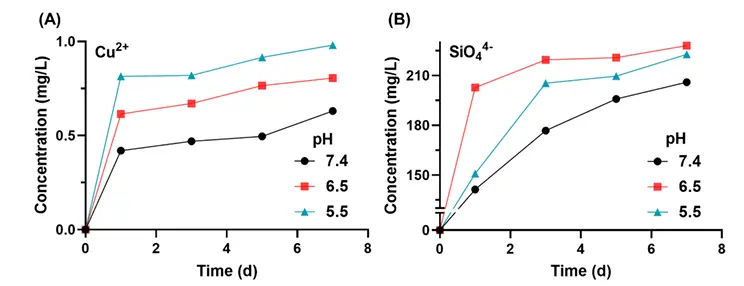
图S6 在37℃、PBS中,用ICP-AES测定1、3、5、7天内Cu²⁺与SiO₄4-的释放量
(4)CuS@MSN-SCS 生物相容性评估实验
细胞相容性评价是判断纳米材料能否用于生物医学的关键。研究人员利用L929成纤维细胞进行了相关的生物相容性实验,结果如图5A所示,除300μg/mL组外,L929成纤维细胞在Day1和Day2的存活率均高于75%,表明CuS@MSN-SCS在≤250μg/mL时具有良好的细胞相容性。而血实验(图5B)显示,各浓度CuS@MSN-SCS的上清液均未出现明显溶血,溶血率均低于5%,符合医用材料标准。综上,CuS@MSN-SCS在250μg/mL以下浓度展现出卓越的生物相容性。
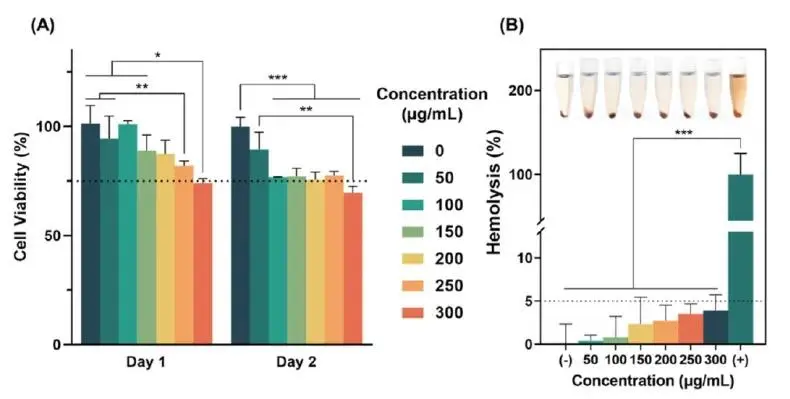
图5 CuS@MSN-SCS的生物相容性:(A)与CuS@MSN-SCS纳米颗粒共培养后L929细胞的细胞活力;(B)红细胞溶血率。磷酸盐缓冲液(PBS)作为阴性对照(-),双蒸水作为阳性对照(+)
(5)uS@MSN-SCS促进牙周炎大鼠的骨再生
基于抗菌能力和生物相容性的结果,研究人员选择了250μg/mL的CuS@MSN-SCS浓度用于治疗大鼠牙周炎。他们采用结扎联合高糖饮食的方法诱导大鼠牙周炎(图6A)。将丝线结扎于大鼠上颌第二磨牙颈部,并喂食高糖饮食14天以诱导炎症。随后,局部应用CuS@MSN-SCS治疗10次,以临床常用抗生素米诺环素(MiNo)作为阳性对照组进行疗效比较。与空白组相比,牙周炎组表现出明显的骨量丢失,证实牙周炎模型建立成功(图6B)。相比之下,CuS@MSN-SCS和MiNo组均表现出积极的治疗效果,牙槽骨出现再生,且两组之间无显著差异。牙槽骨丢失(ABL)分析进一步验证了上述结果(图6C)。此外,CuS@MSN-SCS治疗后大鼠体重显著增加(图6D),表明CuS@MSN-SCS对正常组织无明显毒性。XPS分析检测到CuS@MSN-SCS中存在痕量残留的CTAB,已知CTAB对真核细胞具有一定毒性,但已有研究表明大鼠对CTAB具有一定耐受性,在饮用水中给予低于20mg/kg/天的剂量持续一年未出现明显毒性反应。因此,大鼠对CTAB的耐受性解释了为何CuS@MSN-SCS中残留的CTAB未引起明显毒性反应,未影响主要器官和体重。
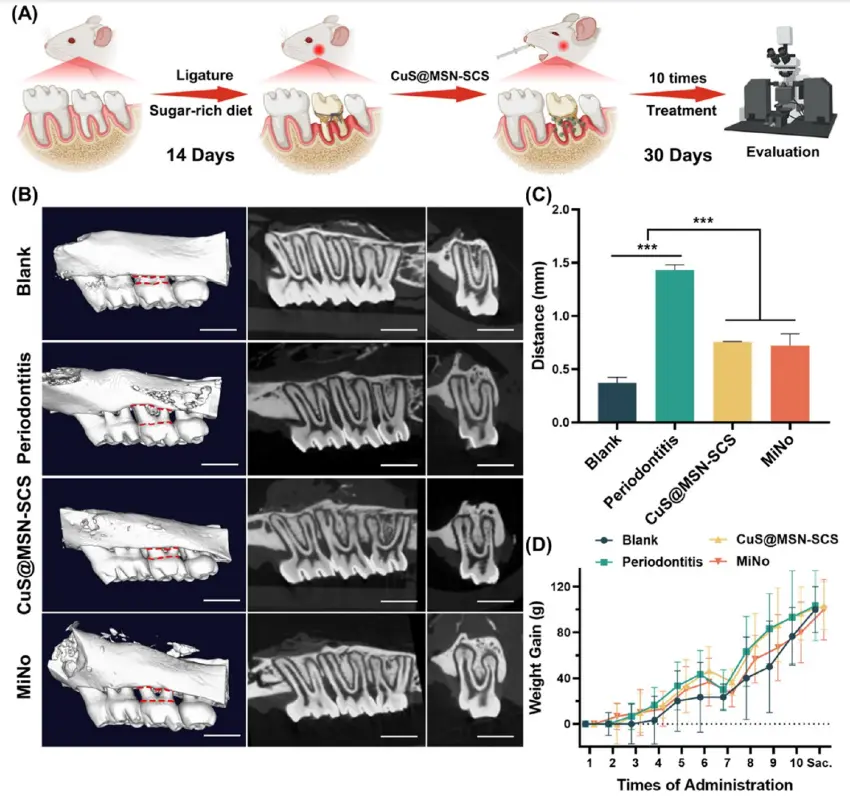
图6 CuS@MSN-SCS治疗后牙周炎大鼠的骨再生观察:(A)牙周炎模型建立示意图;(B)上颌第二磨牙的3D micro-CT重建图像和切片图像(比例尺= 2 mm)。牙骨质-釉质交界(CEJ)和牙槽嵴顶(ABC)用红色虚线标记;(C)基于micro-CT图像的ABL分析;(D)大鼠体重增长
(6)CuS@MSN-SCS治疗后牙周组织免疫反应和胶原沉积分析
研究人员们对鼠上颌第二磨牙牙周组织进行了H&E和Masson染色分析(图7A)。与空白组相比,牙周炎组表现出明显的免疫反应迹象,经CuS@MSN-SCS或MiNo治疗后,这些反应明显缓解。空白组牙周组织结构完整,胶原纤维排列有序,纺锤形纤维细胞和星形成纤维细胞沿纤维束排列。然而,牙周炎组结合上皮向牙根方向增殖和延伸,牙龈上皮可见上皮钉突,胶原纤维出现水肿变性,排列紊乱,伴有炎症细胞浸润。值得注意的是,CuS@MSN-SCS或MiNo治疗后,牙龈上皮钉突减少,结合上皮增殖减轻,胶原纤维恢复线性排列,牙周组织炎症明显减轻,表明治疗效果显著。为更直观反映治疗效果,对炎症细胞数量(图7B)和胶原降解程度(图7C)进行定量分析。免疫反应评分和胶原降解百分比均证实CuS@MSN-SCS纳米颗粒能够缓解炎症并抑制胶原降解,从而促进牙周炎治疗中的牙槽骨再生。
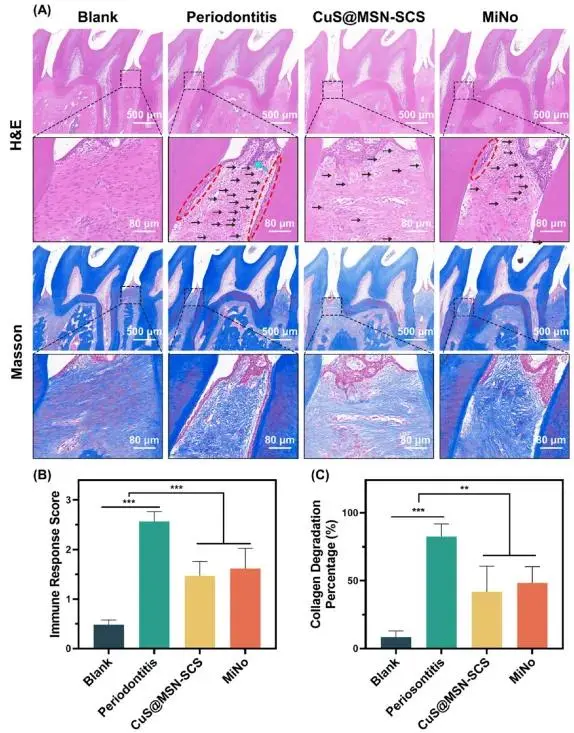
图7 CuS@MSN-SCS治疗后牙周组织免疫反应和胶原沉积分析:(A) 上颌第二磨牙牙周组织的H&E和Masson染色图像。(B) 免疫反应评分;(C) 胶原降解
(7)CuS@MSN-SCS治疗后牙周组织炎症和血管生成标志物评估
为确认炎症缓解情况,科研人员们进行了TNF-α 免疫组化染色,牙周炎组TNF-α表达明显(图8A)。CuS@MSN-SCS和MiNo治疗后,炎症水平显著降低,且CuS@MSN-SCS组与MiNo组之间无显著差异(图8B),进一步证实CuS@MSN-SCS纳米颗粒在减轻炎症方面的积极作用。炎症与新生血管化和血管功能密切相关,两者在骨愈合中起关键作用。因此,评估了血管生成标志物CD31的表达(图8A)。与其他组相比,CuS@MSN-SCS组CD31阳性的血管生成水平显著升高(图8C),这可归因于CuS@MSN-SCS释放的Cu²⁺离子和SCS的协同作用。这些发现表明,CuS@MSN-SCS 具有缓解炎症和促进牙槽骨再生所需的新生血管化能力,在牙周炎治疗中展现出显著的体内治疗效果。
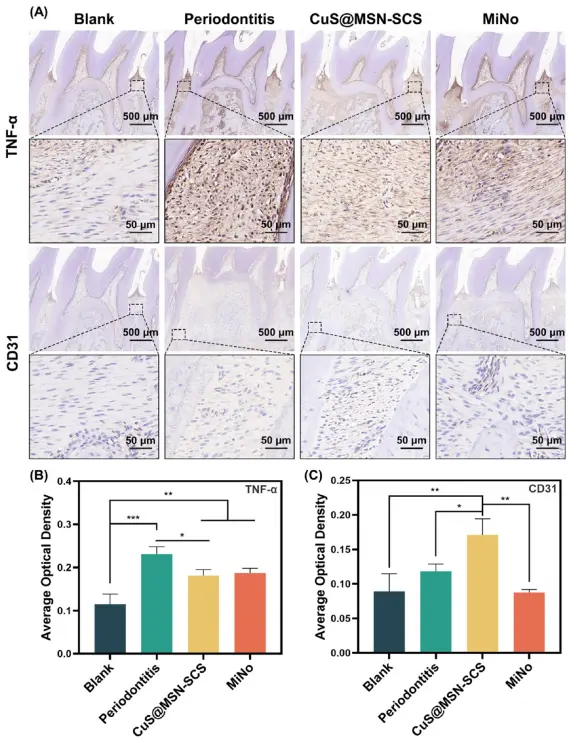
图8 CuS@MSN-SCS治疗后牙周组织炎症和血管生成标志物评估:(A) TNF-α和CD31的免疫组化染色;(B) TNF-α的平均光密度;(C) CD31的平均光密度
本研究成功构建的CuS@MSN-SCS纳米体系突破了传统“抗生素-杀菌”单一模式,在牙周炎局部治疗中实现“抗菌-促血管-成骨”三重协同:①利用Cu²⁺介导类芬顿反应爆发ROS,高效灭菌且规避耐药;②持续释放的Cu²⁺、SCS协同促血管新生,为骨修复提供微环境;③SiO₄⁴⁻与SCS共同刺激牙槽骨再生。体内实验证实其骨再生与抗炎疗效与临床抗生素MiNo相当,但血管化更优,且无全身毒性,兼具克服耐药、多功能整合等临床转化优势。未来需系统优化CuS粒径、壳层厚度及SCS装载量,以进一步提升治疗指数并推进临床前评价。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

