
缺血性心脏病是全球范围内发病和死亡的主要原因。尽管及时的冠状动脉介入再灌注能够有效挽救缺血心肌,但心肌缺血再灌注损伤仍是导致大量患者死亡的重要因素。目前尚无针对该损伤的特异性治疗药物进入临床应用。谷胱甘肽过氧化物酶4是抑制铁死亡的关键因子,但其蛋白水平的调控及降解机制尚不明确。同时,cGAS-STING通路作为先天免疫的核心组成部分,除抗病毒作用外,还在自噬、衰老等非经典功能中发挥作用,但其在心肌铁死亡中的具体角色仍有待阐明。研究提出“STING-GPX4-自噬性降解-铁死亡”新轴心,为MI/R提供可临床转化的联合干预靶点。

针对上述问题,山东大学齐鲁医院张猛/张澄团队探讨了当心脏经历MI/R损伤时STING如何调节心肌铁死亡的分子机制。研究发现,I/R诱导的线粒体损伤导致dsDNA释放,随后被cGAS识别,导致第二信使cGAMP的产生和STING的激活,STING 可以通过与GPX4的相互作用直接触发心肌铁死亡。STING与GPX4结合,促使自噬增强,随后又反过来导致GPX4降解,从而促进心肌铁死亡。利用AAV介导的GPX4过表达和施用STING拮抗剂是针对MI/R损伤的有效治疗策略。研究强调STING作为预防MI/R损伤、改善患者预后和降低与缺血性心脏病相关的死亡率的潜在治疗靶点。该文章于2025年04月25日以《STING Aggravates Ferroptosis-Dependent Myocardial Ischemia-Reperfusion Injury by Targeting GPX4 for Autophagic Degradation》为题发表于《Signal transduction and targeted therapy 》(DOI:10.1038/s41392-025-02216-9)。
(1)I/R引起心肌细胞中cGAS-STING信号上调
8 周龄雄性 C57BL/6J 小鼠 I/R 模型(图 1a、b)中,与假手术组相比,I/R 组心脏边界区域胞质双链 DNA(dsDNA)含量显著增加、cGAS 激活(图 1c),cGAS 和 STING 蛋白表达显著上调(图 1d、e),而梗死核心区和非缺血区的 cGAS、STING 蛋白水平无显著变化,免疫荧光结果证实 STING 在 I/R 边界区域表达增强。从 WT、cgas−/− 或 Sting−/− 小鼠心脏分离的细胞中,仅 I/R 边界区域的 CMs 出现 cGAS 和 STING 蛋白上调,cgas−/− 或 Sting−/− 小鼠的 CMs 中该上调效应不明显,成纤维细胞和巨噬细胞未观察到显著差异(图 1f、g),免疫荧光共定位进一步显示 I/R 心脏边界区域 CMs 的 STING 表达显著上调(图 1h)。体外实验中,小鼠原代 CMs(MPCs)缺氧 / 复氧(A/R)模型(图 1i)显示,与对照组相比,A/R 处理后 MPCs 线粒体严重损伤(表现为肿大、缩短、增厚),同时伴随 dsDNA 大量释放,胞质中出现不与细胞核或线粒体共定位的 dsDNA(图 1j)。
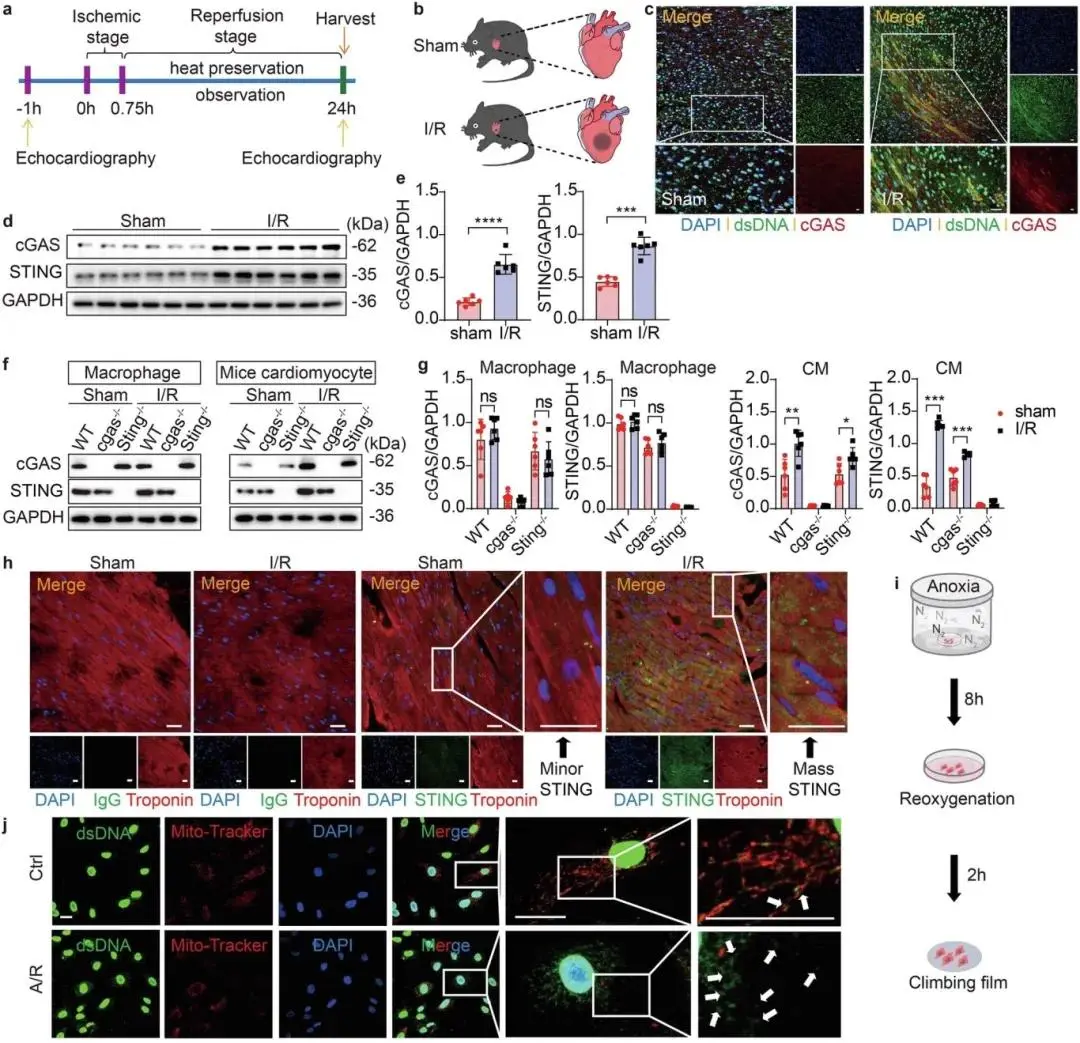
图1 I/R 诱导 CMs 中 cGAS-STING 上调。(a)小鼠 I/R 模型手术流程图;(b)小鼠 I/R 损伤模型示意图;(c)WT 小鼠 I/R 或假手术组心脏边缘区切片 dsDNA 与 cGAS 双免疫荧光分析;(d、e)WT 小鼠 I/R 或假手术组心脏边缘区分离细胞中 cGAS 和 STING 的 Western blot 检测及定量分析;(f、g)cgas−/−、Sting−/−及 WT 小鼠 I/R 或假手术组心脏边缘区不同细胞中 cGAS 和 STING 的 Western blot 检测及定量分析;(h)WT 小鼠 I/R 或假手术组心脏边缘区切片 CM 标志物与 STING 双免疫荧光分析;(i)CM 缺氧复氧(A/R)操作流程图;(j)A/R 后 MPCs 中 dsDNA 与线粒体双免疫荧光分析
(2)心肌细胞特异性敲除cGAS或STING显著减轻MI/R损伤
心肌细胞特异性cgas敲除(cgasfl/fl Myh6cre,cgas-CKO)和Sting敲除(Stingfl/fl Myh6cre,Sting-CKO)小鼠经构建用于MI/R损伤相关研究(图2a);KO小鼠与对照小鼠基线左心室射血分数(LVEF)、短轴缩短率(FS)无显著差异,不存在内在心功能异常。I/R后,cgas-CKO小鼠坏死面积减少、心功能(EF、FS)改善、纤维化面积降低(图2b–d),cgas或Sting-CKO小鼠再灌注7天的心肌纤维化程度同样减轻。体内I/R模型中,对照心肌细胞在生理状态下cGAS表达极低,I/R可诱导其表达,而cgas-CKO心肌细胞中该上调现象缺失(图2e);Sting-CKO小鼠呈现类似结果(图2f–h),且I/R可诱导Stingfl/fl心肌细胞STING表达,Sting-CKO心肌细胞的STING蛋白水平不受I/R影响(图2i)。
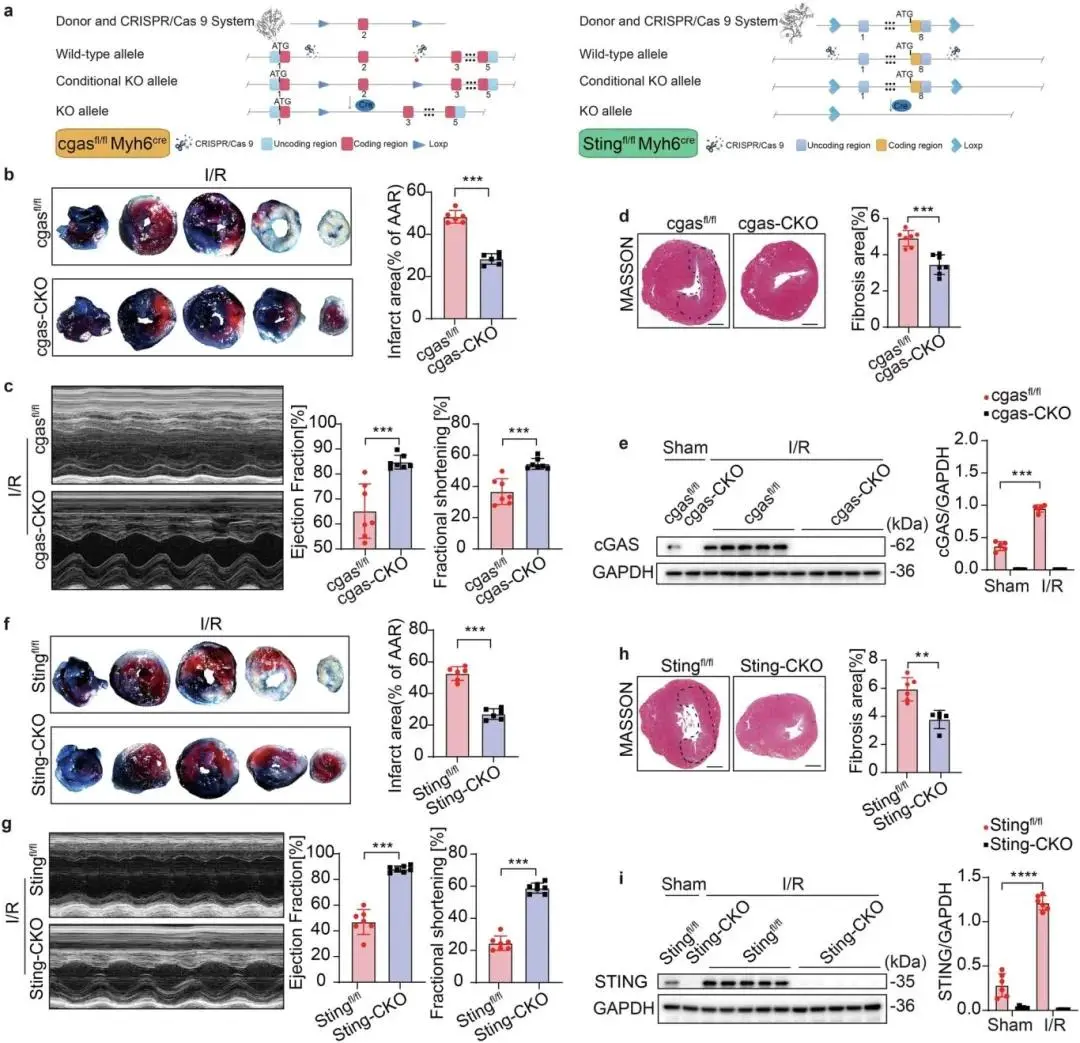
图2 cGAS-STING缺失可减轻心肌I/R损伤。(a)cgas或Sting心肌细胞特异性条件性基因敲除小鼠结构示意图;b 心肌梗死面积及代表性组织切片;c 超声心动图及EF%、FS%测量;d Masson染色及纤维化面积百分比;e 心脏边界区心肌细胞cGAS的Western blot及定量;f 心肌梗死面积(占AAR百分比)及代表性组织切片;g 超声心动图及EF%、FS%测量;h Masson染色及纤维化面积百分比;i 心脏边界区心肌细胞STING的Western blot及定量
(3)STING通过调节氧化应激损伤加剧心肌铁死亡
Sting-CKO 小鼠与对照小鼠 I/R 后的心肌组织经 RNA 测序(图 3a),京都基因与基因组百科全书(KEGG)通路分析显示差异表达基因(DEGs)显著富集于细胞生长和死亡通路(图 3b);I/R 后心肌 Tunel 阳性细胞增多,而 cgas-CKO 和 Sting-CKO 小鼠的 Tunel 阳性细胞水平显著降低,但 Sting-CKO 小鼠与对照小鼠的凋亡标志物(Pro-caspase-3、Cleaved-caspase3、BCL-2)蛋白丰度无显著差异,表明 STING 缺失可减轻 I/R 后的心肌细胞死亡,但并非通过调控凋亡(图 3c)。基因本体论(GO)富集分析显示,与 Sting-CKO 小鼠相比,Stingfl/fl 小鼠 I/R 后心肌组织中自溶酶体相关、氧化应激及铁死亡信号通路相关基因富集更为显著(图 3d)。A/R 处理后,STING 可有效促进脂质过氧化终产物丙二醛(MDA)生成,效果与阳性对照 Erastin 相当,且 STING 激活能阻断铁死亡抑制剂 Fer-1 对 MDA 的抑制作用(图 3e);体外培养心肌细胞经 A/R 处理后活性氧(ROS)生成增加,Fer-1 预处理可降低 ROS 水平,而加入 cGAMP 激活 STING 后,Fer-1 对 ROS 的抑制作用显著受阻(图 3f)。Western blot 检测显示,Sting-CKO 小鼠 I/R 后心肌组织中酰基辅酶 A 合成酶长链家族成员 4(ACSL4)、转铁蛋白受体(TFR)表达降低,谷胱甘肽过氧化物酶 4(GPX4)表达升高,溶质载体家族 7 成员 11(SLC7A11)无显著变化(图 3g、h),A/R 处理的心肌祖细胞(MPCs)中也证实铁死亡相关蛋白表达存在类似变化(图 3i、j),且 Sting 缺失可阻断 A/R 诱导的 GPX4 降解;qPCR 结果显示,I/R 后 Stingfl/fl 与 Sting-CKO 小鼠心肌组织中 gpx4 mRNA 水平无差异,提示 GPX4 蛋白减少源于翻译后调控而非转录水平下调。
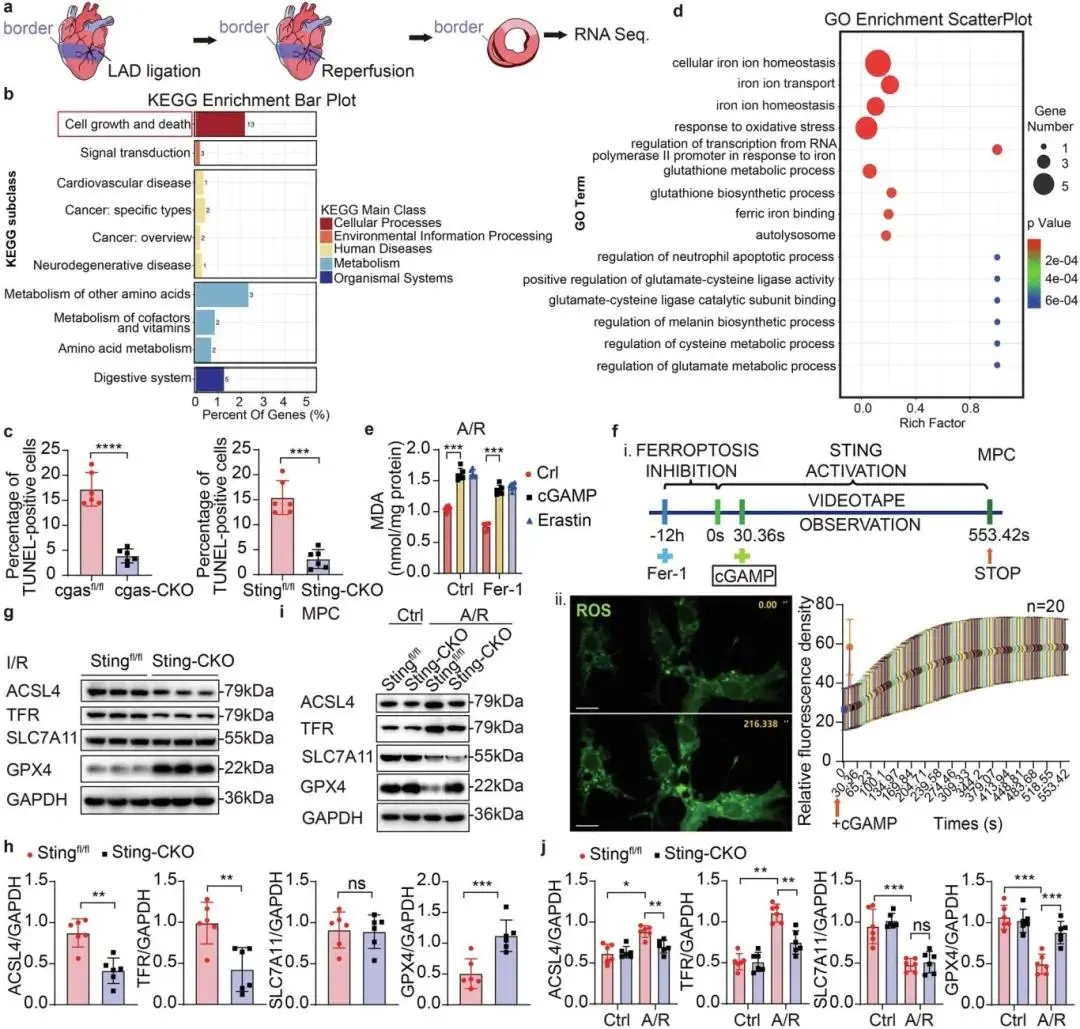
图3 STING通过调控氧化应激损伤加剧心肌铁死亡。(a)I/R后用于RNA-seq的心脏区域示意图;(b)RNA-seq的KEGG富集条形图;(c)cgas-CKO、Sting-CKO及对照小鼠边界区心脏切片Tunel免疫荧光统计图;(d)RNA-seq的GO富集散点图;(e)脂质过氧化MDA分析;(f)MPC中ROS活细胞免疫荧光成像分析;(g,h)Stingfl/fl与Sting-CKO心肌细胞I/R后ACSL4、TFR、SLC7A11和GPX4的Western blot及定量;(i,j)Stingfl/fl与Sting-CKO的MPC在A/R或常氧条件下ACSL4、TFR、SLC7A11和GPX4的Western blot及定量
(4)STING直接靶向GPX4并与其相互作用
RNA-seq差异表达基因的京都基因与基因组百科全书(KEGG)通路分析显示,铁死亡相关基因显著富集(图4a);通过心肌干细胞(MPCs)中STING蛋白亲和抗体的串联亲和纯化、免疫沉淀产物银染(图4b i)及液相色谱-质谱联用(LC-MS/MS)分析(图4b ii),鉴定出铁死亡相关因子GPX4可能为STING的相互作用蛋白,分子对接预测STING(PDB ID: 4F5W)与GPX4(PDB ID: 5L71)存在10种潜在结合模式,Match-Align评分为8.157(图4c)。内源性免疫共沉淀(Co-IP)实验表明,A/R后心肌细胞中内源性STING与GPX4形成复合物,cGAMP可进一步增强该复合物形成(图4d),且GPX4的内源性纯化产物中可检测到STING(图4e);HeLa细胞中过表达Myc标签STING(Myc-STING)和Flag标签GPX4(Flag-GPX4)后,Myc或Flag IP实验显示两者存在相互作用(图4f、g),cGAMP处理可时间依赖性增强该相互作用,而Erastin则减弱其结合强度(图4h)。免疫染色结果显示,常氧条件下MPCs中STING低表达且与GPX4无共定位(图4i i),A/R后STING激活并与GPX4形成聚集点(图4i ii),cGAMP刺激后两者大量聚集并共定位(图4i iii),Erastin处理后共定位显著减少(图4i iv);Stingfl/fl小鼠I/R心肌边界区STING表达升高且与GPX4共定位(图4j),而Sting-CKO小鼠中GPX4荧光增强且无STING共定位。
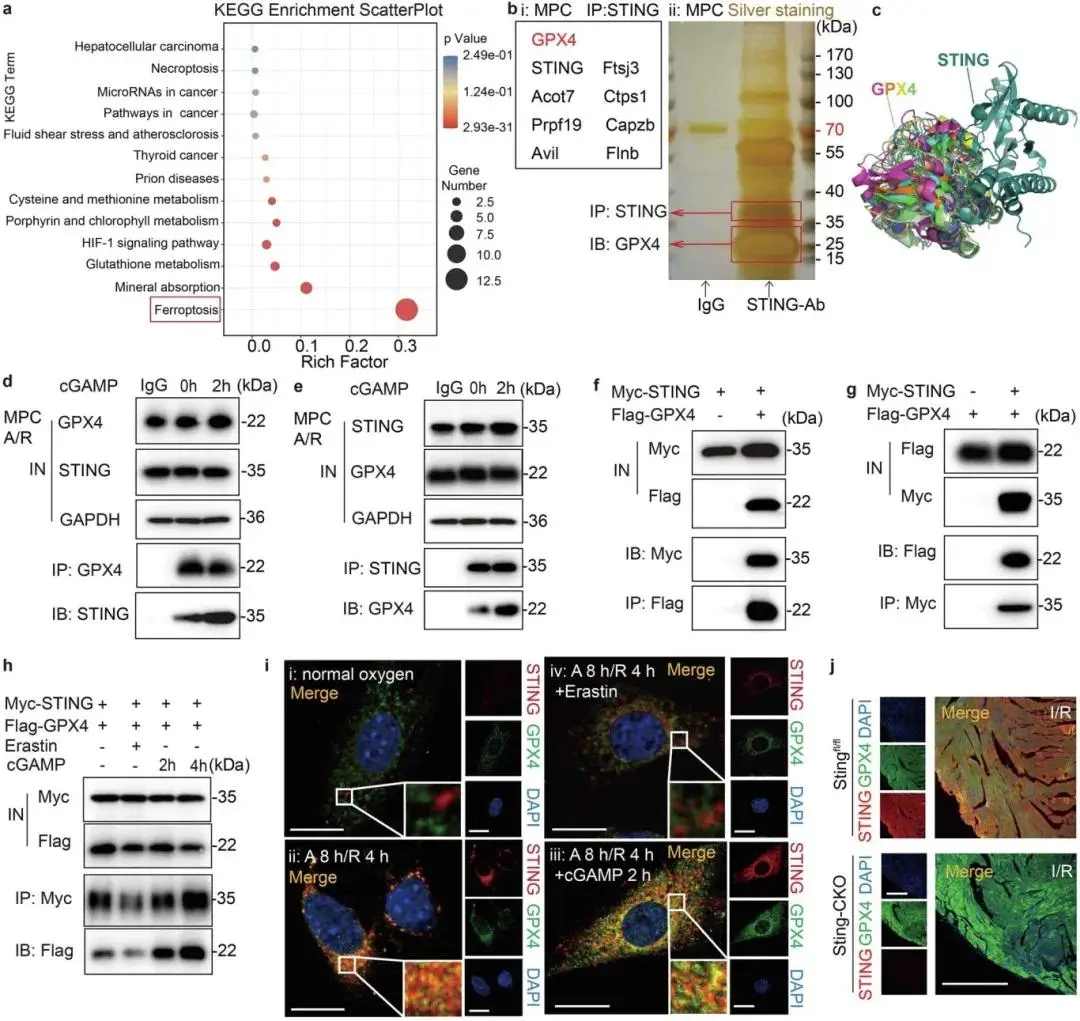
图4 GPX4靶向STING。(a)KEGG显示铁死亡通路富集;(b)MPCs A/R后使用STING亲和抗体进行串联亲和纯化的银染和LC-MS/MS分析;(c)STING与GPX4分子对接的十种潜在接触模式图像;(d)MPCs中内源性GPX4与STING相互作用及cGAMP短时刺激影响的Co-IP分析;(e)MPCs中内源性STING与GPX4相互作用及cGAMP短时刺激影响的Co-IP分析;(f)HeLa细胞中STING与GPX4相互作用的Co-IP分析;(g)HeLa细胞中GPX4与STING相互作用的Co-IP分析;(h)HeLa细胞中Erastin或cGAMP处理下GPX4与STING相互作用受cGAMP时间梯度或Erastin影响的Co-IP分析;(i)HeLa细胞中STING和GPX4共定位的双免疫荧光分析;(j)Stingfl/fl或Sting-CKO边界区心脏切片中GPX4和STING共定位的双免疫荧光分析
(5)STING与GPX4在GPX4的N146位点和STING的T267位点发生直接相互作用
基于蛋白质数据库(PDB)中 Apo STING(PDB ID: 4F5W)和 GPX4(PDB ID: 5L71)的相互作用预测,STING 可能通过 Y167、E260、Y245、Q266 或 T267 位点与 GPX4 的 G126、R127 或 N146 位点结合(图 5a)。HeLa 细胞中 Flag-GPX4 突变体与 Myc-STING 的 IP 实验显示,仅 Flag-GPX4-ΔN146 突变体丧失与 STING 的相互作用(图 5b);Myc-STING 突变体实验中,仅 Myc-STING-ΔT267 突变体无法与 GPX4 结合(图 5c)。稳定过表达 Myc-STING 和 Flag-GPX4 的 HeLa 细胞中,STING 缺失 T267 位点或 GPX4 缺失 N146 位点时,两者共定位完全消失(图 5d)。超分辨成像显微镜(SIM)观察显示,转染 Myc-STING 和 Flag-GPX4 质粒的 HL-1 细胞中,两者存在强烈结合与共定位(图 5e);cGAMP 可促进 STING-GPX4 复合物形成,但 Flag-GPX4-ΔN146 与 Myc-STING 共转染时,即使加入 cGAMP 也无法恢复共定位,证实 N146 和 T267 位点为两者相互作用的关键位点。
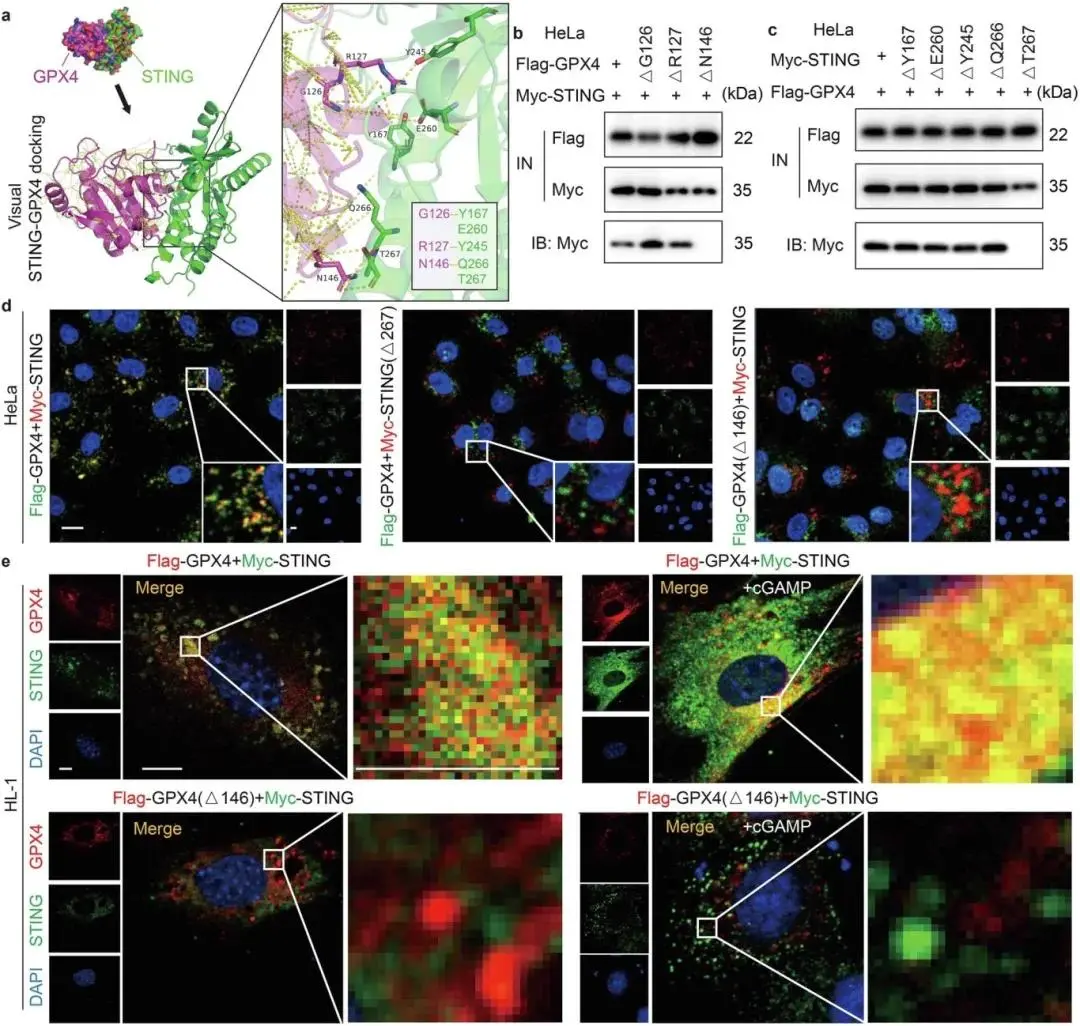
图5 STING与GPX4通过GPX4的N146和STING的T267氨基酸残基直接相互作用。(a)GPX4与STING潜在结合位点的分子对接图像;(b)HeLa细胞中Flag-GPX4及其点突变体与Myc-STING的Co-IP分析;(c)HeLa细胞中Flag-GPX4与Myc-STING及其点突变体的Co-IP分析;(d)HeLa细胞中STING与GPX4及其突变体共定位的双免疫荧光分析;(e)HL-1细胞中STING与GPX4在cGAMP处理下的共定位双免疫荧光分析
(6)STING通过自噬-溶酶体途径降解GPX4促进铁死亡
STING 可促进 GPX4 蛋白降解,该过程是铁死亡、活性氧(ROS)生成及脂质过氧化的关键环节。cGAMP(STING 激活剂)能降低 GPX4 蛋白水平,而铁死亡抑制剂 Fer-1 对 GPX4 的升高作用可被 cGAMP 阻断;Erastin 与 cGAMP 作用类似,STING 抑制剂 H-151 则能抑制 Erastin 诱导的 GPX4 降解(图 6a、b)。蛋白降解途径验证显示,仅溶酶体抑制剂(氯喹 CQ、NH4Cl)可有效阻断 cGAMP 诱导的 GPX4 降解并增加其丰度,自噬晚期抑制剂巴佛洛霉素 A1(Baf A-1)能阻断该降解,而自噬早期抑制剂(LY294002、3-MA、Wortmannin)及蛋白酶体抑制剂(MG-132、calpeptin)无此效果,表明 STING 通过促进自噬体与溶酶体融合介导 GPX4 的自噬降解(图 6c、d)。Sting 缺失可抑制 I/R 诱导的自噬(补充图 2g);RFP-GFP-LC3 双荧光自噬示踪系统显示,A/R 条件下自噬激活,Sting-CKO 心肌祖细胞(MPCs)中黄色荧光点增多、红色荧光点减少,提示自噬体 - 溶酶体融合受阻、自噬体成熟障碍(图 6e–g)。三色免疫荧光分析显示,A/R 激活 STING 后,Stingfl/fl MPCs 中出现 LC3 斑点,且 STING、LC3 与 GPX4 存在明确共定位,Sting 缺失细胞中无此现象(图 6h)。STING-GPX4 复合物最初定位于内质网 - 高尔基体中间室(ERGIC),随后转运至 COP-I 囊泡及 LC3 标记的自噬体;A/R 诱导的 GPX4-STING 斑点可被溶酶体相关膜蛋白 2B(LAMP2B)标记的自溶酶体膜环绕,表明 STING 可招募 GPX4 进入自噬体,通过自噬 - 溶酶体途径降解(图 6i)。
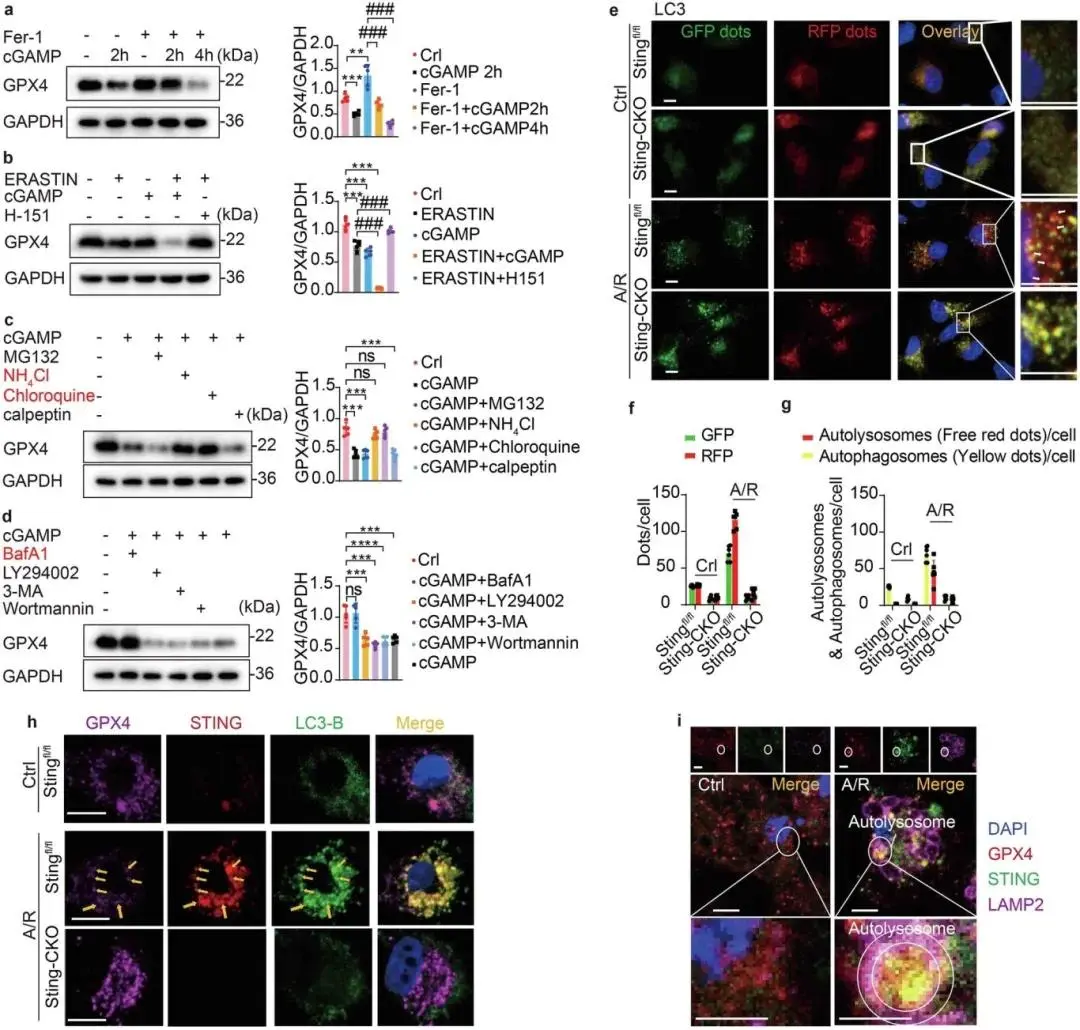
图6 STING 通过自噬 - 溶酶体介导的 GPX4 降解促进铁死亡。(a)Fer-1 或 cGAMP 对 MPCs 中 GPX4 表达的 Western blot 检测及定量;(b)Erastin、cGAMP 或 H-151 诱导的 MPCs 中 GPX4 降解 Western blot 检测及定量;(c)cGAMP 诱导的 MPCs 中 GPX4 降解及 MG-132、NH4Cl、氯喹、钙蛋白酶抑制剂的阻断作用 Western blot 检测及定量;(d)cGAMP 诱导的 MPCs 中 GPX4 降解及 Baf A-1等的阻断作用 Western blot 检测及定量;(e–g)有无 A/R 处理的 Stingfl/fl 或 Sting-CKO MPCs 中 mRFP-GFP-LC3 标记的自噬流免疫荧光分析;(h)Stingfl/fl 或 Sting-CKO MPCs 中 GPX4、STING 与 LC3B 三重免疫荧光分析;(i)有无 A/R 处理的 MPCs 中 GPX4、STING 与 LAMP2B 三重免疫荧光分析
(7)AAV介导的GPX4过表达可缓解STING激活引起的心肌缺血再灌注损伤
携带心肌细胞特异性 cTNT 启动子且标记 GFP 的腺相关病毒(AAV-GPX4)用于体内实验,小鼠尾静脉注射该病毒 14 天后,术前 3 天腹腔注射 STING 激活剂 DMXAA 或 DMSO(图 7a),Western blot 与免疫荧光染色证实心肌细胞中 GPX4 过表达效率(图 7b)。DMXAA 可增大 I/R 后的心肌梗死面积,而 GPX4 过表达能显著缩小该面积(图 7c、d);STING 激活会加剧 I/R 后的心脏功能障碍,GPX4 过表达则可明显改善心功能,表现为 I/R 后左心室射血分数(EF)和短轴缩短率(FS)升高(图 7e、f)。脂质过氧化标志物 4 - 羟基壬烯醛(4-HNE)水平因 STING 激活显著升高,GPX4 过表达可逆转该升高趋势,提示铁死亡被抑制(图 7g),心肌祖细胞(MPCs)中活性氧(ROS)积累检测结果与此一致(图 7h)。阻断 cGAS/STING 信号或过表达 GPX4,可部分恢复 A/R 条件下心肌细胞的 ATP 水平、线粒体膜电位(ΔΨm)、基础线粒体呼吸、ATP 生成量及最大和备用呼吸容量(补充图 4b–g),表明线粒体功能得到部分恢复。
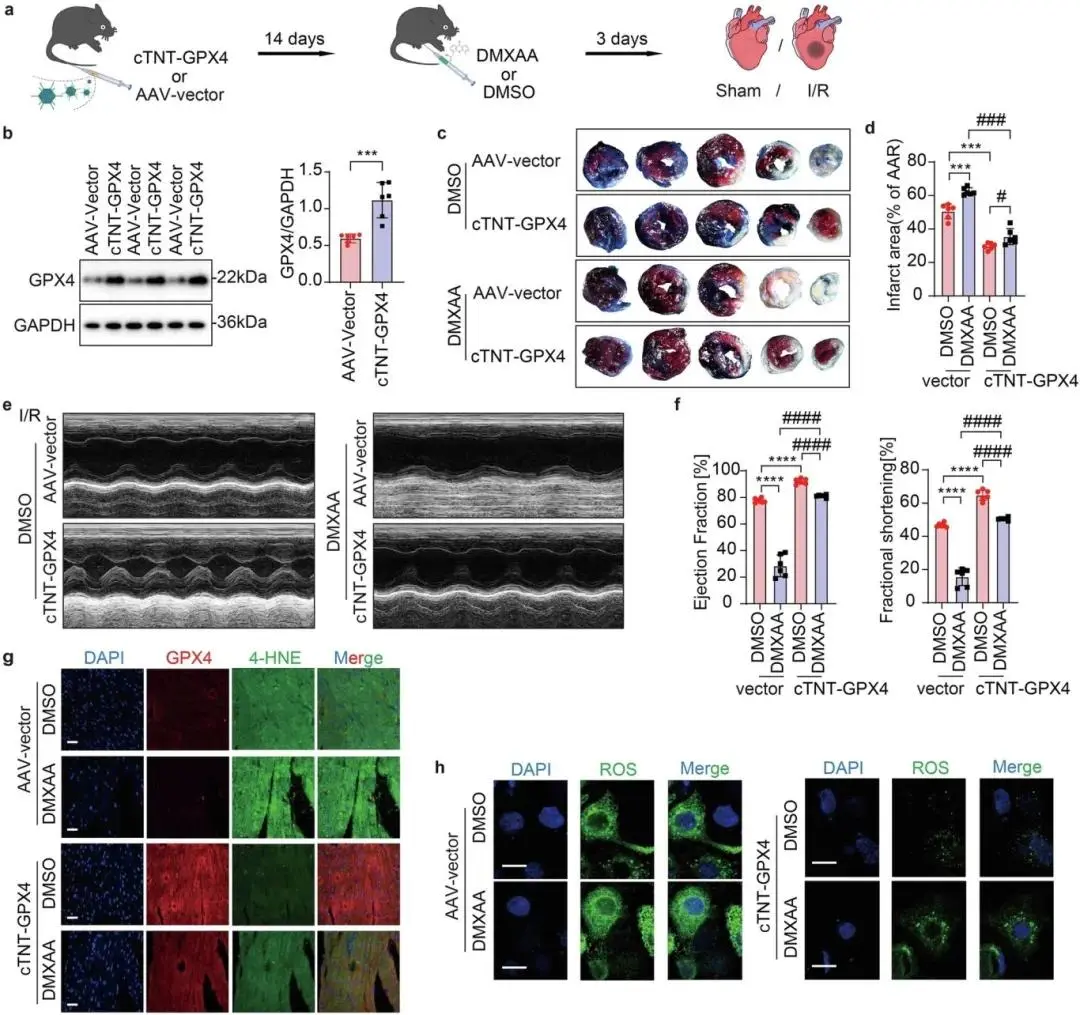
图7 AAV 介导的 GPX4 治疗对 STING 激活引发的严重 I/R 损伤的心脏功能保护作用。(a)AAV 或 DMXAA 处理的 I/R 诱导心功能障碍时间线示意图;(b)心肌细胞中 GPX4 过表达验证的 Western blot;(c、d)心肌梗死面积;(e、f)超声心动图及 EF%、FS% 检测;(g)心脏边缘区切片 GPX4 与 4-HNE 双免疫荧光分析;(h)A/R 后 DMSO 或 DMXAA 处理下,AAV-cTNT-GPX4 或 AAV-Control 感染小鼠心肌细胞中 ROS 免疫荧光成像分析
(8)STING抑制剂H-151可减轻心肌缺血再灌注损伤
I/R 术前小鼠腹腔注射 STING 抑制剂 H-151(每两天一次,共 7 天)(图 8a i),体内心脏成像显示心肌坏死范围得到有效控制(图 8a ii);H-151 处理可减少梗死面积(图 8b、c)、恢复心功能(图 8d、e),并缓解 I/R 诱导的 4 - 羟基壬烯醛(4-HNE)水平升高,提示脂质过氧化及铁死亡被抑制(图 8f)。体外实验中,H-151 可阻断 STING 与 GPX4 的相互作用(图 8g)、抑制自噬流(图 8h),进而减少活性氧(ROS)积累,减轻心肌铁死亡(图 8i)。
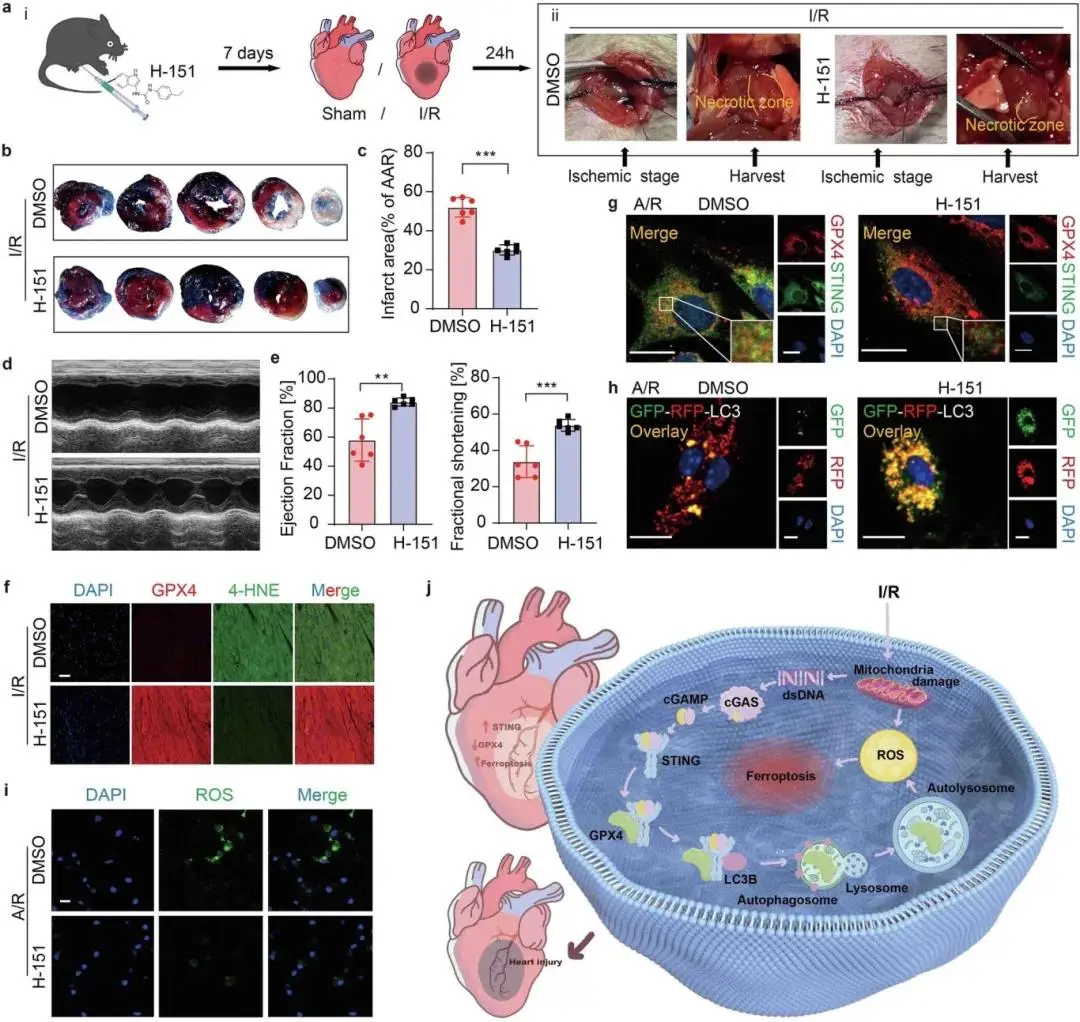
图8 STING 是缓解 I/R 后心功能障碍的潜在治疗靶点。(a)i. H-151 或 DMSO 处理的 I/R 诱导心功能障碍时间线示意图;ii. I/R 后 DMSO 或 H-151 处理小鼠的心脏代表性照片;(b、c)心肌梗死面积;(d、e)超声心动图及 EF%、FS% 检测;(f)心脏边缘区切片 GPX4 与 4-HNE 双免疫荧光分析;(g)A/R 后 DMSO 或 H-151 处理小鼠心肌细胞中 GPX4 与 STING 免疫荧光分析;(h)A/R 后 DMSO 或 H-151 处理小鼠心肌细胞中 mRFP-GFP-LC3 标记的自噬流免疫荧光分析;(i)A/R 后 DMSO 或 H-151 处理小鼠心肌细胞中 ROS 免疫荧光成像分析;(j)STING 促进 MI/R 损伤的机制示意图
本研究聚焦心肌缺血再灌注(MI/R)损伤中的铁死亡机制,核心揭示了 STING 在该病理过程中的关键调控作用。研究证实,MI/R 损伤会导致心肌细胞胞质双链 DNA 积累,激活 cGAS-STING 信号通路,而 STING 作为下游关键分子,可通过其 T267 位点与 GPX4 的 N146 位点直接结合,启动自噬 - 溶酶体介导的 GPX4 降解,进而诱发氧化应激、脂质过氧化及活性氧积累,最终加剧心肌细胞铁死亡。通过构建心肌细胞特异性 cGAS/STING 敲除小鼠模型,发现敲除该通路分子可在急性及慢性阶段(7 天再灌注)均发挥心脏保护作用,减少铁死亡和纤维化;而 STING 激活则会恶化上述病理改变。机制上,STING 通过非免疫依赖途径调控自噬,介导 GPX4 进入自噬溶酶体降解,且该过程独立于泛素 - 蛋白酶体途径。此外,AAV 介导的 GPX4 过表达及 STING 拮抗剂(如 H-151)可有效抑制 MI/R 诱导的铁死亡和心脏损伤。 该研究首次阐明了 STING 直接调控 GPX4 降解的铁死亡新机制,明确了 STING 作为 MI/R 损伤的潜在治疗靶点,为临床开发针对性干预策略提供了重要理论依据,同时也指出未来需在大动物模型中验证核心发现,并进一步探索其他细胞死亡机制的协同作用。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

