
研究背景:
全球糖尿病患者规模庞大,预计2030年将达6.43亿,慢性创面是其严重并发症之一,不仅影响患者生活质量,还可能导致截肢风险。高糖环境会促使晚期糖基化终产物(AGEs)大量产生,与多种细胞(包括炎症细胞、内皮细胞和神经元)表面广泛表达的AGE受体(RAGE)发生相互作用,持续刺激活性氧(ROS)生成和促炎细胞因子释放,进而形成氧化应激与慢性炎症的恶性循环,损伤神经血管再生,最终延缓创面愈合。传统抑制AGEs形成的化合物(如氨基胍、吡哆胺)存在生物利用度低、副作用明显等问题,临床应用受限。多数创面敷料研究仅侧重血管生成或神经再生单一维度,忽视了神经血管网络重构在创面愈合中的关键作用。

针对上述问题,中国海洋大学韩璐教授团队提出了一种“生物-电”协同治疗平台,该平台将多酚工程化海带外泌体(CA@Exos)产生的生物信号与导电微针(pCNTs-ASA MNs)传递的电信号相结合,通过双通路重塑糖尿病创面愈合过程中的神经血管微环境。CA@Exos作为生物活性载体,可抑制AGEs形成、清除ROS并逆转炎症微环境;同时,其在调控血管生成和神经营养信号方面的固有生物活性,还能增强施万细胞与血管内皮细胞之间的通讯。与此同时,导电pCNTs-ASA MNs发挥时空生物电支架的作用:通过传递外源性电刺激,既提高了外泌体的细胞摄取效率,又放大了创面内源性电流。这种双模态策略协同促进血管生成、神经再生及再上皮化,成功实现了糖尿病大鼠全层创面的闭合。该文章于2025年8月26日以《Conductive Microneedles Loaded With Polyphenol-Engineered Exosomes Reshape Diabetic Neurovascular Niches for Chronic Wound Healing》为题发表于《Advanced Science》(DOI:10.1002/advs.202507974)。
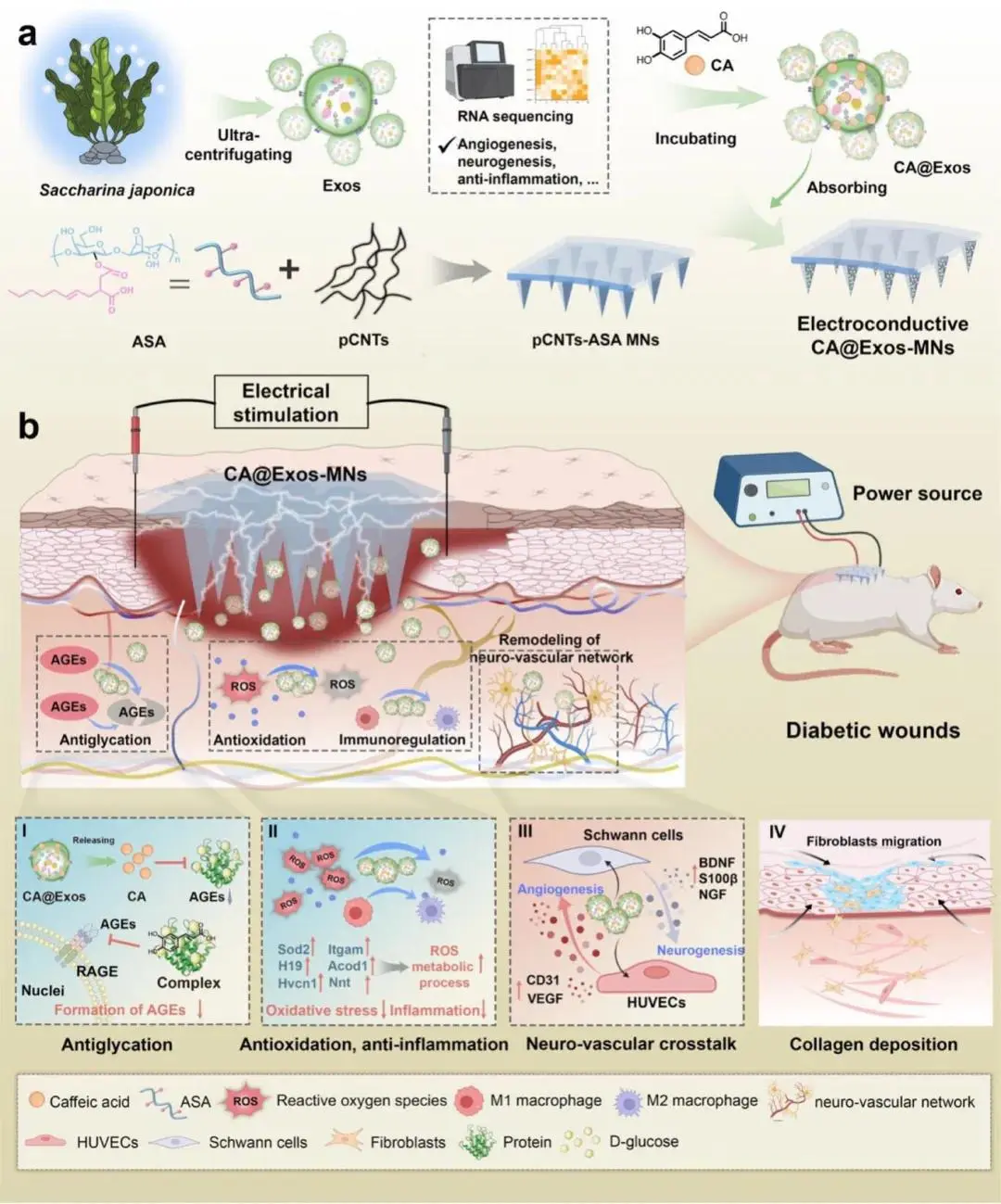
图1. 海带来源外泌体功能化导电微针通过调控高糖微环境与神经血管重塑加速糖尿病创面愈合的示意图。a)制备流程示意图,包括海带Exos的分离、外泌体负载CA得到CA@Exos、ASA与pCNTs复合导电微针(MNs)的制备,以及将CA@Exos物理吸附于pCNTs-ASA MNs表面,最终得到CA@Exos-MNs贴片的过程。b)CA@Exos-MNs贴片联合外源性电刺激的作用机制:抑制AGEs、ROS生成及炎症反应,同时促进细胞迁移与神经血管通讯、胶原沉积,进而加速糖尿病创面愈合
(1)海带来源Exos的分离及其在调控血管生成和神经营养信号中的生物活性
差速离心-超速离心-密度梯度超速离心三步法分离纯化海带来源外泌体,产物富集于蔗糖梯度30%/45%界面(图2b)。TEM显示典型杯状囊泡(图2c),NTA粒径3.01×10¹³ particles/mL(图2d)。三批次miRNA谱高度重合(图2e),靶基因GO富集于皮肤发育、创面愈合、神经元分化、轴突导向、免疫、血管生成、细胞迁移(图2f);KEGG前20条通路显著富集Wnt、轴突导向、神经营养因子及NF-κB信号(图2g)。
HUVEC与施万细胞模型验证:10–75 μg/mL外泌体作用24 h细胞存活率>90%(图2h,i);50 μg/mL DiO-外泌体6 h即核周聚集(图2j,k)。成管实验50 μg/mL组6 h管长、连接点、覆盖面积均增(图2l),VEGF mRNA上调(图2m)。施万细胞6 d后S100β荧光增强(图2n),BDNF、NGF、S100β mRNA及BDNF蛋白升高(图2o)。
综上所述,这些研究结果表明,海带来源外泌体兼具促血管生成与促神经生成活性,可用于糖尿病创面神经-血管协同修复。
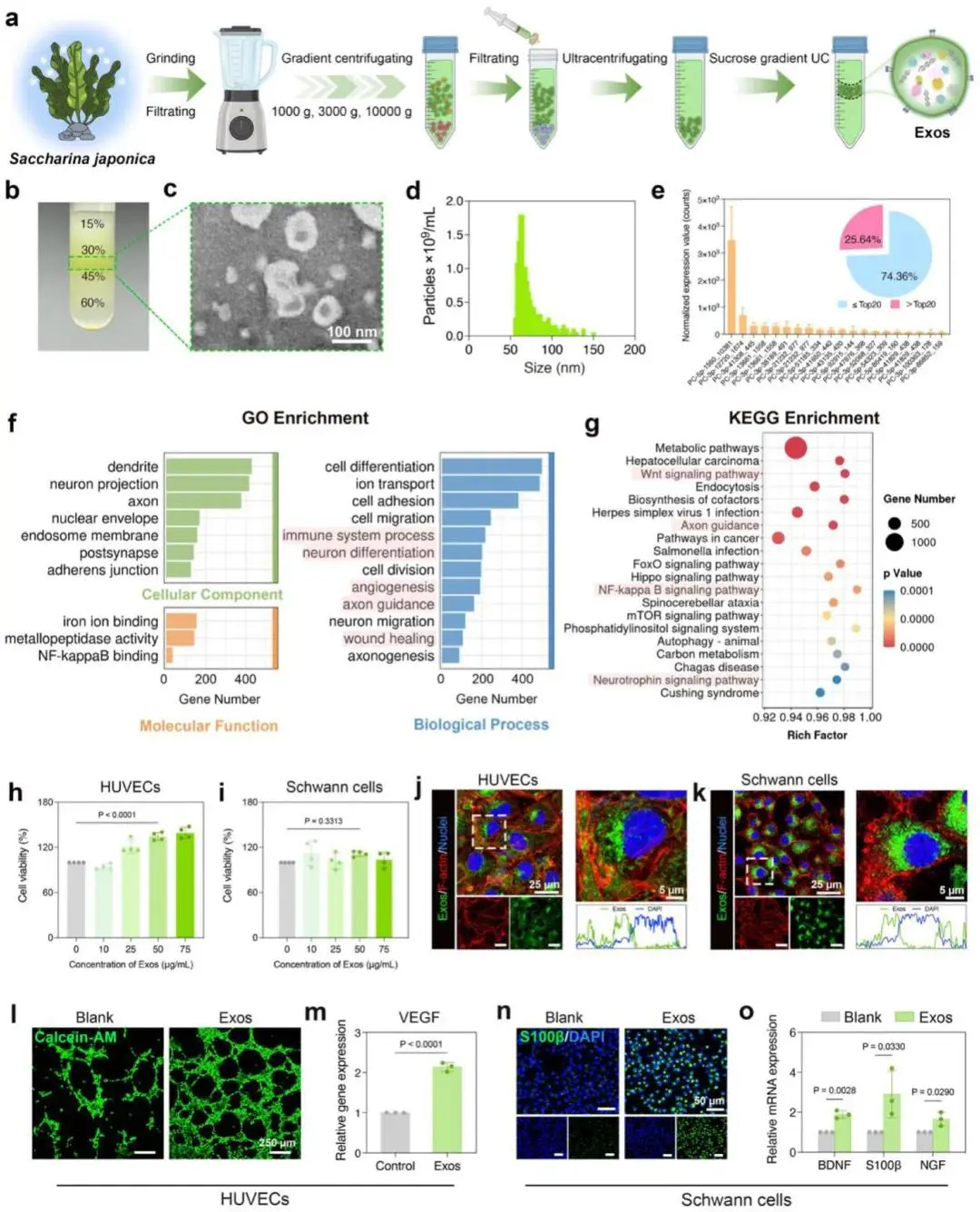
图2. 海带来源Exos的分离与表征。a)从海带中分离纯化外泌体的流程示意图。b)纯化后外泌体条带的照片。c)外泌体的TEM图像。d)通过NTA测得的外泌体粒径分布与浓度。e)三个不同批次海带外泌体中前20种miRNA的标准化表达量及其占所有miRNA的比例。f)外泌体miRNA靶基因的GO富集分析柱状图,涉及生物过程、细胞组分和分子功能三大类别。g)外泌体miRNA靶基因的京都基因与KEGG通路富集散点图。h、i)HUVECs和施万细胞与不同浓度外泌体共培养24小时后的细胞活力检测结果。j、k)HUVECs和施万细胞与50 μg/mL DiO标记外泌体在完全DMEM培养基中孵育6小时后的荧光成像图。l)基质胶管形成实验荧光图:HUVECs分别在完全DMEM培养基(空白组)和含50 μg/mL 外泌体的完全DMEM培养基中培养6小时。m)HUVECs与50 μg/mL外泌体共培养6天后,VEGF基因表达水平的RT-qPCR检测结果。n)施万细胞与50 μg/mL外泌体共培养6天后,S100β的免疫荧光染色图。o)施万细胞与50 μg/mL外泌体共培养6天后,BDNF、S100β 和NGF基因表达水平的RT-qPCR检测结果
(2)CA@Exos的制备及其在对抗AGEs积累与氧化还原失衡中的作用
37 ℃共孵2 h将CA载入海带来源外泌体(图3a);CA@Exos zeta电位由−15.35 ± 1.44 mV增至−16.82 ± 0.61 mV(图3b)。pH 7.4 PBS中72 h累积释放81.06%,含0.1% Triton X-100组达96.09% ± 3.14%(图3c)。葡萄糖-BSA 37 ℃孵育3月得AGE-BSA,溶液色深,SDS-PAGE条带分子量升高(图3e、f)。370 nm激发荧光监测显示,14 d内CA@Exos组相对荧光强度显著低于空白组,Exos组保持≥94%(图3g);CA@Exos与预制AGE-BSA共孵3 d后278 nm紫外吸收峰增强,Exos组无变化(图3h)。分子对接CA-AGEs结合能−4.52 kcal/mol,与LYS413、ARG409、SER488形成氢键(图3i)。50 μg/mL CA@Exos与AGE-BSA共作用6 h,施万细胞DCFH-DA荧光强度下降(图3j、k);50 μM H₂O₂模型中CA@Exos同样降低胞内ROS(图3l、m)。DiO-Exos摄取基线实验显示,AGE-BSA刺激使胞外荧光升至96586 ± 14270 a.u.,CA@Exos组回降至23293 ± 304 a.u.,接近未处理组23931 ± 669 a.u.(图3n、o)。CA@Exos通过抑制AGEs生成、结合预制AGEs并阻断RAGE轴,减轻氧化应激,减少细胞外泌体无效释放(图3p)。

图3. CA@Exos的表征、抗糖基化及抗氧化能力评价。a)CA@Exos的制备流程示意图。b)Exos与CA@Exos的zeta电位值。c)CA@Exos在37℃、pH 7.4且含0.5%吐温80的PBS中72小时的CA释放曲线。d)AGE-BSA的合成流程示意图。e)AGE-BSA溶液与BSA溶液在37℃避光条件下孵育3个月后的颜色照片。f)AGE-BSA与BSA的SDS-PAGE图谱。g)BSA与葡萄糖混合溶液分别加入PBS、Exos或CA@Exos后,在6天、9天、14天时的相对荧光强度。h)CA@Exos溶液、AGE-BSA溶液,以及AGE-BSA与50 μg/mL Exos或CA@Exos共培养3天后的UV-vis吸收光谱。i)分子对接得到的CA与AGEs复合物最低能量构象。j)AGE-BSA存在条件下,CA@Exos作用于施万细胞的ROS染色代表性图像。l)H2O2存在条件下,CA@Exos作用于施万细胞的ROS染色代表性图像。m)定量分析不同处理条件下施万细胞的平均荧光强度。n)DiO标记外泌体循环利用评价实验流程示意图。o)培养基的荧光强度检测结果。p)CA@Exos释放CA后抑制AGEs形成、缓解氧化应激及阻止氧化诱导外泌体分泌的机制示意图
(3)多酚工程化外泌体(CA@Exos)在体外促进巨噬细胞重编程、成纤维细胞迁移及神经血管网络重建
LPS刺激24 h诱导RAW264.7向M1极化后,继续以50 μg/mL CA@Exos处理24 h;iNOS荧光减弱、CD206荧光增强(图4a),M1/M2比值降至0.45%±0.24%,低于LPS组2.92%±0.75%(图4b)。L929划痕实验显示,CA@Exos组24 h迁移率29.09%±4.95%,48 h达38.88%±1.03%,均高于空白组(图4c、d)。间接共培养体系中,CA@Exos诱导的施万细胞条件培养基(Schwann cells^CM)使HUVECs血管样结构增多,CD31、VEGF mRNA上调(图4f、g);反之,CA@Exos处理的HUVECs条件培养基(HUVECs^CM)亦提高施万细胞BDNF、S100β、NGF表达(图4h)。CA@Exos重塑的分泌微环境驱动施万细胞与HUVECs双向交叉调控,加速神经血管网络重建。
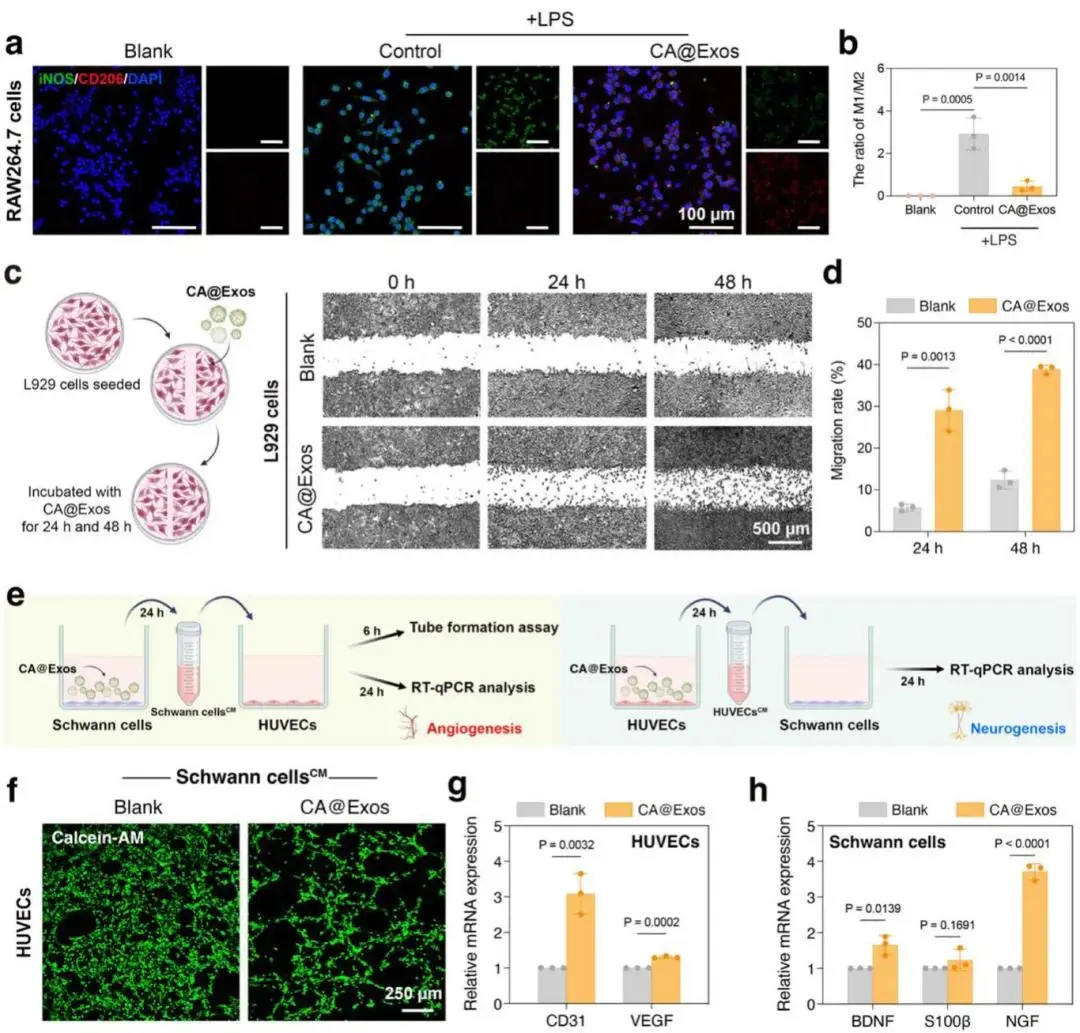
图4. CA@Exos在抗炎、促进细胞迁移及神经血管网络交联中的作用。a)RAW264.7细胞与 CA@Exos共培养24小时后,CD68与CD86或CD206的免疫荧光共染色图像。b)M1型与M2型巨噬细胞比例的定量分析结果。c)L929细胞在24小时和48小时的划痕实验代表性图像。d)24小时和48小时细胞迁移率的定量分析结果。e)间接共培养系统设计示意图(用于研究神经血管交联):左图为Schwann cells^CM对HUVECs血管生成的影响,右图为HUVECs^CM对施万细胞神经生成的影响。f)基质胶管形成实验荧光图:HUVECs分别在空白组和施万细胞条件培养基中培养6小时。g)HUVECs与施万细胞条件培养基孵育24小时后,CD31和VEGF基因表达水平的RT-qPCR检测结果。h)施万细胞与人脐静脉内皮细胞条件培养基孵育24小时后,BDNF、S100β和NGF基因表达水平的RT-qPCR检测结果
(4)负载多酚工程化外泌体(CA@Exos)的导电微针制备与表征
pCNTs与ASA的DMSO混合液注入PDMS模具,离心后60 ℃干燥8 h,制得8×8 mm²、100针阵列(图5a、b)。0–10 wt.% pCNTs梯度微针压缩测试显示,pCNTs 5 wt.%时机械强度最高,达3.73±0.33 N/针(图5c、d);四探针法测得同比例薄膜电导率0.049±0.004 S/cm,CV氧化还原电流高于纯ASA(图5e、f)。DPPH清除率随pCNTs增加而升高,5 wt.%组为70.66%±5.07%,与10 wt.%组(73.47%)无显著差异(图5g)。
以5 wt.% pCNTs-ASA微针物理吸附CA@Exos得CA@Exos-MNs,针尖表面粗糙度增加(图5i),DiO荧光3D重建显示CA@Exos均匀分布于针尖(图5j)。施万细胞表面贴附CA@Exos-MNs 1.5 h后施加400 mV、0.5 h电刺激,胞内绿色荧光强度较无电刺激组提高1.53倍(图5k、l)。猪皮穿刺20 min,CLSM观测微通道及DiO信号深达480 μm(图5m);BALB/c小鼠背部创面应用DiD-CA@Exos-MNs,6 h可检出荧光并持续至48 h(图5n)。
5 wt.% pCNTs-ASA导电微针兼具3.73 N/针机械强度、0.049 S/cm电导率及70%自由基清除能力,可负载CA@Exos并在电刺激下实现透皮480 μm深度递送与细胞内化,体内滞留≥48 h,为糖尿病创面治疗提供递送平台。
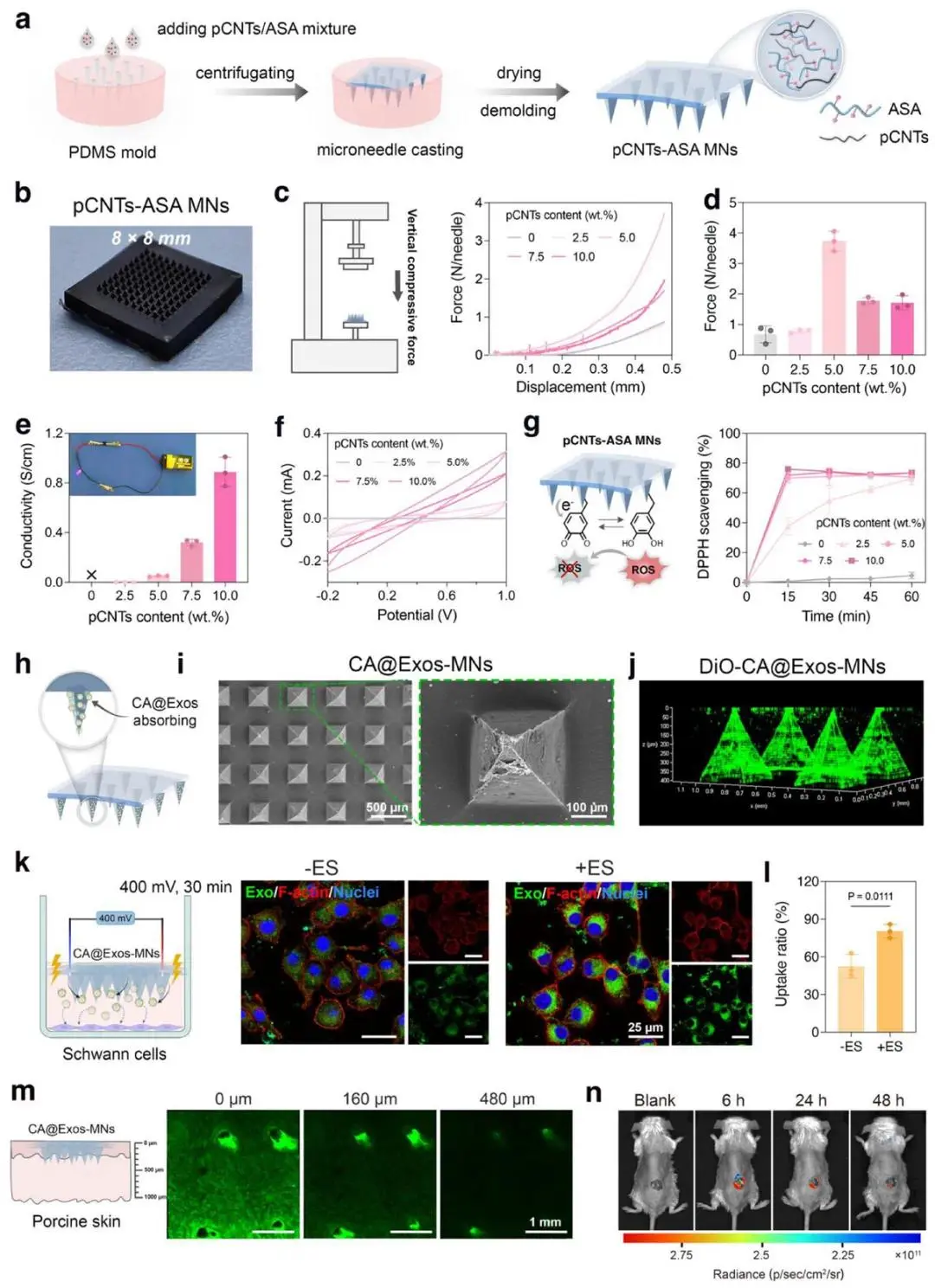
图5. CA@Exos-MNs的制备与表征。a)pCNTs-ASA 微针的制备流程示意图。b)pCNTs-ASA微针的宏观图像。c)不同pCNTs含量的pCNTs-ASA微针的压缩力 - 位移曲线。d)pCNTs-ASA微针的压缩力(N/针)。e)不同pCNTs含量的pCNTs-ASA微针的电导率。f)不同pCNTs含量的pCNTs-ASA微针的循环伏安(CV)曲线。g)不同pCNTs含量的pCNTs-ASA微针的DPPH自由基清除率。h)通过将CA@Exos物理吸附于pCNTs-ASA微针表面制备CA@Exos-MNs的流程示意图。i)CA@Exos-MNs的SEM图像。j)DiO标记CA@Exos-MNs的代表性CLSM 3D重建图像。k)施万细胞在DiO标记CA@Exos-MNs下方培养,施加400 mV、30分钟电刺激(ES)的实验装置示意图。l)有无电刺激条件下,施万细胞对CA@Exos的摄取率。m)DiO标记CA@Exos从微针中释放并穿透猪皮不同深度的CLSM图像。n)小鼠背部创面应用DiD标记CA@Exos-MNs后,不同时间点(6、24、48小时)的在体荧光成像图
(5)CA@Exos-MNs联合ES在糖尿病创面愈合中的体内疗效
STZ诱导糖尿病大鼠全层皮肤创面模型构建成功,血糖升高、体重下降(图6a)。8组干预:空白、Exos、MNs、CA@Exos-MNs、ES、Exos+ES、MNs+ES、CA@Exos-MNs+ES;电刺激组每日60 min×8 d(图6b)。第28天CA@Exos-MNs+ES组残留创面最小(图6c、d),愈合率95.61%±0.49%,高于Exos+ES组85.26%±3.52%(图6e);无电刺激条件下CA@Exos-MNs组86.65%±1.47%,较Exos组81.75%±0.44%提升1.06倍。H&E示CA@Exos-MNs+ES组边缘间隙最窄、毛囊新生最多,表皮厚度最大(图6f、g)。
第2天创面免疫荧光:CA@Exos-MNs+ES组CD206⁺面积升高、CD86⁺面积降低,M2极化优于CA@Exos-MNs组(图7a)。第14天AGEs荧光:CA@Exos-MNs与CA@Exos-MNs+ES组信号显著低于其余各组(图7b)。第28天CD31/α-SMA共定位:CA@Exos-MNs+ES组新生血管数量与成熟度最高(图7c)。NF200与PGP9.5荧光显示,CA@Exos-MNs+ES组神经密度显著增加(图7c)。CK14表达在同一组达峰值,再上皮化程度最大(图7d)。
CA@Exos-MNs联合电刺激通过抑制AGEs、促进M2极化、加速血管-神经协同重建并增强表皮分化,实现糖尿病创面最快完全愈合。

图6. CA@Exos-MNs联合ES在糖尿病创面愈合中的体内治疗效果。a)SD大鼠糖尿病全层皮肤创面的治疗方案示意图。b)CA@Exos-MNs联合电刺激治疗SD大鼠的实物照片。c)不同治疗组从0天到28天的创面照片。d)不同治疗组从0天到28天的创面闭合轨迹图。e)28天创面愈合率的定量分析结果。f)28天不同治疗组创面组织切片的H&E染色代表性图像。g)28天创面皮肤表皮厚度的定量分析结果
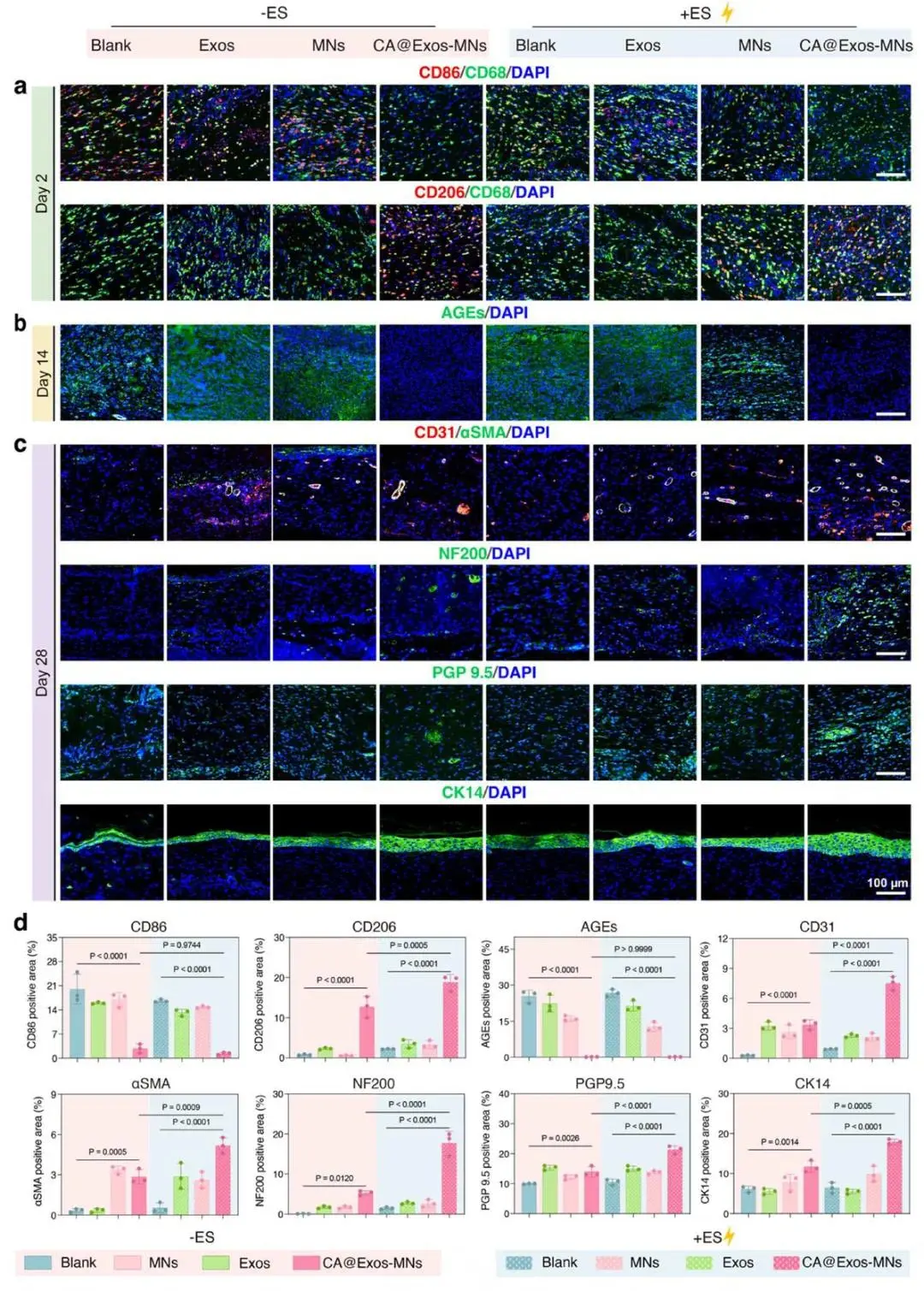
图7. CA@Exos-MNs联合ES在糖尿病创面愈合中对炎症的调控、糖基化的抑制及神经血管网络重建的促进作用。a)不同治疗组2天创面组织切片的免疫荧光染色图。b)不同治疗组14天创面组织切片的AGEs免疫荧光染色图。c)不同治疗组28天创面组织切片的CD31与αSMA共染、NF200、PGP 9.5和CK14免疫荧光染色。d)免疫荧光染色图像中 CD86、CD206、AGEs、CD31、αSMA、NF200、PGP 9.5、CK14阳性区域的定量分析结果
(6)CA@Exos-MNs联合ES促进糖尿病创面愈合的转录组学分析
第28天创面组织RNA-seq显示,CA@Exos-MNs+ES组与空白组共有18716个基因,其中872个为特有表达(图8a);差异表达基因共807个,上调566个、下调241个(图8b)。GO富集指向“创面愈合”“上皮细胞迁移”“ROS代谢正向调控”“血管生成正向调控”“钙离子转运正向调控”“ERK1/2级联”“轴突导向”(图8c);KEGG显著簇集于“轴突导向”“cAMP信号”“Rap1信号”“cGMP-PKG信号”(图8d)。
抗氧化基因热图:Sod2、Hmox1、Itgb2、Itgam、Acod1、Nnt、H19显著上调(图8e-g)。血管生成基因Vcam1、C3、Ptgs2、Chi3l1、Fgf1(图8h-j)与神经生成基因Cfl2、Camk2a、Camk2b、Disc1、Dcx、Dpysl5同步升高(图8k-m)。Chi3l1、Plcβ-Ca²⁺-CaMKII轴激活ERK1/2与cGMP-PKG级联,Camk2a/b协同驱动血管与神经生成。CA@Exos-MNs+ES通过Hmox1/Sod2缓解氧化应激,并经ERK1/2-cGMP-PKG网络加速神经血管重建,最终促进糖尿病创面愈合(图8n)。
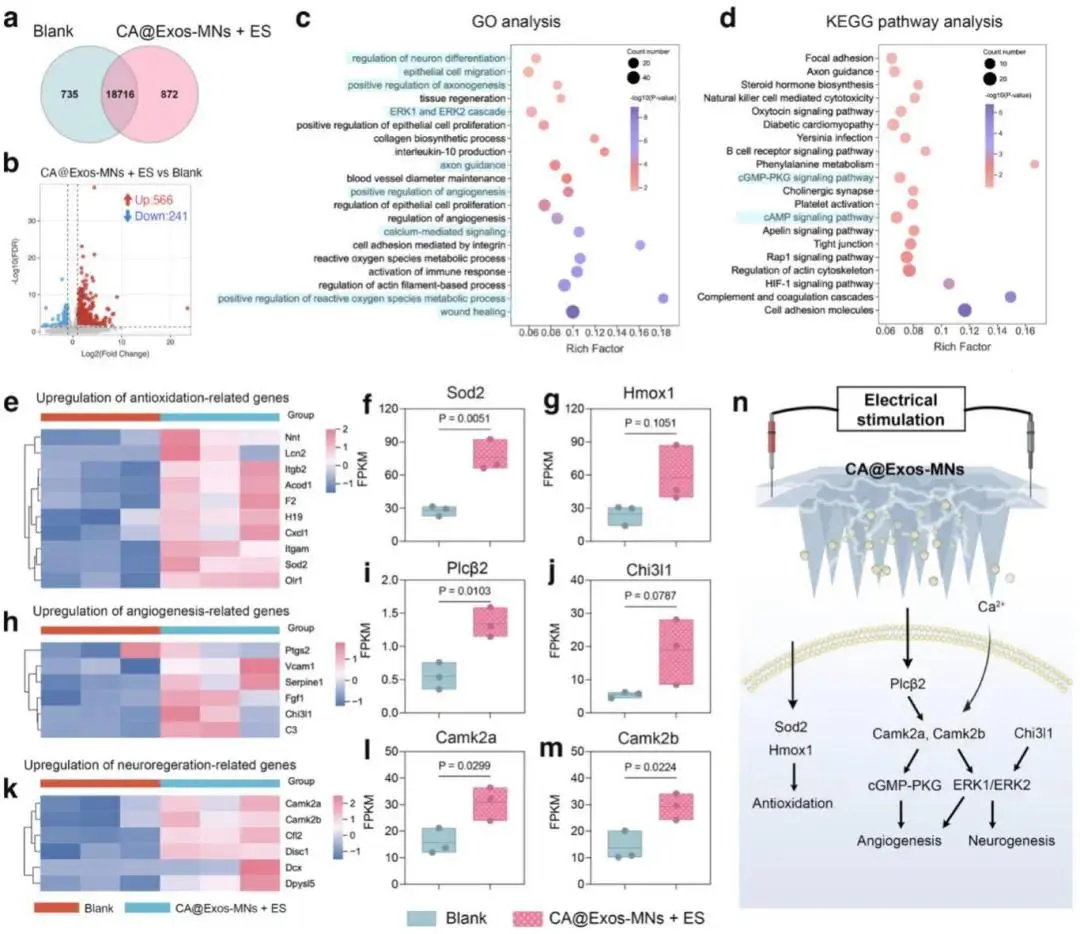
图8. 糖尿病创面组织的RNA测序分析。a)空白组与CA@Exos-MNs+电刺激治疗组的基因数量对比韦恩图。b)空白组与CA@Exos-MNs+电刺激治疗组之间差异表达基因(DEGs)的火山图。c)CA@Exos-MNs+电刺激治疗组差异表达基因的GO分类图。d)已鉴定差异表达基因的KEGG富集通路分析图。e-h)CA@Exos-MNs+电刺激治疗组与空白组相比,抗氧化相关基因(e)、血管生成相关基因(h)的显著上调热图,以及Sod2(f)、Hmox1(g)、Plcβ2(i)、Chi3l1(j)的每千碱基百万片段(FPKM)值。k-m)CA@Exos-MNs+电刺激治疗组与空白组相比,神经再生相关基因的显著上调热图(k),以及Camk2a(l)、Camk2b(m)的FPKM 值。n)CA@Exos-MNs 联合电刺激促进糖尿病创面愈合的潜在机制示意图
本研究构建“CA@Exos-MNs+电刺激”一体化平台,利用导电微针把负载咖啡酸的海带外泌体递送至深层创面,同步施加电刺激。该策略抑制AGEs-ROS轴,诱导M2巨噬细胞极化,并通过Camk2a/b-ERK1/2-cGMP-PKG级联持续放大神经血管信号,实现氧化稳态-神经-血管自循环。糖尿病大鼠创面28 d愈合率提升至95.6%,表皮厚度、成熟血管密度及神经纤维量均达峰值,为慢性创面提供时空可控的免疫-代谢精准干预范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

