
心肌缺血的本质是冠状动脉血流量急剧或持续减少,使心肌组织处于“供氧-需氧”失衡状态。缺血区氧分压骤降,线粒体氧化磷酸化受阻,ATP 合成锐减,无氧糖酵解代偿性增强,乳酸与 H⁺大量蓄积,诱发细胞内酸中毒、钙超载及活性氧(ROS)爆发;三者交互作用,触发线粒体通透性转换孔(mPTP)开放、细胞色素 c 泄漏和凋亡级联,最终造成心肌细胞死亡、胶原沉积、心室重构和收缩/舒张功能不可逆损伤。再灌注治疗(药物溶栓、PCI 或搭桥)虽可恢复宏观血流,却难以即刻纠正缺血微区持续存在的低氧、线粒体呼吸链复合体损伤和代谢“冷区”。因此,临床亟需一种能在缺血灶原位、可控、持续供氧并同步修复受损能量代谢链的创新策略,以阻断“缺血-凋亡-纤维化”恶性循环,真正实现心肌细胞功能与结构的挽救。

针对上述问题,山东师范大学唐波团队构建了一种由小球藻(C. pyre)、可降解上转换纳米颗粒(UCNPs)及透明质酸甲酰丙烯酸酯(HAMA)组成的天然光合系统(HCU),可在近红外光照射下实现原位光交联、光合产氧及线粒体细胞色素c氧化酶(CCO)活性增强。该系统在MI小鼠模型中显著提升了心肌ATP水平,缓解缺氧微环境,减少梗死面积并恢复心功能,提出了一种基于光合产氧与光生物调节协同作用的心肌缺血治疗新思路。该文章于2025年9月30日以《Chlorella-derived natural photosynthetic system for in situ energy metabolism enhancement in cardiomyocytes》为题发表于《Nature Communications》(DOI: 10.1038/s41467-025-63749-9)。
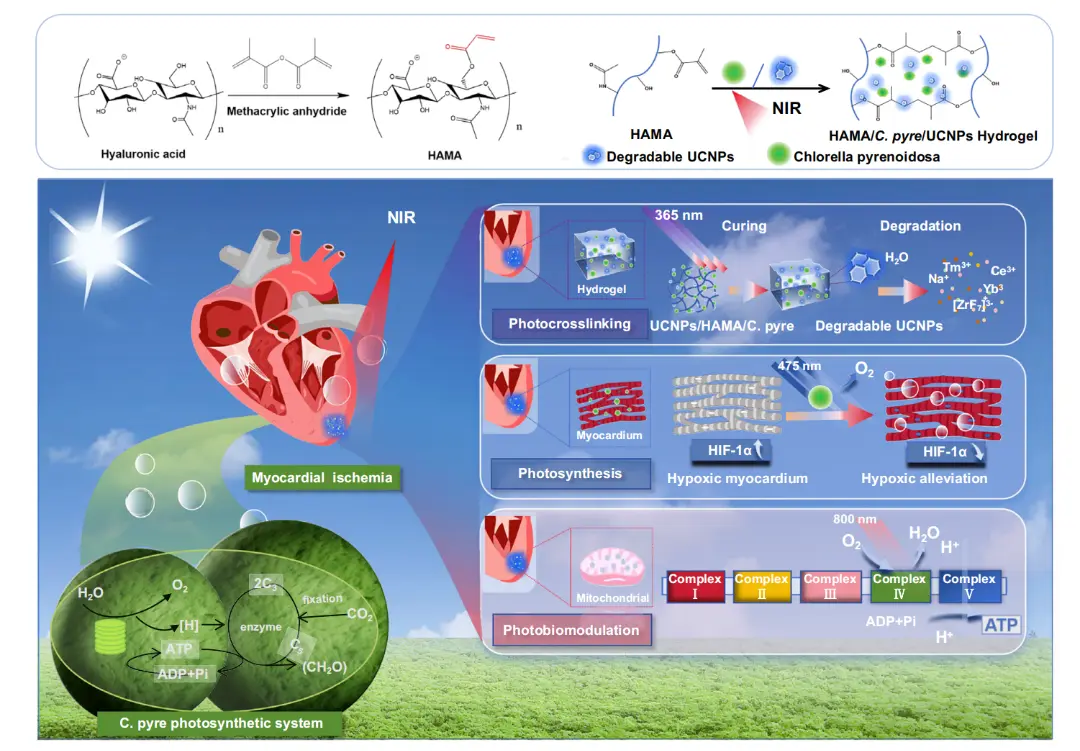
图1.原位心肌缺血修复的自然光合作用系统示意图
(1)可降解UCNPs的合成与表征
研究团队用一种改进的水热方法合成了具有可控生物降解性和良好上转换荧光性能的UCNPs(NaCeF4:Yb,Tm,Zr)。透射电子显微镜(TEM)、扫描电子显微镜(SEM)和扫描电子显微镜(STEM)图像(图2A)表明,合成的UCNPs呈均匀的矩形结构,且分散良好,粒径为50 nm。X射线衍射图显示合成的UCNP的所有衍射峰都与NaCeF4纳米晶(JCPDS no.75-1924)相匹配,这表明成功地合成了NaCeF4基质(图2D)。值得注意的是,XPS(图2E)、EDS(图2C)、相应的元素图(图2B)和X射线衍射峰的右移表明掺杂离子(Yb、Tm和Zr)已经进入了NaCeF4基质的晶格。在980 nm的激发下,UCNP发出了不同波长的光(图2F),包括365 nm(1D2→3F6,四光子过程),475 nm(1G4→3H6,三光子过程)和800 nm(1D2→3F3,双光子过程)(图2G)。上转换发光(UCL)的性质UCNPS/C.pyre/HAMA(HCU)实现交联(365 Nm)、小球藻光合作用(475 Nm)和CCO活化(800 Nm)提供了必要条件。
水溶性的[ZrF7]4-物种具有快速溶解的倾向,导致NaCeF4晶格被破坏,转变为正离子和[ZrF7]4-团簇(图2H)。此外,透射电子显微镜图像显示,在PBS缓冲溶液中48小时后,部分UCNP已解体为碎片(图2I)。在PBS溶液中,随着时间的推移,降解的锆离子的浓度呈现出逐渐增大的趋势,而降解速率随着锆离子掺杂量的增加而相应地逐渐增加(图2J,K)。此外,UCNPs在纯水中分散48h后,明亮的蓝色UCL消失(图2L),进一步证实了UCNPS的降解性。
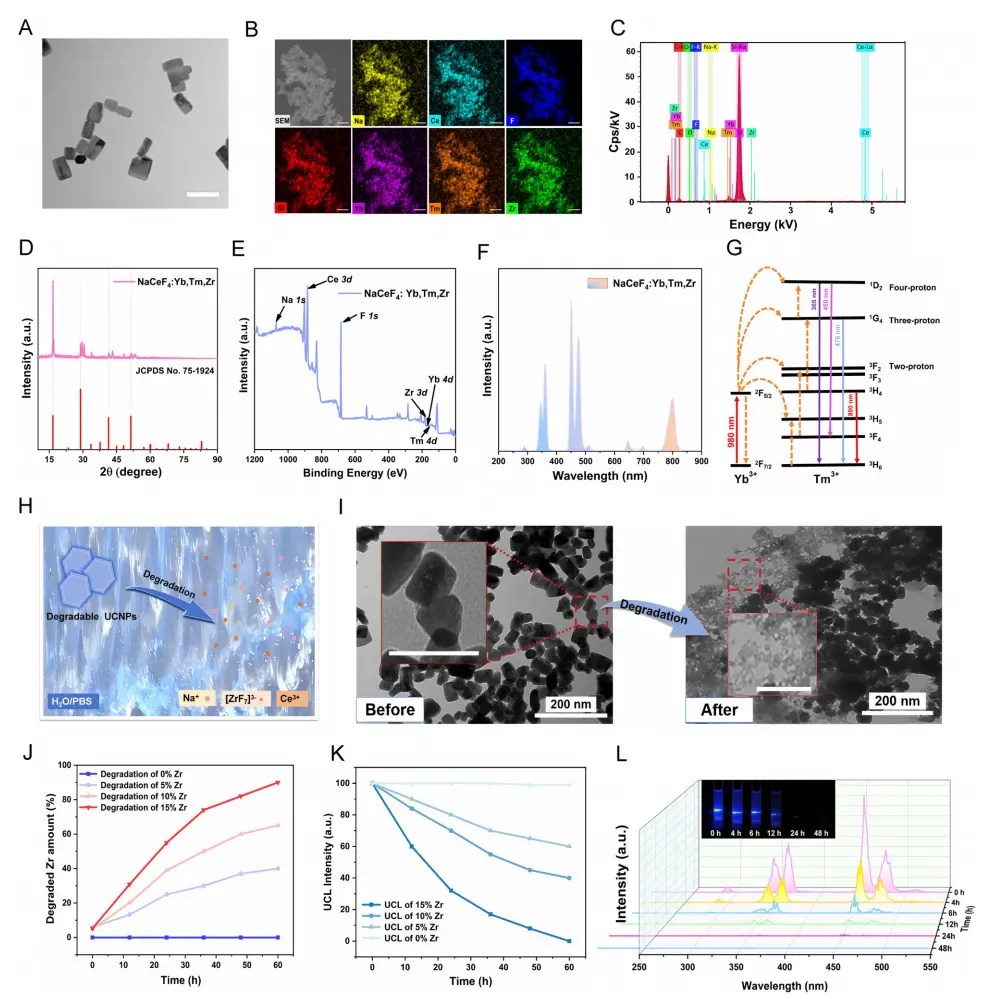
图2.可降解NaCeF4:Yb,Tm,Zr UCNPs的表征。A NaCeF4的电子显微镜图像(比例尺:50 nm)。B对应的NaCeF4元素图谱:YB,Tm,Zr,C EDS分析,D X射线衍射谱和E XPS谱。F 激发波长为980 nm,功率密度为1.0W/cm2的NaCeF4:Yb,Tm,Zr的上转换发射光谱。G提出了能量传递机制。H UCNPs降解过程示意图。I 在PbS缓冲溶液中分散NaCeF4:Yb,Tm,Zr 48h前(左)和后(右)的电子显微镜图像。(图像部分放大,比例尺:100 nm。) J 在PbS缓冲溶液中分散NaCeF4:Yb,Tm,Zr时,随着时间的推移降解的Zr组分的累积释放曲线和K 475 nm发射的UCL强度随时间的变化。L 在功率密度为1.0W/cm2的980 nm激光激发下,在去离子水中的上转换发射光谱和UCL亮度随时间变化的照片
(2)HCU的合成与表征
研究者制备了由HAMA、C.pyre和UCNPs组成的光合作用系统(HCU),通过原位光固化实现心肌的光合作用产氧(图3A)。LAP的紫外吸收与UCNPS的365 nm UCL一致(图3B)。同样,小球藻的明显紫外吸收峰也与UCNPs的460 nm和475 nm UCL很好地对准(图3B)。光谱重叠为HCU提供了响应近红外光的机会,促进了原位固化和光合作用。在980 nm激发下,UCNPs在365 nm、460 nm和475 nm处的UCL强度同时降低,进一步表明LAP和小球藻可以通过吸收UCNPs的UCL而被激活(图3B)。在980 nm激发下,HCU通过10 mm厚的鸡肌组织原位固化(图3C)。扫描电子显微镜(SEM)图像显示出一个坚韧的水凝胶网络,而UCNPs和小球藻均匀地分布在水凝胶中(图3D)。 由于HAMA的羟基(-OH)与组织的氨基(-NH2)和巯基(-SH)之间的氢键,HCU对组织表面表现出很强的粘附性(图3E,F)。此外,固化的水凝胶块在15天后完全溶解在PBS中(图3G)。
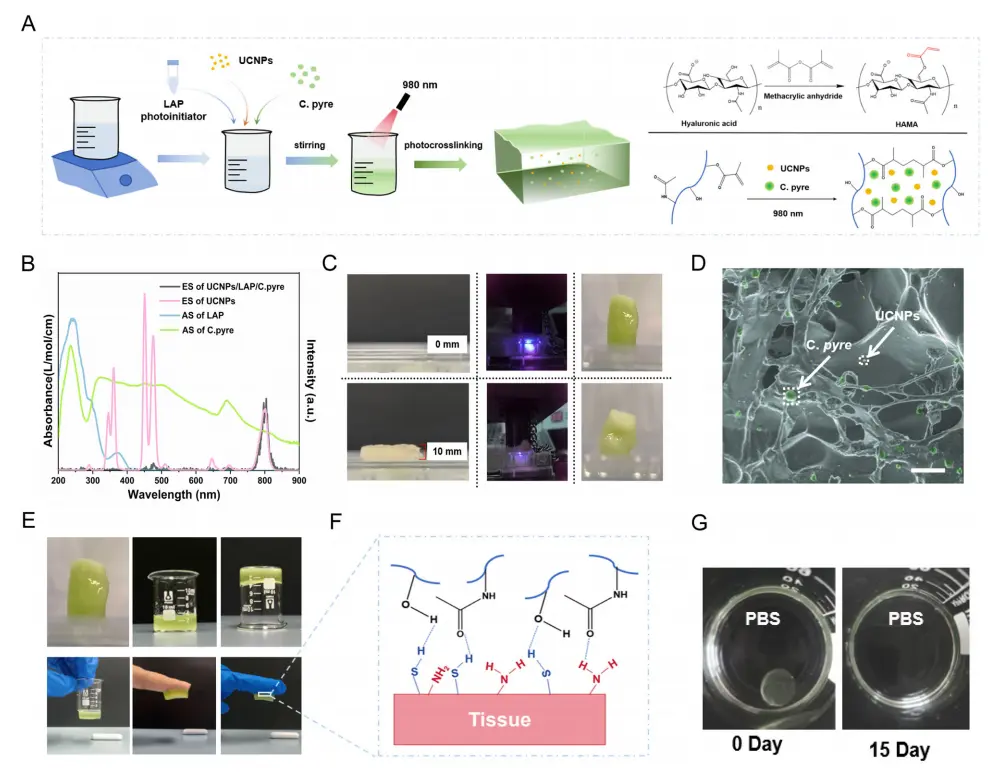
图3.HAMA/C.pyre/UCNPS(HCU)的制备与表征。A 原位光合作用系统的制备工艺及光交联机理。B 激发波长为980 nm,功率密度为1.0W/cm2的NaCeF4:Yb,Tm,Zr(粉红)晶体的吸收光谱和上转换发射光谱。C近红外光固化HCU被10 mm厚度的鸡肉覆盖的照片。D 扫描电子显微镜图像显示HCU内的铜绿假单胞菌(绿色)和UCNPs(黄色)。比例尺,10μm。E与各种基材表面的粘附性。F HCU凝胶的粘合机理。D HCU在PBS中的降解过程
(3)HCU的原位产氧能力
球形小球藻发出明亮的红色荧光(图4A),表明小球藻在HCU中具有显著的生物活性。用氧指示剂探针([Ru(DPP)3]Cl2,RDPP)可以检测到小球藻产生氧气。荧光强度的变化表明,在充足的光照条件下,小球藻溶液中的可溶性氧浓度增加,并在黑暗中降低(图4B),这表明小球藻完全具有进行光合作用的活性。另外,用功率密度为1.0W/cm2的980 nm激光辐照C.pyre、HAMA/C.pyre(HC)和HAMA/C.pyre/UCNPs(HCU),每隔2min测量体系中RDPP荧光强度的变化,共30min。正如预期的那样,荧光强度逐渐减弱,验证了HCU(NIR)组中的C.pyre能够有效地产生氧气(图4C)。
(4)HCU对缺氧微环境的逆转作用
使用缺氧和葡萄糖剥夺(OGD)方法诱导心肌细胞缺氧(图4D)。为了研究HCU对心肌细胞的影响,研究者使用RDPP探针评估了氧浓度的变化。在980 nm微米辐射下,HCU(NIR)处理的H9c2细胞的RDPP荧光强度显著降低,表明HCU的光合氧产生能力(图4E)。此外,通过免疫荧光法在体外评价了光合作用系统缓解低氧的能力。与常氧条件下相比,MI组的H9c2细胞显示出明显的低氧诱导因子-1α(HIF-1α)的红色荧光(图4F)。相比之下,HCU(NIR)组的红色荧光强度显著降低,表明HCU先前具有缓解缺氧的作用(图4F)。低氧激活了细胞内的各种凋亡途径。正如预期的那样,HCU(近红外)处理下调了低氧诱导的HIF-1α的蛋白表达水平,表明低氧微环境得到缓解(图4I)。同时,抗凋亡蛋白Bcl2表达上调,并抑制线粒体细胞色素c的释放。抗凋亡蛋白C-Caspase3的表达下调,进一步表明HCU(NIR)组caspase途径的激活受到抑制(图4I-M)。此外,利用流式细胞仪进一步评价低氧诱导心肌细胞凋亡的治疗效果(图4N)。缺氧组心肌细胞凋亡率为23.91%,HCU(NIR)组心肌细胞凋亡率显著下降至8.72%(图4N,O)。提示HCU对缺氧诱导的心肌细胞凋亡有明显的抑制作用。
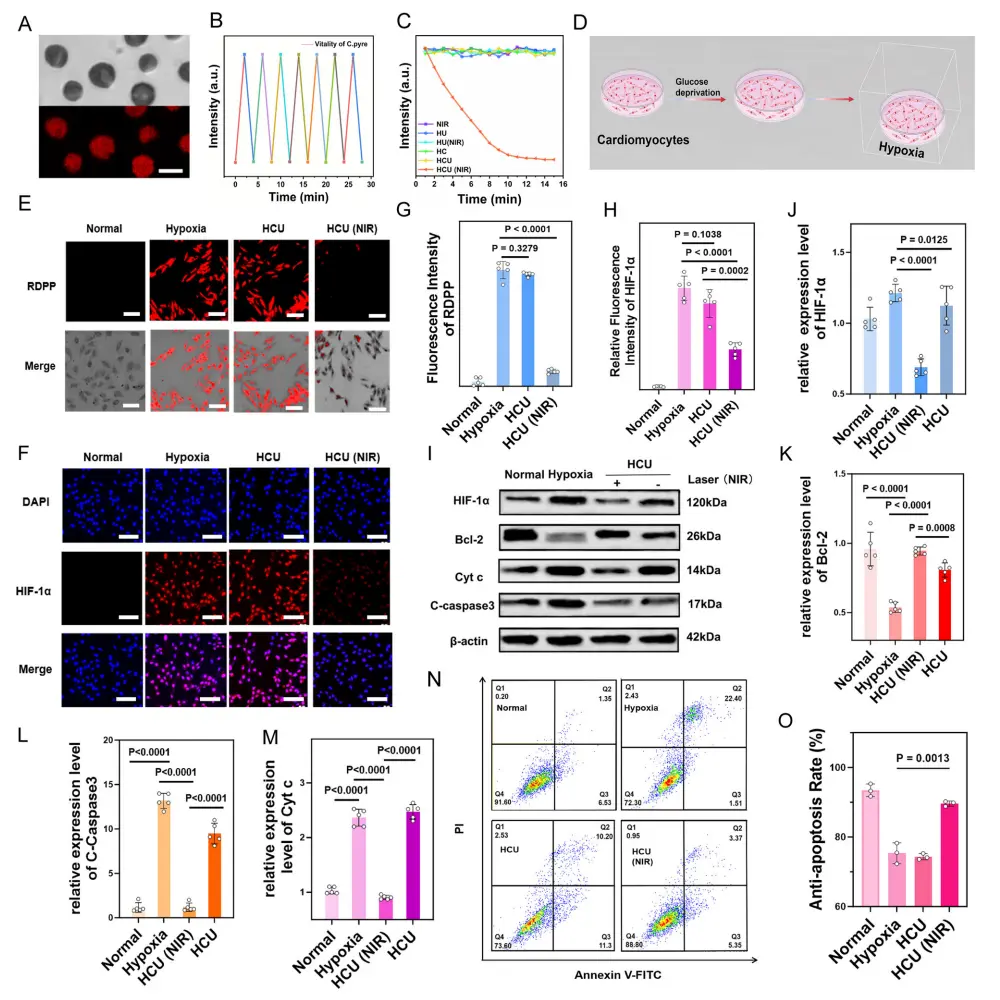
图4.光合作用系统对心肌细胞耐缺氧能力和抗凋亡作用的验证。A亮场和荧光场的图像。比例尺,5μm。B小球藻活性。C溶解含HCU溶液在不同处理条件下的O2水平变化。D 诱导心肌细胞缺氧的三维流程图。E H9c2细胞经不同处理后用RDPP探针染色的荧光图像。F H9c2细胞经不同处理后用HIF-1α抗体(红色)和DAPI(蓝色)染色的荧光图像,比例尺:50μm。G荧光定量分析RDPP探针。H荧光定量分析HIF-1α。I 免疫印迹法检测H9c2细胞中缺氧诱导因子-1、α、c-半胱氨酸天冬氨酸蛋白酶3和细胞色素c的表达水平。J-M对应的蛋白表达定量直方图。N流式细胞仪检测不同处理后H9c2细胞的抗凋亡作用。O相应的抗细胞凋亡率定量直方图
(5)通过HCU恢复能量代谢
线粒体在为心肌组织提供能量方面起着至关重要的作用。赋予水凝胶线粒体保护特性是防止心肌缺血进展的有效策略。用透射电子显微镜(TEM)评价心肌细胞线粒体的形态(图5A)。与正常组相比,缺氧状态下线粒体形态变圆,基质密度降低。此外,脊骨明显缩小、缩短,甚至完全消失,这表明线粒体受到了严重的损伤。与之形成鲜明对比的是,HCU(NIR)组(980 nm,1.0W/cm2)的线粒体呈棒状,外膜光滑,内膜折叠成不同长度的嵴,与正常线粒体非常相似(图5B,C)。线粒体形态的恢复提示HCU可减轻缺氧所致的线粒体损伤。光生物调节(PBM)是一种通过上调细胞色素c氧化酶(CCO)活性来促进三磷酸腺苷(ATP)合成的治疗方法。在氧化磷酸化过程中,质子泵通过运输质子来建立跨膜潜力。线粒体膜电位的测量被用来评估呼吸链损伤的程度和能量代谢。不出所料,HCU(NIR)和HU(NIR)都能防止线粒体膜电位在低氧环境中的下降。与HU(NIR)组相比,HCU(NIR)组对线粒体膜电位下降的抑制作用更明显(图5D,H),说明产氧和光生物调节相结合对线粒体提供了更好的保护作用。为了验证光生物调节效应,研究者测量了CCO的活性。结果发现,HU(NIR)组和HCU(NIR)组的CCO活性增加,表明UCNP的UCL通过PBM提高了CCO的活性(图5F)。然后评估HCU对细胞代谢的光可控效应。在980 nm激光(1.0W/cm2)照射10min后,HU(NIR)组和Hcu(NIR)组的ATP水平均升高,而Hcu(NIR)组的ATP水平接近正常组(图5e)。这些结果表明,原位供氧进一步刺激了ATP的产生。
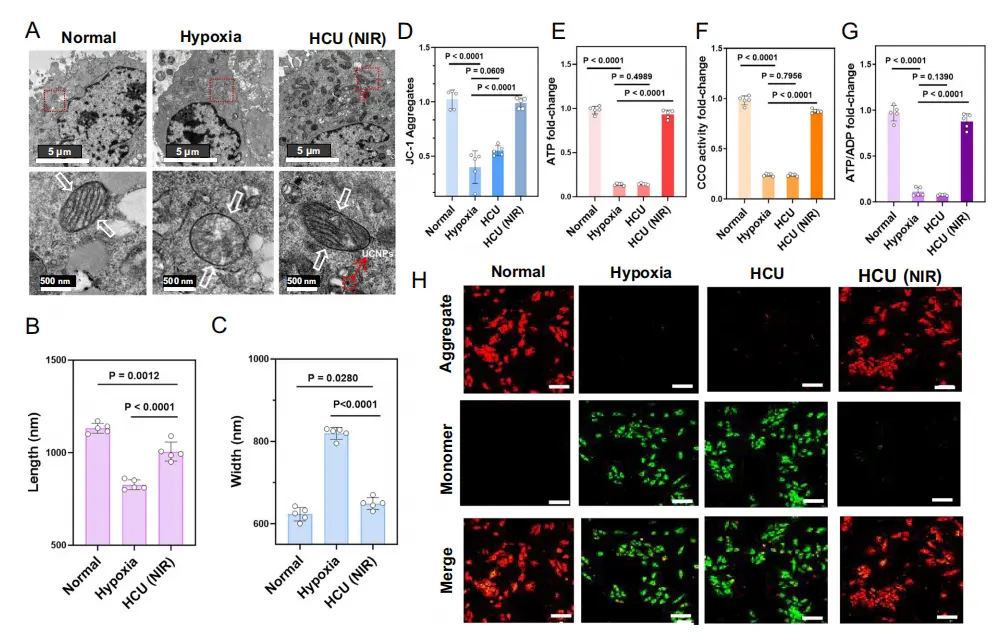
图5.水凝胶的线粒体功能修复能力。A H9c2细胞的生物电子显微镜图像显示线粒体的形态变化,比例尺:500 nm。B、C线粒体的长度、宽度。D JC-1聚集体的三维荧光定量。E不同处理后的ATP倍数变化。F 不同处理后CCO活性倍数变化。G GATP/ADP倍数变化。H 正常组、缺氧组、NIR组(980 nm、1.0W、20min)、HC(HAMA/C.pyre)组、HC(NIR)组、HU(HAMA/UCNPs)组、HU(NIR)组、HCU(HAMA/C.pyre/UCNPs)组、HCU(NIR)组的H9c2细胞荧光图像。标尺,20μm
(6)HCU对活体心肌缺血的治疗作用
为了评价HCU对心肌梗死(MI)的治疗效果,我们用异丙肾上腺素(ISO,一种非选择性β-肾上腺素能受体激动剂)诱导小鼠心肌梗死(图6A)。在ISO诱导后,小鼠的心电图显示ST段显著抬高,病理性Q波加深,T波倒置,QRS时限延长(图6B)。同时,超声心动图显示射血分数(EF)和短轴缩短率(FS)显著降低,表明MI模型诱导成功(图6C)。然后将这些MI小鼠随机分为三组:MI组、BB组(酒石酸美托洛尔;β1-肾上腺素能受体拮抗剂)和HCU(近红外线)组。由于缺乏氧气供应,心肌梗死组的心功能在7天内趋于下降(图6C,D)。TTC染色用于进一步评估MI模型中的梗塞范围(图6I)。梗死区Hcu(NIR)组由33.38%±6.69%降至3.20%±1.47%,与正常组相当,优于BB组(图6I、N)。提示HCU可逆转ISO所致的心肌损伤。应用H&E和Masson染色评价不同治疗方法对心肌修复的疗效(图6J)。心肌梗死组出现恶性的室壁重构,如心肌纤维化和胶原沉积。此外,HCU还阻止了进一步的梗塞扩大和纤维化沉积,从而缩小了梗塞面积(图6J和L-N)。这些结果表明,氧的产生和血管紧张素转换酶可抑制心室重构。此外,对免疫荧光染色进行了分析。心肌梗死组HIF-1α呈鲜红色荧光(图6K)。值得注意的是,BB组和HCU(NIR)组的亮红色荧光均显著减少(图6g),表明供氧引起的心肌缺氧减轻。
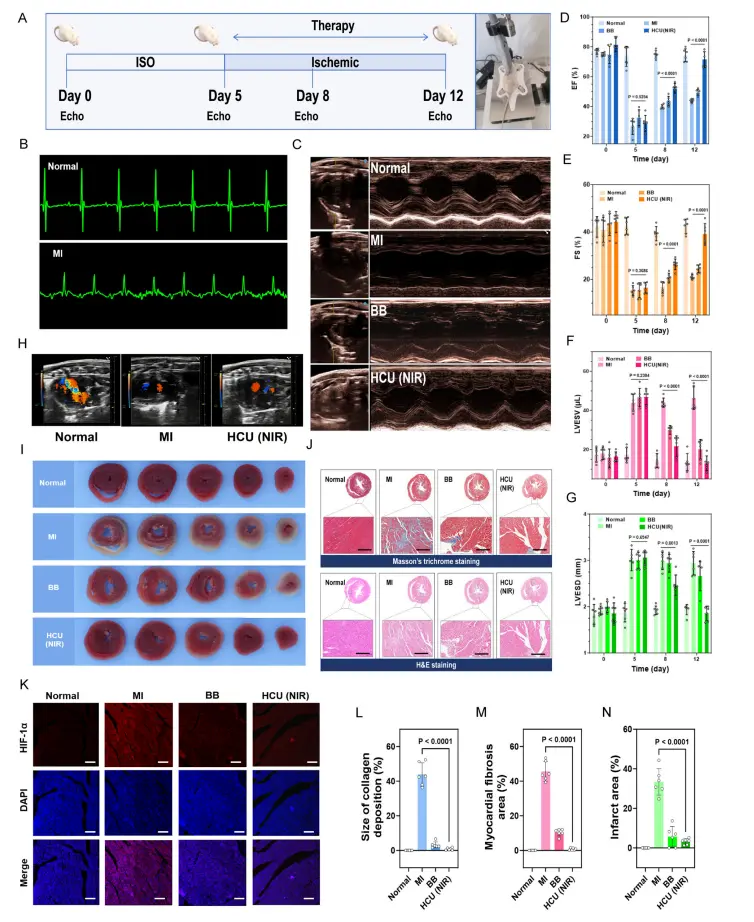
图6.光合作用系统对心肌缺血小鼠的体内治疗作用。A MI模型中动物治疗方案的示意图。B小鼠诱导前(左)和诱导后(右)的心电图。C不同治疗组小鼠治疗7d后的超声心动图。D-G对不同时期的EF、FS、LVESV和LVESD进行定量分析。H 彩色多普勒超声检测小鼠缺血心脏的典型图像。I 不同组小鼠心脏的TTC染色。J Masson和H&E染色显示不同组小鼠心脏切片的纤维组织(蓝色)和心肌(红色)三色染色,比例尺:100μm。K HIF-1α(红色)和DAPI免疫染色(蓝色),比例尺:50μm,L-N定量分析胶原面积、纤维化区、梗死区
(7)HCU对心肌梗死影响的心脏转录分析
对6周龄KM小鼠心脏组织进行RNA-seq分析(N:正常组;M:MI组;T:心肌内注射HCU组)。RNA-SEQ分析发现心肌梗死后1331个基因的表达增加,134个基因的表达减少,而HCU处理的心脏中139个基因的表达增加,1550个基因的表达减少(图7A,B)。基因本体论分析显示,上调的基因富含在线粒体呼吸链复合体和ATP合成酶复合体中(图7C,D)。与心肌梗死相比,经HCU处理的心脏mt-ATP8(三磷酸腺苷合成酶)和mt-CO2(细胞色素c氧化酶)的mRNA水平显著升高(图7D)。对HCU处理的转录本数据集的分析显示,能量代谢基因mt-ND5和mt-Atp8以及心肌收缩基因Trdn的表达增加(图7D)。在HCU处理的小鼠中,增加了ATP的合成以及CCO的活性。此外,对HCU处理的心脏和MI心脏之间KEGG途径丰富的GSEA分析显示,在ATP形成、心肌收缩、ABC转运体和细胞凋亡的丰富方面存在显著差异(图7E)。综上所述,这些发现表明,HCU治疗导致线粒体氧化呼吸和心功能恢复的改善。最后,还观察到炎症相关基因如Igkc和Jchain的减少,表明HCU具有良好的生物相容性,与血清和H&E/Masson结果一致(图7D)。这些结果提示,HCU诱导的能量代谢调节和心功能恢复。
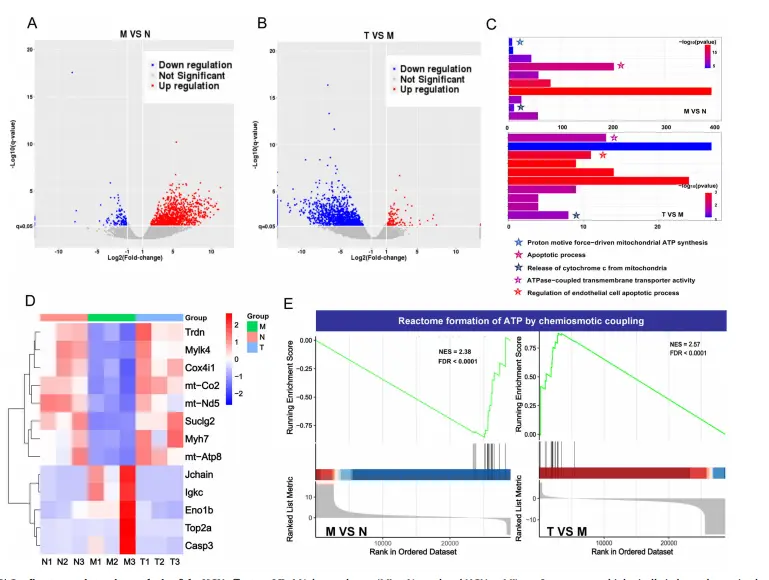
图7 HCU对心肌梗死影响的心脏转录学分析。A DEGS分布趋势的火山图(MI与正常)。B DEGS分布趋势的火山图(HCUvsMI)。C GO富集度分析。E GSEA分析心肌梗死与正常及HCU与心肌梗死形成过程中KEGG途径的丰富
本研究构建可注射、可降解的天然光合体系HCU(HAMA-C.pyre-UCNPs),在 980 nm 近红外光照射下实现“一石三鸟”:UCNPs 上转换发射 365 nm 诱导水凝胶原位交联,牢固贴附心肌;475 nm 蓝光激发小球藻产氧,迅速提升缺血区氧分压;800 nm 光生物调节显著上调 CCO 活性与 mt-Co2 表达,修复线粒体呼吸链,ATP 产量回升。MI 小鼠经 7 天治疗,EF、FS 恢复至接近正常,梗死面积由 33% 降至 3%,纤维化与细胞凋亡显著减少,且材料 14 天内完全降解、无全身毒性。该策略首次将“原位光合供氧”与“线粒体光生物调节”协同,为缺血性心脏病及类似缺血疾病的代谢-氧供同步治疗提供了可临床转化的新范式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

