
脑部中枢神经系统(CNS)疾病,如神经退行性疾病、中风和创伤性脑损伤(TBI),与蛋白质功能障碍密切相关。蛋白质治疗药物因其高生物活性和特异性被期望能够提供治疗这些疾病的重要选择。蛋白药物虽具有高活性与特异性,却被血脑屏障牢牢挡在脑外,无法用于中枢神经系统疾病治疗。

针对上述问题,上海交大高小玲团队设计了一种细胞基质仿生蛋白质递送系统,模拟蛋白质的自然环境,采用透明质酸(HA)和鱼精蛋白(PRTM)自组装形成蛋白质载荷核心,并将其包裹在ApoE3重组高密度脂蛋白(rHDL)中,形成蛋白质-HA-PRTM-rHDL仿生纳米载体。此仿生纳米载体不仅能够保护蛋白质药物,还能促进其穿越BBB并进入脑细胞,实现药物的脑内递送和生物学效应的发挥。该文章于2024年8月5日以《Brain Delivery of Protein Therapeutics by Cell Matrix-Inspired Biomimetic Nanocarrier》为题发表于《Advanced Materials》(Doi:10.1002/adma.202405323)。
(1)蛋白质-HA-PRTM-rHDL的制备与表征
通过自组装工艺制备蛋白质-HA-PRTM-rHDL。实验结果显示,该纳米载体能有效地装载不同分子量和电荷性质的蛋白质,无需对蛋白质进行修饰,并且具有良好的BBB穿越能力和胞质递送效率。
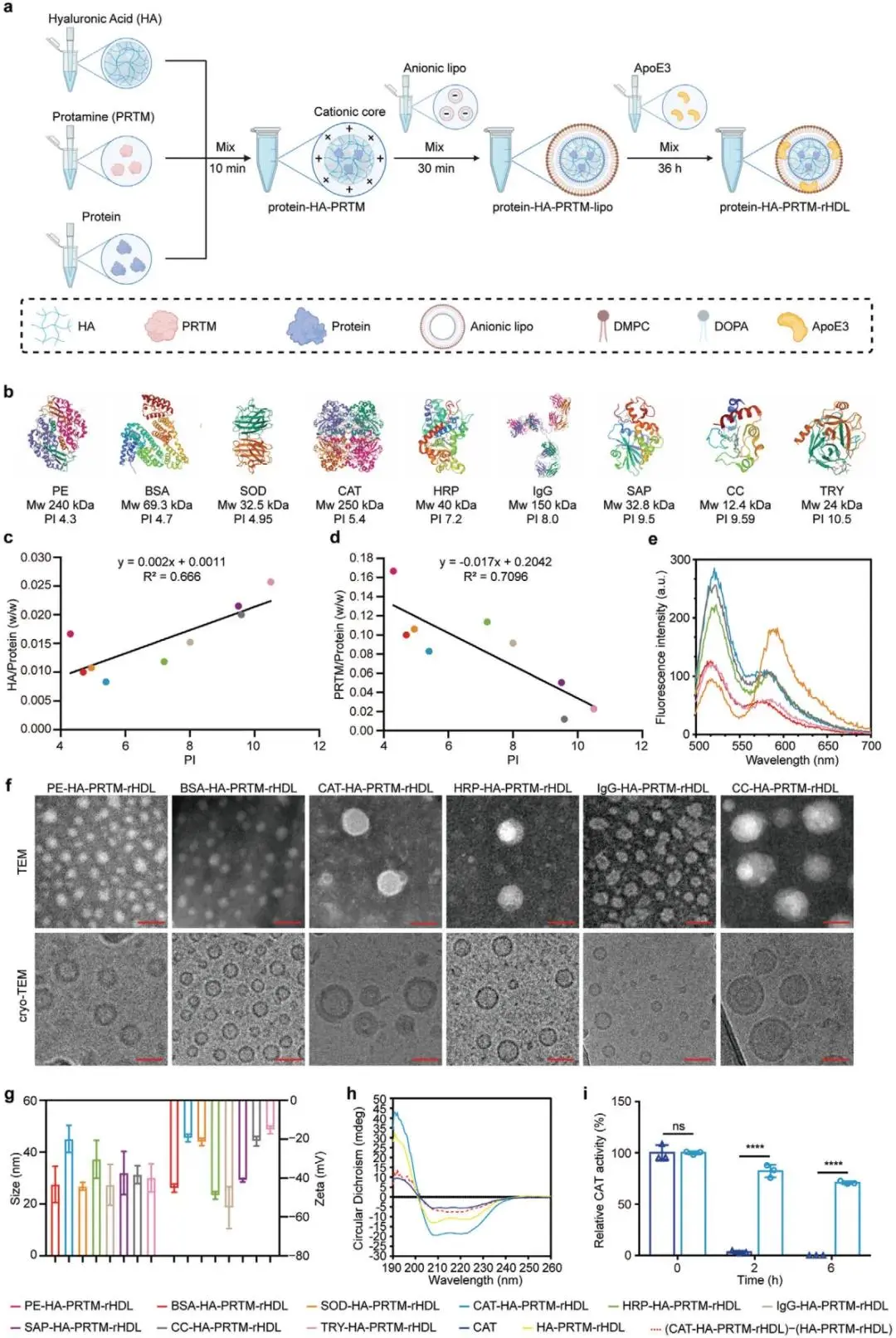
图1.蛋白质-HA-PRTM-rHDL的制备、表征及配方优化(A)Protein-HA-PrTM-rHDL制备示意图。(B)不同相对分子质量和等电点的蛋白质载体。(C)线性回归方法模拟不同蛋白质载体仿生纳米载体优化配方中HA/蛋白质投料比(w/w)与蛋白质等电点之间的关系。(D)通过线性回归模型建立了不同蛋白质载体仿生纳米载体最佳配方中蛋白质等电点与PRTM/蛋白质(w/w)的投料比之间的关系。(E)FRET Protein-HA-PrTM-rHDL进行表征。(F)不同蛋白质载体的仿生纳米载体在透射电子显微镜和低温电子显微镜下的形态。(G)装载不同蛋白质货物的仿生纳米载体的大小和Zeta电位。H)CAT、HA-PRTM-rHDL、CAT-HA-PRTM-rHDLCD光谱
(2)穿越BBB与脑细胞靶向递送
通过在小鼠脑内皮细胞bEnd.3上的实验验证了HA-PRTM-rHDL穿越BBB的能力。结果显示,FITC标记的CAT-HA-PRTM-rHDL在12小时内有效穿越了细胞层,并在脑损伤模型小鼠中实现了高效的靶向递送。
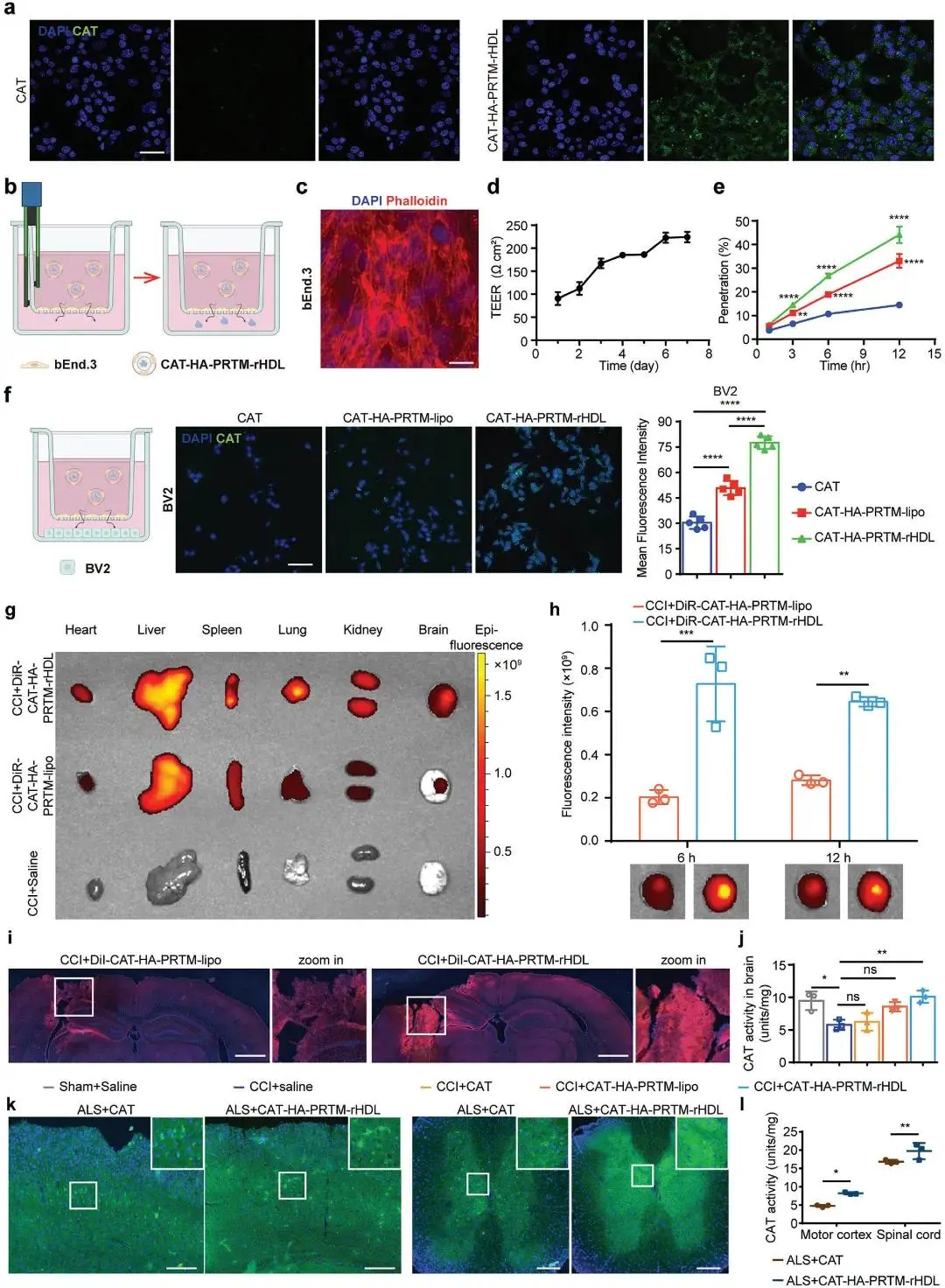
图2.蛋白质-HA-PRTM-rHDL有效地穿透血脑屏障,靶向CCI小鼠的病变部位,并进入ALS模型小鼠皮质和脊髓。(A)将CAT制剂与bEnd.3细胞孵育4 h。(B)体外血脑屏障模型。(C)细胞培养7天后的单层荧光图像。(D)血脑屏障模型第1天至第8天的TEER值。E)归一化计算穿透的CAT百分比。(F)在上室加入不同的制剂4h后,BV-2细胞在基底室的荧光图像和细胞摄取的定量分析。(H)半定量分析DIR标记的CAT制剂在尾静脉注射后不同时间点的脑分布。(I)在CCI模型小鼠尾静脉注射不同CAT制剂后检测脑组织CAT酶活性。(K)尾静脉注射CAT检测FITC标记的CAT-HA-PRTM-rHDL3h在ALS小鼠皮质和脊髓的分布;(2)肌萎缩侧索硬化症小鼠注射不同CAT剂型检测运动皮质和脊髓CAT酶活性
(3)多种蛋白质货物的胞内递送与生物活性保持
在不同的脑细胞(如HT22、BV2和U87)中,HA-PRTM-rHDL成功递送了各种电荷性质的蛋白质,并保持了它们的生物活性。实验结果表明,相较于游离蛋白质,仿生纳米载体显著提高了蛋白质的胞内荧光强度和生物活性。
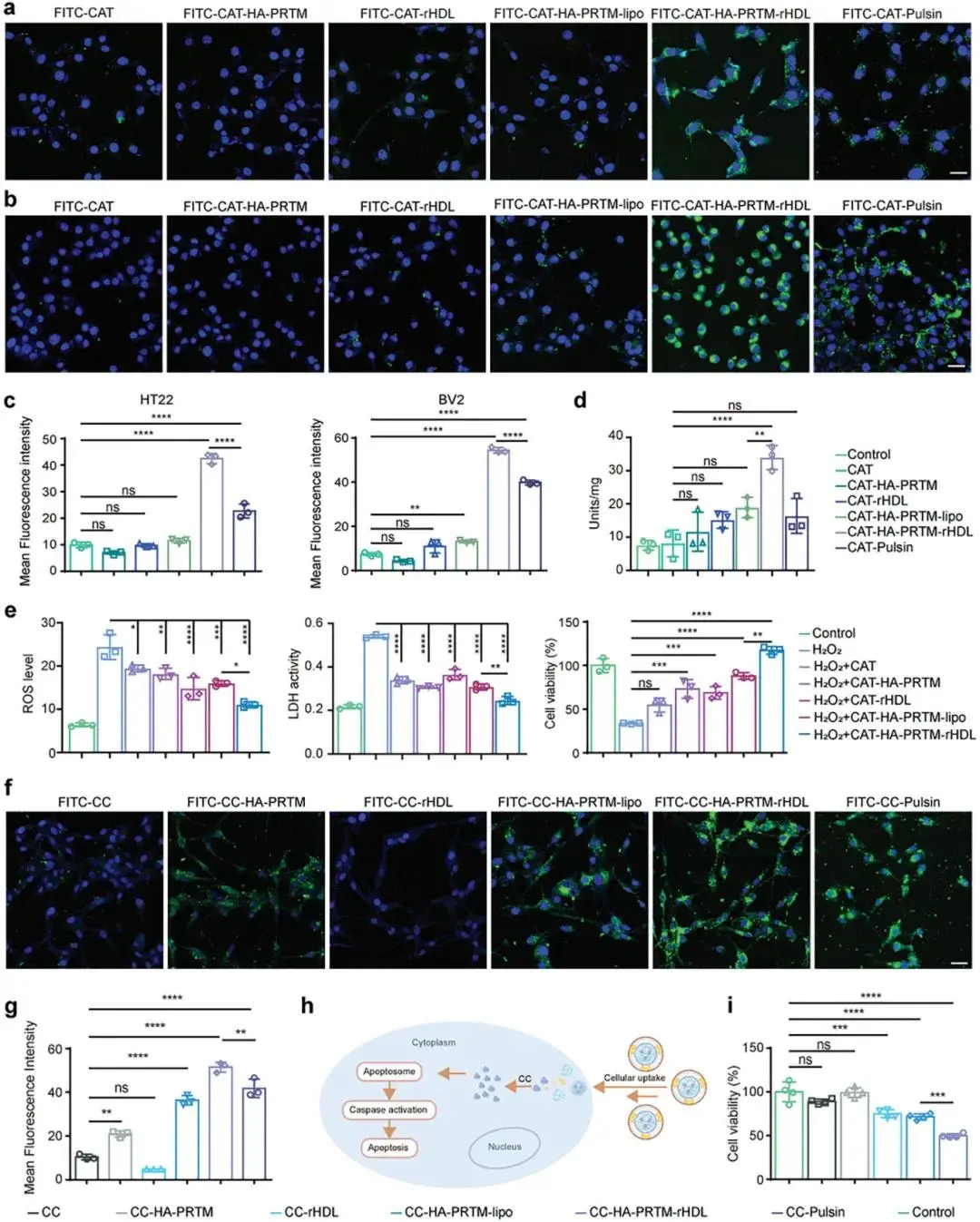
图3.蛋白质-HA-PRTM-rHDL促进了有效的细胞内递送,并保存了各种蛋白质的生物活性。(A)和(B)FITC标记的CAT在HT22细胞和BV2细胞的胞质递送。(C)定量分析HT22细胞和BV2细胞内FITC标记的CAT的水平。(D)HT22细胞的过氧化氢酶活性。(E)HT22细胞的ROS水平、LDH活性和细胞活力。(F)不同剂型的FITC标记CC在U87细胞内持续时间。(G)定量分析U87细胞内标记CC的水平。(H)CC的细胞毒性机制图。(I)CC导入U87细胞24小时后的细胞活力
(4)巨胞饮触发的膜融合机制
研究发现,HA-PRTM-rHDL通过巨胞饮途径进入细胞并通过膜融合机制实现蛋白质货物的快速胞内释放,绕过了溶酶体途径,有效保护了蛋白质货物的生物活性。
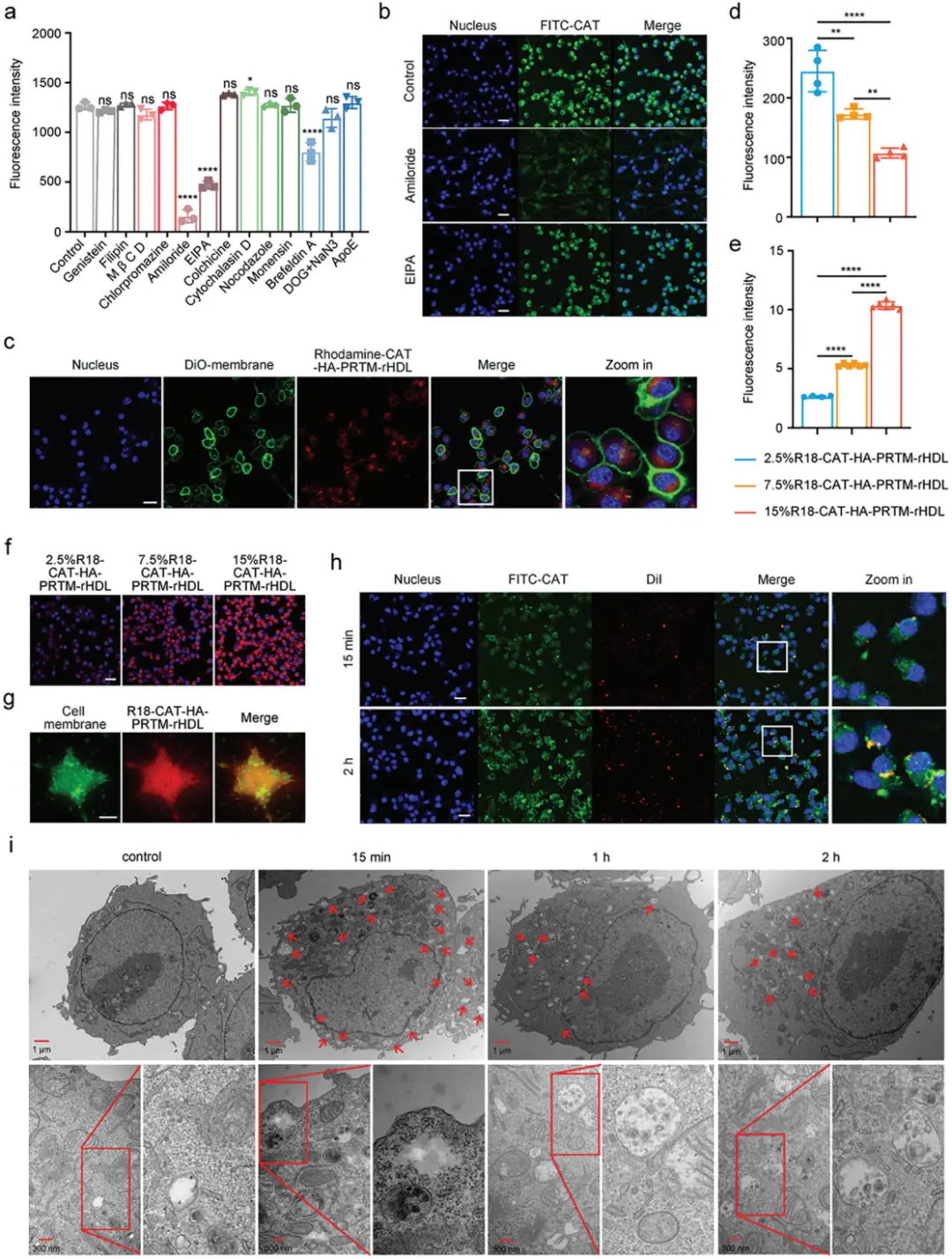
图4.巨胞饮触发的膜融合介导小胶质细胞内蛋白质转运。(A)在不同的内吞抑制剂存在下,CATHA-PRTM-rHDL与细胞结合。(B)激光共聚焦显微镜下,细胞在EIPA和阿米洛利存在下对CAT-HA-PRTM-rHDL的摄取。(C)CAT-HA-PRTM-rHDL与BV2细胞共孵育15分钟的激光共聚焦图像。(D)荧光强度统计。(F)激光共聚焦显微镜下R18标记的CAT-HA-PRTM-rHDL胞内摄取。(G)在全内反射荧光显微镜下孵育15分钟后,DiO标记的BV2细胞膜和R18标记的CAT-HA-PRTM-rHDL15分钟后共定位。(H)在BV2细胞中以10 μg mL/L的CAT浓度孵育15分钟和2小时后,FITC标记的CAT(绿色)从载体上解离。(I)将BV2细胞与CAT-HA-PRTM-rHDL共孵育后进行透射电子显微镜观察
(5)脑损伤小鼠模型中的治疗效果
在TBI和ALS小鼠模型中,CAT-HA-PRTM-rHDL显著改善了TBI小鼠的空间学习和记忆能力,并延长了ALS小鼠的生存期。这表明该仿生纳米载体在蛋白质治疗药物的CNS递送中具有显著的治疗潜力。
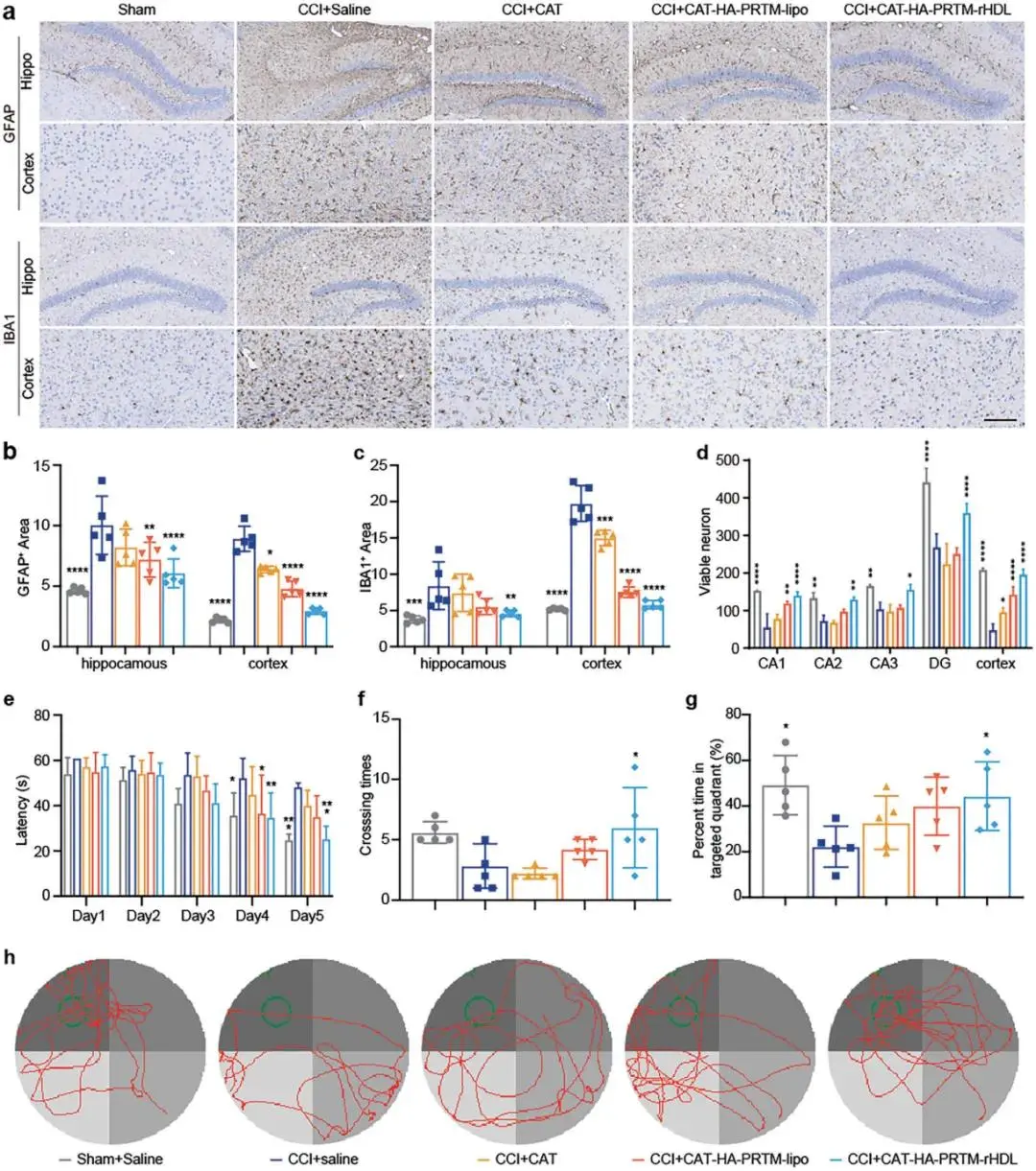
图5.CAT-HA-PRTM-rHDL可减轻CCI模型小鼠的神经病理损伤并改善记忆缺陷。A)海马区和大脑皮层GFAP和IBA1免疫组织化学染色显示,CAT-HA-PRTM-rHDL处理组小胶质细胞活化和星形胶质细胞增生减弱。激活的星形胶质细胞(B)和小胶质细胞(C)在海马区和大脑皮层定量分析。(D)大脑皮层和海马区Nissl存活神经元定量分析。(E)逃生潜伏期。(F)跨台时间。(G)逃生平台先前所在的象限花费的时间百分比。(H)代表性游泳路径
该研究开发了一种高效、通用且生物相容的细胞基质仿生纳米载体(HA-PRTM-rHDL),能够有效地递送各种蛋白质治疗药物至CNS。这一创新的递送平台不仅在实验室模型中展示了显著的治疗效果,还为严重脑疾病的治疗提供了重要的技术支持。此外,本研究的细胞基质仿生纳米载体通过模拟蛋白质的自然环境,有效保护了蛋白质的生物活性,促进其穿越BBB并实现靶向递送,展示了在CNS疾病治疗中的广泛应用潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

