
肝纤维化是各类慢性肝病进展为肝硬化与肝癌的共同病理通路,全球每年约100万人死于肝纤维化终末期。其核心环节在于氧化应激持续激活肝星状细胞(HSC),导致细胞外基质异常沉积。传统静脉输注人脐带间充质干细胞外泌体(hucMSC-Exo)虽具抗纤维化潜能,但易被单核-巨噬系统快速清除,且缺乏对活化HSC的靶向性,难以在肝脏维持有效浓度。

针对上述问题,兰州大学李汛教授、姚佳研究员团队设计了一种可腹腔注射的金属多酚水凝胶(CMC-OD-TA-Fe(III))缓释体系:先将高亲和力配体AEAA修饰于hucMSC-Exo表面,赋予其特异性识别并内化活化HSC的能力;再将该靶向外泌体包载于羧甲基壳聚糖/氧化葡聚糖-单宁酸-Fe³⁺三维网络凝胶中。凝胶经肠系膜动脉-门静脉途径高效入肝,持续释放外泌体,实现“长循环-靶向蓄积-抗纤维化”一体化治疗,为临床提供安全、经济、高效的新策略。该文章于2025年9月26日以《Hydrogel Loaded with Aminoethyl Anisamide-Modified Exosomes Attenuates Hepatic Fibrosis by Targeting Activated Hepatic Stellate Cells》为题发表于《ACS NANO》(DOI:10.1021/acsnano.5c06003)。
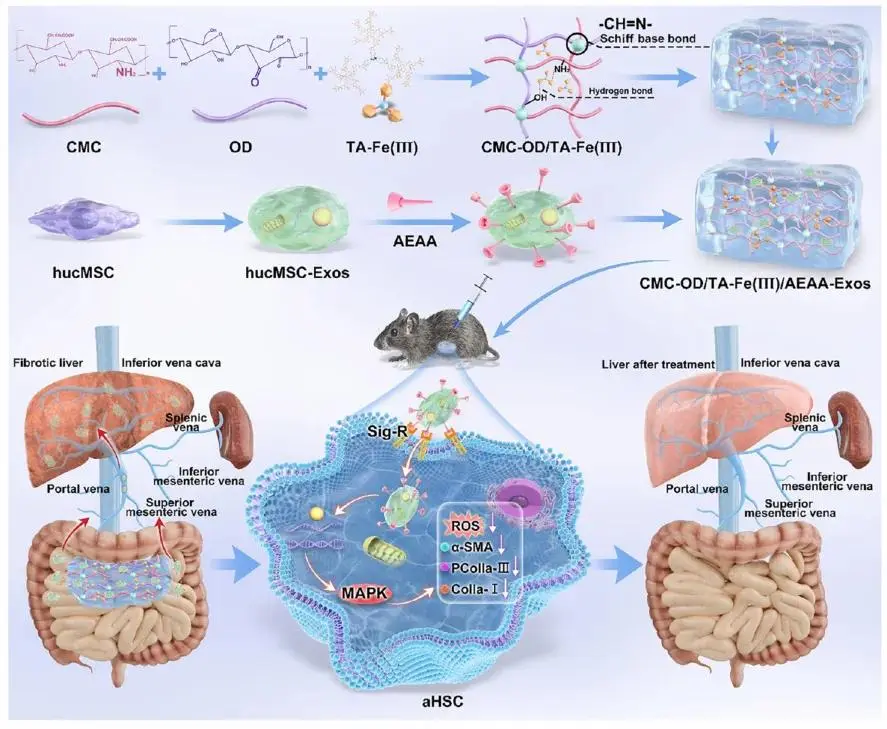
研究示意图
(1) 水凝胶和外泌体的合成与表征
本研究证实人脐带间充质干细胞来源的外泌体具有治疗潜力。外泌体表征结果显示:扫描电镜显示典型囊泡结构(图1A),纳米颗粒追踪分析表明粒径集中分布于135 nm(图1B),Western blot检测到TSG101、CD81、CD9等表面标志物阳性表达(图1C)。水凝胶系统表征表明:CMC-OD/TA-Fe及载外泌体水凝胶均呈现均匀多孔结构,孔径较CMC-OD凝胶更小且分布均匀(图1D)。高倍电镜可见外泌体附着于凝胶表面(图1E),元素能谱检测到C、N、O、P、Fe等特征元素(图1F),证实AEAA-外泌体成功负载。
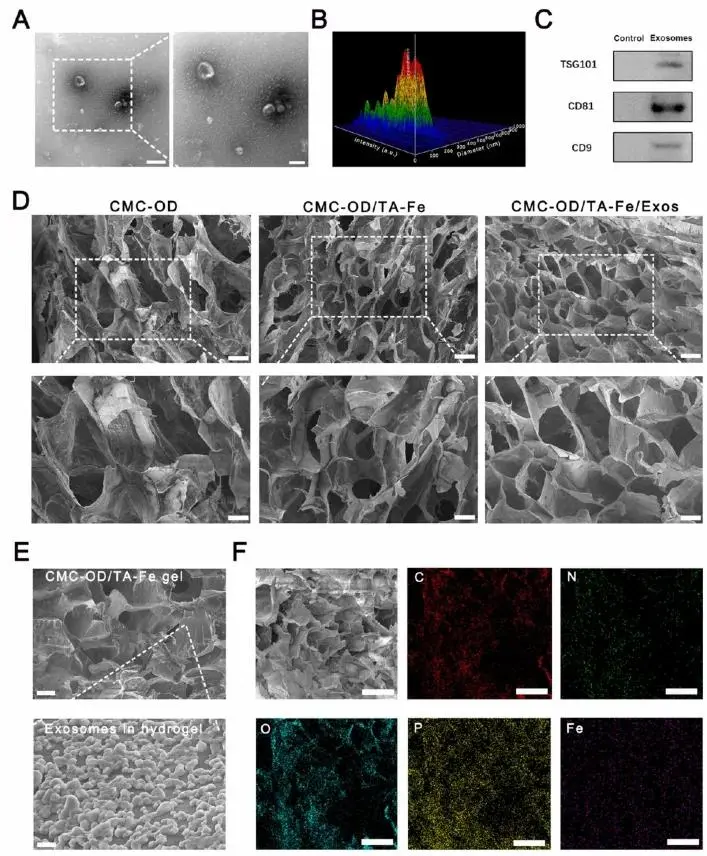
图1.(A)采用透射电子显微镜表征外泌体超微结构。(B)通过纳米颗粒追踪分析技术检测外泌体粒径分布。(C)采用蛋白质印迹法检测外泌体标志物(TSG101、CD9、CD89)。(D)冷冻干燥后不同水凝胶的SEM微观形貌。(E)CMC-OD/TA-Fe/AEAA-Exos水凝胶的SEM微观结构及表面附着外泌体的高倍形貌。(F)CMC-OD/TA-Fe/AEAA-Exos水凝胶的元素能谱分析
(2)水凝胶的合成与性能表征
本研究测得OD氧化度为40%,傅里叶变换红外光谱显示氧化葡聚糖在1731.8 cm−1处出现醛基特征吸收峰(图2A),1H NMR谱图在4.2−5.8 ppm化学位移区间出现半缩醛结构特征峰(图2B),证实葡聚糖成功氧化。CMC-OD水凝胶在1608.9 cm−1处出现亚胺键特征峰(图2A),表明成功通过席夫碱反应形成凝胶。CMC-OD/TA-Fe水凝胶呈红褐色(图2D),凝胶时间短于CMC-OD凝胶。注射性测试表明该水凝胶可通过注射器顺畅推注并保持形态稳定(图2E)。自愈合实验显示切断的水凝胶30分钟内可重新愈合(图2F),指关节弯曲实验证实其具有良好的粘弹性(图2G)。猪皮实验表明CMC-OD/TA-Fe凝胶在生理盐水中浸泡24小时后仍保持完整粘附(图2H)。降解实验显示CMC-OD/TA-Fe水凝胶14天后降解速率趋于稳定,结构稳定性优于CMC-OD凝胶(图2I)。溶胀实验表明CMC-OD/TA-Fe水凝胶达到溶胀平衡时间稍长,最大溶胀度较低(图2J)。流变学测试显示水凝胶储能模量为1000 Pa,临界应变为113%(图2K),阶跃应变实验证实其具备完整的结构自恢复能力。
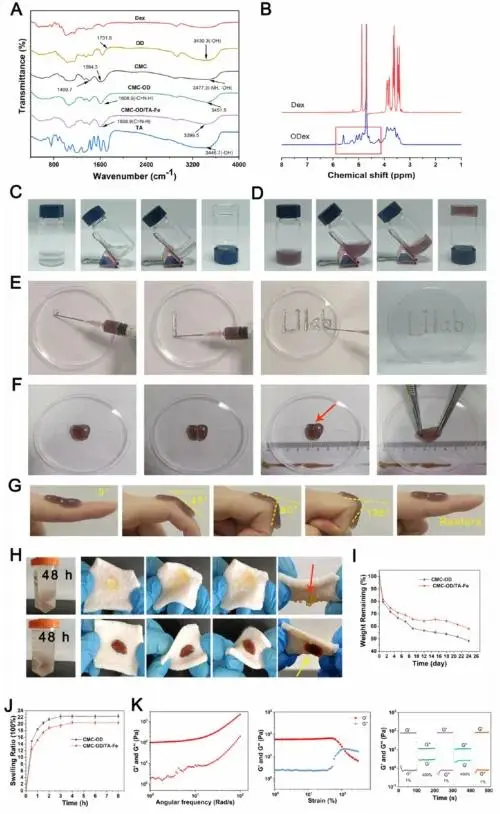
图2.(A)水凝胶组分的傅里叶变换红外光谱分析。(B)葡聚糖及氧化葡聚糖的1H NMR检测。(C,D)分别为CMC-OD与CMC-OD/TA-Fe水凝胶的胶体状态展示。(E)CMC-OD/TA-Fe水凝胶的注射性能测试。(F)CMC-OD/TA-Fe水凝胶的自愈合性能测试。(G)CMC-OD/TA-Fe水凝胶的粘弹性测试。(H)通过猪皮实验评估CMC-OD与CMC-OD/TA-Fe水凝胶的粘附性能。(I)水凝胶降解特性分析。(J)水凝胶溶胀性能分析。(K)分别通过角频率测试、应力测试与阶跃应变测试评估CMC-OD/TA-Fe水凝胶的流变学特性
(3)水凝胶和外泌体系统体外生物安全性评估
通过体外生物相容性实验评估水凝胶系统的生物安全性。活死染色显示L929细胞在不同组别水凝胶提取物中培养后,细胞形态与存活率均无显著变化(图3A、C)。细胞黏附实验表明L929与BRL-3A细胞在CMC-OD、Gel及Gel/AEAA-Exos水凝胶表面均生长良好(图3B),培养24小时后荧光强度定量分析显示各组间细胞数量无显著差异(图3D)。
CCK-8检测显示:经不同浓度(10%-100%)Gel/AEAA-Exos水凝胶提取物培养1/3/5天后,L929与BRL-3A细胞活力分别维持在91.7%以上(图3E)和84.3%以上(图3F)。100%浓度不同组别水凝胶提取物培养1/3天后,L929细胞活力均高于91.8%(图3G),符合ISO 10993-5标准中0级细胞毒性要求。溶血实验显示Gel与Gel/AEAA-Exos组溶液呈无色透明状,溶血率低于5%(图3H)。凝血功能检测表明Gel/AEAA-Exos组的PT、APTT、TT及FIB指标与对照组均无显著差异(图3I-J)。
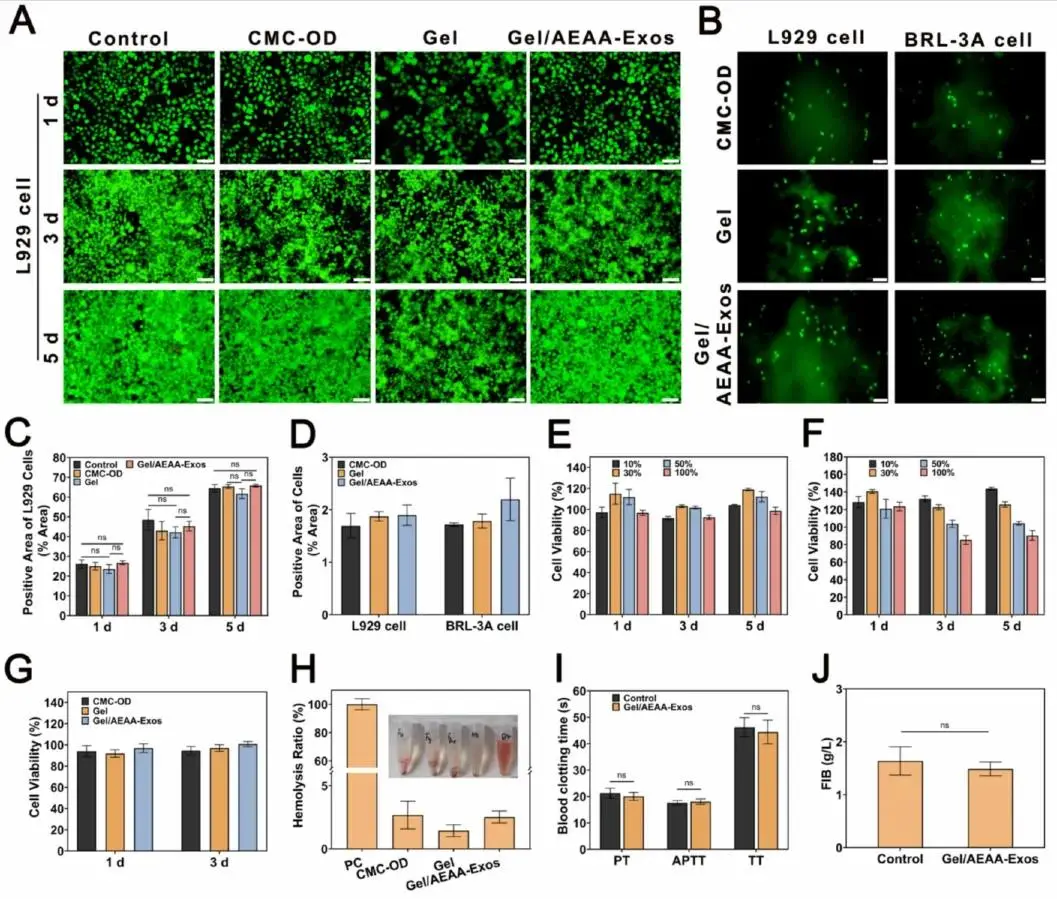
图3.(A)经不同组别水凝胶提取物处理的L929细胞活死染色结果。(B)在不同水凝胶表面培养的L929细胞与BRL-3A细胞黏附测试。(C)基于ImageJ软件对(A)图中L929细胞活细胞阳性表达区域的定量分析。(D)基于ImageJ软件对(B)图中L929与BRL-3A细胞活细胞阳性表达区域的定量分析。(E)水凝胶对L929细胞的CCK-8毒性检测。(F)水凝胶对BRL-3A细胞的CCK-8毒性检测。(G)通过CCK-8法检测不同水凝胶对BRL-3A细胞的毒性效应。(H)水凝胶溶血效应评估。(I,J)水凝胶凝血功能评估
(4)水凝胶和外泌体系统体外生物学功能评价
为增强外泌体靶向治疗效果,采用AEAA对hucMSCs来源外泌体进行工程化修饰。细胞摄取实验显示,AEAA修饰外泌体(AEAA-Exos组)在活化肝星状细胞核周呈现显著富集的红色荧光信号(图4A),定量分析证实其对活化肝星状细胞具有特异性靶向能力(图4E)。DCFH-DA探针检测显示,AEAA-Exos组能显著降低活化肝星状细胞内ROS水平,荧光定量分析(图4F)证实其抗ROS效果优于未修饰外泌体组(图4B)。纤维化指标检测表明,AEAA-Exos可有效抑制活化肝星状细胞中α-SMA(图4C、G)和Colla I(图4D、H)的表达,RT-PCR分析进一步显示其能显著降低α-SMA和Col1a1的mRNA表达水平。
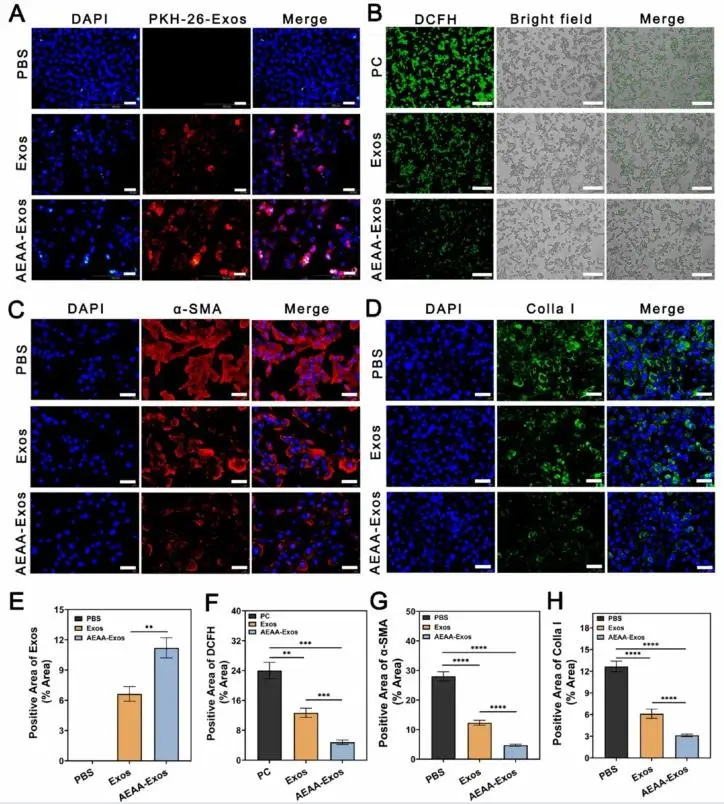
图4.(A)凝胶/AEAA-Exos系统对活化肝星状细胞的靶向性评估。(B)凝胶/AEAA-Exos系统的抗ROS能力评价。(C)通过α-SMA指标评估系统的抗纤维化效果。(D)通过Colla I指标评估系统的抗纤维化效果。(E)外泌体阳性区域、(F)DCFH阳性区域、(G)α-SMA阳性区域及(H)Colla I阳性区域的定量分析
(5)水凝胶和外泌体系统体内靶向能力评估
通过SD大鼠体内实验评估凝胶/AEAA-Exos递送系统的靶向能力。小动物活体成像显示:水凝胶组在植入后12小时至7天内外泌体信号持续增强(图5A),而游离AEAA-外泌体组在第1天即显著减少,第7天基本消失(图5A、D、E)。器官分布检测表明Gel/AEAA-Exos组外泌体在肝脏中富集最显著,脾、肾、心、肺中分布较少(图5B、D)。体外释放实验显示59.3%的外泌体在前7天释放,与体内7天达到积累峰值的结果相符(图5B)。组织免疫荧光分析显示,Gel/AEAA-Exos组在α-SMA标记的活化肝星状细胞周围呈现大量红色外泌体信号聚集(图5C),定量分析证实其外泌体定位效率显著高于未修饰组(图5F)。
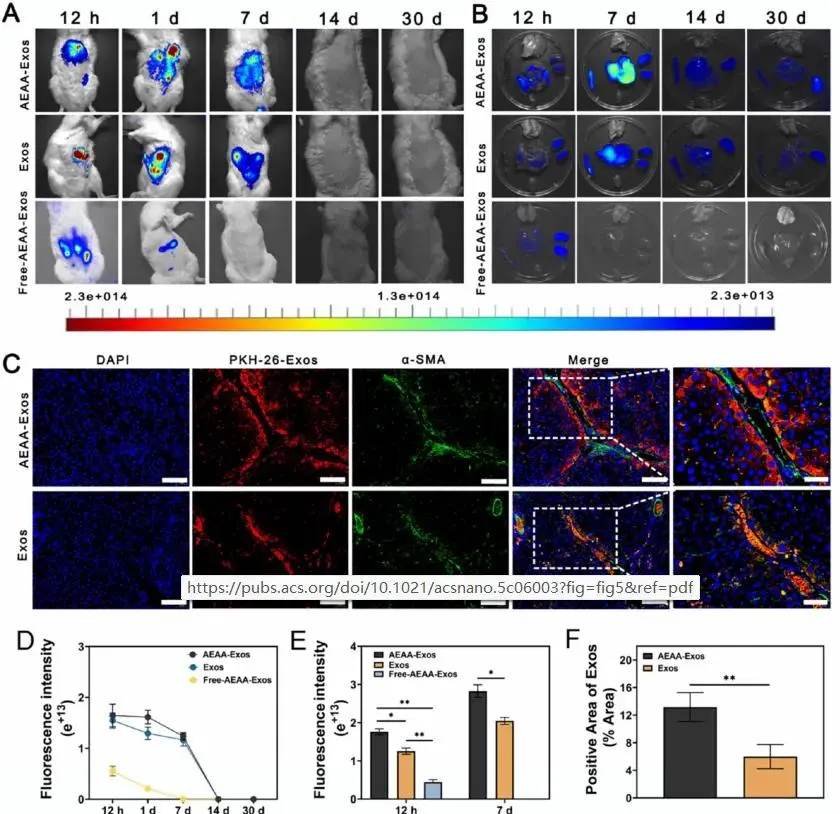
图5. (A)不同处理组SD大鼠在不同时间点的小动物活体成像;(B)外泌体在肝脏分布的时相评估;(C)外泌体靶向活化肝星状细胞的免疫荧光分析;(D)体外外泌体分布荧光定量;(E)肝脏外泌体分布荧光定量;(F)外泌体肝内分布定量分析
(6)水凝胶和外泌体系统体内生物安全性评价
通过30天体内实验评估水凝胶/外泌体递送系统的生物安全性。降解实验显示水凝胶在30天内未完全降解,证实其具备持续释放的物理基础。大鼠整体状态良好,胃肠道系统通畅无粘连。组织病理学分析表明,Gel/AEAA-Exos组肝脏结构完整,肝细胞形态正常,脾、肾、肺、心脏(图6A)及脑组织的实质细胞形态与炎症细胞浸润程度均与正常组无显著差异。血清学检测显示Gel/AEAA-Exos组的ALT、AST、CREA、UREA指标(图6B-E)以及TNF-α和IL-4炎症因子水平(图6F-G)与正常组均无统计学差异(P > 0.05)。
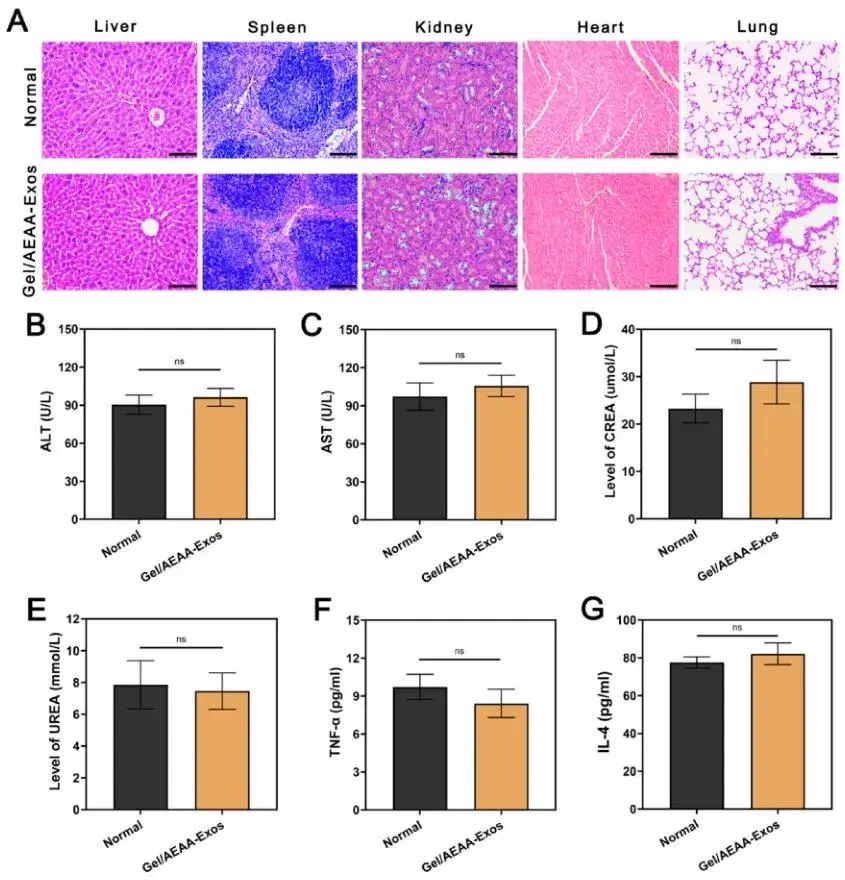
图6.(A)小鼠植入Gel/AEAA-Exos 7天后正常组与实验组肝脏、脾脏、肾脏、心脏和肺的HE染色图(标尺:400 μm)。(B-E)分别通过血清ALT、AST、CREA和UREA水平评价Gel/AEAA-Exos系统的生物安全性。(F,G)分别通过ELISA试剂盒检测血清TNF-α和IL-4水平评价Gel/AEAA-Exos系统的生物安全性
(7)水凝胶和外泌体系统体内抗纤维化能力评估
采用C57BL/6J小鼠建立肝纤维化模型(图7A)。肝脏大体观察显示Model组和Gel组出现明显纤维化瘢痕,而Gel/AEAA-Exos组与Gel/Exos组无显著差异。HE染色表明Gel/AEAA-Exos组的炎症细胞浸润显著少于Model组、Gel组及Gel/Exos组(图7B、8D)。Masson染色显示Model组和Gel组形成明显胶原纤维环状结构,Gel/AEAA-Exos组的纤维化面积显著小于其他各组(图7E)。天狼星红染色结果与Masson染色趋势一致。RT-PCR分析证实Gel/AEAA-Exos能显著降低α-SMA、Col1a1和Col3a1的基因表达水平(P < 0.01)。免疫组化检测显示:Gel/AEAA-Exos组PColla III表达显著低于Model组、Gel组及Gel/Exos组(图7B、8F)。MMP9在Gel/AEAA-Exos组中分布最多(图7C),定量分析证实其表达量显著高于Model组(图7G)。
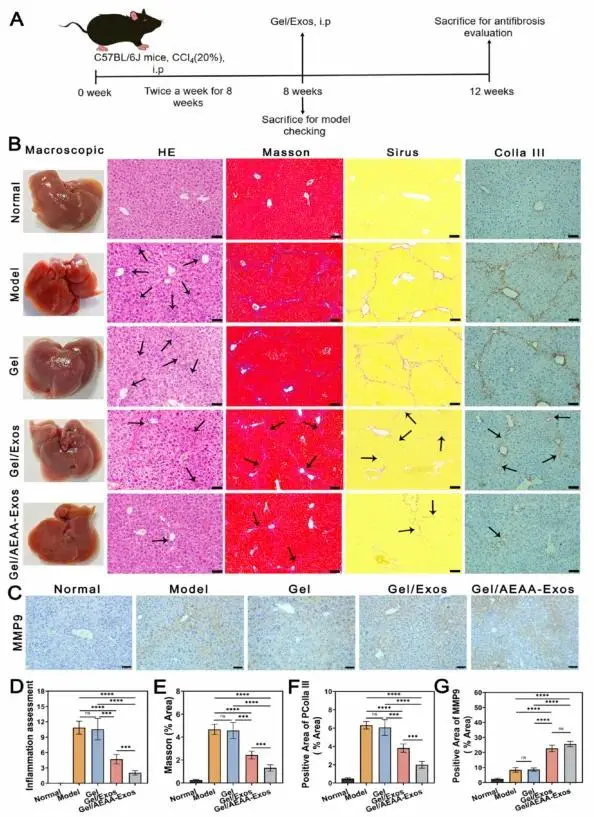
图7.(A)肝纤维化造模及抗纤维化治疗流程示意图。(B)通过HE染色、Masson染色、天狼星红染色和PColla III染色评估凝胶/AEAA-Exos系统的抗纤维化效果。(C)通过MMP9指标评估凝胶/AEAA-Exos系统的抗纤维化效果。(D)炎症阳性区域、(E)Masson阳性区域、(F)PColla III阳性区域及(G)MMP9阳性区域的定量分析
(8)水凝胶和外泌体系统体内抗肝纤维化效果的免疫荧光与血清学评估
通过血清学分析评估肝纤维化改善程度。Model组和Gel组的ALT和AST水平较Normal组显著升高(图8E)。与Model组相比,Gel/Exos和Gel/AEAA-Exos治疗组的ALT/AST水平明显降低,其中Gel/AEAA-Exos组的ALT水平显著低于Gel/Exos组,但两组间AST水平无显著差异(图8E)。细胞因子检测显示,Gel/Exos和Gel/AEAA-Exos组的TNF-α表达均低于Model组,而IL-4水平升高,两组治疗组间的细胞因子谱无显著差异(图8F)。
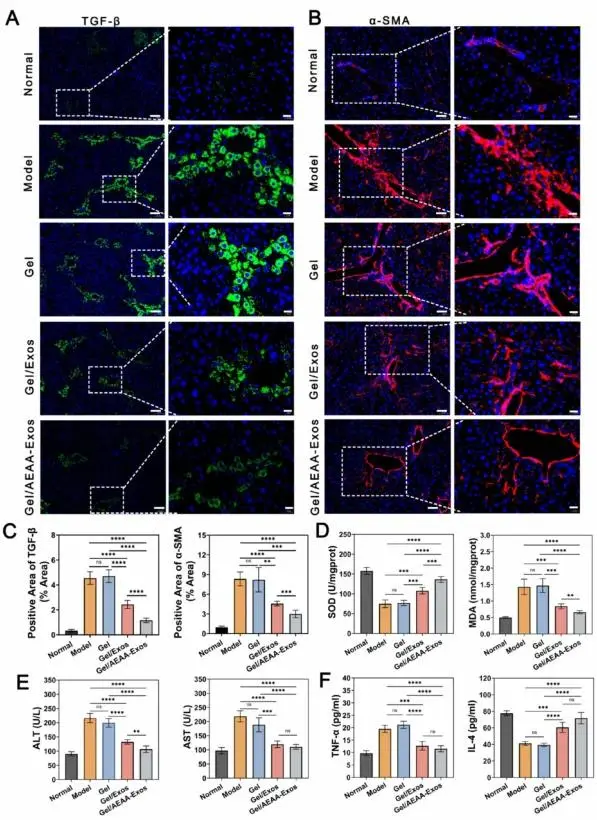
图8.(A、B)分别通过TGF-β与α-SMA评估凝胶/AEAA-Exos系统的抗纤维化效果。(C)TGF-β阳性表达区域与α-SMA阳性表达区域的定量分析。(D)通过Elisa检测评估的氧化应激水平(SOD与MDA)。(E)通过Elisa检测评估的血清ALT与AST水平。(F)通过Elisa检测评估的炎症水平(TNF-α与IL-4)
(9)通过转录组RNA测序分析Gel/AEAA-Exos的抗纤维化机制
差异基因分析显示治疗组与疾病模型共鉴定1398个差异表达基因,其中28个为共有基因(图9A)。模型组与对照组相比存在152个上调基因和58个下调基因(图9B),而Gel/AEAA-Exos治疗组与模型组相比显示1355个基因上调和443个基因下调(图9C)。
KEGG通路分析表明模型组差异基因主要富集于MAPK、PPAR、TGF-β等氧化应激相关通路(图9D),Gel/AEAA-Exos组则显著富集于MAPK通路、NF-κB信号、细胞因子受体相互作用等通路(图9E)。热图分析显示MAPK通路在肝纤维化发生与逆转过程中均呈现显著表达(图9F)。RT-PCR验证证实治疗组中MAP3K13、ASK1、MAPK14、MAPK1、HSPB1表达显著下调,MMP9表达显著上调(图9G),促纤维化基因(α-SMA、Col1a1、Col3a1)表达同步下调。
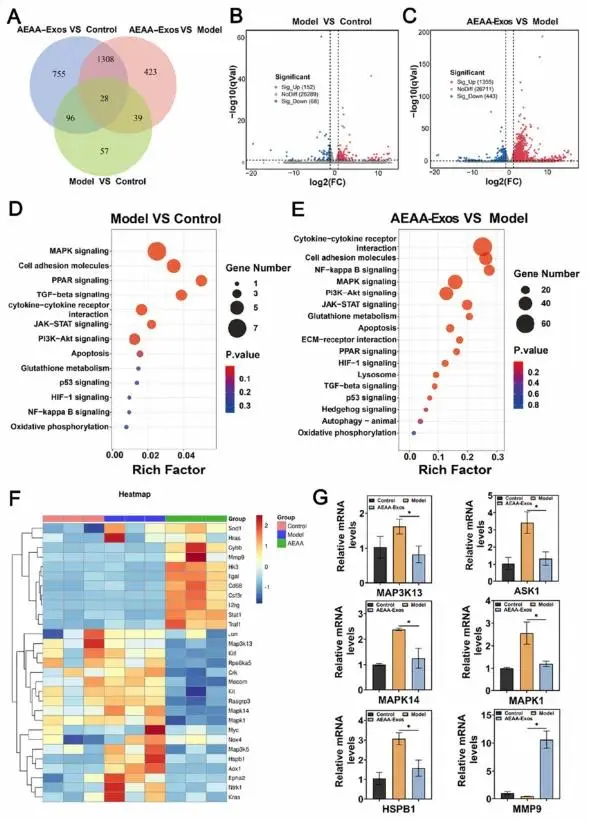
图9.(A)不同组别差异基因韦恩图。(B、C)模型组与Gel/AEAA-Exos组的差异基因火山图。(D、E)模型组和Gel/AEAA-Exos组差异基因相关通路的KEGG散点图分析。(F)抗纤维化通路相关基因的热图分析。(G)通过RT-PCR检测MAP3K13、ASK1、MAPK14、MAPK1、HSPB1和MMP9的基因表达水平
本研究构建的GelMA/HASH@DPDCNs可注射水凝胶兼具良好生物相容性与多重治疗功能:体外促进HUVEC迁移成管,减轻H2O2诱导的H9C2凋亡,并驱动巨噬细胞M2极化、抑制炎症因子;大鼠MI模型中,通过促血管新生、抗氧化与抗炎协同作用显著改善心功能、缩小心梗面积并增加室壁厚度。尽管机制细节及大动物验证仍需深入,该凝胶为MI微创联合治疗提供了新策略。 该研究构建了一种高效的水凝胶/外泌体递送平台--通过腹腔局部注射方式可持续释放靶向活化肝星状细胞的外泌体,并在四氯化碳/橄榄油诱导的小鼠肝纤维化模型中验证了其治疗功效。RNA测序分析表明,基于CMC-OD/TA-Fe水凝胶与AEAA修饰构建的Gel/AEAA-Exos系统,能够通过调控肝组织氧化应激、胶原沉积及炎症反应等机制延缓肝纤维化的发生发展。该平台为肝纤维化乃至肝硬化的防治提供了全新、安全且高效的治疗策略,同时也展现了Gel/AEAA-Exos递送系统在慢性肝损伤及终末期肝病领域的应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

