
牙周炎是一种全球超过40%成年人罹患的多因素慢性炎症性疾病,不仅破坏牙周组织,还与阿尔茨海默病、胃肠道疾病、新冠感染及某些癌症等全身疾病密切相关。传统治疗依赖器械清创和抗生素,但单一抗菌策略难以应对其复杂病理机制(菌群失衡、免疫紊乱、活性氧过度生成),导致疗效不佳、复发率高,且抗生素滥用加剧耐药问题,亟需开发多靶点协同治疗新策略。

针对上述问题,青岛科技大学邹艳丽/吴祥根团队构建了一种可局部施用的多靶点协同核-壳纳米凝胶(R@C)PC,以白藜芦醇-酪蛋白纳米胶束为活性核心,季铵化壳聚糖-聚多巴胺为功能外壳,通过“抗菌光热-抗氧化-免疫微环境重塑”三重机制协同干预牙周炎。该凝胶凭借阳离子外壳靶向并静电捕获细菌,借助聚多巴胺在近红外照射下产生可控高热杀灭病原体;同时持续释放白藜芦醇,诱导巨噬细胞M2极化、下调促炎因子并上调抗氧化酶SOD,从而中断“菌群失衡-炎症-氧化应激”恶性循环。其高黏附、低流动特性显著延长了病灶滞留时间,实现了精准、持续的多靶点治疗。该文章于2025年07月10日以《A Multitarget Synergistic Core-Shell Nanogel for Experimental Periodontitis Treatment》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202420551)。
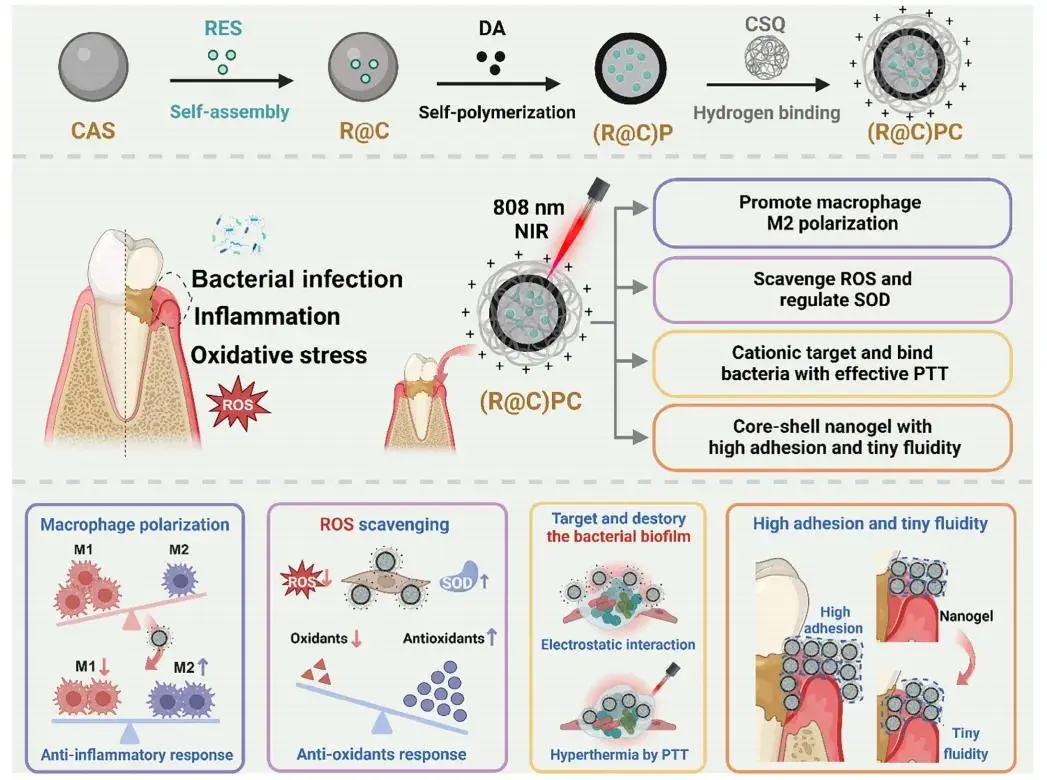
图1 (a) (R@C)PC纳米凝胶多靶点协同治疗牙周炎示意图
(1)纳米胶束的制备与表征
研究者通过 pH-超声转移法在 PBS 中将 RES 包载入 R@C 纳米胶束,使其由结晶态转为无定形并具备水溶性;图 2A 显示 R@C-60:3 的包封率达 99.62 ± 0.43 %,载药量为 4.74 ± 0.02 %,且粒径在图 2B 中以 138.77 ± 5.83 nm 为最小。随后,研究者向该最优配方中分别加入 1、3、5 mg mL⁻¹ DA,使其在 pH 8.5 下自聚形成 (R@C)P-L/M/H;图 2D 表明 (R@C)P-L 出现双峰,而 (R@C)P-M/H 仅呈单峰,且图 2E 中 (R@C)P-L 的 ζ 电位绝对值最低(9.27 ± 0.44 mV)。透射电镜(图 2F)进一步证实低 DA 用量未能完全包裹 R@C,因此研究者将 (R@C)P-H 选为后续材料;荧光光谱(图 2G)与紫外光谱(图 2H)显示 PDA 外壳遮蔽了 CAS 中的色氨酸与赖氨酸,并引入 PDA 特征吸收。储存 30 d 后,图 2I 显示 R@C 出现沉淀而 (R@C)P 无沉淀,图 2J-K 的 RES 保留率分别为 75.88 ± 0.84 % 与 98.04 ± 1.25 %。研究者继而以 30 mg mL⁻¹ CSQ 与 (R@C)P 在 pH 7.2 下搅拌 2 h 构建 (R@C)PC 纳米凝胶,其 ζ 电位在图 2L 中达 9.03 ± 1.02 mV,黏度在图 2M 中为 481 ± 13 mPa·s;图 2N 的 TEM 图像显示 CSQ-PDA 形成致密外壳,图 2O 的 SEM 表明冻干后样品保持均匀纳米结构。FTIR(图 2P)中 RES 特征峰在 R@C、(R@C)P、(R@C)PC 均消失,而 CSQ 特征峰保留且无新生峰,提示氢键作用;XRD(图 2Q)仅观察到 NaCl 晶峰(27.38、31.71、45.46、56.48°),RES 晶峰消失,证实无定形化使其水溶性由 <65 μg mL⁻¹ 升至 12649.10 ± 421.73 μg mL⁻¹,且 PDA/CSQ-PDA 壳层有效克服无定形多酚的储存不稳定性。
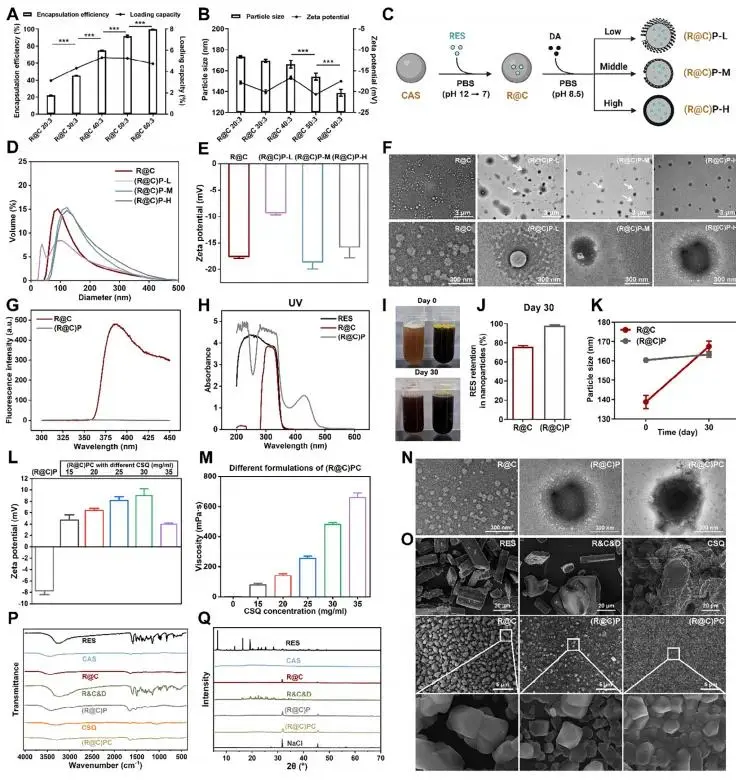
图2. (a) R@C纳米胶束制备示意图;(b) 粒径与包封率;(c) (R@C)P自聚合示意;(d) 粒径分布;(e) Zeta电位;(f) TEM显示PDA包覆;(g) UV光谱;(h) 荧光光谱;(i) 30 d稳定性外观;(j) RES保留率;(k) 粒径变化;(l) Zeta电位随CSQ变化;(m) 黏度变化;(n) TEM;(o) SEM;(p) FTIR;(q) XRD
(2)形貌、结构及稳定性分析
在 808 nm 近红外光照射下,(R@C)P 与 (R@C)PC 的最高温度随激光功率升高而上升(图 3A、3B)。1.5 W cm⁻² 时,(R@C)PC 最高温度约 59 °C,处于有效杀菌区间且低于黏膜耐受阈值,被选为后续灭菌参数。在 1.5 W cm⁻² 照射 10 min 内,(R@C)P 与 (R@C)PC 溶液温度迅速升至约 55 °C 与 60 °C,而 PBS 与 R@C 温度几乎不变;CSQ 的加入进一步提高了 PDA 的升温幅度(图 3C)。三次升温 - 降温循环证实 (R@C)PC 具有优异的光热稳定性(图 3D)。根据升 / 降温曲线与线性拟合,(R@C)PC 的光热转换效率约为 48%,优于已报道的 42%、40% 与 38%(图 3E、3F)。红外热像图直观展示了各制剂在 808 nm NIR 照射下的温度分布(图 3G)。P. gingivalis 与不同浓度的 (R@C)P 或 (R@C)PC 孵育 2 h,(R@C)PC 使 P. gingivalis 的 ζ 电位由负转正,证实其阳离子表面可通过静电相互作用黏附细菌(图 3H)。
采用 ABTS、FRAP 与 DPPH 法评估 (R@C)PC 的体外抗氧化能力,并以维生素 C 为阳性对照。NIR 照射可在 ABTS 与 FRAP 体系中进一步提升抗氧化活性,但对基于乙醇环境的 DPPH 体系无显著影响(图 3I、3J)。10 μg mL⁻¹ RES 当量的各制剂体外抗氧化能力排序为:(R@C)PC ≈ (R@C)P > R&C&D&C > R@C > Vc > RES;R@C 的活性显著高于 RES (p < 0.05),与溶解度提升有关;(R@C)PC 又显著优于 R&C&D&C (p < 0.05),归因于纳米结构设计。NIR 照射后,所有药物抗氧化能力均增强,(R@C)PC 的 ABTS 清除率由 35.68 ± 0.64% 升至 60.72 ± 0.39%,原因可能是 NIR 促进 RES 加速释放及高温加速氧化还原反应(图 3I、3J)。DPPH 结果表明 (R@C)PC 抗氧化能力最佳,且各药物呈时间与浓度依赖性(图 3K)。在 pH 6 与 7.2 条件下测定 (R@C)PC 的体外释放曲线,R@C、(R@C)P 与 (R@C)PC 的释放速率与累积量均显著高于纯 RES(图 3L)。在模拟感染酸性微环境 (pH 6) 及 NIR 照射下,(R@C)PC 的累积释放量显著提高,提示 NIR 可在感染部位加速药物释放(图 3M)。
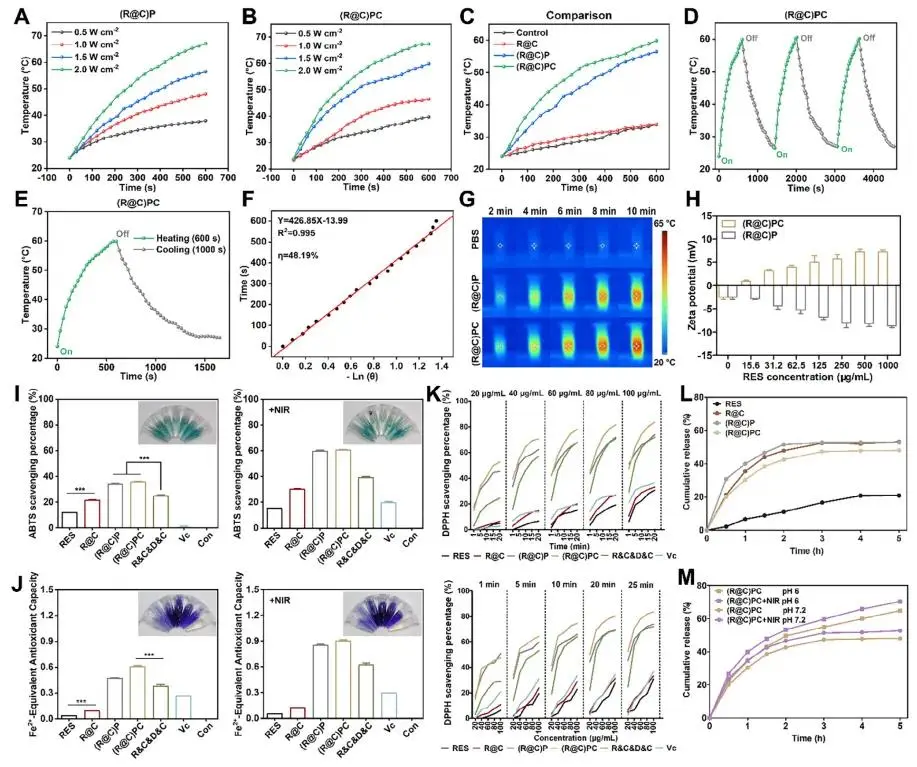
图3. (a–b) (R@C)P与(R@C)PC在不同功率NIR下的光热升温曲线;(c) PBS、R@C、(R@C)P、(R@C)PC的光热对比;(d) (R@C)PC三次光热循环稳定性;(e) 单次升温-降温曲线;(f) 冷却段线性拟合求光热转换效率;(g) 红外热成像实时温度分布;(h) P. gingivalis与(R@C)P/(R@C)PC孵育后Zeta电位变化;(i) ABTS自由基清除;(j) FRAP还原能力;(k) DPPH自由基清除;(l) 不同制剂RES累积释放曲线;(m) pH 6/7.2及NIR触发RES释放
(3)体外与体内生物相容性评价
研究者在体外阶段,其通过鸡胚绒毛尿囊膜(HET-CAM)试验与溶血实验进行考察:图 4A 显示,0.1 m NaOH 阳性对照组出现明显血管出血,而 (R@C)PC 组及其他处理组表现与 0.9 % NaCl 组一致;图 4B 中台盼蓝渗漏量与视觉结果相符,提示 (R@C)PC 各组分无刺激性,且优于弱刺激的甲硝唑(MNZ)组。图 4C 中 0.1 m NaOH 组与 Triton 组呈深红色,提示红细胞破裂;相比之下,MNZ、(R@C)PC 及 0.9 % NaCl 组颜色正常,图 4D 的溶血率测定结果与视觉观察相一致,进一步证实 (R@C)PC 与红细胞具有良好的相容性。 随后,研究者依据图 4E 所示方案开展体内实验:每日于 C57BL/6J 小鼠牙周局部给予 50 μL (R@C)P 或 (R@C)PC,并辅以 10 min NIR 照射,连续 28 d 后取材进行血清学与病理学检测。图 4F 表明,实验期间各组小鼠体重稳步增长,与对照组无差异,提示 (R@C)P 及 (R@C)PC 对体重无显著影响。图 4G–I 的血液学结果显示,对照、(R@C)P 与 (R@C)PC 组在肝功能(ALT、AST)、肾功能(BUN、CREA)及心功能(CK、LDH)指标上均无显著差异;图 4J 的组织学观察亦未发现明显病理改变或组织损伤。综上,研究者认为体外及体内生物相容性评价均充分证实 (R@C)PC 具备优异的生物安全性与生物相容性,有望满足临床药物转化的标准要求。
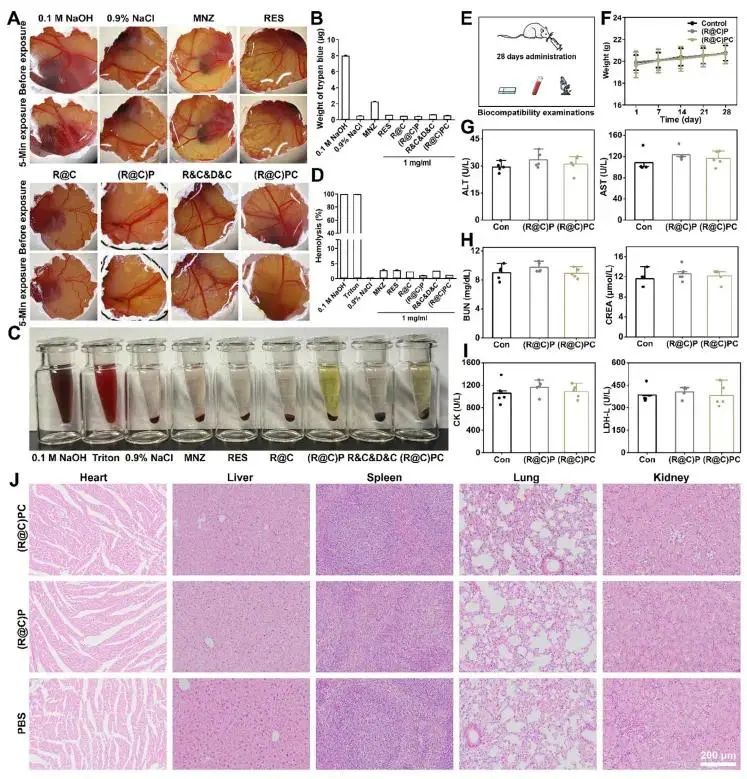
图4. (a) HET-CAM血管刺激性实验图像;(b) 台盼蓝渗出定量;(c) 溶血实验照片;(d) 溶血率统计;(e) 28 d小鼠局部给药示意图;(f) 体重变化;(g) 肝功能指标;(h) 肾功能指标;(i) 心功能指标;(j) 主要器官H&E染色
(4)巨噬细胞极化与抗炎作用
M1/M2 巨噬细胞极化比例升高与牙周病进展显著相关,M1 型巨噬细胞通过释放细胞因子加剧牙周组织破坏。图 5A:(R@C)PC 可诱导巨噬细胞由 M1 表型向 M2 表型转化,发挥抗炎作用并促进牙周组织修复。图 5B:细胞活力实验显示,R@C、(R@C)P 和 (R@C)PC 的细胞毒性低于游离 RES,尤其在 24 和 48 h 差异显著;RES 当量 6.25 μg mL⁻¹ 时,各制剂毒性可忽略,被选为后续细胞实验剂量。图 5C、D:DCFH-DA 染色及荧光强度测定显示,LPS 显著提高 RAW264.7 细胞内 ROS 水平,而 (R@C)P 与 (R@C)PC 对 LPS 刺激表现出优异的抑制效果。图 5E、F:(R@C)P 与 (R@C)PC 显著降低促炎介质 NO、IL-6 及 TNF-α 的表达。图 5G:(R@C)P 与 (R@C)PC 上调 M2 巨噬细胞标志物 IL-10 与 TGF-β 的水平。图 5H、I:qPCR 结果显示,与 M1 表型相关的 IL-1β 与 iNOS mRNA 表达下降,而与 M2 表型相关的 Arg-1 与 CD206 mRNA 表达升高。CSQ 对免疫调节贡献有限,R@C 与 PDA 壳层是调控巨噬细胞极化的主要因素,两者协同使 (R@C)P 与 (R@C)PC 对 M2 标志物表达产生更稳定、更显著的影响,并促进巨噬细胞由 M1 向 M2 表型转化。
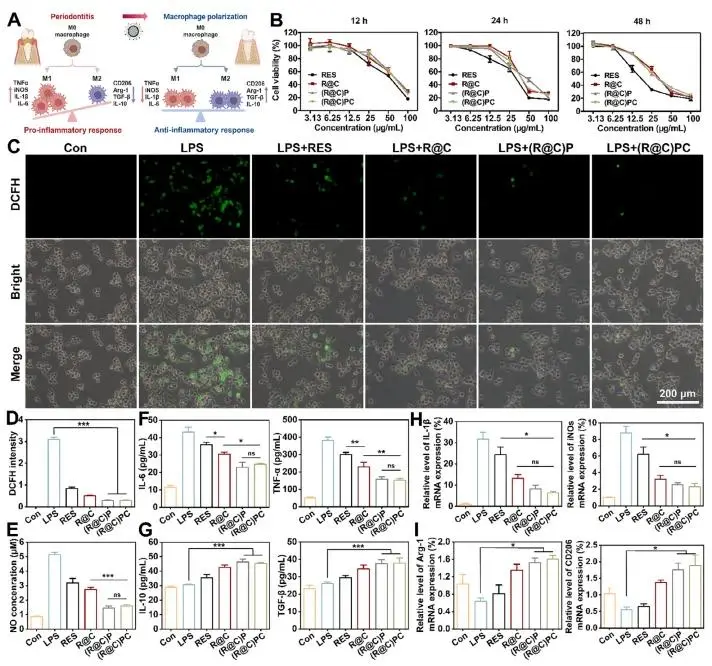
图5. (a) 巨噬细胞M1→M2极化及抗炎示意图;(b) RAW264.7与药物共孵育细胞活力;(c) LPS诱导ROS荧光染色;(d) ROS定量;(e) NO分泌量;(f) IL-6/TNF-α蛋白水平;(g) IL-10/TGF-β蛋白水平;(h) IL-1β/iNOS mRNA水平;(i) Arg-1/CD206 mRNA水平
(5)抗氧化与成纤维细胞保护效应
研究者指出,在牙周炎病灶中,免疫细胞受刺激后产生的 ROS 会损伤其他结缔组织细胞,因此降低胞内 ROS 水平成为亟待解决的问题。图 6A 显示,研究者以 L929 成纤维细胞为结缔组织模型,发现 (R@C)PC 能显著上调 SOD 活性并清除 ROS,表现出优异的抗氧化能力。图 6B 的细胞活力实验表明,所有纳米制剂的生物相容性均优于裸药 RES,且在高浓度(50 与 100 μg mL⁻¹)条件下,(R@C)PC 的细胞毒性显著低于 RES、R@C 及 (R@C)P,提示 CSQ 与 PDA 的协同可促进细胞增殖;值得注意的是,低浓度(3.13 μg mL⁻¹)R@C 对 L929 细胞的促增殖作用最强。依据图 6C 所示不同浓度过氧化氢刺激结果,研究者最终选定 1.5 mm H₂O₂ 作为刺激浓度、3.13 μg mL⁻¹ 作为各制剂实验剂量用于后续研究。图 6D、E 显示,R@C、(R@C)P 与 (R@C)PC 均显著提升细胞存活率并上调 SOD 水平以对抗 H₂O₂ 刺激。图 6F 的 DCFH 染色进一步证明,(R@C)P 与 (R@C)PC 预处理较 R@C 更能降低胞内 ROS,表明 PDA 壳层具有突出的 ROS 清除能力,可与 R@C 协同增强抗氧化效果。此外,图 6G 的细胞划痕实验结果表明,经 (R@C)P 与 (R@C)PC 预处理 24 h 后,L929 细胞的迁移能力显著优于单纯 H₂O₂ 刺激组,证实二者可在氧化应激条件下促进细胞迁移并降低 ROS 造成的损伤。
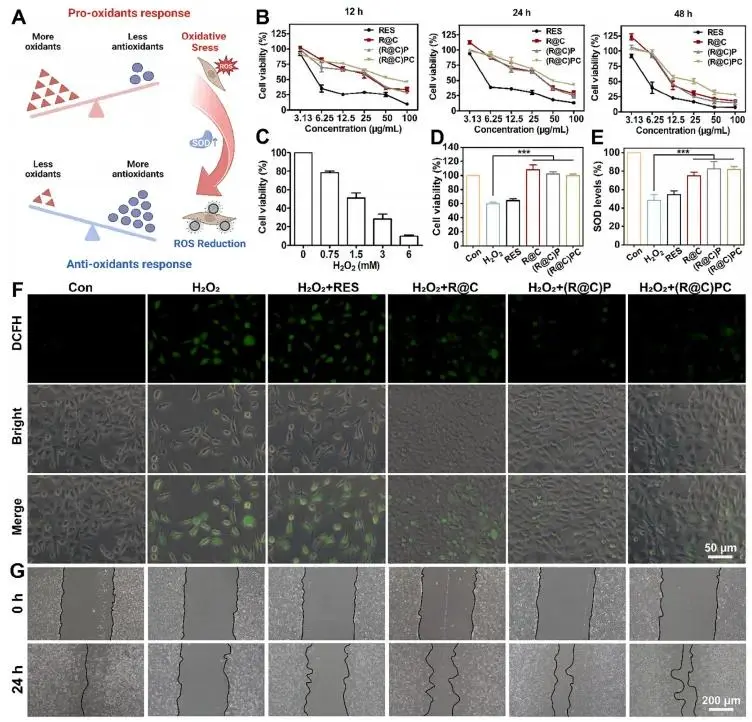
图6. (a) 细胞内氧化应激与抗氧化响应示意图;(b) L929细胞与系列浓度药物共培养12–48 h的细胞活力CCK-8结果;(c) 1.5 mM H₂O₂刺激下L929细胞存活率曲线;(d) 3.13 μg mL⁻¹药物预处理后再加H₂O₂刺激24 h的细胞存活率;(e) 对应SOD活性检测;(f) DCFH-DA荧光探针显示胞内ROS水平(绿色荧光);(g) 细胞划痕实验24 h迁移图像
(6)对 P. gingivalis、S. aureus 与 E. coli 的抗菌活性
选用 P. gingivalis、S. aureus 和 E. coli 作为典型牙周病原菌以评估 (R@C)PC 的抗菌效能。图 7A 显示,在 1×10⁸ CFU mL⁻¹ 条件下,(R@C)P 与 (R@C)PC 组无论是否施加 NIR 照射,菌落数均显著少于 PBS 组,表明 PDA 外壳本身具备优异的抗菌与光热杀菌能力;尽管其抑菌效果优于阳性对照 MNZ,但在该菌量下差异不显著。因此,研究者将菌量提高至 1×10⁹ CFU mL⁻¹,结果显示 (R@C)PC 组抑菌率居首(图 7B、C)。在此条件下,(R@C)PC 可完全杀灭 1×10⁸ CFU mL⁻¹ 的细菌,并对 1×10⁹ CFU mL⁻¹ 的细菌产生强烈抑制,其效果优于或等同于既往以 MNZ 为阳性对照的同类纳米平台。该优异表现归因于 CSQ–PDA 氢键外壳的显著阳离子抗菌活性。值得注意的是,CS–DA 复合物虽已被公认为先进生物材料,但 CSQ–PDA 外壳作为纳米胶束包覆层用于构建软纳米颗粒尚属首次报道。进一步在 NIR 照射下,(R@C)P+NIR 组抑菌率略有提升,而 (R@C)PC+NIR 组显著增强:对 1×10⁹ CFU mL⁻¹ 菌液,(R@C)P+NIR 仅残留 66.64 ± 2.72% 的 S. aureus 与 58.91 ± 7.92% 的 E. coli,(R@C)PC+NIR 则将残留降至 16.52 ± 7.70% 与 4.35 ± 1.77%,研究者将此归因于 CSQ 提高了 (R@C)PC 的光热转换效率。为探明 (R@C)PC+NIR 对细菌结构的影响,研究者利用透射电镜观察细菌超微形态(图 7D)。结果显示,未处理的 P. gingivalis、S. aureus 与 E. coli 表面平滑、结构完整;而经 (R@C)PC 或 (R@C)PC+NIR 处理后,P. gingivalis 呈现碎裂、结构崩解,S. aureus 与 E. coli 的细胞壁和膜溶解,胞内物质外泄。电镜结果证实,(R@C)PC 及其 NIR 照射可破坏 S. aureus 与 E. coli 的膜结构以杀灭细菌,并通过整体结构毁损方式杀灭 P. gingivalis。

图7. (a) 1×10^8 CFU mL-1细菌菌落照片;(b) 1×10^9 CFU mL-1细菌菌落照片;(c) 菌落面积定量;(d) 不同处理后P. gingivalis、S. aureus、E. coli TEM形貌
(7)抗生物膜性能表征
(R@C)PC 对细菌生物膜的靶向与破坏过程如图 8A 所示。经 (R@C)P、(R@C)PC、(R@C)P+NIR 与 (R@C)PC+NIR 处理后,P. gingivalis、S. aureus 与 E. coli 的胞外 AKP 活性显著升高,表明各处理迅速破坏了细菌细胞壁,NIR 照射进一步通过光热效应增强了抗菌能力。其中,P. gingivalis 的 AKP 水平最高,结构破坏最为严重,与平板计数和透射电镜结果一致,提示该纳米药物对 P. gingivalis 的杀灭效果优于对 S. aureus 与 E. coli(图 8B)。AO/EB 活死染色实验显示,MNZ 组出现红色或橙色荧光,而 (R@C)P、(R@C)PC、(R@C)P+NIR 与 (R@C)PC+NIR 组荧光更为强烈(图 8C)。结晶紫染色表明,各处理均显著降低生物膜总量(图 8D)。OD590 结果显示,PBS+NIR 组对 P. gingivalis、S. aureus 与 E. coli 生物膜的 OD590 值分别为 3.24 ± 0.07、3.23 ± 0.08 与 2.18 ± 0.06,而 (R@C)PC+NIR 组则分别降至 0.68 ± 0.06、0.53 ± 0.02 与 0.41 ± 0.03(图 8E)。综合各项实验,(R@C)PC 的抗菌与抗生物膜能力均优于 (R@C)P。P. gingivalis 与 (R@C)PC 共孵后表面电荷由负值(−2.41 ± 1.25 mV)转为正值,而 (R@C)P 无此变化(图 3H)。(R@C)PC 更强的抗菌与抗生物膜活性主要归因于 CSQ 的阳离子特性及其促进光热转化的能力。
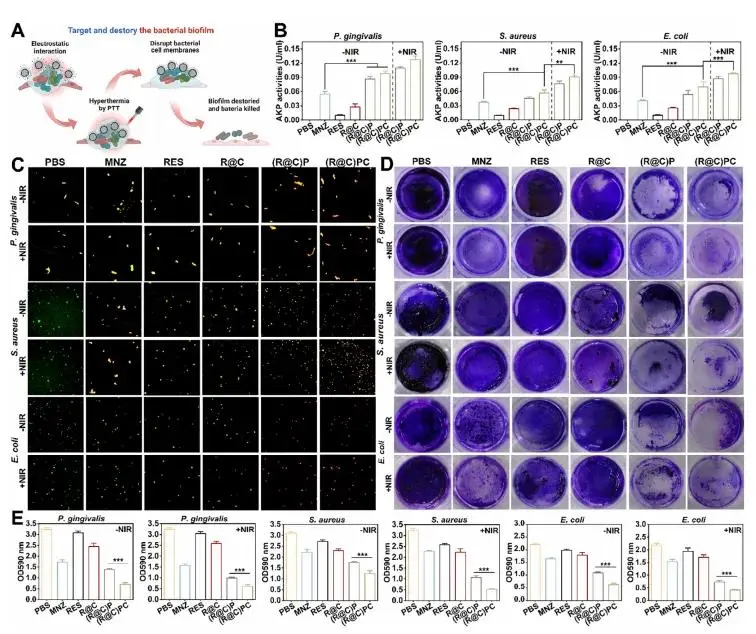
图8. (a) 纳米凝胶破坏生物膜示意图;(b) 胞外AKP活性;(c) AO/EB活/死菌荧光染色;(d) 结晶紫染色生物膜照片;(e) 生物膜OD590定量
(8)牙周炎模型的体内抗菌与抗炎治疗
(R@C)PC 用于牙周炎持续精准治疗的机制如图 9A 所示:该制剂凭借高黏附性与低流动性可长期滞留于牙周组织,从而持续作用于炎症袋。图 9B 和补充材料图 S3 显示,(R@C)PC 在牙周及牙龈区域滞留时间超过 10 min,而 (R@C)P 不足 2 min,表明 (R@C)PC 具备更佳的局部保留能力,简化了给药操作。图 9C 给出了从动物建模到治疗的体内实验流程。图 9D 中,PBS 组牙龈明显红肿,而 MNZ 与 (R@C)PC+NIR 组未见炎症表现。平板计数法结果显示(图 9E),MNZ 及 (R@C)PC+NIR 组的厌氧血平板和兼性厌氧培养基上的菌落显著少于其他各组。此外,(R@C)P 及其 NIR 组在体内疗效不及体外,滞留时间短限制了光热转换效率与药物生物利用度。综合外观与菌落计数,(R@C)PC+NIR 组疗效优于 MNZ。
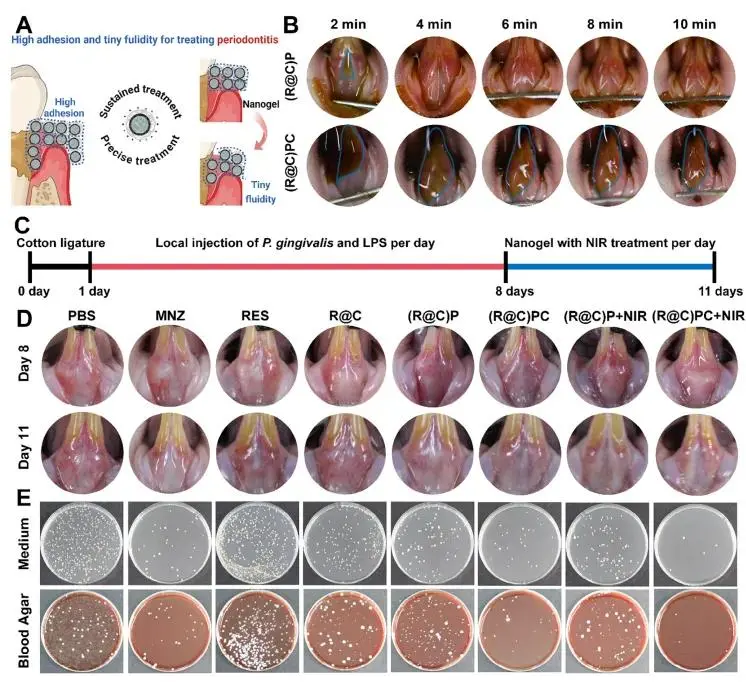
图 9. (a) 示意图:展示 (R@C)PC 通过高黏附与低流动性在牙周袋内实现持续精准治疗。 (b) 滞留时间实验。(c) 动物实验流程图。 (d) 牙龈大体照片。 (e) 平板计数结果
为全面评估牙周组织炎症反应,研究者进行了 H&E 染色。图 10A 显示,PBS 组牙龈组织内炎症细胞密集,血管扩张伴大量红细胞,成纤维细胞减少且排列紊乱;而 MNZ、(R@C)PC 及 (R@C)PC+NIR 组炎症细胞显著减少,成纤维细胞增多,提示炎症程度降低,与图 9E 灭菌结果一致。研究者进一步通过免疫组化检测牙周组织中 IL-6、TNF-α、IL-10 与 TGF-β 的表达。图 10B 显示,MNZ、(R@C)PC 及 (R@C)PC+NIR 组促炎因子 IL-6 与 TNF-α 阳性细胞显著少于其他组,表明其具备强大抗炎能力。相反,图 10C 中 (R@C)PC+NIR 组抗炎因子 IL-10 与 TGF-β 阳性细胞最多,提示该治疗可通过重塑免疫微环境显著降低炎症,其抗炎因子表达水平高于 MNZ 组,归因于 (R@C)PC+NIR 集免疫调节、ROS 清除与杀菌于一体的多功能治疗策略。
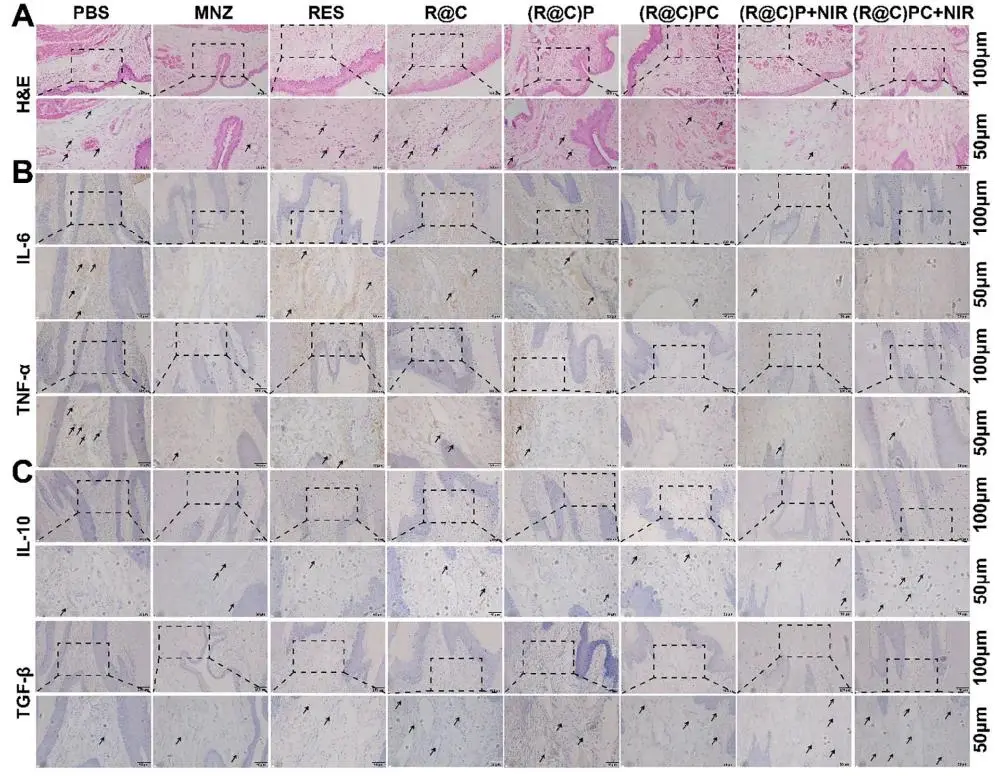
图10. (a) 牙周组织H&E染色炎症细胞浸润;(b) IL-6/TNF-α免疫组化棕色阳性细胞;(c) IL-10/TGF-β免疫组化棕色阳性细胞
本研究以牙周炎的核心病理环节——细菌感染、氧化应激及免疫失衡为主线,设计并构建了一种可注射、高黏附、低流动的多功能纳米凝胶 (R@C)PC。其核心由无定形白藜芦醇(RES)-酪蛋白(CAS)纳米胶束经聚多巴胺(PDA)包覆后再与壳聚糖季铵盐(CSQ)氢键交联而成,兼具光热杀菌、ROS 清除、巨噬细胞极化调控及生物膜破坏等多重功能。 体外实验显示,(R@C)PC 在 1.5 W cm⁻² 808 nm NIR 照射下 10 min 即可升至 59 °C,光热转换效率达 48 %;同时可完全杀灭 10⁸ CFU mL⁻¹ 的 P. gingivalis、S. aureus 与 E. coli,并显著抑制 10⁹ CFU mL⁻¹ 生物膜。抗氧化测试中,(R@C)PC 的 ABTS、FRAP、DPPH 清除率均优于游离药物及同类纳米平台,且 NIR 照射可进一步促进 RES 释放与 ROS 清除。RAW264.7 巨噬细胞实验证实,(R@C)PC 可高效抑制 LPS 诱导的 ROS、NO、IL-6 与 TNF-α 表达,并上调 IL-10、TGF-β,实现 M1→M2 极化;L929 成纤维细胞划痕实验表明其在氧化环境下仍能促进细胞迁移。生物相容性评价显示,(R@C)PC 对红细胞、鸡胚绒毛尿囊膜及小鼠主要脏器均无显著毒性。体内牙周炎小鼠模型中,(R@C)PC 在牙周袋内滞留时间 > 10 min,显著优于 (R@C)P;一次给药联合 10 min NIR 照射即可使牙龈红肿及菌落计数恢复至接近健康水平,组织学证实炎症细胞显著减少,成纤维细胞增多,且 IL-6、TNF-α 表达下调,IL-10、TGF-β 上调。 综上,(R@C)PC 通过整合光热-化学-免疫三重机制,为牙周炎提供了一种无需反复注射、安全高效的“一站式”治疗策略,具有广阔的临床转化前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

