
皮肤伤口在正常情况下可自然愈合,但糖尿病患者的伤口愈合速度较慢,且出现感染、坏疽等并发症的风险较高。糖尿病引发的慢性高血糖会对皮肤伤口环境的病理生理产生复杂影响,如伤口组织常处于持续炎症状态,促炎的M1型巨噬细胞增多,产生过量促炎细胞因子抑制组织再生;会损害伤口组织的血管生成能力,导致慢性缺血和缺氧,延缓伤口恢复;还会降低伤口部位皮肤组织的屏障功能,抑制白细胞的募集和杀菌功能,增加持续感染风险。
目前的糖尿病伤口治疗方法,如高压氧舱、伤口冲洗和抗生素治疗等,在临床实践中疗效不足且副作用不可忽视。因此,迫切需要新的伤口护理技术,以实现糖尿病伤口组织的可持续供氧、炎症逆转及局部微生物感染抑制。

针对上述问题,重庆大学罗忠/胡燕教授团队提出了一种活体微生态微针贴片(LMMP),它能够缓解感染性糖尿病伤口(IDW)部位的缺氧问题,同时减轻过度炎症和微生物感染。通过席夫碱反应将改性的羧甲基壳聚糖(CMC)与氧化透明质酸(OHA)交联,生成柔性片状水凝胶基质;随后通过聚合物浇铸,使小球藻(Chl)整合的微针通过甲基丙烯酸酐改性透明质酸(HAMA)-Chl混合物的光交联作用形成在水凝胶贴片上,实现了小球藻的稳定锚定。LMMP能够无痛地刺穿表层并稳定附着在伤口组织上,通过基于光合作用的局部氧合作用,同时抑制慢性炎症和微生物感染,以微创的方式促进伤口的微环境重塑,从而显著加速IDW的愈合。该文章于2025年6月3日以《Living Microecological Microneedle Patches Enable Proregenerative Microenvironmental Remodeling for Promoting Infected Diabetic Wound Healing》为题发表于《ACS Nano》(DOI:10.1021/acsnano.5c05381)。
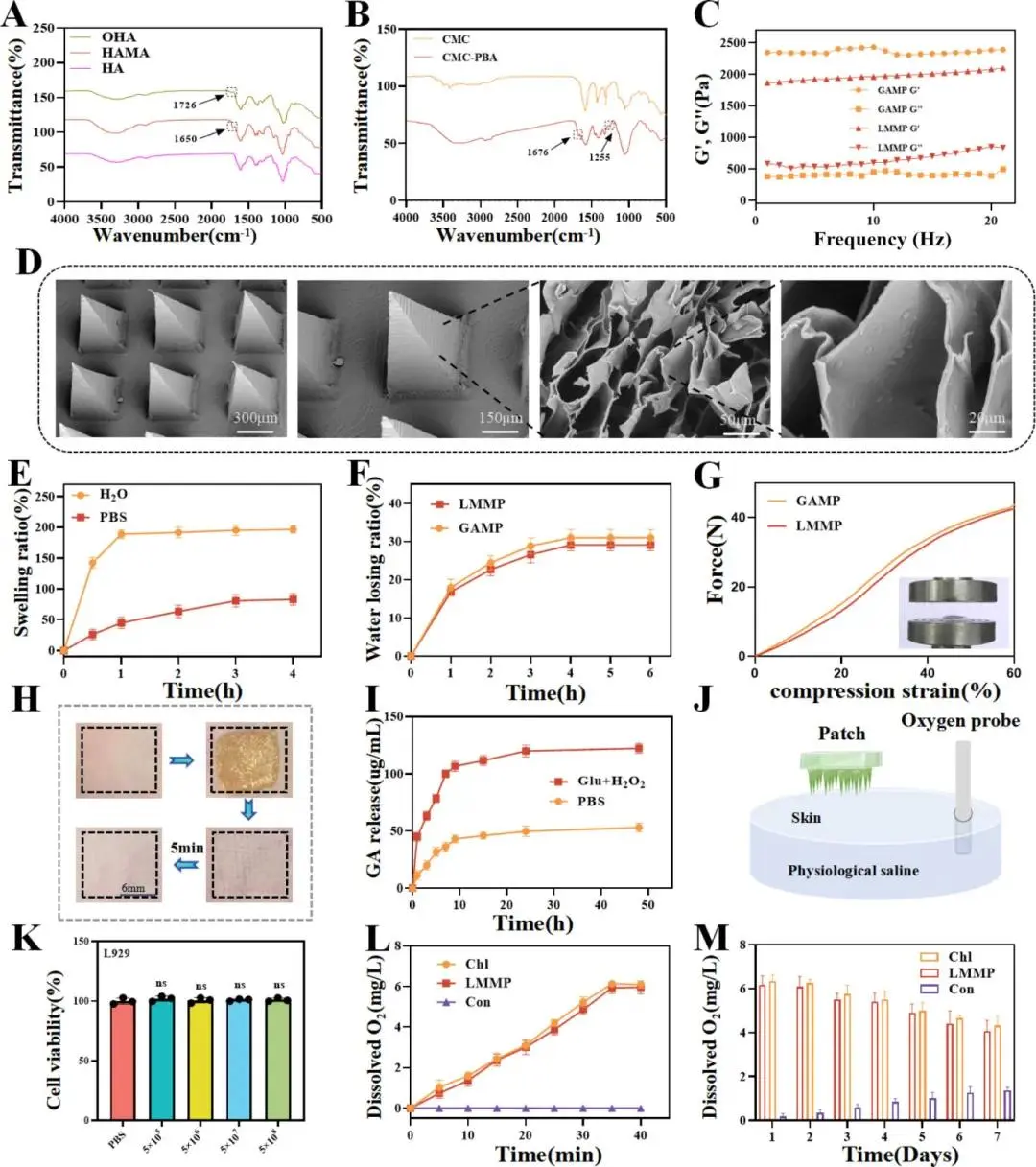
图1. LMMP的合成过程及感染性糖尿病伤口(IDW)治疗机制示意图
(1)LMMP 的制备与表征
LMMP系统由OHA-CMC水凝胶基底与HAMA微针阵列构成:CMC-GA经PBA介导的硼酸酯接枝后与OHA席夫碱交联形成基底;甲基丙烯酸改性透明质酸(HAMA)经紫外光固化在棱锥模具内成型为微针阵列,锚定于基底并物理包封小球藻。FT-IR确认HAMA、OHA、CMC-GA合成完成(图2A、B)。SEM显示微针呈四棱锥形,基底边长320 μm、高640 μm,针内颗粒平均8 μm,证实小球藻整合(图2D)。流变学测试显示0.1–10 rad/s内G'>G'',表明基底具备类凝胶机械稳定性(图2C)。GAMP在去离子水及PBS中4 h溶胀率≈200%,含水率≈70%;30 °C开放环境4 h脱水率≈30%,LMMP与GAMP无显著差异(图2E、F)。力-位移曲线表明60%压缩下,LMMP与GAMP针尖力分别为0.34 N与0.32 N,可完整穿透小鼠皮肤,移除后腔道5 min内消失(图2G、H)。在含16.7 mM葡萄糖+200 μM H₂O₂的模拟IDW液中,LMMP 10 h GA释放量较PBS提高200%,证实硼酸酯连接的IDW响应释放(图2I)。
(2)LMMP 介导的产氧能力评估
小球藻浓度5×10⁸个/mL光照后溶液氧水平达6.3 mg/L,5×10⁷个/mL时为4.2 mg/L,故LMMP采用5×10⁸个/mL浓度(图2J)。L929和HUVEC与小球藻共孵育后细胞活力无变化(图2K)。LMMP与等量小球藻产氧量无显著差异,表明整合过程不影响光合活性(图2L)。LMMP在仿生缓冲液中持续光照,前4天氧浓度≈6 mg/L,随后降至≈5 mg/L(图2M)。

图2. LMMP 的制备与表征。(A)OHA和HAMA的傅里叶变换红外光谱。(B)CMC-PBA的傅里叶变换红外光谱。(C)GAMP和LMMP在37°C下的储能模量(G')和损耗模量(G'')。(D)LMMP的扫描电子显微镜图像。(E)LMMP在水和PBS中孵育后的溶胀率。(F)GAMP和LMMP在30°C下的脱水率。(G)GAMP和LMMP的拉伸应力-应变曲线。(H)LMMP在小鼠皮肤上的处理效果及移除后皮肤恢复的图像分析。(I)在模拟IDW条件下LMMP中GA的释放曲线。(J)氧合测量过程的示意图。(K)不同浓度Chl孵育后L929细胞的存活率变化。(L)光刺激下LMMP介导的氧气生成。(M)不同样品产氧能力的时间依赖性变化
(3)LMMPs 的体外抗菌能力评估
MP对大肠杆菌、铜绿假单胞菌、MRSA、白色念珠菌的抑制率分别为46%、47%、48%、47%;GAMP因GA的加入抑制率均显著升高;小球藻单独作用产生轻微抑制。LMMP在上述四种病原体中的存活率分别降至7%、6%、7%、5%,CLSM活/死染色与显微图像证实其细胞壁破裂、胞质外泄(图3A–G)。结晶紫定量显示,在生物膜条件下,LMMP+光照对四种病原体的存活率分别为10%、9%、8%、8%(图3H–L)。
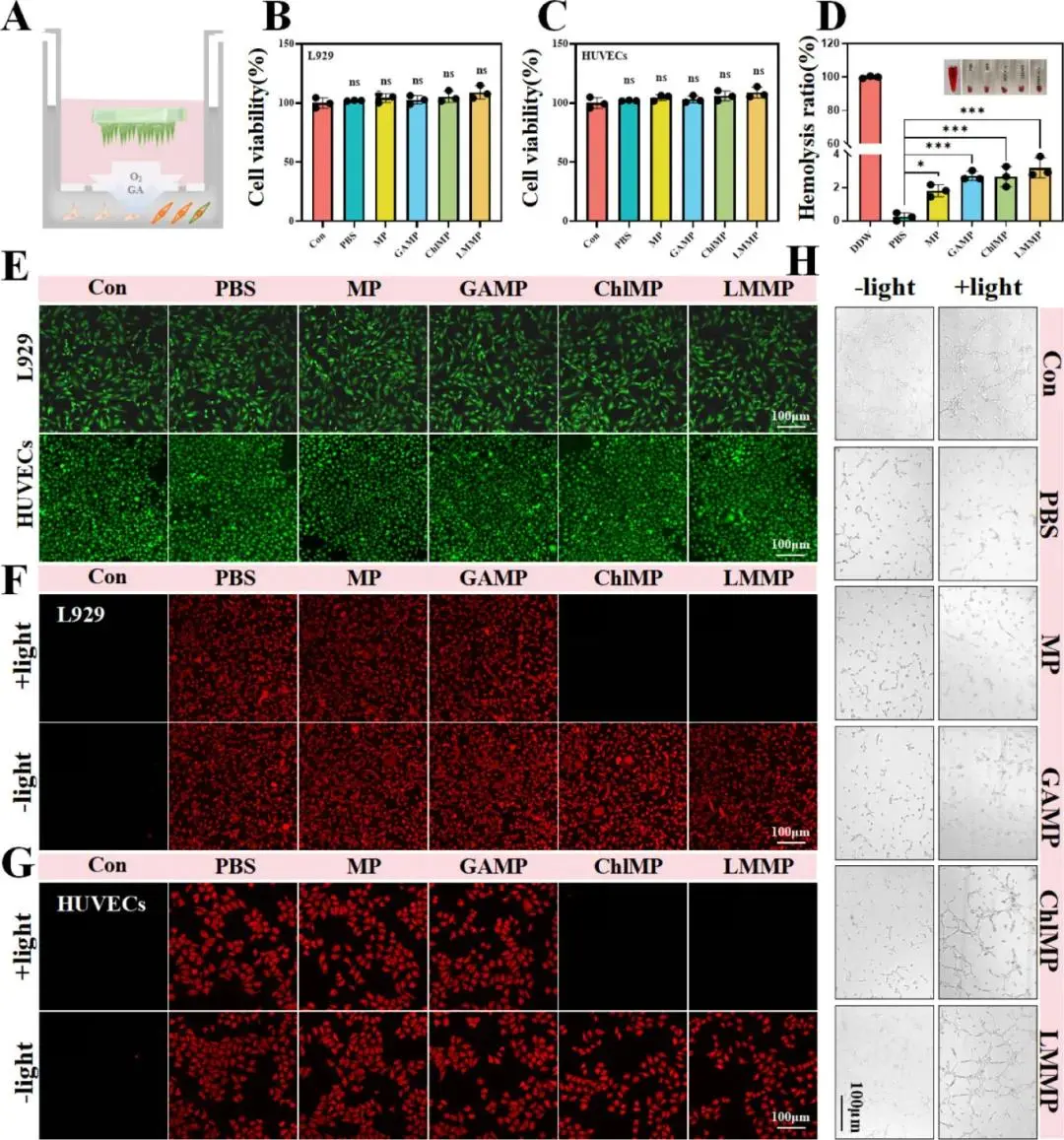
图3. LMMPs的体外抗菌能力。(A)经MP和LMMP处理4小时后,大肠杆菌、铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌和白色念珠菌的存活率。(B-E)不同处理后大肠杆菌(B)、铜绿假单胞菌(C)、耐甲氧西林金黄色葡萄球菌(D)和白色念珠菌(E)的相对微生物存活率。(F)经LMMP处理后,通过碘化丙啶(红色)和SYTO 9(绿色)染色得到的大肠杆菌、铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌和白色念珠菌的共聚焦图像。(G)不同处理后微生物形态的扫描电子显微镜图像。(H)不同处理组生物膜的结晶紫染色图像。(I-L)生物膜中微生物病原体存活情况的定量分析
(4)LMMP 的体外生物相容性分析
LMMP与L929及HUVEC共孵育6 h后,CCK-8测得细胞活力均>100%,CLSM活/死染色未见细胞死亡(图4B、C、E)。与血细胞共孵育溶血率≈3%(图4D)。
(5)LMMP 的体外微生态复氧作用
低氧(1% O₂)下,PBS、MP、GAMP组RDPP荧光持续;ChlMP与LMMP光照6 h后荧光消失,显示小球藻光合供氧(图4F、G)。LMMP光照8 h后HUVEC管状结构数量最多、分支丰富且总长最长(图5A、B);划痕与Transwell实验显示48 h后HUVEC和L929迁移面积最小、侵袭细胞最多(图5C–H)。WB证实LMMP光照显著上调HUVEC中PI3K-AKT及MAPK-ERK磷酸化(图5I–L)。黑暗条件下未见上述效应,排除单纯光照影响。
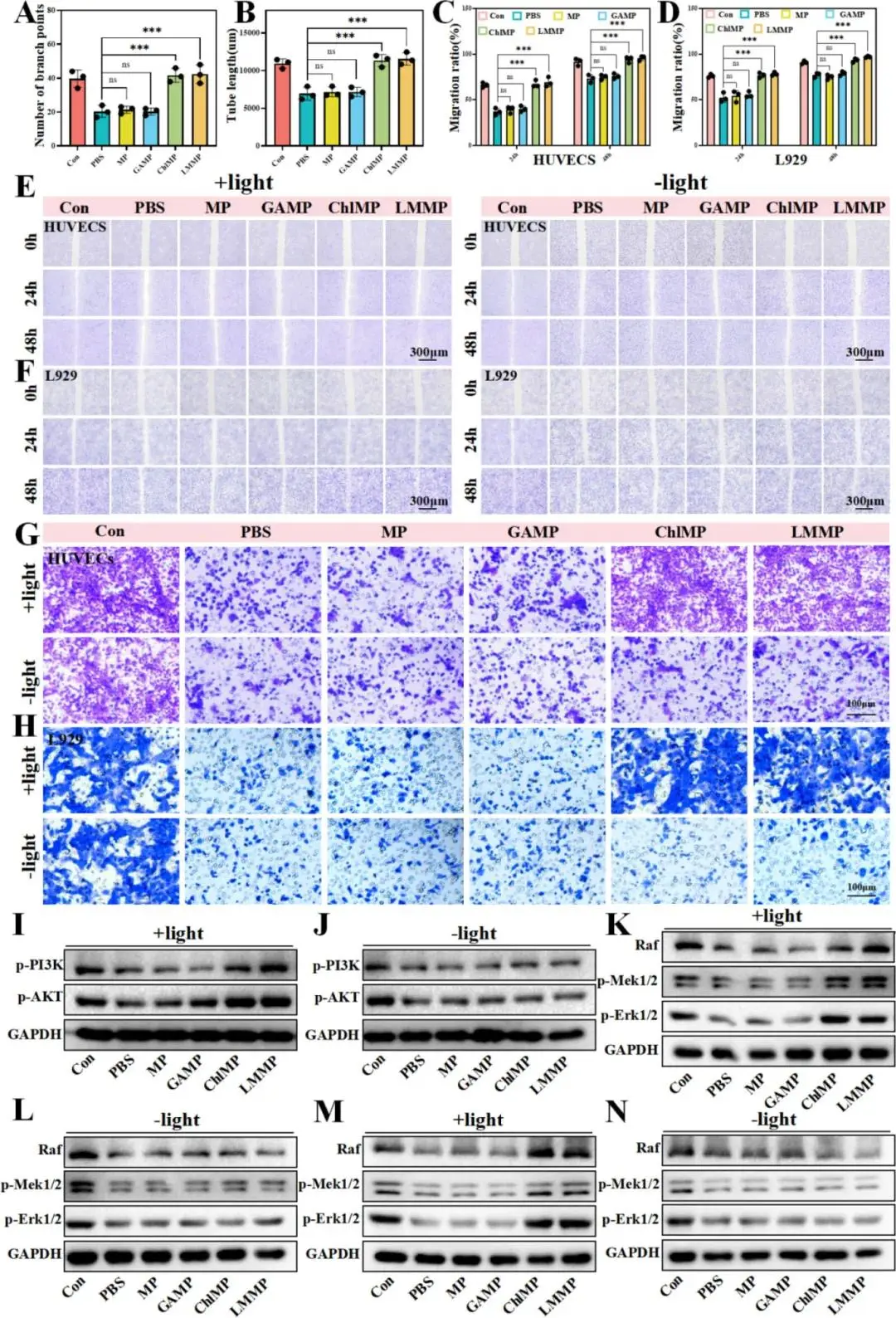
图4. LMMP的体外生物相容性及促愈合能力评估。(A)共培养模型示意图。(B)不同处理后 L929 细胞的活力。(C)不同处理后HUVECs的活力。(D)不同样品的溶血活性。(E)LMMP与L929细胞和人脐静脉内皮细胞的细胞相容性。(F)不同处理下缺氧L929细胞中的氧丰度。(G)不同处理下缺氧人脐静脉内皮细胞中的氧丰度。(H)不同处理后人脐静脉内皮细胞形成管状结构的光学成像
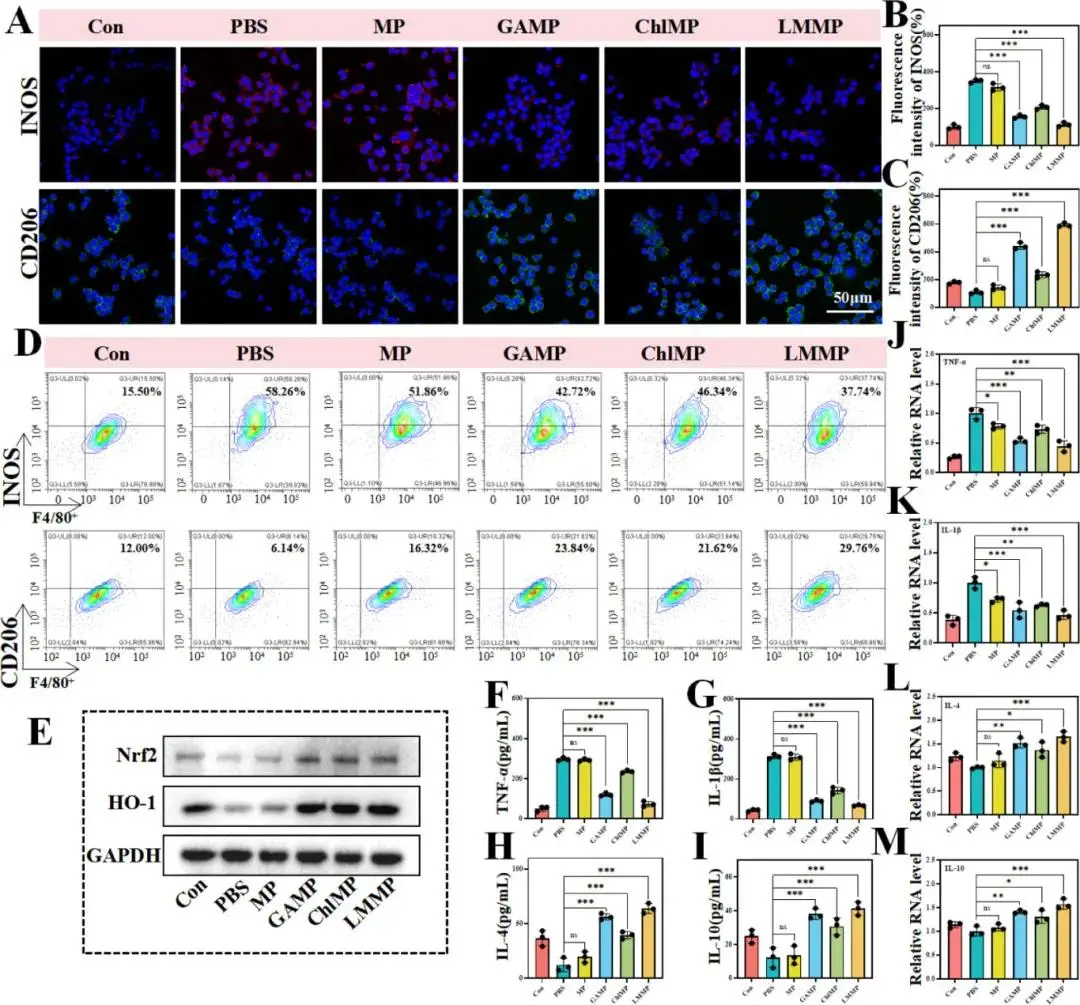
图5. LMMP在体外对内皮细胞和成纤维细胞的调控作用及潜在分子机制研究。(A、B)不同处理后人脐静脉内皮细胞(HUVECs)分支点数量(A)和管长(B)的定量分析。(C)不同处理后HUEVC迁移能力的定量分析。(D)不同处理后L929细胞迁移能力的定量分析。(E)不同处理后HUEVC迁移的光学图像。(F)不同处理后L929细胞迁移的光学图像。(G)不同处理后HUEVC的Transwell侵袭实验结果。(H)不同处理后L929细胞的Transwell侵袭实验结果。(I)不同处理(有光照)后HUEVC中p-PI3K/p-AKT激活状态的免疫印迹分析。(J)不同处理(无光照)后HUEVC中p-PI3K/p-AKT激活状态的免疫印迹分析。(K)不同处理(有光照)后HUEVC中p-Erk激活状态的免疫印迹分析。(L)不同处理(无光照)后HUEVC中p-Erk激活状态的免疫印迹分析。(M)不同处理(有光照)后L929细胞中p-Erk激活状态的免疫印迹分析。(N)不同处理(无光照)后L929细胞中p-Erk激活状态的免疫印迹分析
(5)LMMP 介导的体外抗炎效果评估
LPS诱导RAW264.7呈M1表型(iNOS⁺/CD206⁻)(图6A)。MP无显著影响;无GA的LMMP使M2比例轻度上升(图6B、C)。LMMP组M1/M2比值降至1.27(图6D),Nrf2与HO-1表达较PBS升高200%(图6E)。LMMP+光照下,TNF-α与IL-1β分别下降70%与75%,IL-4与IL-10分别升高300%与230%;ELISA与qPCR结果一致(图6F–M)。
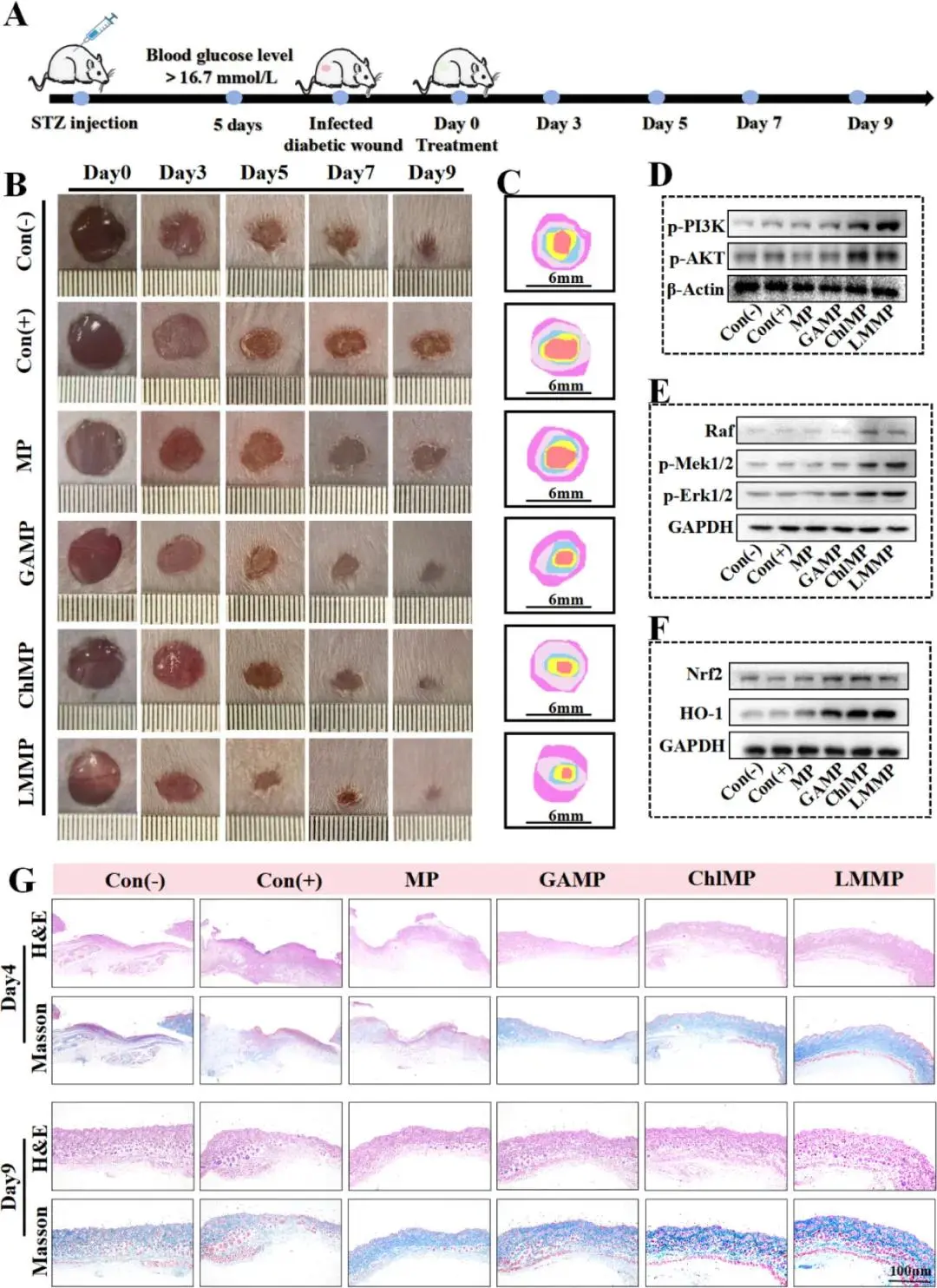
图6. LMMP的体外免疫调节效果评估。(A)RAW264.7细胞中CD206(绿色)和iNOS(红色)表达的荧光显微镜图像。(B、C)iNOS(B)和CD206(C)相对荧光强度的定量分析。(D)不同处理后M1和M2型巨噬细胞极化状态频率的流式细胞术分析。(E)不同处理后RAW264.7细胞中Nrf2和HO-1激活状态的WB分析。(F-I)RAW264.7细胞经不同处理后,TNF-α(F)、IL-1β(G)、IL-4(H)和IL-10(I)水平的ELISA结果。(J-M)RAW264.7细胞经不同处理后,TNF-α(J)、IL-1β(K)、IL-4(L)和IL-10(M)mRNA表达水平的qPCR分析
(6)LMMP 介导的IDW体内治疗效果评估
MRSA感染糖尿病小鼠模型中,9天后Con-、Con+相对伤口面积≈13%、45%,LMMP+光照组伤口基本闭合(图7B、C)。LMMP+光照4天出现密集肉芽组织与部分表皮修复,9天组织完全愈合,胶原沉积量最高(图7G)。LMMP+光照组K14连续基底细胞层与成熟K10棘层覆盖伤口;CD31荧光115.29%,高于Con+86.87%,并上调VEGFA、激活PI3K-AKT、MAPK-ERK通路(图8A–E,7D–E)。Nrf2-HO-1激活,iNOS下调90%、CD206上调500%,TNF-α与IL-1β mRNA降低,IL-4与IL-10 mRNA升高(图8F–L,7F)。

图7. LMMP介导的IDW愈合的体内分析。(A)在ICR小鼠模型上评估LMMP效果的实验设置示意图。(B)9天内不同处理后的伤口随时间变化的闭合情况。(C)在第0、3、5、7和9天不同处理后的伤口愈合进程。(D)不同处理后IDW组织中p-PI3K/p-AKT激活状态的免疫印迹分析。(E)不同处理后IDW组织中MAPK-ERK1/2激活状态的免疫印迹分析。(F)不同处理后IDW组织中Nrf2-HO-1激活状态的免疫印迹分析。(G)第4天和第9天受伤皮肤的H&E染色和马松三色染色结果
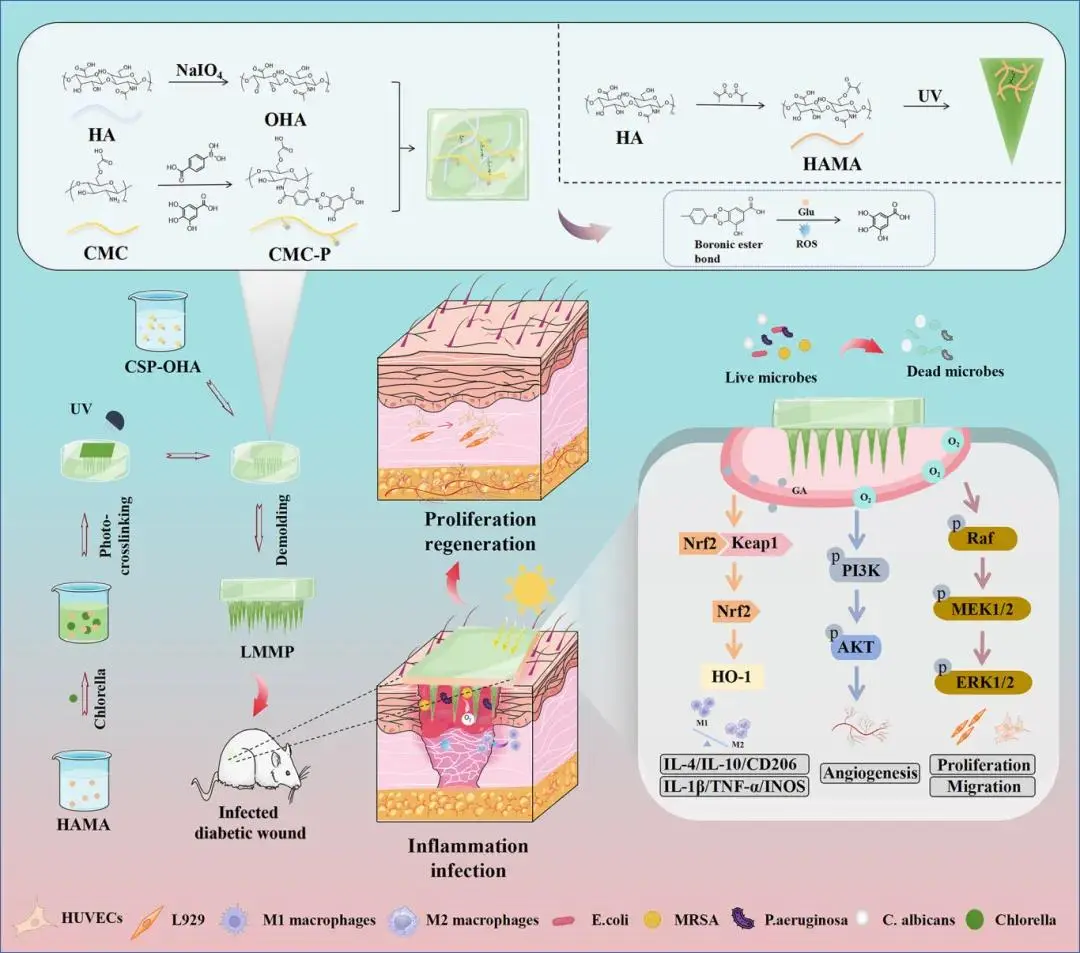
图8. LMMP加速IDW愈合的体内机制研究。(A)不同处理后IDW组织中细胞角蛋白10(K10,绿色)和细胞角蛋白14(K14,红色)的免疫荧光染色结果。(B)不同处理后IDW组织中CD31的免疫染色结果。(C)不同处理后IDW组织中iNOS和CD206的免疫荧光染色结果。(D、E)细胞角蛋白14(D)和细胞角蛋白10(E)的定量分析结果。(F)CD31表达的定量分析结果。(G、H)iNOS(G)和CD206(H)表达的定量分析结果。(I-L)不同处理后IDW组织中TNF-α(I)、IL-1β(J)、IL-4(K)和IL-10(L)分泌水平的相对表达量
该研究开发了一种活体微生态微针贴片(LMMP),其能够通过重塑促再生微环境,有效加速感染性糖尿病伤口(IDW)的愈合。LMMP 采用简便的聚合物浇铸法制备而成,当贴附于IDW表面时,其中的小球藻可在水凝胶介导的持续大气二氧化碳供应下,借助光合作用高效产氧,从而以可持续的方式为缺氧的伤口组织复氧,成功克服糖尿病相关的抗愈合应激。LMMP所增加的氧气供应能激活内皮细胞中的PI3K-AKT和MAPK-ERK信号通路,促进伤口血管生成。同时,通过激活MAPK-ERK信号,可增强成纤维细胞的迁移与增殖能力。另一方面,IDW微环境中升高的活性氧应激和高血糖信号会触发水凝胶片基底按需释放没食子酸(GA),GA能激活伤口驻留的促炎性M1型巨噬细胞中的Nrf2-HO-1信号,促使其向M2型极化,进而缓解IDW部位的慢性炎症。此外,羧甲基壳聚糖(CMC)、GA与小球藻成分协同作用,可清除局部病原微生物,预防糖尿病伤口感染。该研究为临床治疗难愈性IDW提供了一种基于活体微生态的新方法。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

