
炎症性肠病(IBD)是一种累及全球数百万人的慢性肠道炎性疾病,其发病机制与肠黏膜屏障受损、菌群失衡及过激免疫反应密切相关。传统口服药物(5-氨基水杨酸、激素、免疫抑制剂等)因全身分布难以精准靶向病灶,长期使用感染与肿瘤风险增加,急需能够实现炎症部位精准递送并兼顾菌群调控与抗氧化保护的新型治疗策略。
针对上述问题,浙江大学鲜于运雷团队以天然螺旋藻(SP)为微纳机器人骨架,将携带金铈纳米酶(AuCe)的益生菌植物乳杆菌(LP)共组装成口服递送系统SP@LP@AuCe。该微纳机器人利用SP的螺旋形态、生物相容性和叶绿素自发荧光,实现胃酸保护、炎症部位长时滞留及实时成像;同时AuCe清除ROS、保护益生菌活性,LP重塑菌群并诱导巨噬细胞向抗炎表型极化,协同修复肠屏障、抑制炎症因子,最终恢复肠道微生态平衡,为IBD的精准与个性化治疗提供了新平台。该文章于2025年8月5日以《A Microalgae-Probiotic-Nanozyme Robot for Alleviating Intestinal Inflammation and Microbiota Dysbiosis》为题发表于《Advanced Materials》(DOI:: 10.1002/adma.202508754)。
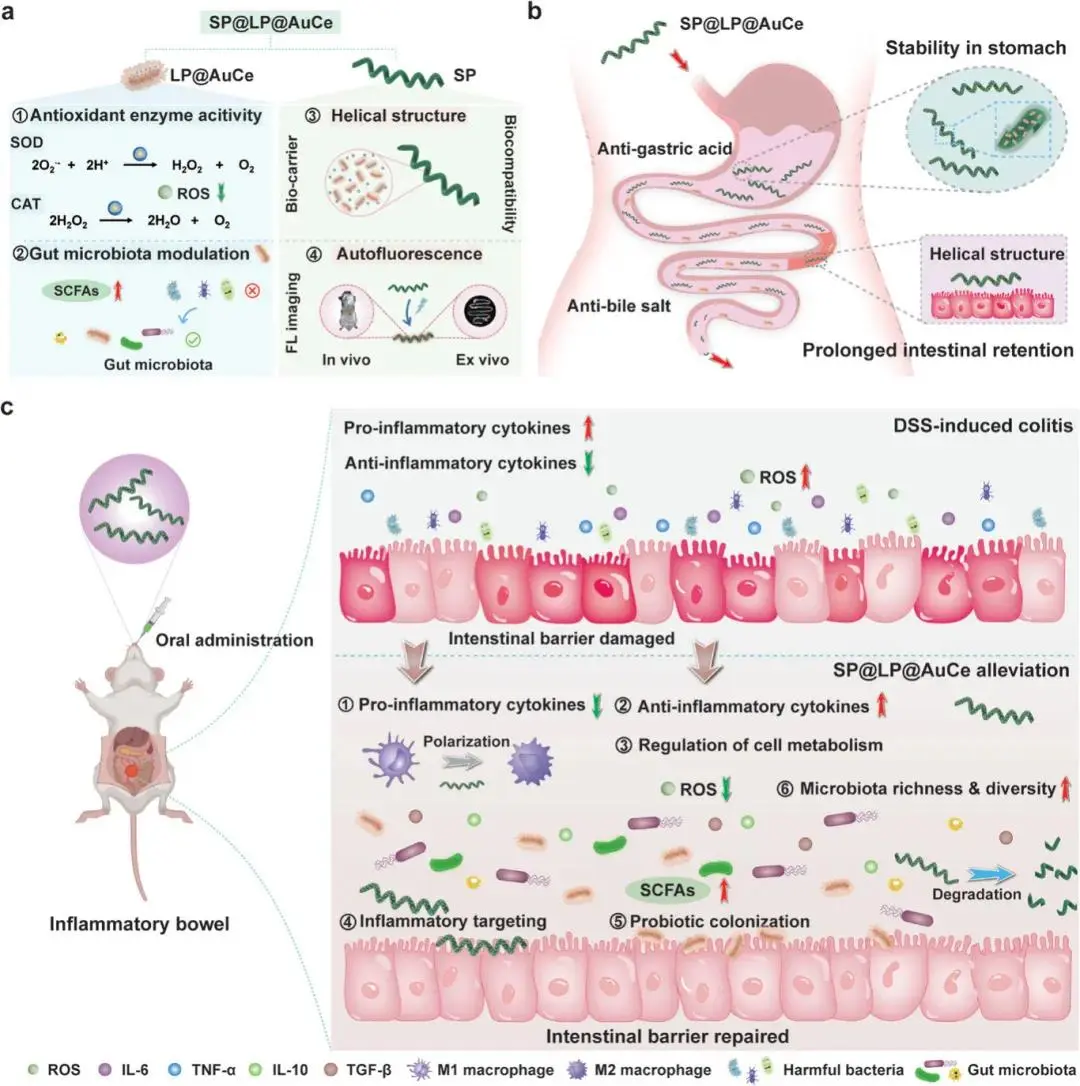 研究示意图
研究示意图
(1)SP@LP@AuCe的合成与表征
AuCe纳米酶呈核-壳球形,平均直径22 nm(图1a)。LP@AuCe生物复合体中,AuCe均匀分布于LP表面,C、N、O、P、Au、Ce元素共定位(图1b–d)。50 µg mL⁻¹ AuCe与10⁸ CFU mL⁻¹ LP为最佳配比,该条件下LP生长曲线与对照无差异,表明AuCe对菌活性影响可忽略(图1e)。SP@LP@AuCe显微呈绿色,自发红色荧光;FITC-LP(绿)与SP(红)共定位,证实复合体形成(图1f–i)。UV–vis、FTIR光谱显示SP光学性质及结构保持不变(图1j,k)。动态光散射测得AuCe、LP、LP@AuCe、SP、SP@LP@AuCe水合粒径依次为20.91 nm、1.64 μm、2.04 μm、4.59 μm、5.25 μm;ζ电位-38.64 mV(SP)与4.58 mV(LP@AuCe)证实静电吸附(图1l,m)。AuCe对LP包覆率95.04%,LP@AuCe对SP包封率64.45%。SP@LP@AuCe对O₂•⁻清除率>60%,H₂O₂分解活性最高,协同SP自身抗氧化组分,总体SOD-与CAT-样活性优于AuCe单独体系(图1n,o)。
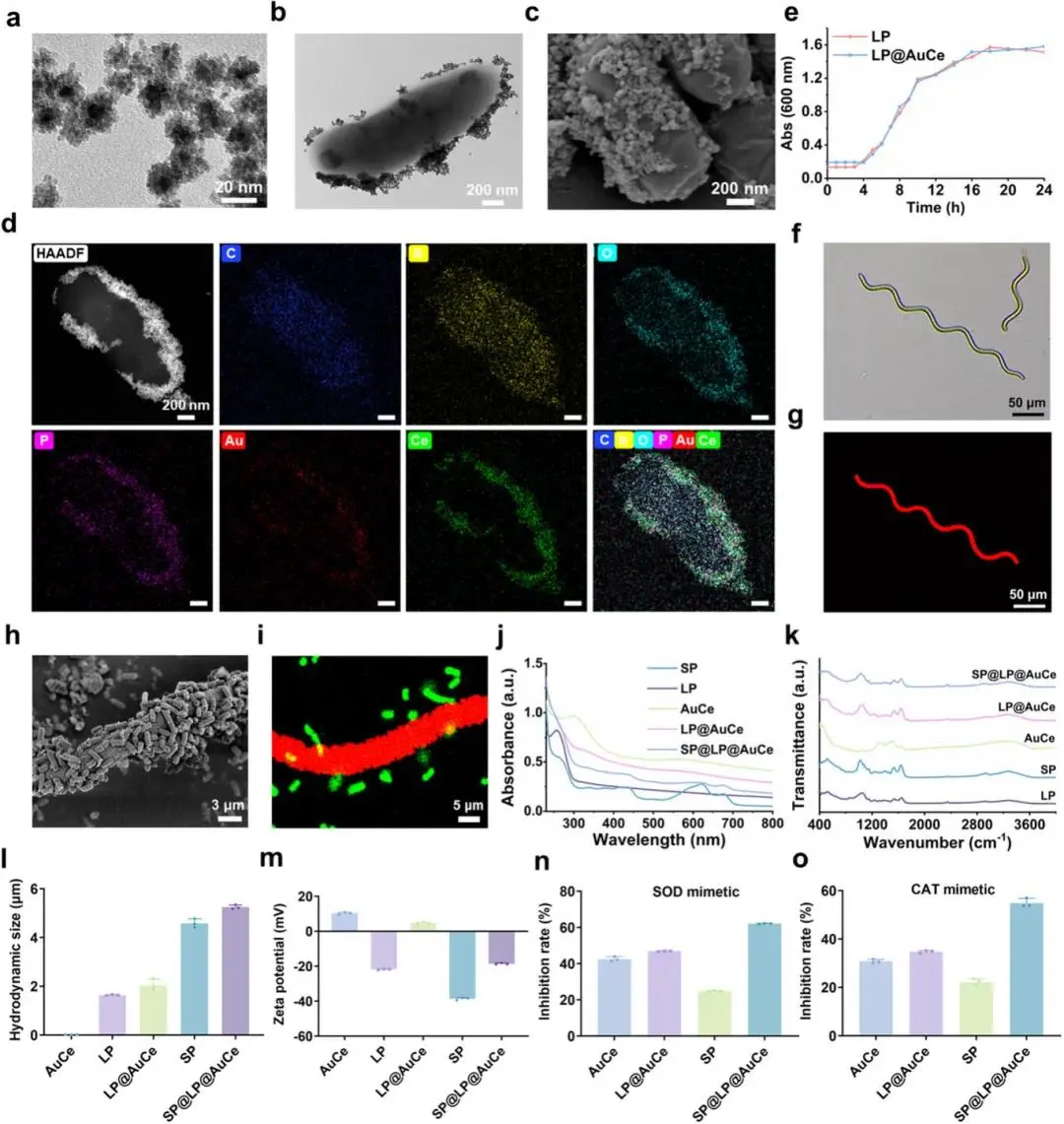
图1 SP@LP@AuCe的表征。(a)AuCe的TEM图像;(b)LP@AuCe的TEM图像;(c)LP@AuCe的SEM图像;(d)LP@AuCe的HAADF-STEM图像及元素分布图;(e)LP与LP@AuCe的生长曲线;(f)SP的明场图像;(g)SP的荧光图像;(h)SP@LP@AuCe的SEM图像;(i)SP@LP@AuCe的CLSM图像;(j)LP、SP、AuCe、LP@AuCe与SP@LP@AuCe的UV–vis光谱;(k)LP、SP、AuCe、LP@AuCe与SP@LP@AuCe的FTIR光谱;(l)AuCe、LP@AuCe、SP与SP@LP@AuCe的水合粒径;(m)AuCe、LP@AuCe、SP与SP@LP@AuCe的ζ电位;(n)AuCe、LP@AuCe、SP与SP@LP@AuCe的SOD活性;(o)AuCe、LP@AuCe、SP与SP@LP@AuCe的CAT活性
(2)SP@LP@AuCe 的环境耐受性和体内生物分布
SP@LP@AuCe经SGF、SIF、SCF处理后保留>80%原始SOD-及CAT-活性(图2a–f);SP形态未变,SEM证实螺旋结构完整,LP与AuCe仍附着其表面(图2g)。经上述模拟液孵育后,SP@LP@AuCe内LP存活率显著高于LP及LP@AuCe组(图2h–k)。在氧化应激条件下,LP@AuCe清除ROS并协同SP提升LP存活与增殖(图2l–n)。DLS及ζ电位在模拟液前后几乎不变,表明整体稳定性(图2o)。体内荧光成像显示SP@LP@AuCe口服后1 h达峰,24 h清除;离体成像示30 min在胃、4 h至回肠/盲肠/结肠、8 h开始减弱,心肝脾肺肾膀胱无信号(图2p)。FITC标记显示SP@LP@AuCe较游离FITC-LP在小肠保留时间更长,8 h仍可见,24 h微弱;菌落计数证实8 h结肠LP留存量显著升高。
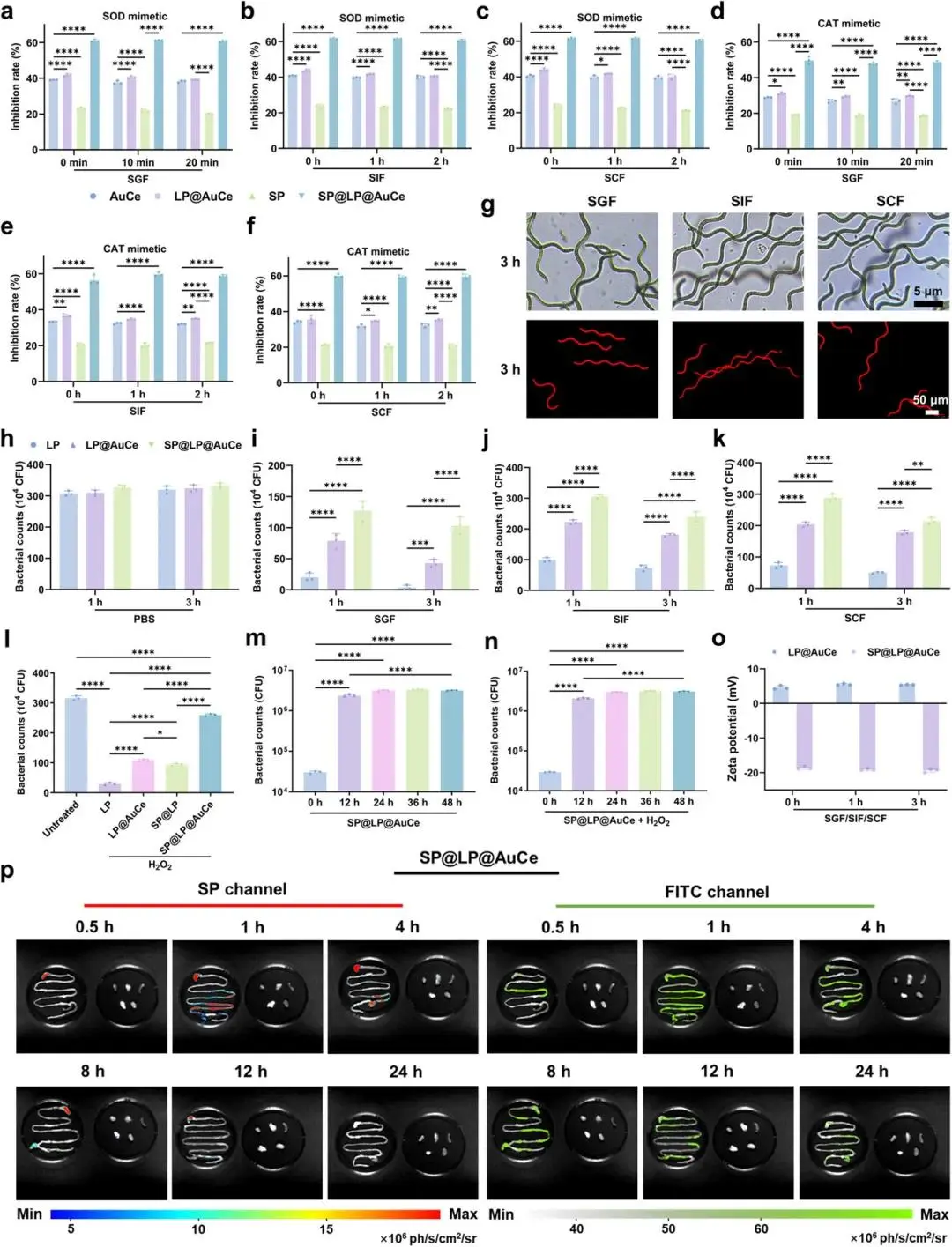
图2 SP@LP@AuCe的环境耐受与体内分布。(a–c)AuCe、LP@AuCe、SP及SP@LP@AuCe在SGF、SIF、SCF中的SOD活性;(d–f)同组样品在上述模拟液中的CAT活性;(g)SP经SGF、SIF、SCF处理后的明场与荧光图像;(h–k)LP、LP@AuCe及SP@LP@AuCe分别暴露于PBS、SGF、SIF、SCF后的活菌计数;(l)200 µM H₂O₂中不同组LP 2 h存活率;(m)无氧化应激及(n)200 µM H₂O₂存在下SP@LP@AuCe内LP的增殖曲线;(o)LP@AuCe与SP@LP@AuCe在模拟胃肠液中不同时间点的ζ电位;(p)小鼠灌胃SP@LP@AuCe后不同时间点离体胃肠道及主要器官(心、肝、脾、肺、肾)荧光成像(SP通道:Ex 605 nm/Em Cy5;LP通道:Ex 460 nm/Em FITC)
(3)体外抗氧化活性和抗炎作用
RAW264.7细胞经LPS诱导氧化应激后,SP@LP@AuCe处理组胞内ROS水平显著降低,流式及共聚焦均显示绿色荧光强度低于其余组(图3b–e)。SP@LP@AuCe降低MDA与MPO,提高CAT、SOD活性,恢复GSH水平与GSH/GSSG比值(图3f,g)。ELISA显示其下调IL-6、TNF-α并上调IL-10、TGF-β(图3h–k)。流式示CD86⁺ M1比例下降46.1%,CD206⁺ M2比例上升25.17%(图3l–n);免疫荧光示CD206红色信号增强。细胞毒性实验表明SP@LP@AuCe在24 h及48 h内细胞活力接近100%。
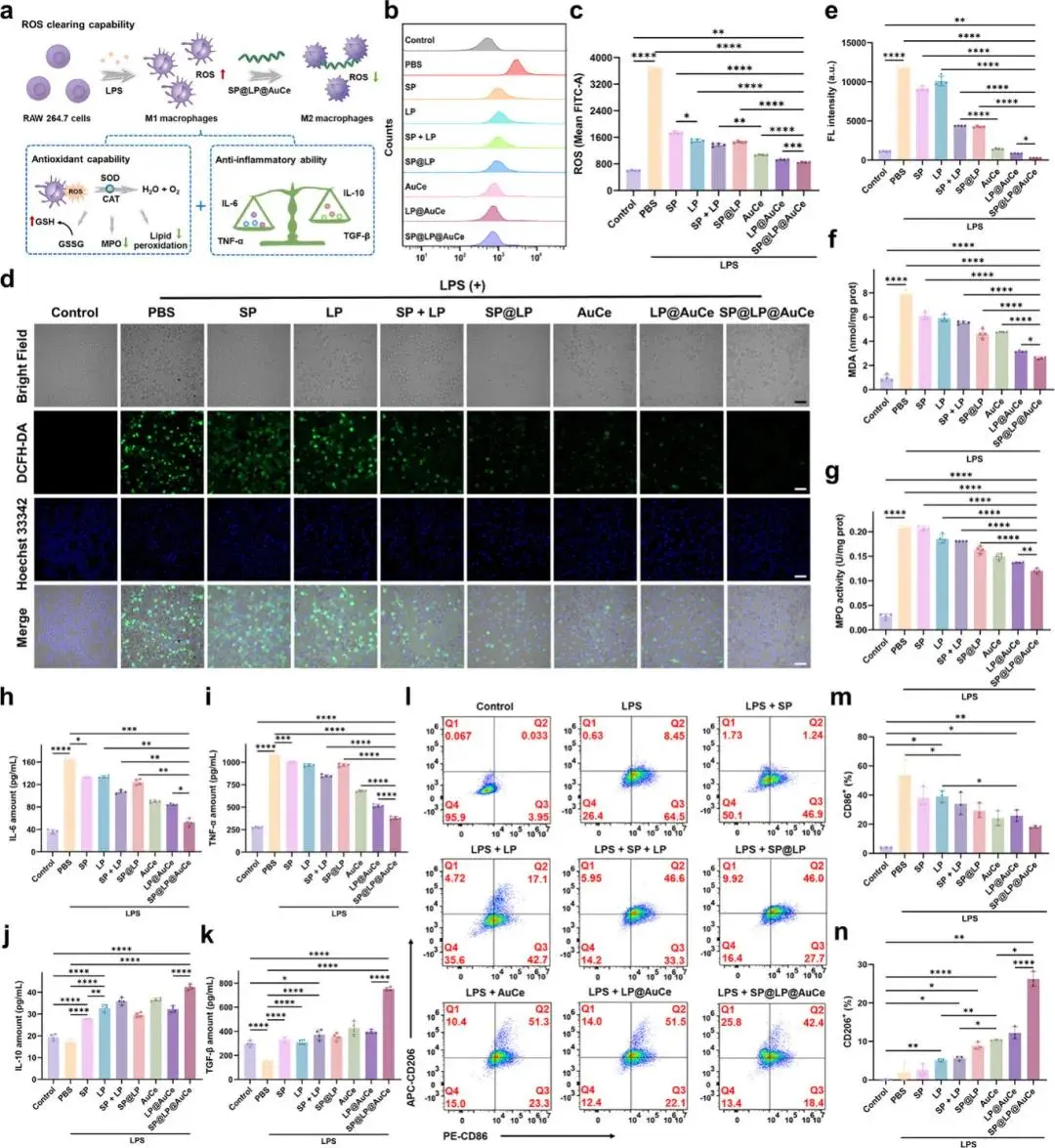
图3 体外抗氧化与抗炎性能。(a)细胞水平抗氧化及抗炎作用示意图;(b)DCFH-DA染色RAW264.7细胞的流式分析;(c)不同处理后胞内ROS荧光强度定量;(d)DCFH-DA(绿)与Hoechst 33342(蓝)共染的共聚焦图像;(e)绿色荧光强度统计;(f)不同处理后细胞MDA含量;(g)不同处理后细胞MPO活性;(h–k)不同处理后RAW264.7细胞分泌的IL-6、TNF-α、IL-10及TGF-β水平;(l)不同处理后RAW264.7细胞CD86/CD206表达的流式分析及其(m)CD86、(n)CD206的定量统计
(4)SP@LP@AuCe 对 DSS 诱导的小鼠结肠炎的治疗作用
DSS诱导的IBD小鼠模型中,SP@LP@AuCe组体重下降最小、DAI最低(图4b,c);结肠长度与对照相当,显著长于DSS组,脾指数最低(图4d–f)。DCFH-DA示该组结肠ROS水平最低(图4g,h)。
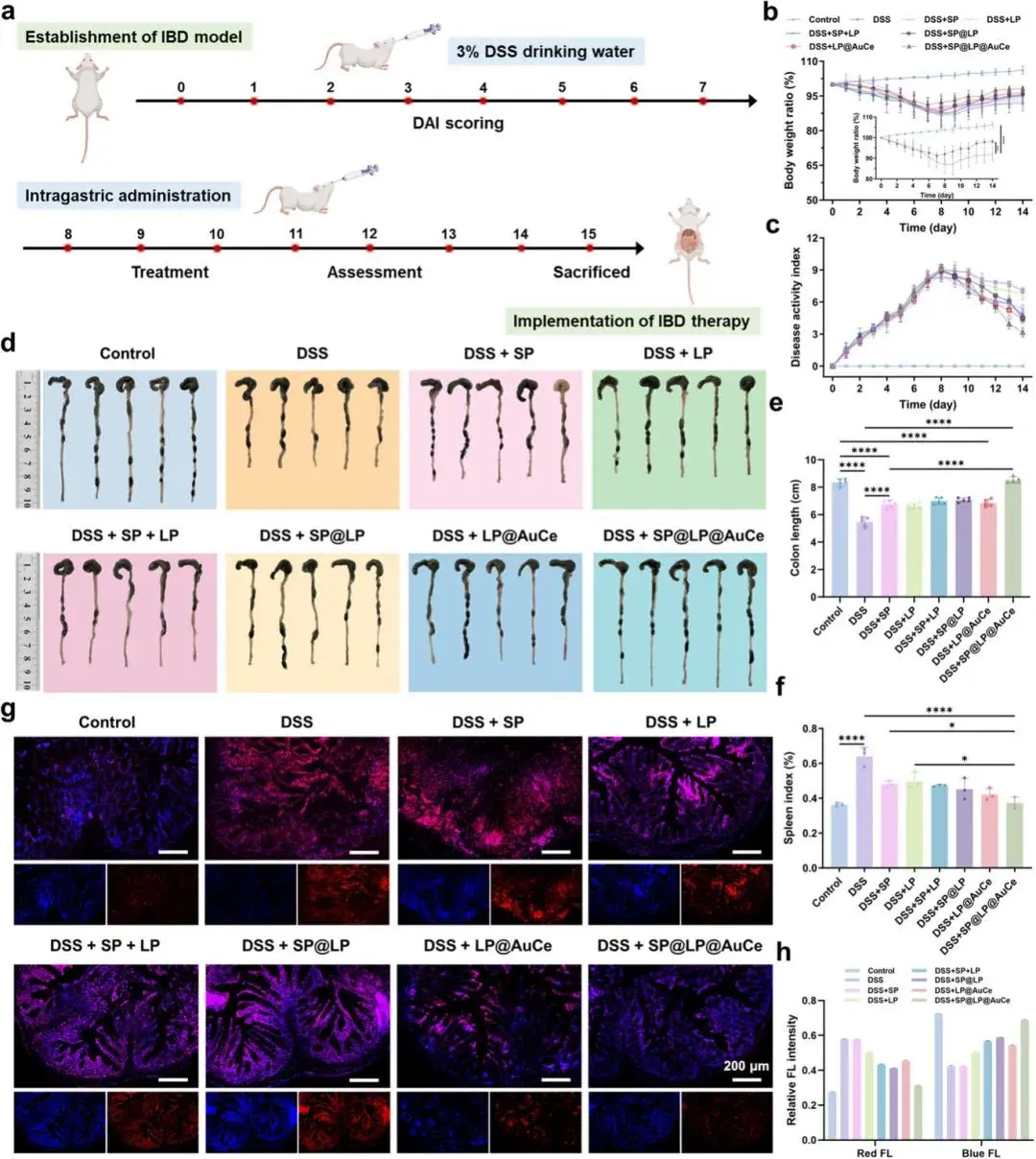
图4 DSS诱导小鼠结肠组织学评估。(a)不同组结肠H&E染色及放大图(b)不同组结肠IL-6、TNF-α、IL-10、TGF-β免疫组化染色;(c)不同组H&E切片结肠组织学损伤评分;(d–g)不同组结肠IL-6、TNF-α、IL-10、TGF-β定量;(h,i)ELISA定量不同组结肠occludin与ZO-1表达;(j)ELISA定量不同组血清DAO水平;(k–n)不同组结肠组织GSH活性、SOD活性、MDA含量与MPO活性
H&E示DSS组隐窝破坏、大量炎性浸润,SP@LP@AuCe组结构完整,组织学评分最低(图5a,c)。免疫组化示SP@LP@AuCe下调IL-6、TNF-α并上调IL-10、TGF-β(图5b,d–g)。ELISA示该组occludin、ZO-1表达升高,血清DAO降低(图5h–j)。氧化应激指标中,GSH、SOD升高,MDA、MPO下降(图5k–n)。主要器官H&E及血常规、生化指标无异常。
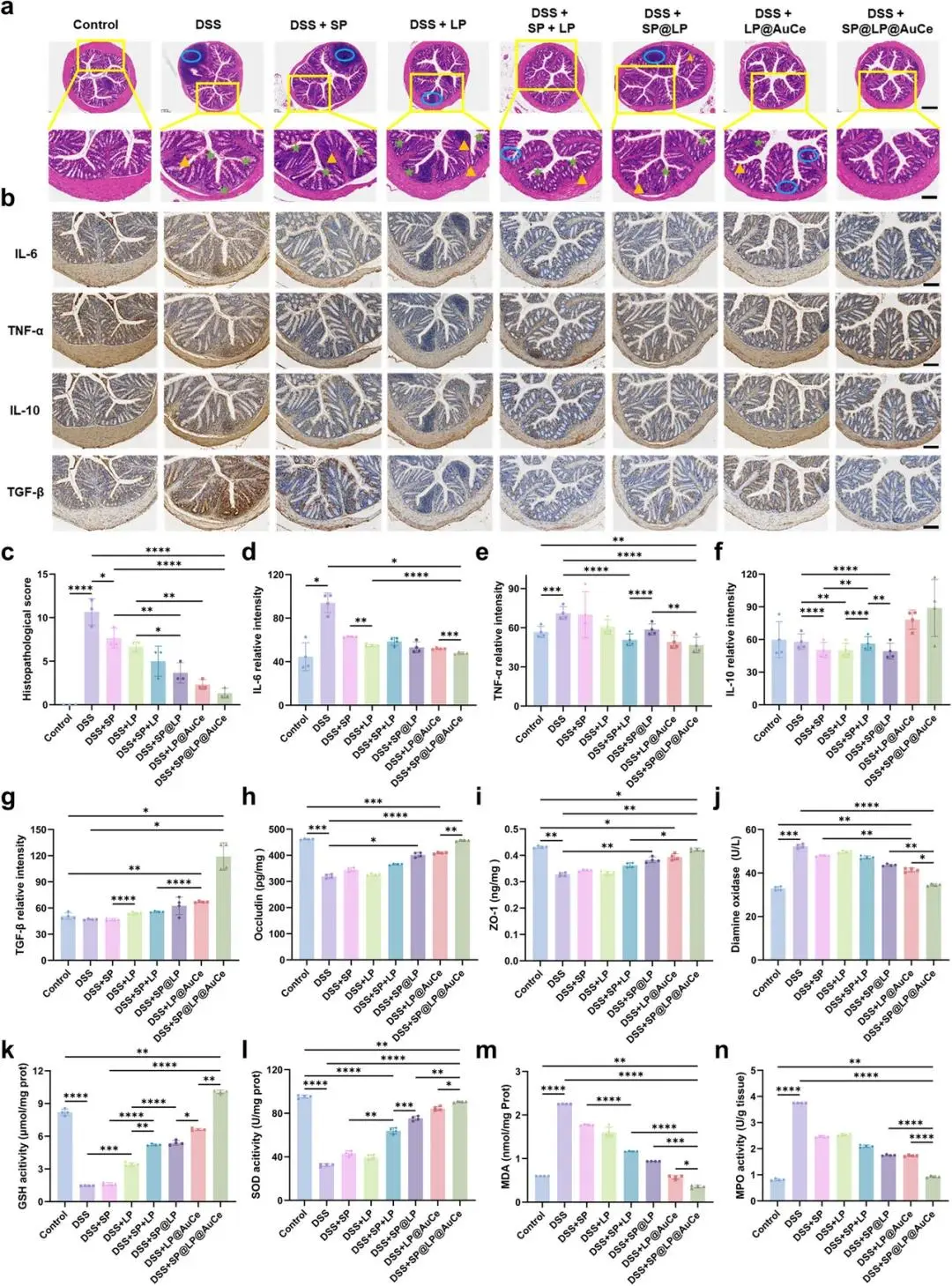
图5 DSS诱导小鼠结肠组织评估。(a)不同组结肠H&E染色及放大图,(b)不同组IL-6、TNF-α、IL-10、TGF-β免疫组化染色;(c)各组结肠H&E组织学损伤评分;(d–g)各组结肠IL-6、TNF-α、IL-10、TGF-β定量;(h,i)ELISA定量各组结肠occludin与ZO-1表达;(j)ELISA定量各组血清DAO水平;(k)GSH活性、(l)SOD活性、(m)MDA含量、(n)MPO活性于各组结肠匀浆
(5)SP@LP@AuCe 对结肠炎肠道菌群的调节作用
α多样性箱线图显示SP@LP@AuCe组Ace、Chao、Shannon、Simpson指数趋向对照(图6a–d)。Venn图表明该组与对照共享ASV 368个,DSS组独有907个(图6e)。PCoA与NMDS均将SP@LP@AuCe样本聚类于对照附近(图6f,g)。GMHI恢复至对照水平。门水平与属水平分析示,DSS组Proteobacteria 及Escherichia-Shigella 升高,SP@LP@AuCe组Akkermansia、Lachnospiraceae_NK4A136、norank_f_Muribaculaceae 、Lactobacillus 、Odoribacter丰度增加(图6h,i)。Circos图与LEfSe(LDA>3)进一步证实SP@LP@AuCe降低Enterobacteriaceae等致病菌,提升Lachnospiraceae等有益菌(图6j)。表型预测显示SP@LP@AuCe减少革兰阴性及潜在致病菌,恢复耐压厌氧有益菌(图6k–m)。
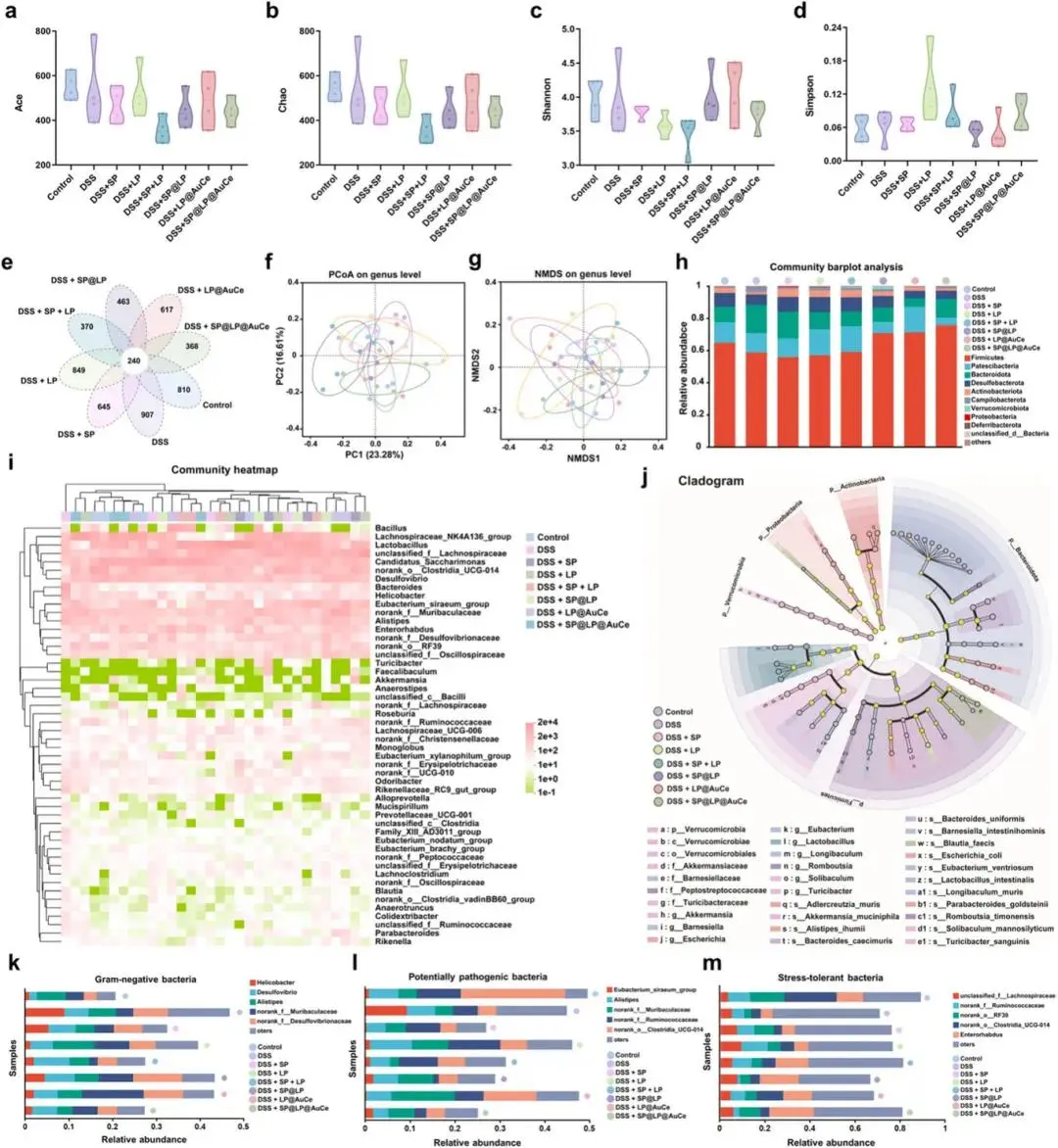
图6 SP@LP@AuCe对结肠炎肠道菌群的调控。(a–d)Chao、Ace、Shannon、Simpson α多样性箱线图;(e)各组物种ASV韦恩图;(f)PCoA主坐标分析;(g)NMDS非度量多维尺度图;(h)门水平菌群相对丰度;(i)属水平菌群相对丰度热图;(j)LEfSe差异菌群分支图;(k–m)BugBase预测的革兰阴性菌、潜在致病菌及耐压菌相对丰度
(6)小鼠短链脂肪酸、结肠指数和肠道菌群的相关性分析
SP@LP@AuCe组总SCFA及乙酸、丙酸、丁酸、异丁酸含量均显著高于DSS组,戊酸与异戊酸仍低于对照(图7a–g)。RDA显示对照与乙酸、戊酸共聚,DSS远离该簇,SP@LP@AuCe向对照回归(图7h)。Akkermansia与丁酸、丙酸正相关,Muribaculum与乙酸负相关;Akkermansia亦与TGF-β正相关,Parabacteroides与TNF-α负相关,Muribaculum与ROS正相关(图7i,j)。Mantel检验示SP@LP@AuCe与抗炎因子IL-10、TGF-β及有益脂肪酸呈正相关,DSS与IL-6、TNF-α及组织损伤指标呈正相关(图7k,l)。
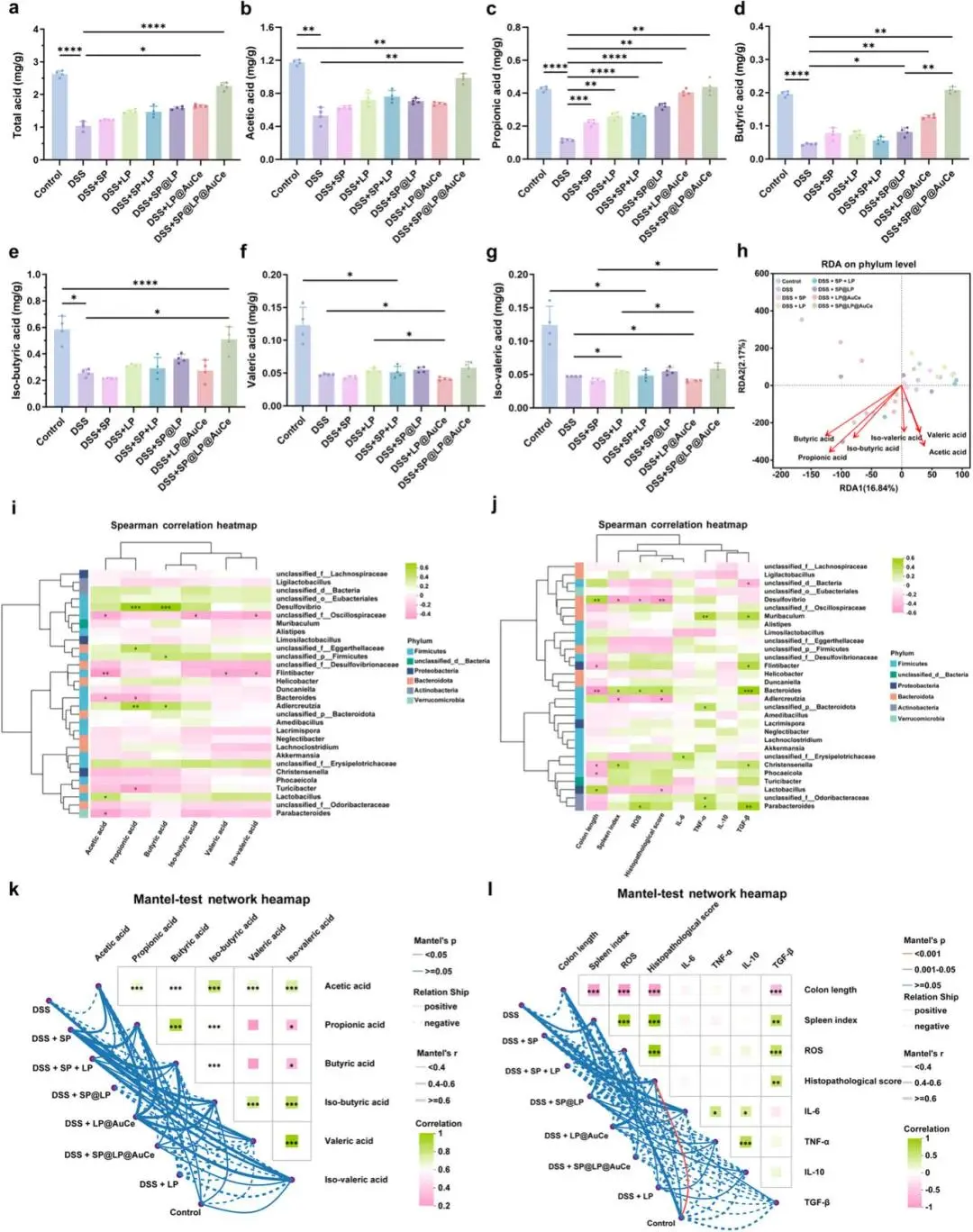
图7 短链脂肪酸、结肠指标与肠道菌群相关性分析。(a–g)结肠内容物总酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸浓度;(h)菌群丰度与SCFAs的RDA图;(i)门水平菌群与SCFAs指标的相关热图;(j)门水平菌群与结肠指标的相关热图;(k,l)SCFAs指标及结肠指标与菌群结构的Mantel检验网络热图
本研究构建的口服微纳机器人SP@LP@AuCe将螺旋藻的天然螺旋结构、金铈纳米酶的ROS清除功能与植物乳杆菌的菌群调控能力整合于一体,可在胃肠道内稳定滞留并持续发挥抗氧化、抗炎及屏障修复作用。动物实验证实,该机器人显著缓解DSS诱导的小鼠结肠炎,降低组织ROS与促炎因子水平,恢复紧密连接蛋白表达和短链脂肪酸生成,重建健康菌群并延长益生菌定植时间,且系统毒性低。该策略为IBD等肠道疾病的精准递送和协同治疗提供了新平台。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

