
结肠癌,亦称结直肠癌,其总体五年生存率约为64%;一旦发生远处转移,该比例骤降至仅14%。免疫逃逸与远处转移是推动肿瘤进展、导致预后极差的核心机制。遗憾的是,现有治疗手段——包括手术切除、以奥沙利铂联合氟尿嘧啶为代表的化疗,以及以帕博利珠单抗、纳武利尤单抗为代表的免疫治疗——在激活机体抗肿瘤免疫、重塑“免疫冷”肿瘤微环境方面疗效有限,因而难以避免治疗失败和患者死亡的结局。鉴此,亟须开发能够显著提升抗肿瘤免疫活性、阻断结肠癌转移的新策略。

针对上述问题,汪卫平团队首次提出并验证“FSP1 基因沉默 + PDT”协同策略。该团队将近红外光敏剂维替泊芬与阳离子助脂质 DOTAP 共组装,构建可共递送 FSP1 siRNA 与光敏剂的脂质纳米颗粒(FSP1/LNPs)。该纳米颗粒在血液循环中稳定,被动富集于肿瘤;经近红外光照后,维替泊芬产生 ROS,耗竭 GSH 并放大脂质过氧化,同时 FSP1 siRNA 沉默 FSP1 表达,双重打击诱导结肠癌细胞铁死亡和 ICD,促进树突状细胞成熟与细胞毒性 T 细胞活化。CT26 荷瘤小鼠实验显示,FSP1/LNPs 显著抑制原发瘤和远端转移瘤生长,系统提升抗肿瘤免疫,为结肠癌精准协同免疫治疗提供了可临床转化的新平台。该文章于2025年8月7日以《Synergizing Ferroptosis Suppressor Protein 1 Gene Silencing and Photodynamic Therapy Based on Photosensitive Lipid Nanoparticles for Colon Cancer Immunotherapy》为题发表于《ACS Nano》上(DOI: 10.1021/acsnano.5c06115)。
 研究示意图
研究示意图
(1)光敏脂质纳米粒的筛选与优化
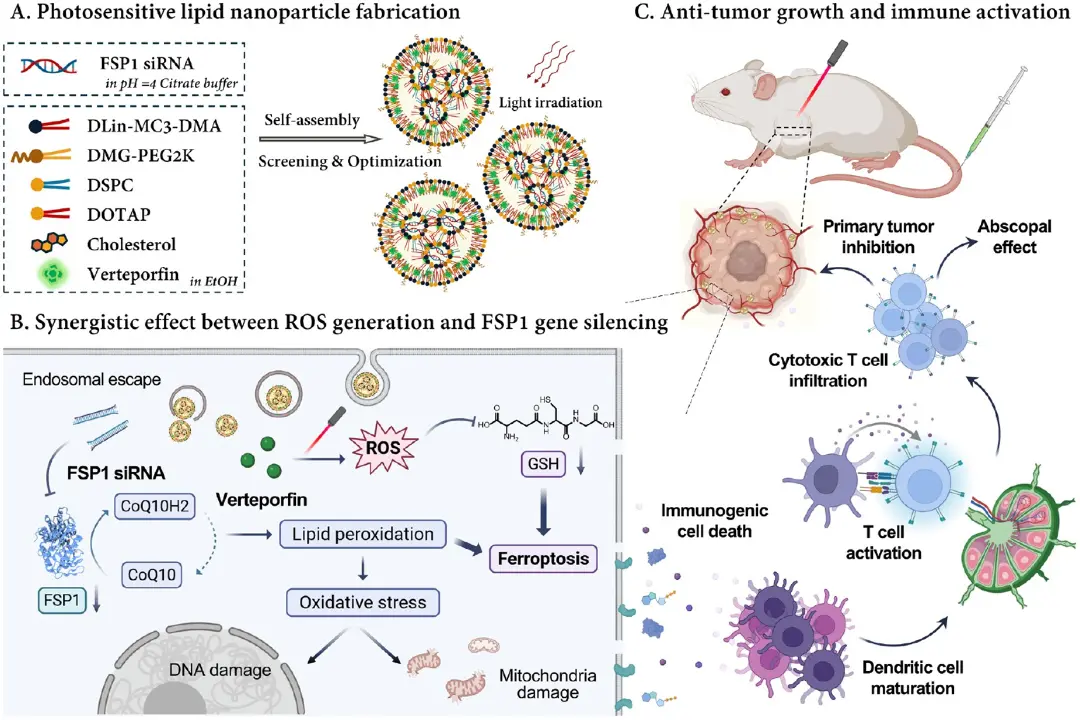
为了制造光敏LNP,如图1 A-B所示,该研究将不同类型的光响应小分子,如卟啉、吲哚菁或BODIPY分子,加入高(10 mol %)或低(5 mol %)的LNP配方中。图1C的电泳结果表明,只有卟啉类的Ce6、Verteporfin和Hemin可在不降低siRNA包载效率的前提下与脂质共组装。基于此,图1D选定FDA批准的近红外光敏剂Verteporfin(5 mol %)用于后续制剂,其粒径与PDI与无光敏剂对照相当。随后,图1E-F显示,以0-10 mol %的阳离子脂质DOTAP逐步取代DSPC,粒径由130 nm增至190 nm,ζ电位由-16.2 mV升至+3.5 mV。图1G-H的流式结果指出,5 mol % DOTAP组的细胞摄取在1 h和4 h时分别达到无DOTAP组的2.54倍与2.06倍;DOTAP比例继续升高反致摄取下降。图1I的共聚焦成像进一步证实,5 mol % DOTAP组4 h后的siRNA-内体共定位Pearson系数降至0.55,显著低于0 mol %组的0.78,说明DOTAP促进了内体逃逸。综上,Verteporfin-5 mol %/DOTAP-5 mol %/DSPC-5 mol %的配方被确定为最佳光敏LNP平台,用于后续共递送FSP1 siRNA与光动力协同治疗结肠癌的研究。
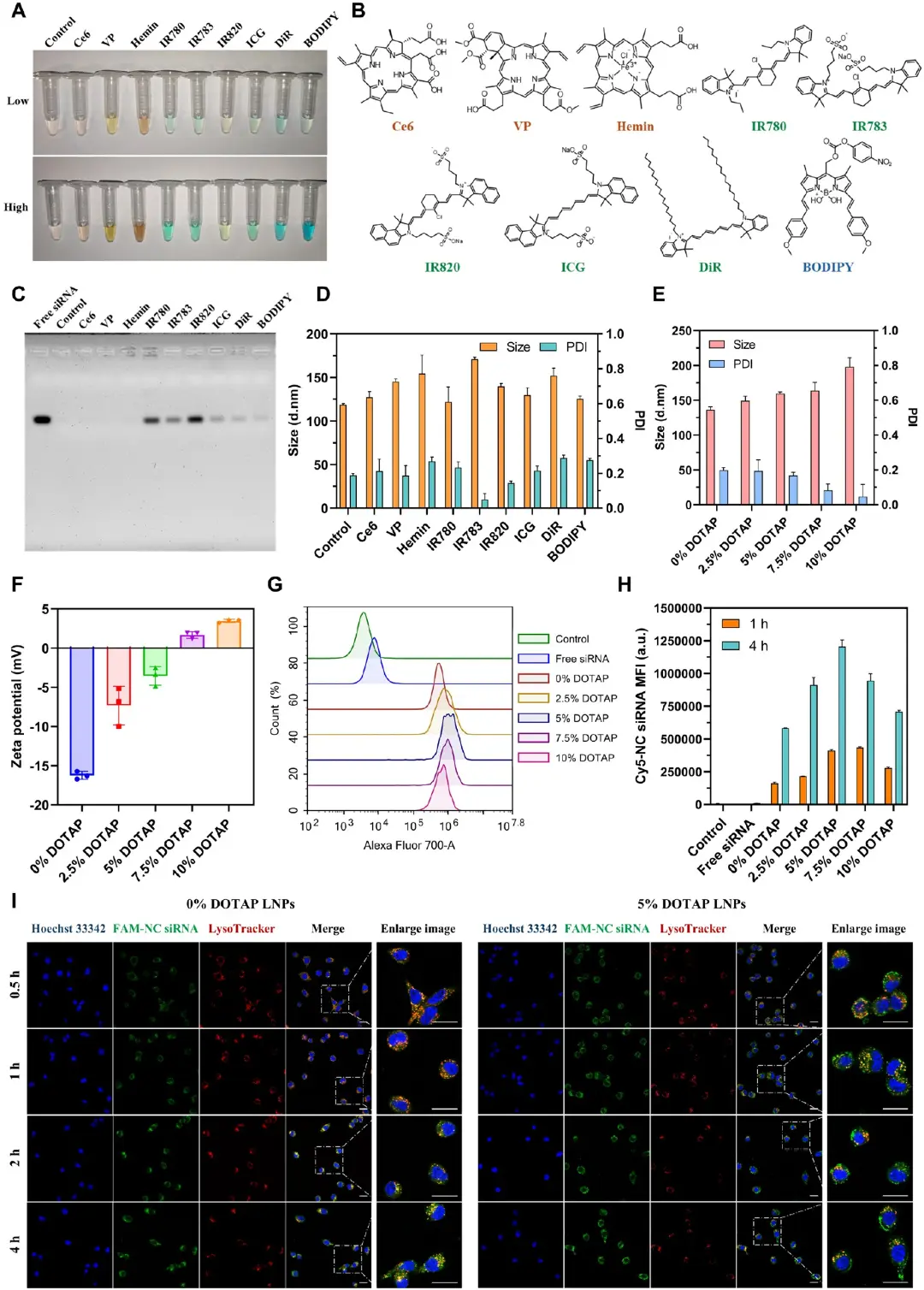
图1.光敏LNP配方的筛选和优化。A)不同光敏分子(卟啉、吲哚菁或BODIPY,高摩尔比//低摩尔比)配方图片;B)基于卟啉、吲哚青氨酸或BODIPY的光响应分子的化学结构;C)10 mol %光敏分子载siRNA LNP的琼脂糖凝胶电泳图; D)不同光敏LNP制剂的大小和PDI值; E)不同DOTAP摩尔比的Verteporfin-LNP的大小和PDI值; F)光敏LNPs的Zeta电位; G)细胞摄取流式分析(4 h); H)不同DOTAP比例Verteporfin-LNP在CT26细胞中1 h/4 h摄取量; I)0或5 mol % DOTAP LNP的内吞体逃逸
(2)FSP1/LNPs的制备与表征
为了制备FSP1/LNPs,将FSP1 siRNA包封到设计的光敏LNPs中。图2A显示FSP1/LNPs粒径145.4 nm、PDI 0.11;图2B测得ζ电位−2.8 mV;图3C证实其在PBS或10% FBS中96 h仍维持约150 nm,粒径稳定性良好。图2D电泳表明N/P≥3时siRNA被完全包封;图2E紫外光谱在254、420、690 nm同时出现siRNA与Verteporfin特征峰;图2F的细胞实验指出,1 μM Verteporfin或12.5 nM FSP1 siRNA单用使CT26存活率降至72%与70%,而二者联用并光照后存活率骤降至36%;图2G计算的平均协同分为27.28;图2H流式结果证明FSP1/LNPs递送siRNA的效率优于Lipo3000;;图2I显示,M-β-CD、氯丙嗪和染料木素显著抑制摄取,提示FSP1/LNPs主要经脂筏-、网格蛋白-及小窝介导的内吞途径进入细胞。
图2.FSP1/LNPs的制备和表征。A)FSP1/LNPs的粒度分布和透射电子显微镜成像;B)FSP1/LNPs的Zeta电位;C)FSP1/LNPs在PBS中37℃恒温96 h的稳定性试验;D)不同N/P比的FSP1/LNPs的琼脂糖凝胶电泳;E)FSP1siRNA、Verteporfin和FSP1/LNPs的UV−Vis吸收光谱;F)在光照(Xe灯,690 nm,2.7 mW/cm2,2min;n=3)下,与Verteporfin和FSP1 siRNA孵育的CT26细胞的细胞活力;G)光照射下CT26细胞中维替泊芬和FSP1 siRNA的协同作用分数;H)细胞对游离siRNA、Lipo3000-siRNA复合体和光敏脂质纳米粒的摄取水平;I)CT26细胞经不同内吞抑制剂孵育后FSP1/LNPs的细胞内化水平
(3)FSP1/LNP的细胞毒性和FSP 1基因的沉默效应
为了探索纳米颗粒的抗癌性能,该研究将CT26细胞暴露于FSP1/LNPs或阴性对照sirna负载的光敏LNPs (NC/LNPs)中,图3A的MTT结果显示,FSP1/LNPs光照组对各浓度CT26细胞的抑制率最高;图3B LDH释放量在该组亦达峰值,提示膜完整性受损。为了确定结肠癌细胞的氧化应激,采用DCFH-DA测定细胞内ROS水平。图3C流式检测表明,FSP1/LNPs光照组胞内ROS水平最高,显著高于NC/LNPs光照组及FSP1/LNPs无光照组。图3D-E凋亡分析显示,FSP1/LNPs光照组晚期凋亡比例为NC/LNPs光照组的1.71倍;图3F活/死染色呈现一致趋势。为了探究光敏LNPs对FSP1基因的沉默作用,图3G qPCR的结果证实了FSP1/LNPs光照组FSP1 mRNA表达显著下调;图3H的Western blot显示,其蛋白水平降低57%。
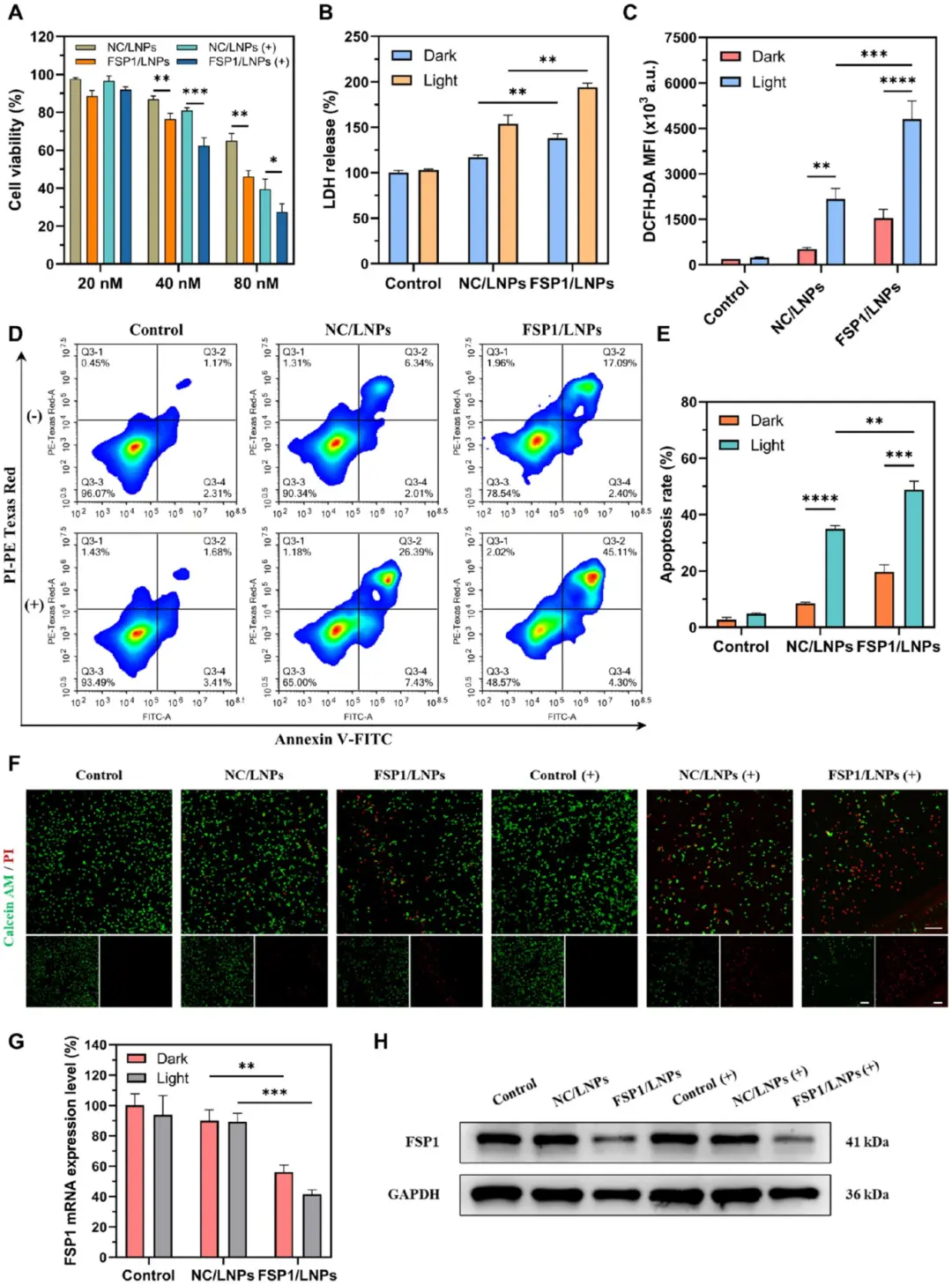
图3 FSP1/LNP的细胞毒性和FSP 1基因的沉默效应。A)用各种制剂处理后CT 26细胞的细胞活力;B)进行各种处理的CT 26细胞的乳酸脱氢酶(LDH)释放;C)通过流式细胞术评估CT 26细胞中的ROS产生;D)暴露于指定制剂的CT 26细胞的凋亡水平;E)凋亡水平的定量评估;F)接受指定处理的CT 26细胞的活染色和死染色;G)在指定处理后CT 26细胞中FSP 1的mRNA表达;H)不同处理后CT 26细胞内FSP 1和GAPDH表达水平的Western印迹评估
(4)FSP 1/LNP引起的铁凋亡和氧化损伤
由于光敏LNPs可以促进ROS的产生并实现FSP1基因的沉默,该研究接下来探讨了结肠癌细胞中的铁凋亡和氧化损伤。图4A-B的BODIPY-C11成像显示,FSP1/LNPs光照组绿色荧光最强,脂质过氧化水平显著高于NC/LNPs光照或FSP1/LNPs无光照组;图4C ELISA测定该组CoQ10含量升高,提示FSP1活性下降。图4D指出,光照后两种LNPs均降低胞内GSH水平,其中FSP1/LNPs降幅最大。图4E-F的γ-H2AX荧光显示,FSP1/LNPs光照组核内绿色信号最强,伴随DAPI形态圆缩;图4G的JC-1流式结果进一步证实该组线粒体膜电位下降最显著,图4H的TEM观察到线粒体嵴消失、碎裂。图4I-J揭示,FSP1 siRNA仅抑制CT26增殖,对NIH 3T3无明显影响;图4K表明,无光照FSP1/LNPs在NIH 3T3中细胞存活率>90%。
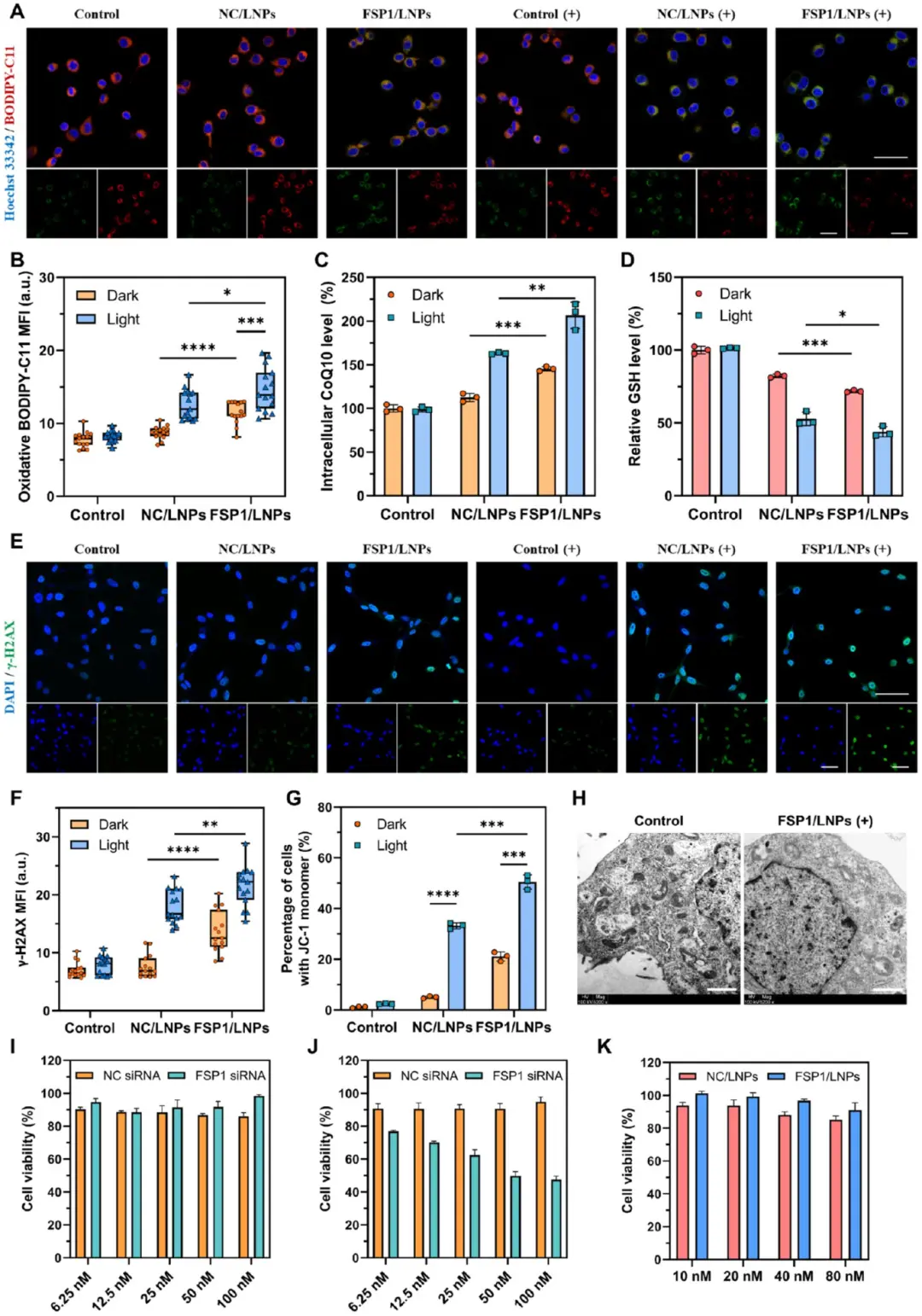
图4 FSP 1/LNP引起的铁凋亡和氧化损伤。A)各种处理条件后CT 26细胞中脂质过氧化水平的CLSM图像;B)氧化BODIPY-C11的绿色荧光定量分析;C)用指定制剂处理的CT 26细胞的细胞内CoQ 10水平;D)CT 26细胞内的GSH水平;E)CT 26细胞中γ-H2 AX水平的CLSM图像;F)γ-H2 AX水平的定量分析;G)具有JC-1单体的CT 26细胞的百分比;H)正常和FSP 1/LNP(+)的横截面TEM图像;I)用NC siRNA或FSP 1 siRNA处理后NIH 3 T3细胞活力的评估;J)用NC siRNA或FSP 1 siRNA处理后CT 26细胞活力的评估
(5)FSP 1/LNP的ICD和DC成熟效应
为了研究FSP1基因沉默和PDT对结肠癌细胞的联合作用,该研究对正常或FSP1/lnps处理的CT26细胞中提取的总RNA进行了转录组测序分析。图5A转录组显示FSP1/LNPs光照组较对照组上调1437个、下调1290个基因;图5B列示差异基因:Egr1、Txnip、Btg2、Rnd1上调,Cp、Scd1、Sema5a下调,Gadd45g升高而Rhbdd1降低,Nrp2、Grem1、Fn1、Slit1下调。为了探讨抗肿瘤免疫反应。采用免疫荧光法测定高迁移率组盒1 (HMGB1)和钙网蛋白(CRT)在细胞内的表达水平。图5C-D免疫原性细胞死亡检测显示,FSP1/LNPs光照组核内HMGB1荧光强度显著降低,表明其大量外释;图5E-F提示膜表面CRT荧光强度最高,证实免疫原性信号充分暴露。图5I胞内ATP水平下降40%,进一步支持DAMPs释放。图5G-H BMDCs与处理后上清共培养结果显示,CD80⁺CD86⁺双阳性成熟树突状细胞比例由22.37%激增至52.93%,标志DC成熟及后续T细胞激活能力显著增强。
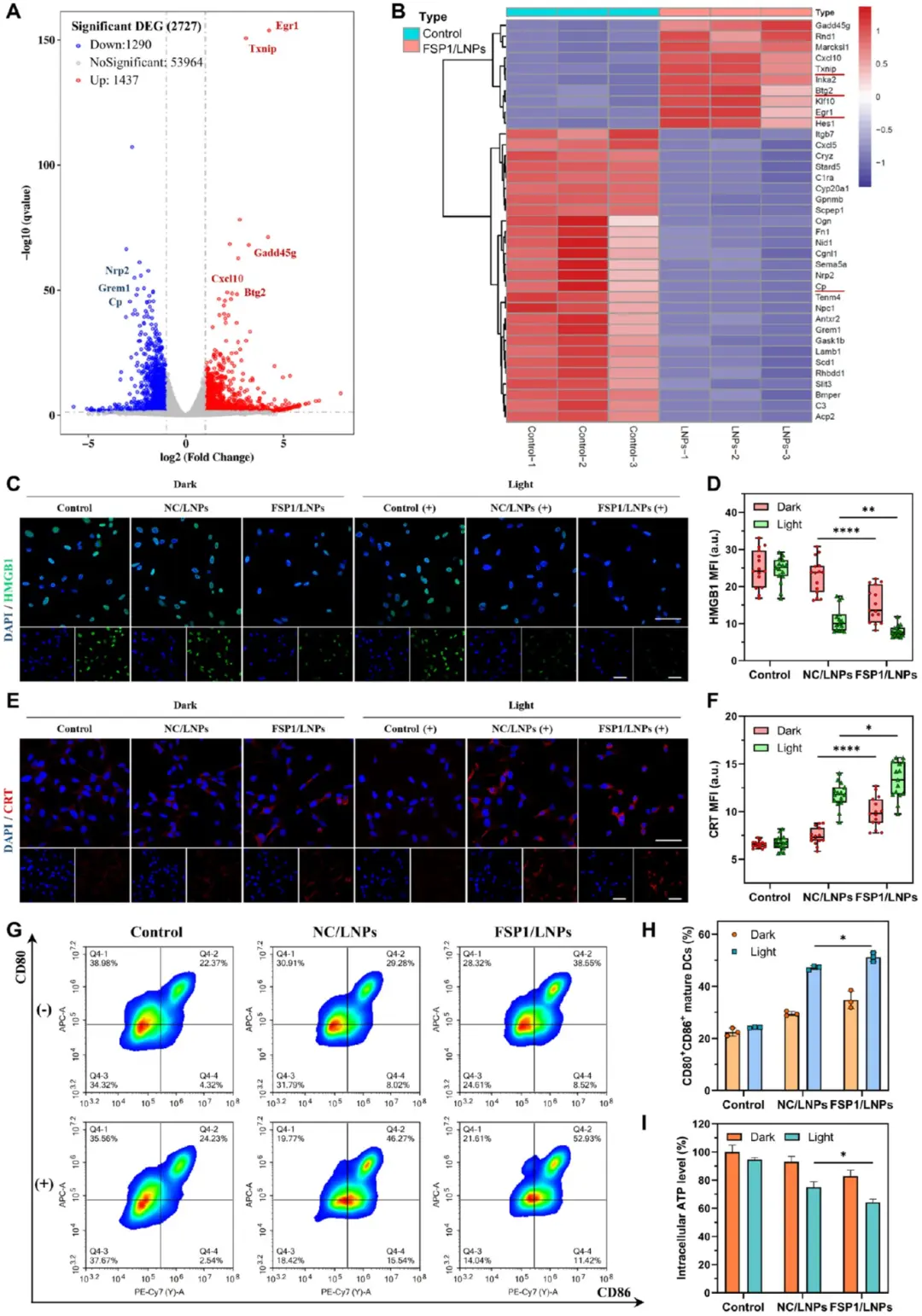
图5 FSP 1/LNP的ICD和DC成熟效应。A)正常CT 26细胞和FSP 1/LNP(+)处理的CT 26细胞之间鉴定的总DEG的火山图;B)描绘正常与FSP 1/LNP(+)处理的CT 26细胞中的特异性DEG的热图;C)CT 26细胞中HMGB 1表达的CLSM图像;D)HMGB 1表达的定量分析;E)CT 26细胞中CRT表达的CLSM图像;F)CRT表达的定量分析;G)与CT 26上清液孵育后BMDC成熟的流式细胞术评估;H)成熟CD 80+细胞的定量分析;I)CT26细胞中细胞内ATP水平的评估
(6)FSP 1/LNP的生物分布和肿瘤生长抑制作用
为了研究光敏LNPs在BALB/c小鼠体内的生物分布和抗肿瘤生长作用,建立了CT26荷瘤模型。在系统给予游离光敏剂或FSP1/LNPs后,通过体内成像系统(IVIS)确定其在不同时间点的生物分布行为。图6A活体成像显示,FSP1/LNPs在肿瘤部位的荧光信号于4 h达峰,且显著高于游离药物;图6B离体成像证实其主要分布于肿瘤与肝脏;图6C定量示肿瘤荧光强度为游离药的1.75倍。图6D-E显示治疗12 d后,FSP1/LNPs光照组肿瘤最小;图6F-G体积与重量曲线表明该组抑瘤效果最佳;图6H体重监测未见明显变化,提示其生物安全性良好;图7I肿瘤切片CRT免疫荧光显示,FSP1/LNPs光照组膜CRT信号最高,显著高于NC/LNPs光照组。
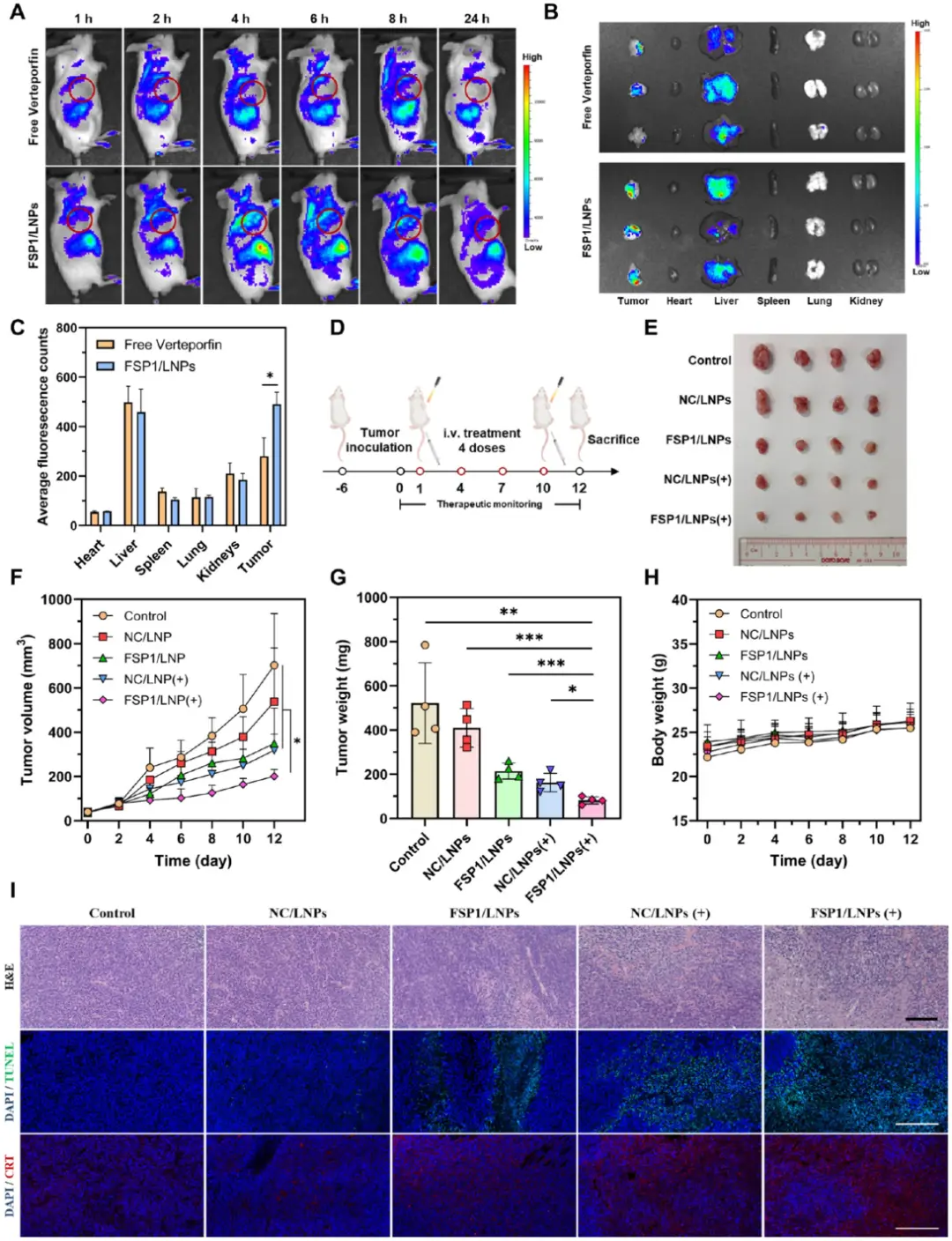
图6 FSP 1/LNP的生物分布和肿瘤生长抑制作用。(A)游离Verteporfin和FSP 1/LNP的生物分布评价;B)治疗后24 h肿瘤和器官的荧光成像;C)器官和肿瘤中荧光信号的定量评价;D)使用光敏LNP通过协同FSP 1基因沉默和ROS产生来抑制肿瘤生长的治疗方案;E)第12 d来自治疗小鼠的肿瘤照片;F)评估接受各种治疗的小鼠中的肿瘤体积;G)各组中第12 d的肿瘤重量;H)12 d内小鼠的体重变化
(7)FSP 1/LNP的抗癌免疫应答和远端肿瘤抑制作用
考虑到光敏LNPs可诱导铁上沉和氧化应激,从而促进ICD和DC成熟,提出其治疗效果也可能通过重塑免疫抑制肿瘤微环境在体内发挥结肠癌免疫治疗作用。图7A-B进一步指出,引流淋巴结中CD45⁺MHC-II⁺CD11c⁺群体里的CD80⁺CD86⁺成熟DC比例由对照的10.51%增至NC/LNPs光照组的19.82%,再升至FSP1/LNPs光照组的24.57%。图7C–I的双侧瘤模型结果表明,FSP1/LNPs光照组原发肿瘤与远端肿瘤均最小:肿瘤体积和重量均达最低值,且远端瘤的显著抑制证实全身免疫激活。图7J–L显示,肿瘤内CD45⁺CD3⁺CD4⁺FoxP3⁺Treg比例依次由对照13.45%、NC/LNPs光照6.6%降至FSP1/LNPs光照2.6%;图7K–M的脾脏流式显示,CD3⁺CD8⁺CD44⁺CD62L⁻效应记忆T细胞比例由对照9.98%、NC/LNPs光照25.37%升至FSP1/LNPs光照38.74%。图7N–O证实,原发与远端肿瘤中CD45⁺CD3⁺CD8⁺细胞毒性T细胞比例在FSP1/LNPs光照组均达到最高。总的来说,这些双侧肿瘤模型的免疫表型结果表明,FSP1/LNPs可以重塑免疫抑制的肿瘤微环境,并通过激活T细胞和协调抗癌免疫反应来引发持久的肿瘤抑制。
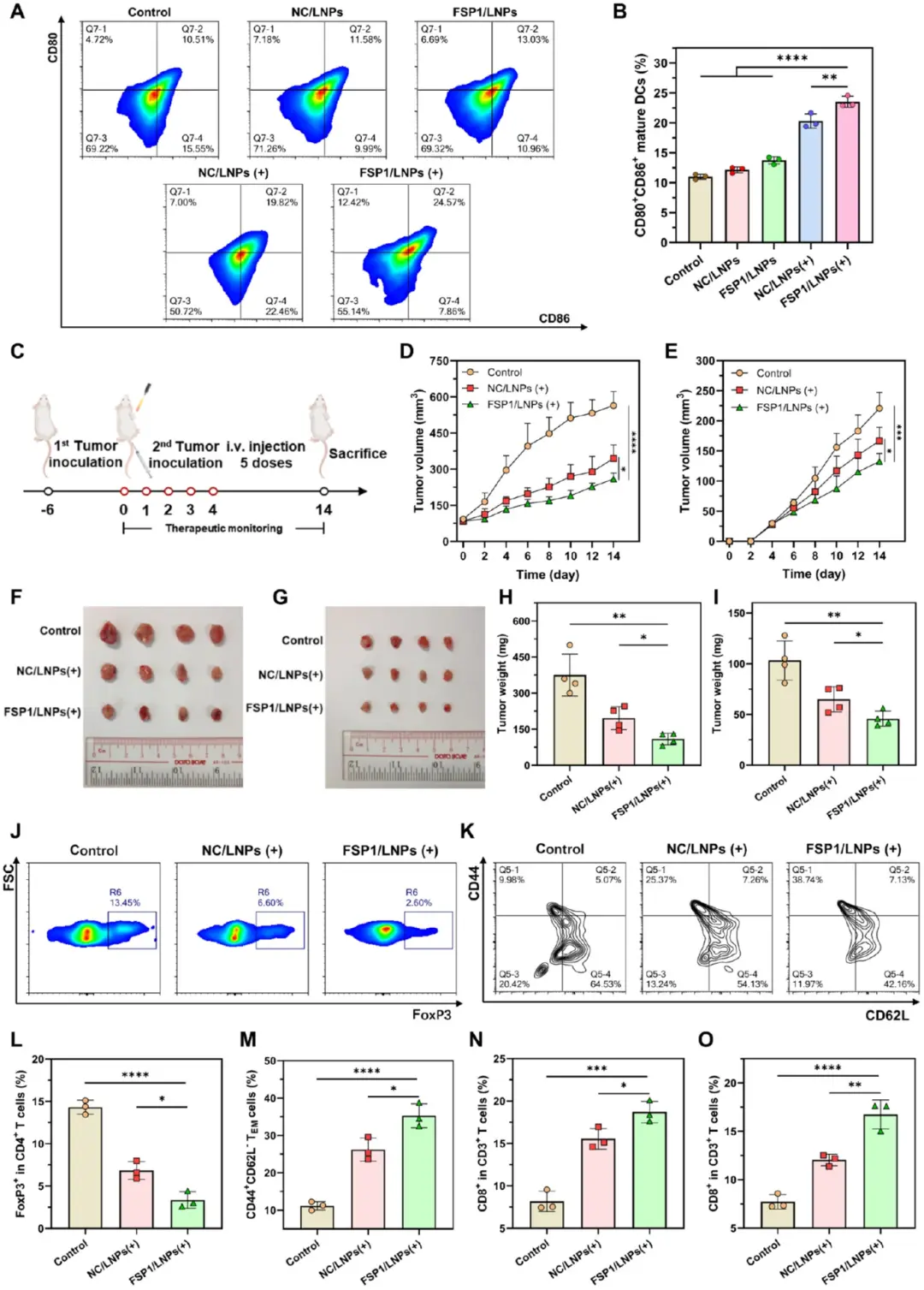
图7 FSP 1/LNP的抗癌免疫应答和远端肿瘤抑制作用。A)肿瘤引流淋巴结中DC成熟的评估;B)CD 80 + CD 86+成熟DC的定量评估(;C)采用光敏LNP刺激全身抗肿瘤免疫的治疗方案;D)小鼠中原发肿瘤体积的变化;E)远处肿瘤体积变化;F)第14 d原发肿瘤的照片;G)远端肿瘤的照片;H)第14d原发肿瘤重量;I)第14 d远端肿瘤重量;J)FoxP 3+的流式细胞术评估原发性肿瘤内的调节性T细胞;K)脾样品中效应记忆T细胞(CD 44 + CD 62 L-)的评估;L)调节性T细胞的FoxP 3+的定量结果;M)效应记忆T细胞的定量;N)原发性肿瘤内CD8+ T淋巴细胞的定量结果;O)远端肿瘤内CD8 + T淋巴细胞的定量结果
本研究通过把维替泊芬光敏剂与FSP1 siRNA共包载于可光照激活的脂质纳米颗粒(FSP1/LNPs),实现“基因沉默+光动力”协同治疗。该纳米颗粒在结肠癌细胞中摄取效率高,经近红外照射后同步诱导铁死亡与氧化损伤,促进肿瘤细胞凋亡、抗原释放及树突状细胞成熟,显著激活全身抗肿瘤免疫。CT26荷瘤小鼠实验显示,FSP1/LNPs可被动靶向肿瘤,光照下明显抑制原发灶和远端转移灶生长,且毒副作用低,为结肠癌安全高效的精准免疫治疗提供了可临床转化的多功能纳米平台。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

