
慢性不愈合伤口是一个重大的临床挑战,其漫长的治疗过程和高昂费用给全球医疗系统带来了沉重负担。这一问题在糖尿病伤口(DWs)中尤为突出,其管理不当常导致截肢和死亡率升高。糖尿病中的高血糖和缺氧微环境破坏了正常的愈合过程,特别是延长了炎症阶段,导致持续炎症、感染并阻碍血管生成,从而妨碍伤口闭合。
基于生长因子或血糖控制的临床干预效果仍不理想。高血糖导致M1巨噬细胞极化增加,通过分泌促炎细胞因子加剧氧化应激和细胞损伤,最终导致血管功能障碍。因此,旨在调节免疫微环境,特别是通过促进巨噬细胞M2极化的治疗方法显示出潜力。MicroRNA-21-5p (miR-21-5p) 在促进血管生成、抑制中性粒细胞胞外诱捕网(NETs)形成、通过PI3K/AKT信号通路促进M2巨噬细胞极化以及抑制NF-κB活化方面发挥着重要作用。然而,其治疗应用受到固有不稳定性和易降解性的限制。四面体框架核酸(tFNAs)作为一种DNA纳米结构,具有优异的生物相容性、高效的细胞摄取能力,并能实现精确的药物递送。

针对上述问题,四川大学林云锋教授团队设计并构建一种多功能核酸水凝胶(TR21@TS),通过负载miR-21-5p的tFNAs(TR21)与由单宁酸(TA)和四臂聚乙二醇(4-PEG)衍生物组成的止血水凝胶系统(TS)相结合,用于协同调控止血、免疫反应和血管生成,从而促进DWs愈合。该文章于2025年8月7日以《A Sprayable Nucleic Acid Hydrogel for Diabetic Wound Healing via Immunomodulation and Angiogenesis》为题发表于《Small》(DOI: 10.1002/smll.202506587)。
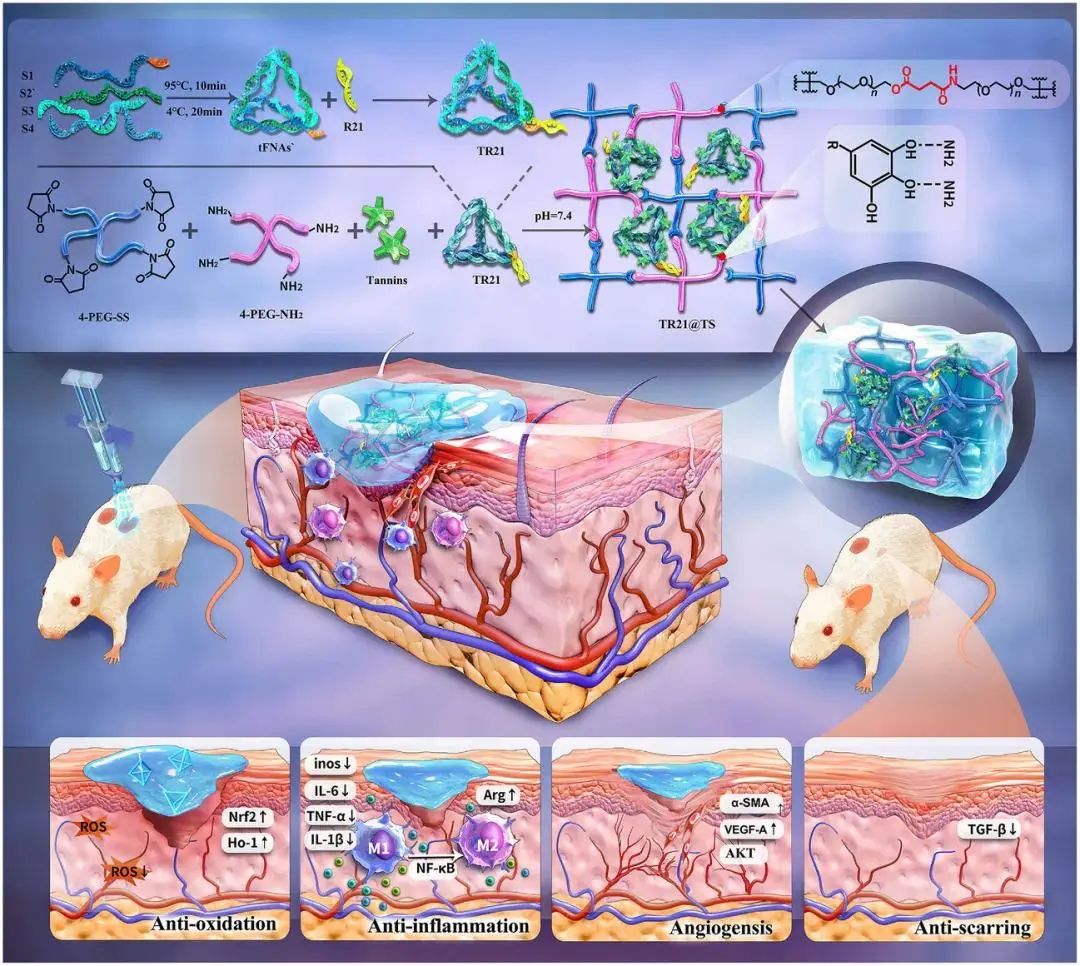
图1. TR21@TS的合成及其在糖尿病伤口愈合中的免疫调节、促血管生成和抗瘢痕效应示意图
(1)TR21和tFNAs的制备与表征
通过Watson-Crick碱基配对,四条单链DNA自组装成tFNAs,并将miR-21-5p加载到tFNAs的粘性末端上,得到复合物TR21(图2a)。PAGE和毛细管电泳(CE)证实了TR21的成功合成(图2b,c)。透射电镜(TEM)和原子力显微镜(AFM)显示TR21和tFNAs均呈现均匀的三角形结构(图2d,e)。动态光散射(DLS)测量显示TR21的尺寸(14.44 ± 3.68 nm)大于tFNAs(10.72 ± 1.58 nm),且zeta电位更负,进一步证实了miR-21-5p的成功加载(图2f)。稳定性实验表明,TR21在胎牛血清(FBS)和RNase A中比游离miR-21-5p更稳定,并具有良好的储存稳定性(图2g,h)。细胞摄取实验显示,与Cy5标记的游离miR-21-5p (Cy5-R21) 相比,Cy5标记的TR21 (Cy5-TR21) 和tFNAs (Cy5-tFNAs) 在人脐静脉内皮细胞(HUVECs)和RAW264.7巨噬细胞中的摄取效率显著更高(图2i,j)。
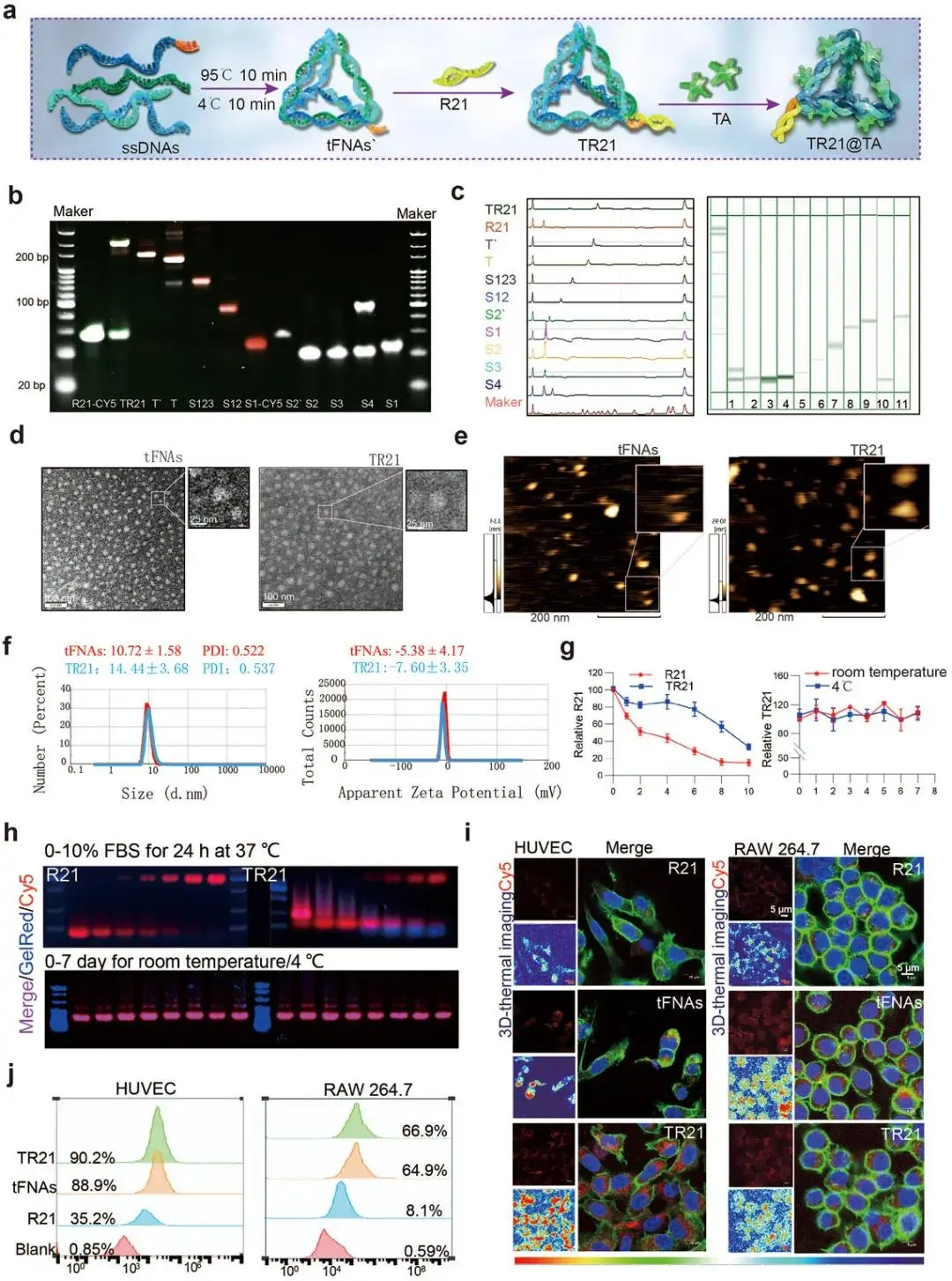
图2. TR21的表征。(a)TR21与TR21@TA组成示意图;(b)PAGE凝胶证实TR21合成成功;(c)CE图谱进一步验证TR21合成;(d)tFNAs与TR21的TEM图像(标尺100与25 nm);(e)tFNAs与TR21的AFM图像(标尺200 nm);(f)DLS测定tFNAs与TR21的粒径及ζ电位;(g)未降解miR-21-5p相对浓度统计;(h)AGE凝胶展示Cy5-R21与Cy5-TR21在不同FBS浓度(0–10%,37 °C,24 h)及温度(室温、4 °C,0–7 d)下的稳定性;(i)共聚焦荧光图像显示RAW264.7与HUVEC对Cy5-R21、Cy5-tFNAs、Cy5-TR21的摄取(绿:骨架,红:Cy5,蓝:核,3D热图:Cy5荧光强度三维重建;标尺5 μm);(j)流式细胞术检测RAW264.7与HUVEC对Cy5-R21、Cy5-tFNAs、Cy5-TR21的摄取
(2)TR21@TS的合成与表征
TR21@TS水凝胶通过两步策略合成:将TR21与4-PEG-SS和4-PEG-NH₂整合,然后加入TA形成最终的复合水凝胶(图3a)。¹H NMR证实了4-PEG-NH₂和4-PEG-SS的成功合成(图3b)。该水凝胶表现出快速的凝胶化(≈37秒)、优异的可注射性和可喷涂性(图3c,d)。傅里叶变换红外光谱(FTIR)证实了水凝胶的合成(图3e)。扫描电镜(SEM)显示TS水凝胶具有微孔结构,且孔隙率高于SS水凝胶(图3f)。TS水凝胶能有效粘附多种大鼠组织和器官(图3g),并表现出比SS水凝胶更优的机械强度和粘附性能(图3h,i,j),这归因于TA通过氢键作用增强了交联和组织粘附。流变学分析确认了TR21@TS水凝胶的凝胶化和稳定性(图3k)。TR21@TS水凝胶在12-24小时期间表现出显著的TR21释放行为。细胞毒性试验(CCK-8)表明,水凝胶提取物(10 mg mL⁻¹)在HUVECs和RAW264.7细胞中均无细胞毒性,且TR21@TS在250 nM浓度下能显著增强细胞活力(图3l)。

图3. TS与TR21@TS水凝胶的制备、表征及细胞毒性评价。(a)TR21@TS凝胶组成示意图;(b)4-PEG-SS与4-PEG-NH₂的¹H NMR谱;(c)TR21@TS与TS的成胶示意图;(d)TR21@TS可注射及可喷涂性能;(e)PEG-SS、4-PEG-NH₂与SS凝胶的FTIR谱;(f)TS与SS凝胶截面SEM(标尺200 μm);(g)TR21@TS在多器官表面的黏附;(h)TS与SS压缩测试及(i)压缩应力;(j)TS与SS黏附皮肤的剪切-位移曲线;(k)TR21@TS与TS的时间/应变流变;(l)CCK-8统计:RAW264.7与HUVEC经TS、tFNAs@TS、R21@TS、TR21@TS浸提液处理24 h后活性(tFNAs、R21、TR21 250 nM,浸提液10 mg mL⁻¹)
(3)TR21@TS的体外促血管生成活性
划痕实验表明,与对照组和纯水凝胶组相比,所有载药水凝胶均显著增强了HUVECs的迁移能力,其中TR21@TS组的促迁移效果最显著,24小时迁移率约为60%(图4a,b; 图S9)。Transwell实验进一步验证了TR21@TS组迁移的细胞数量约为tFNAs组的两倍(图4c,d)。体外成管实验显示,TR21@TS处理能最有效地促进HUVECs形成毛细血管样网络结构,并显著增加总管长、网格数、网格面积、分支数和连接点数(图4e,f)。蛋白质印迹(WB)和免疫荧光分析表明,TR21@TS处理显著上调了血管内皮生长因子A(VEGF-A)、α-平滑肌肌动蛋白(α-SMA)以及磷酸化AKT(p-AKT)的表达(图4g-i,j)。这些结果表明TR21@TS通过激活PI3K/AKT通路并上调VEGF-A和α-SMA来促进血管生成(图4k)。

图4. TR21@TS水凝胶经AKT信号通路促进细胞迁移并增强成管能力。(a)不同水凝胶组在0小时和24小时的划痕实验代表性图像。(b)划痕实验中细胞迁移速率的定量分析(n = 3)。(c)24小时后transwell迁移实验的代表性图像。(d)Transwell实验中细胞迁移数量的定量分析(数据以均值±标准差表示;n = 3)。(e)不同水凝胶组的血管生成实验代表性图像。(f)连接数、分支数量、网格数量及网格面积定量分析。(g,h)HUVECs经不同处理24小时后a-SMA和VEGF-A的免疫荧光图像(细胞骨架:绿色;细胞核:蓝色;a-SMA和VEGF-A:红色;三维热成像:基于a-SMA和VEGF-A荧光强度的三维重建)。比例尺为5 μm。(i)a-SMA、VEGF-A、AKT及p-AKT表达水平的蛋白质印迹分析。(j)HUVECs经不同处理24小时后a-SMA、VEGF-A、AKT及p-AKT的相对蛋白表达强度(数据以均值±标准差表示;n = 3)。(k)TR21@TS诱导HUVECs血管生成的作用机制示意图
(4)TR21@TS通过巨噬细胞重编程发挥免疫调节作用
为了评估不同处理对巨噬细胞极化的调节作用,用脂多糖(LPS)和高糖条件诱导M1极化。免疫荧光显示,TR21@TS处理组的M1标志物iNOS表达最低,而M2标志物Arginase-1表达最高(图5a,b)。TR21@TS组在降低炎症细胞因子(TNF-α, IL-6, IL-1β)和活性氧(ROS)水平方面效果最为显著(图5c-g; )。机制研究表明,TR21@TS处理有效抑制了NF-κB信号通路(降低p-p65/p65比率),并增强了Nrf2/HO-1通路(特别是HO-1)的表达(图5h,i,j)。这表明TR21@TS通过抑制NF-κB和上调Nrf2/HO-1通路来促进巨噬细胞向M2表型极化,从而发挥抗氧化和抗炎作用。

图5. TR21@TS通过抑制NF-κB表达减轻RAW264.7的炎症反应及M1极化。(a)不同处理后RAW264.细胞中iNOS和Arginase-1的免疫荧光图像(细胞骨架绿色,细胞核蓝色,iNOS与Arginase-1红色,3D热成像基于其荧光强度);(b)iNOS与Arginase-1的定量分析;(c)TNF-α、IL-6和IL-1β的定量分析;(d)ROS的定量分析;(e,f)TNF-α与IL-1β的免疫荧光图像;(g)ROS的免疫荧光图像;(h)LPS诱导炎症及TR21@TS免疫调节机制示意图;(i)NF-κB p65、p-p65、iNOS、Nrf2、HO-1、TNF-α、IL-6、IL-1β相对蛋白表达强度;(j)上述蛋白的Western blot分析(1: Control, 2: LPS, 3: TS, 4: R21@TS, 5: tFNAs@TS, 6: TR21@TS;β-actin为内参)
(5)水凝胶的体内安全性、生物降解性、凝血效率及止血效果
体外凝血实验表明,TS和TR21@TS水凝胶能显著加速血液凝固,凝血时间缩短至约6-8分钟,优于明胶海绵(GS)组(≈11分钟)和对照组(≈18分钟)(图6a,b,c)。凝血指数(BCI)分析显示TR21@TS组的BCI值最低(图6d)。在大鼠肝脏出血模型中,TS和TR21@TS水凝胶几乎能立即止住可见血流,止血时间显著短于对照组和GS组,失血量也最低(图6e,f,g)。溶血实验证实TS水凝胶具有优异的血液相容性(溶血率<5%)(图6h,i)。体内降解实验显示,皮下注射的TR21@TS水凝胶在24-48小时内大量降解,72小时几乎完全降解,仅伴有轻微的早期炎症反应(图6j,k)。主要器官的H&E染色未见明显异常,证实了其良好的生物安全性。体内荧光成像显示,Cy5标记的TR21@TS比游离Cy5-TR21在皮下保留时间更长(可达48小时),表明水凝胶能延长药物滞留(图6l,m)。

图6. GS、TS和TR21@TS水凝胶的体内安全性、生物降解、凝血效率及止血效果。(a)水凝胶体外与体内凝血实验示意图;(b)不同水凝胶包被与未包被孔的时间依赖性凝血;(c)凝血时间统计;(d)血凝指数(BCI)统计;(e)不同水凝胶处理下肝出血面积随时间变化;(f,g)出血时间与失血量比较;(h)溶血照片及(i)溶血率定量;(j)植入后水凝胶宏观形态;(k)植入区H&E与Masson染色(箭头示炎症细胞);(l)体内成像示意图;(m)Cy5标记TR21与TR21@TS水凝胶体内降解荧光影像
(6)TR21@TS对大鼠糖尿病伤口的体内治疗效果
在STZ诱导的I型糖尿病大鼠模型上创建全层皮肤伤口。TR21@TS处理显著加速了伤口闭合,在第14天时伤口闭合率达到约92%,显著高于对照组(≈65%)及其他治疗组(图7a-d)。H&E染色显示,TR21@TS组在第7天炎症减轻,肉芽组织排列有序,表皮完全再生;到第14天,表皮厚度最薄,表明组织重塑更完全(图7e,f)。Masson染色显示,TR21@TS组在第7天和第14天的胶原沉积最为显著(图7g,h)。
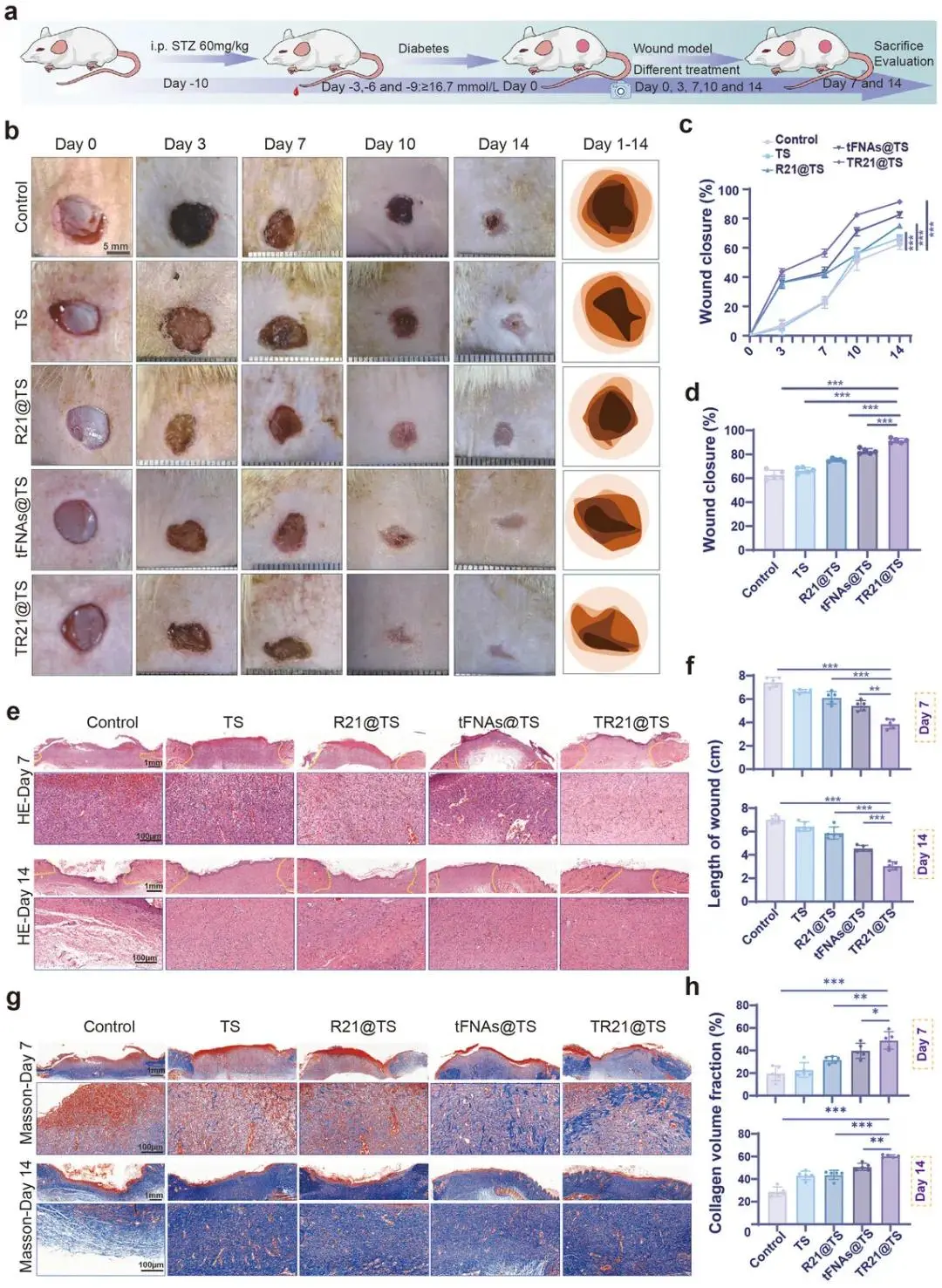
图7. TR21@TS促进糖尿病大鼠皮肤缺损愈合。(a)糖尿病大鼠全层皮肤缺损模型建立及治疗过程示意图;(b)不同愈合时期伤口代表性图像及创面痕迹;(c)各组愈合过程中伤口闭合率统计;(d)第14天伤口闭合率定量;(e)第7和14天伤口切片H&E染色;(f)第7和14天相对伤口长度统计;(g)第7和14天Masson染色;(h)基于Masson染色的胶原沉积定量
(7)TR21@TS水凝胶通过免疫调节和促进血管生成加速伤口愈合
基于体外结果,推测TR21@TS通过抑制NF-κB促进巨噬细胞M2极化,并通过上调PI3K/AKT通路促进血管生成,从而加速糖尿病伤口愈合(图8a)。对第7天TR21@TS组和对照组伤口组织进行RNA测序(RNA-Seq)分析。主成分分析(PCA)和差异表达基因分析显示两组间转录谱存在显著差异(图8b; 图S14)。通路富集分析表明,TR21@TS显著调节了炎症、角质形成细胞增殖和细胞外基质合成,并显著富集于NF-κB和PI3K/AKT信号通路(图8c)。基因集富集分析(GSEA)证实TR21@TS上调了PI3K通路(图8d,e),并下调了NF-κB信号通路和炎症反应通路(图8g)。多个血管生成相关基因在TR21@TS组上调(图8f)。免疫组化(IHC)分析显示TR21@TS组血管标志物CD31的表达显著上调,表明新生血管形成增加(图8h,i)。免疫荧光分析显示,TR21@TS组在第14天下调了与瘢痕形成相关的转化生长因子-β1(TGF-β1)的表达(图8j,k)。对第7天组织进行免疫荧光染色显示,TR21@TS处理显著降低了M1巨噬细胞(CD86+F4/80+)的比例,同时增加了M2巨噬细胞(CD206+F4/80+)的比例,并显著降低了炎症细胞因子(TNF-α, IL-1β, IL-6)的水平(图9a-i)。
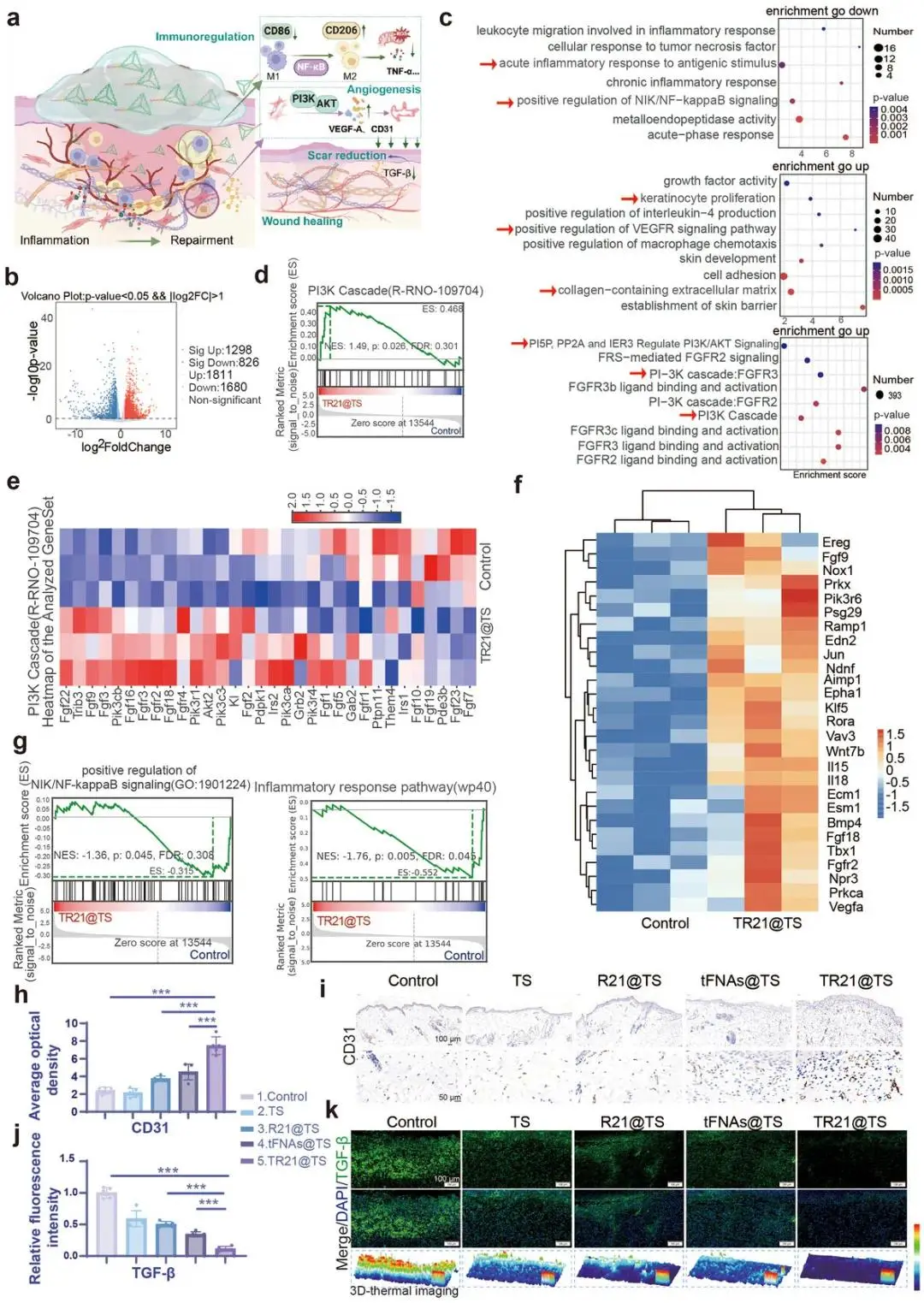
图8. 不同处理下创面的转录组测序分析、血管生成及疤痕减少评估。(a)TR21@TS水凝胶免疫调节、促血管生成及抗疤痕机制示意图;(b)差异基因火山图;(c)GO上下调通路富集(红色箭头示TR21@TS最相关通路);(d)PI3K通路的GSEA;(e)PI3K相关热图;(f)血管生成相关热图;(g)NIK/NF-κB与炎症反应通路的GSEA;(h)CD31阳性区域统计;(i)CD31免疫组化图像;(j)TGF-β1荧光定量;(k)TGF-β1免疫荧光图像(绿色示TGF-β1,蓝色为细胞核,3D热图基于荧光强度重建)
(8)TR21@TS水凝胶通过免疫调节加速伤口愈合
探讨了TR21@TS对巨噬细胞极化的调节作用。通过免疫荧光染色检测第7天组织样本中CD86与CD206的表达,并使用F4/80标记巨噬细胞。对照组中M1型巨噬细胞标志物CD86呈现高表达,而M2型标志物CD206表达最低;相反,TR21@TS处理组则表现出CD86表达下降和CD206表达上升的趋势(图9a,b)。定量分析显示,与对照组(约37.8%)相比,tFNAs@TS组(约11.3%)与TR21@TS组(约8.1%)中CD86⁺巨噬细胞比例显著降低,同时CD206⁺巨噬细胞比例明显增加(图9c-e)。值得注意的是,TS、R21@TS及DM组之间未见显著差异,表明tFNA在促进细胞摄取miR-21-5p中具有重要作用。此外,对IL-1β、IL-6和TNF-α的免疫荧光染色及半定量分析表明,TR21@TS处理显著减轻炎症反应,尤其在IL-1β和IL-6水平上,与tFNAs@TS组相比差异具有统计学意义(图9f-i)。

图9. TR21@TS基于巨噬细胞对创面的抗炎与免疫调节作用。(a,b)不同处理后皮肤组织中F4/80、CD80及CD86的免疫荧光图像与定量;(c)F4/80标记巨噬细胞定量;(d)F4/80与CD86标记M1型巨噬细胞定量;(e)F4/80与CD206标记M2型巨噬细胞定量;(f)TNF-α定量;(g,h)TNF-α、IL-1β与IL-6免疫荧光图像(绿色示细胞因子,蓝色为细胞核,3D热图基于荧光强度重建);(i)IL-1β与IL-6定量
本研究成功构建了一种多功能止血愈创水凝胶TR21@TS,它将功能化的miR-21-5p tFNAs (TR21) 整合到止血TS水凝胶中。该水凝胶表现出快速凝胶化、可控降解、优异的生物相容性、强组织粘附性和高效的止血性能。机理上,TR21@TS通过抑制NF-κB活化促进巨噬细胞向M2表型极化以减轻炎症,并通过上调PI3K/AKT通路促进血管生成,从而协同加速糖尿病伤口愈合并减少瘢痕形成。这种集成止血、免疫调节和再生能力于一体的水凝胶系统,在伤口护理方面展现出巨大的临床应用潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

