
肽类药物凭借高特异性和选择性,在调节生理及病理过程方面展现出显著优势,尤其在肿瘤免疫治疗中备受关注。这类药物可通过阻断免疫检查点或调控翻译后修饰增强抗肿瘤免疫应答,例如靶向PD-1/PD-L1通路的肽类能够有效抑制肿瘤生长。然而,肽类药物的临床应用仍面临生物利用度低、膜透性差、半衰期短及靶向性不足等挑战。

基于上述问题,浙江大学林爱福团队开发了一种光控、温度响应的混合仿生纳米载体,用于靶向递送PD-L1抑制肽PTPR。该系统具有由1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC)和吲哚菁绿(ICG)组成的热敏脂质体核心,可实现近红外(NIR)触发的药物释放。氟化PTPR增强了PD-L1抑制效果,而外部仿生血小板膜涂层形成混合囊泡,延长了体循环并主动靶向肿瘤。在近红外(NIR)照射下,该系统在DPPC核心中诱导可调相变,触发肽释放并实现温和的光热疗法介导的ICD。在三阴性乳腺癌模型(包括原位、远端和转移性模型)中,该系统增强了T细胞浸润,促进了树突状细胞成熟,刺激了全身免疫反应,并有效下调了PD-L1表达,从而抑制了肿瘤进展。值得注意的是,它还在侵袭性肿瘤模型中诱导了持久的免疫记忆反应。总而言之,我们的研究提出了一个集成纳米平台,将精准的肿瘤靶向性和药物控制释放相结合,为改善基于肽的癌症免疫疗法的疗效提供了一种有前景的策略。该文章于2025年8月11日以《PD-L1-Targeting Biomimetic Photoresponsive Thermosensitive Liposomes for Triple-Negative Breast Cancer》为题发表于《Advanced Science》上(DOI: 10.1002/advs.202506841)。
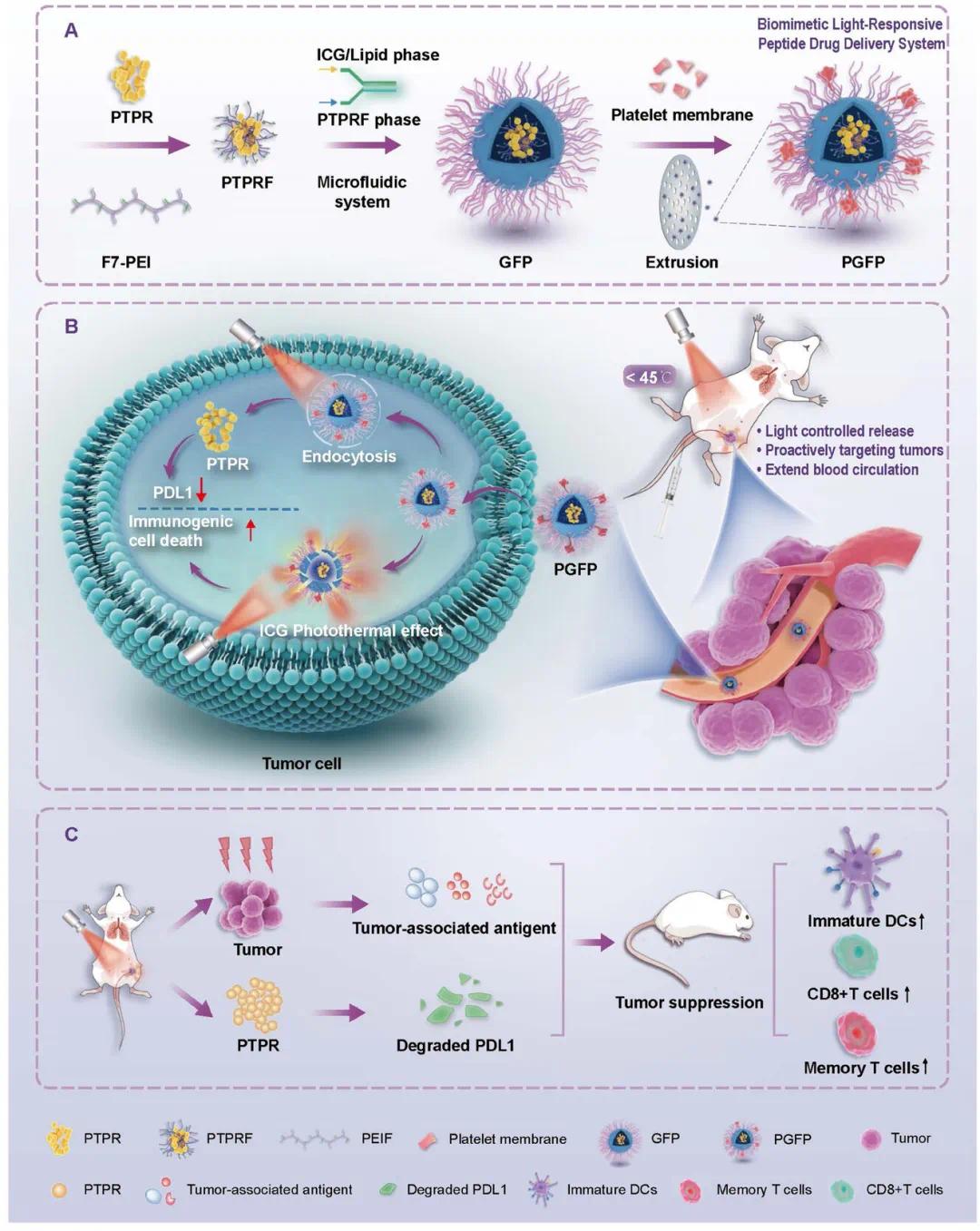
研究示意图
(1)PGFP的制备与表征
如图1A所示。该肽可破坏PD-L1与TMUB1之间的相互作用,并促进E3泛素连接酶HUWE1与PD-L1结合,从而诱导PD-L1泛素化降解,降低其细胞内水平(图1B、C)。此外,PTPR还显著增强T细胞对肿瘤细胞的杀伤作用,并上调T细胞中TNF-α和IFN-γ的表达(图1D–G),显示出恢复抗肿瘤免疫反应的潜力。为推进PTPR的治疗应用,我们构建了一种仿生、光响应及温敏的脂质体递送系统PGFP。该系统通过微流控技术将光敏剂ICG与氟化修饰的PTPR(PTPRF)共同包封于DPPC温敏脂质体中,实现药物的可控装载与释放。透射电镜图像显示,经血小板膜伪装的PGFP呈现典型核壳结构,表明膜融合成功(图1H)。其粒径约120 nm,分布均匀,适于肿瘤积聚与药物滞留(图1I)。Zeta电位表明脂质体或血小板膜有效屏蔽了纳米颗粒表面电荷(图1J)。紫外吸收光谱显示PGFP在785 nm处有特征吸收峰,证明ICG光热性能得以保持(图1K)。蛋白电泳与免疫印迹结果表明,PGFP保留了血小板膜的关键蛋白成分(如CD41、CD61),证实其仿生特性(图1L、M)。细胞毒性实验显示,PGFP及氟化PEIF1800处理组细胞存活率高,而PEI2500和PEI1800则显著降低细胞活力(图1N–Q)。不同浓度PGFP即便无激光照射也表现出良好生物安全性(图1R、S)。综上,PGFP具备低细胞毒性、高载药效率、膜衍生靶向能力及免疫调节功能,为靶向与刺激响应型递送提供了理想平台。

图1 PTPR 和 PGFP 的制备和表征。(A)PTPR肽的结构示意图;(B、C)免疫印迹和共沉淀实验;(D、E)RT-qPCR显示经PTPR处理的细胞中IFN-γ和TNF-α的mRNA水平;(F、G)4T1 细胞与活化的 T 细胞共培养染色实验;(H)TEM图像;(I)动态光散射;(J)Zeta电位;(K)吸收光谱;(L, M)SDS-PAGE和免疫印迹;(N,O)钙黄绿素 AM/PI 染色图像;(P, Q)CCK-8检测;(R, S)经不同浓度 PGFP 处理的 MDA-MB-231 细胞的 Calcein AM 和 PI 染色图像及荧光统计分析
(2)PGFP的体外细胞摄取和免疫治疗效果
采用FITC-PGFP体系评估PTPR体外胞质递送。PGFP以时间依赖性方式促进PTPR转运进入胞质。在孵育的第一个小时内,大部分内化的PGFP与LysoTracker Red共定位,表明其定位于胞质体(图 2 A,B)。在无激光照射的情况下孵育3-6 h后,一小部分PGFP成功从胞质体中逸出并释放到胞质中(图 2C,D)。8 h后,未观察到额外的胞质逸出,表明PGFP已完成胞质释放(图 2E)。用 FITC-PGFP 处理的 4T1 细胞的流式细胞术分析显示,PTPR 呈剂量依赖性增加(范围从 10 到 50 µM),与用 50 µM 游离 FITC-PTPR 处理的细胞相比,PGFP 处理的细胞的摄取量明显更高(图 2F、G)。这些结果证实 PGFP 显著增强了 PTPR 的递送和细胞摄取。与 GP 和 GFP 相比,涂有血小板膜的 PGFP 纳米粒子被 MDA-MB-231 细胞内化率明显提高。这种增强的摄取可能归因于血小板膜的仿生特性。具体来说,血小板衍生的粘附分子,如 P 选择素、整合素 α6β1 和整合素 αIIbβ3,可能与肿瘤相关受体(如 PSGL-1、CD44、ADAM9 和整合素 αvβ3)结合,最终促进肿瘤细胞主动内化。免疫印迹分析表明,PGFP 和 PTPRF 在浓度为 10 µ M时即可有效抑制 PD-L1 表达,而游离 FITC-PTPR 则需要更高的 20 µM 剂量才能达到相当的抑制效果(图 2H)。此外,与单独使用PTPR治疗相比,PGFP显著上调了T细胞中TNF-α和IFN-γ的表达(图 2I、J),凸显了其增强抗肿瘤免疫反应的潜力。这些结果表明,PGFP不仅改善了PTPR的细胞内递送,还通过有效下调PD-L1并促进T细胞介导的细胞毒作用来增强其免疫治疗效果。

图2 PGFP的细胞摄取和体外免疫因素。(A-E)4T1细胞与FITC标记的PGFP孵育1、3、6和8小时的共聚焦激光扫描显微镜图像。内体用LysoTracker Red染色,细胞核用Hoechst 33342复染。(F,G)流式细胞术分析细胞摄取(H)免疫印迹分析(I,J)使用 RT-qPCR 分析 PTPR 或 PGFP 处理后 T 细胞中 IFN-γ (I) 和 TNF-α (J) 的表达
(3)PGFP的光热效应及光热激活评价
ICG 因其优异的生物相容性和强大的近红外荧光特性,被广泛应用于血液循环监测、肝功能评估、肿瘤检测和淋巴结成像等医疗应用。为评价仿生 PGFP 纳米载体的光热效应和药物释放行为,监测了不同 PGFP 浓度在近红外辐照下的温度变化。在 808 nm 激光辐照(1.0 W/cm2)下PGFP 表现出浓度依赖性温度升高,在 60 µM 浓度下 2 分钟内温度飙升超过 30 ℃。相反,PBS 在相同条件下显示出最小的温度变化(图 3A、B)。此外,PGFP(ICG 80 µM)在连续五次开启/关闭辐照循环中表现出很强的光热稳定性,在重复暴露后加热效率仅略有降低,同时将温度保持在 60 ℃ 以上(图 3C)。为了评估其在温和辐照条件下的光热性能,测量了不同功率密度下 PGFP(60 µM)的温度变化。随后,在 4T1 和 MDA-MB-231 细胞中评估了光活化 PGFP 的细胞毒性。PGFP 诱导的细胞毒性具有剂量和激光依赖性,浓度升高、照射时间延长和功率密度更高会导致细胞活力下降幅度更大(图 3D-G)。使用标记有DID或FITC-PTPR的PGFP纳米粒子,结合溶酶体标记物LysoTracker Green或Red,评估了PGFP在近红外照射下的溶酶体逃逸能力。孵育3小时后,与未照射的对照组相比,激光照射的PGFP纳米粒子表现出显著增强的逃逸溶酶体的能力(图 3H-J)。激光引起的温度升高(≈42℃)促进了PTPR从PGFP纳米粒子中释放,破坏了PD-L1的翻译后修饰,导致其表达降低(图 3K-M)。)。此类结果强调了PGFP促进精确激光触发药物释放的潜力,从而提高PD-L1免疫检查点阻断的治疗效果。通过将PGFP注射到小鼠尾静脉,然后在8 h循环期后用近红外光照射肿瘤来评估体内光热性能。在初始激光功率为2.0 W/cm 2的情况下,PGFP处理小鼠的肿瘤表现出快速的温度升高,并且通过调节激光功率成功地将肿瘤温度维持在≈42 ℃(图 3N)。相反,PBS,闪烁脂质体或GFP处理小鼠的肿瘤表现出较慢的温度升高和较低的最高温度。虽然GFP处理的肿瘤显示出温度的快速升高,但它们未达到与PGFP组相同的肿瘤温度。PGFP增强的光热性能可能归因于仿生血小板膜涂层,其提高了肿瘤的积累和光热转换效率。这些结果表明PGFP是一种高效且可控的光热剂,具有明显的肿瘤靶向性和治疗潜力。
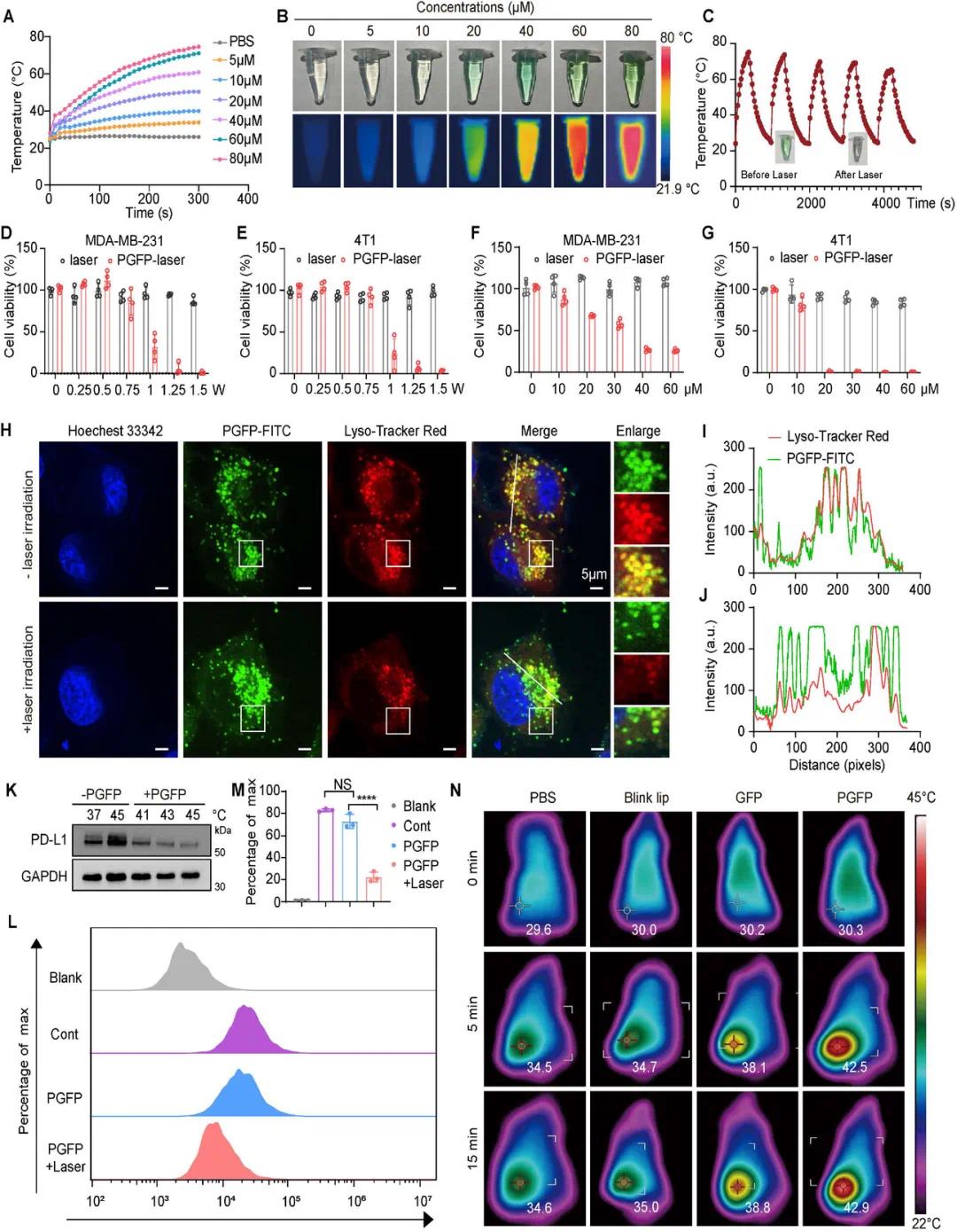
图3 体外和体内 PGFP 光热激活评估。(A) 在 1 W/cm 2近红外激光辐照下,不同 ICG 浓度的 PGFP 温升曲线。(B) 在 1 W/cm2 激光辐照下,不同 ICG 浓度的 PGFP 的红外热图像。(C) 在 1 W/ cm 2下连续五个开/关辐照周期内 PGFP 的温度波动。(D,E)在不同功率密度的激光辐照下用 PGFP 处理的 MDA-MB-231 或 4T1 细胞的细胞活力。(F,G) 在 1 W/cm 2 激光辐照下,用不同 ICG 浓度的 PGFP 处理的 MDA-MB-231 和 4T1 细胞的细胞活力。 (H-J)共聚焦激光扫描显微镜 (CLSM) 图像和定位分析曲线。(K)在不同温度下 PGFP 处理后 PD-L1 蛋白表达的免疫印迹分析。(L,M)在有和没有近红外照明的条件下,流式细胞术分析 PGFP 对 PD-L1 蛋白的抑制情况。(N)小鼠的红外热图像
(4)CD62p/CD44介导的PGFP纳米载体体内肿瘤靶向性
将荧光标记的纳米载体(PTPR-FITC、GFP-FITC 或 PGFP-FITC)静脉注射到 4T1 荷瘤 BALB/c 小鼠体内,以评估其循环动力学和生物分布。尾静脉注射后 24 小时对肿瘤和主要器官进行成像,结果显示 PGFP-FITC 和 GFP-FITC 在肿瘤组织中的蓄积量高于 PTPR-FITC,而 PTPR-FITC 的荧光相对较弱。值得注意的是,用仿生血小板膜修饰的 PGFP-FITC 表现出比 GFP-FITC 更强的肿瘤蓄积量(图 4 A、B)。这种增强作用归因于混合血小板膜蛋白 CD62p 与肿瘤细胞表面过表达的 CD44 受体的特异性结合。这些研究结果表明, CD62p/CD44 相互作用可有效介导 PGFP 主动靶向肿瘤微环境。对不同时间点采集的血液样本进行荧光成像分析显示,与PTPR-FITC相比,GFP-FITC和PGFP-FITC显著延长了血浆循环时间(图 4C、D)。在测试的制剂中,PGFP-FITC的循环时间最长,约为48小时(图 4D)。这些结果表明,血小板膜修饰显著延长了纳米载体在血液中的循环时间,从而可能增强其治疗效果。进行体内成像以评估小鼠体内的DID-PGFP生物分布。注射后12小时,DID-PGFP信号主要定位于肝脏和乳腺区域附近的皮下肿瘤结节(图 4E,F)。相反,未封装的DID表现出较低的肿瘤定位和快速的全身清除(图 4G-I)。对注射FITC-PGFP 12小时后收集的主要器官(心脏,肺,肾,肝脏和脾脏)的冷冻切片进行荧光分析证实了脱靶积累减少和肿瘤特异性定位增加(图 4J,K)。这些结果表明,血小板膜修饰的PGFP纳米系统具有显着延长的血浆半衰期和增强的肿瘤蓄积,支持其作为靶向癌症治疗的有效平台的潜力。

图4 PGFP的体内肿瘤靶向作用。(A,B)在静脉注射FITC-PTPR、GFP-FITC或PGFP-FITC 24小时后,进行离体荧光成像和定量分析,以评估4T1肿瘤小鼠肿瘤和主要器官中FITC-PTPR的积累情况。(C,D)在静脉注射游离FITC-PTPR或PGFP-FITC后,测量小鼠血清中FITC-PTPR的时间依赖性荧光强度。(E)在尾静脉注射游离DID或DID标记的PGFP(n=3)后12小时对小鼠进行体内荧光成像。(F,G)在 4T1 荷瘤小鼠的肿瘤和主要器官中进行离体荧光成像和 DID 蓄积定量分析。(H,I)在小鼠静脉注射游离 DID 或 DID-PGFP 12 小时后,进行荧光成像和定量分析小鼠血清中的 DID 荧光强度。(J,K)冷冻肿瘤切片和主要器官的代表性荧光图像和荧光强度定量分析
(5)808nm激光照射对PGFP的抗肿瘤作用
使用 4T1 荷瘤 BALB/c 小鼠模型评估 PGFP 联合温和光热疗法的抗肿瘤效果,重点关注实体肿瘤中的 PD-L1 破坏和 ICD。NIR 激光治疗组在注射后 8 小时接受单次激光照射(808 nm,42 ℃,15 分钟)(图 5 A)。与盐水、PTPR 和 PGF+(用血小板膜包裹并共负载 ICG 和 PEIF 的脂质纳米颗粒;“+”表示近红外激光照射)治疗相比,PTPR 联合纳米载体介导的光热疗法(PGFP+)表现出更好的抗肿瘤效果(图 5B-E)。此外,我们分析了脾脏、淋巴结和肿瘤中的免疫细胞活性,以及关键免疫细胞因子的血清水平。与盐水组相比,PTPR 组的肿瘤组织中 CD8⁺ T 细胞浸润增加,PD-L1 蛋白表达降低。同样,温和的光热疗法导致 PD-L1 蛋白表达上调、CD8⁺ T 细胞浸润增加,表明 ICD 增强和潜在的适应性免疫反应。值得注意的是,PGFP+ 组的肿瘤组织中 PD-L1 蛋白表达低于 PGF+ 组,CD8⁺ T 细胞浸润高于 PGF+ 组(图 5F)。此外,与 PGF+ 和 PTPR 组相比,PGFP+ 治疗小鼠的血清 TNF-α 和 IFN-γ 水平显着升高(图 5G、H),表明免疫激活强劲。此外,成熟树突状细胞(图 5I、J)和 CD8⁺ 细胞毒性 T 淋巴细胞(图 5K、L)的比例在 PGFP+ 组中显著较高,而调节性 T 细胞 (Tregs) 的比例显著较低(图 5M、N)。与肿瘤浸润淋巴细胞的这些改变相对应,PGFP+ 治疗显着抑制了肿瘤细胞增殖,促进了肿瘤组织内的坏死和凋亡,并显着延长了生存期(图 5O、P)。这些结果表明,我们的输送系统成功地将温和热疗与 PD-L1 抑制相结合,大大降低了肿瘤相关的免疫抑制并增强了抗肿瘤免疫反应。

图5 温和光热疗法联合免疫疗法有效抑制原发性肿瘤生长。(A)动物实验设计示意图。(B)4T1肿瘤BALB/c小鼠各治疗组治疗后肿瘤图像。(C)不同治疗组小鼠肿瘤重量统计(D)治疗后小鼠肿瘤体积统计。(E)4T1荷瘤BALB/c小鼠模型中,不同治疗方案后各小鼠原发性肿瘤的生长曲线。(F)治疗后BALB/c小鼠肿瘤组织中CD8+ T细胞的免疫荧光图像和PD-L1的免疫组化图像。(G,H)用ELISA法测定治疗后小鼠血浆中TNF-α和IFN-γ的水平。(I,J)4T1荷瘤小鼠模型中PGFP+策略诱导的树突状细胞(DC)成熟分析(以CD11c+ DC细胞为门控)。治疗后收集淋巴结细胞,并使用流式细胞术分析 CD11c、CD80 和 CD86 标记物。(K,L)小鼠脾脏 CD4+和 CD8+ T 细胞 的流式细胞术分析。(M,N)治疗后小鼠脾脏中 Treg 细胞频率的流式细胞术分析。(O,P)肿瘤组织切片的共聚焦图像
(6)PGFP策略抑制远端肿瘤生长
为评估PGFP诱导的主动免疫反应对未经治疗远处肿瘤的抑制作用,我们建立了双侧4T1肿瘤模型(图6A),仅原发瘤接受光照,远处瘤不进行治疗。结果显示,PGFP+治疗不仅有效抑制原发瘤生长(图6B–F),还显著延缓了远处肿瘤进展,其效果优于PGF+,表明温和光热疗法与PD-L1抑制在逆转“冷”肿瘤微环境中具有协同作用。PGFP+处理组小鼠血清中TNF-α和IFN-γ水平显著高于PTPR及PGF+组(图6G,H),提示全身免疫应答增强。同时,该组CD8⁺ T细胞比例上升、Treg比例下降(图6I–M),树突状细胞成熟程度也显著提高,表明PGFP+可有效诱导全身抗肿瘤免疫及免疫原性细胞死亡(ICD)。在未经照射的远处瘤内,PGFP+组也观察到细胞毒性T淋巴细胞浸润和活化增加(图6N,O),PD-L1蛋白表达下降,细胞凋亡(TUNEL⁺)增多,增殖指标(Ki67⁺)减少,说明其肿瘤微环境免疫应答显著增强。所有治疗组小鼠体重稳定,未出现明显下降,进一步证实PGFP策略具有良好的生物相容性和安全性。

图6 PGFP+策略对远处肿瘤的治疗效果。(A)小鼠远处肿瘤实验设计示意图。(B)4T1肿瘤BALB/c小鼠模型的原发性肿瘤和远处肿瘤组织的体外图像。(C,D)4T1肿瘤BALB/c小鼠模型中原发性肿瘤和远处肿瘤的肿瘤生长曲线。(E,F)接受不同治疗的小鼠原发性肿瘤和远处肿瘤的肿瘤重量。(G,H)不同治疗后小鼠血清中TNF-α和IFN-γ的水平。(I-K)对接受不同治疗的小鼠脾脏中的CD4 +和CD8 + T细胞进行流式细胞术分析。(L,M)各种治疗后小鼠脾脏组织中调节性T细胞(Tregs)的频率。(N,O)原发性肿瘤和远处肿瘤组织切片中CD8 +效应T细胞和TUNEL染色 的图像。肿瘤组织切片中PDL1和Ki67蛋白表达的免疫组织化学图像
(7)光激活PGFP系统的抗转移性肿瘤活性
采用肺转移性4T1肿瘤再刺激模型评估PGFP+治疗诱导的长期免疫记忆效应(图7A)。在该模型中,预先治疗两周的小鼠经尾静脉注射荧光素酶标记的4T1细胞,仅原发瘤接受照射。结果表明,PGFP+联合温和光热治疗与抗PD-L1肽递送显著抑制了原发瘤生长(图7B),并激活系统性抗肿瘤免疫。经生物发光成像及H&E染色评估,PGFP+预处理组小鼠未见明显肺转移,而盐水或载体组在14天内出现显著转移(图7C–E)。流式细胞术显示,PGFP+、PGF+及PTPR处理组小鼠脾脏中CD8⁺ T细胞比例增高(图7F–H),记忆T细胞群(包括中枢记忆与效应记忆T细胞)也显著扩增(图7I、J),表明免疫记忆成功建立。免疫荧光进一步证实,上述组别中转移性肺瘤内CD8⁺ T细胞浸润明显增加(图7K、L)。ELISA检测显示PGFP+组血清TNF-α和IFN-γ水平上升,印证免疫系统强效激活。综上,PGFP+疗法可系统抑制肿瘤转移、促进免疫记忆形成、增强T细胞浸润及树突细胞成熟,且所有治疗组未引起明显体重下降,显示出良好的生物相容性与治疗潜力。
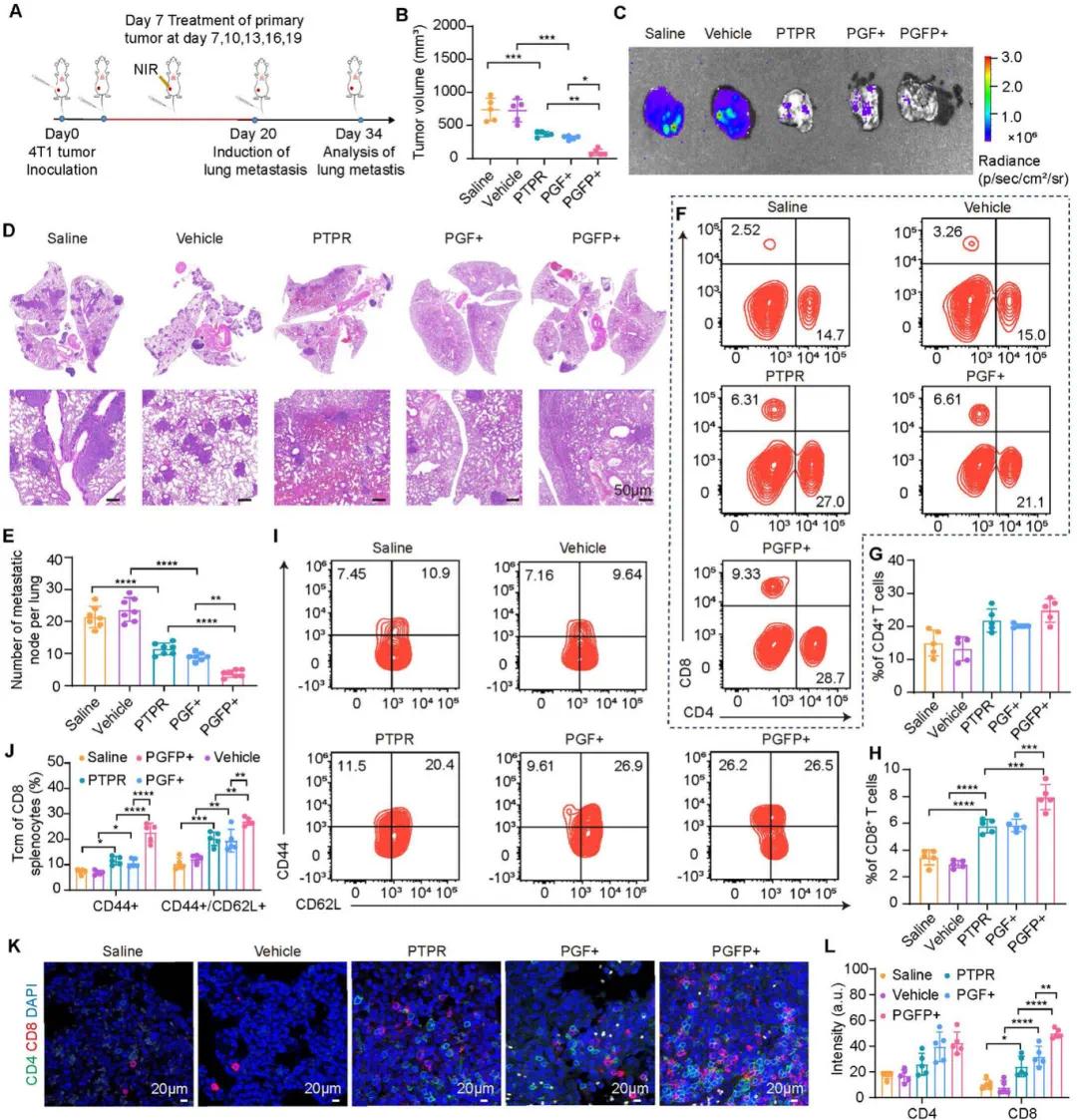
图7 PGFP+ 诱导的长期免疫效应对小鼠肿瘤转移的预防。(A) PGFP+ 介导的肿瘤转移抑制实验设计示意图。(B) 统计小鼠接受生理盐水、载体、PTPR、PGF+、PGFP+ 治疗后分离的原发性肿瘤体积。(C) 接受指定治疗后 4T1 肿瘤肺转移性结节的生物发光成像。(D) 接受指定治疗后 4T1 肿瘤肺转移性结节的 H&E 染色。(D) 肺转移性结节的定量分析。(F-H)治疗后小鼠脾脏中CD4+和 CD8+ T细胞的流式细胞术分析。(I,J) 小鼠在接受指定治疗后,效应记忆T 细胞 (CD3+ CD8+ CD44+ CD62L− ) 和中央记忆T 细胞 (CD3⁺ CD8⁺ CD44⁺ CD62L⁺) 的代表性流式细胞术图像和定量分析。(K,L)4T1肺转移性肿瘤组织切片中CD4 +(绿色)和CD8+(红色)T细胞的代表性免疫荧光图像及定量分析
本研究成功开发了一种多功能仿生纳米递送平台PGFP+,通过协同整合靶向肽介导的PD-L1蛋白降解和光热免疫调控策略,为肿瘤治疗提供了一种创新策略。该平台采用血小板膜功能化的纳米载体精准靶向肿瘤微环境,而温敏脂质体则能够在温和的局部热条件下实现药物的可控释放。氟化治疗肽有效抑制TMUB1与PD-L1的结合,并通过泛素-蛋白酶体途径促进PD-L1降解。此外,光敏剂ICG介导的光热效应可诱导免疫原性细胞死亡,从而重塑免疫抑制微环境。总之,本研究提出了一种新颖且前景广阔的基于肽的免疫治疗方法,旨在通过优化抗肿瘤免疫肽的递送以及利用光热效应的免疫调控策略来增强癌症免疫治疗。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

