
研究背景:
免疫治疗作为癌症治疗的新策略,尤其是免疫检查点抑制剂(ICIs)的应用,因其能诱导抗原特异性免疫记忆并控制肿瘤生长而备受关注。然而,在胶质瘤等实体瘤中,免疫治疗效果受限于脑部高度免疫抑制的肿瘤微环境(TME)。cGAS-STING通路在重编程免疫抑制性TME和增强ICIs治疗中起关键作用,但STING激动剂的临床应用受到多种因素限制。为克服这些限制,免疫治疗与放疗、化疗等联合应用成为研究热点。

针对上述问题,北京大学第三医院韩洪斌团队基于由聚合物PC6AB与磷酸锰离子聚合物(MnP)组成的有机-无机共聚物,开发了一种肿瘤微环境(TME)响应性纳米激动剂。纳米激动剂在酸性TME中的降解使其能够分别向肿瘤细胞和免疫细胞进行时空控制递送。具有膜溶解活性的PC6AB选择性地与肿瘤细胞膜相互作用以诱导免疫原性细胞死亡,而锰金属可以激活免疫细胞中的STING通路并触发下游免疫刺激信号。纳米激动剂在脑细胞外空间(ECS)局部注射后可以刺激强大的抗肿瘤免疫,在鼠胶质瘤中显示出显著的治疗效果。纳米激动剂能够响应TME并实现STING激活的时空协调,增强对“冷”实体瘤的免疫反应,为临床免疫治疗提供了一种有前景的方法。该文章于2025年4月29日以《Smart Organic–Inorganic Copolymer Nanoparticles Distinguish Between Microglia and Cancer Cells for Synergistic Immunotherapy in Glioma》为题发表于《Advanced Science》(DOI:10.1002/advs.202500882)。
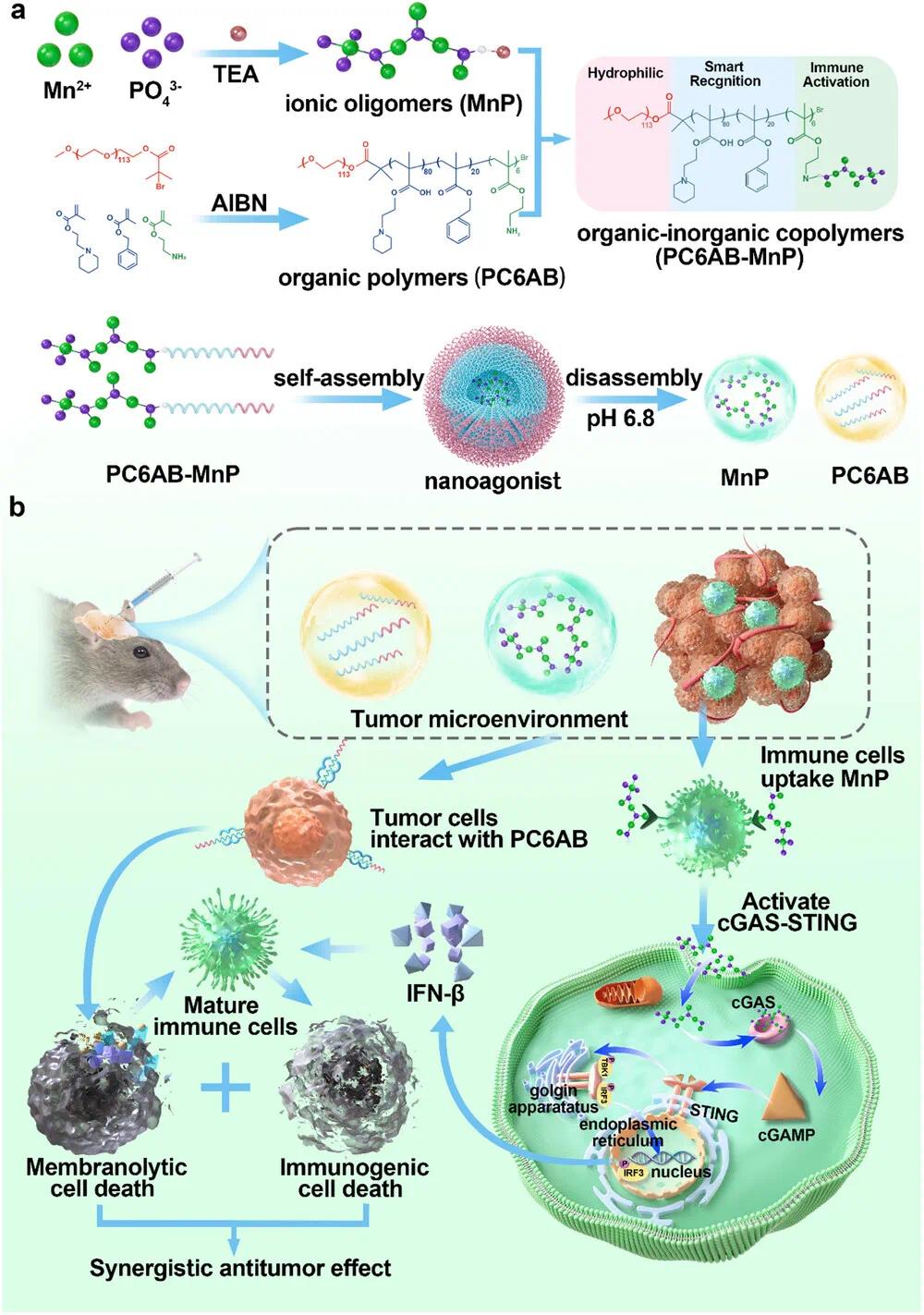
研究示意图
(1)纳米配体的构建与表征
MnP通过将锰离子和磷酸溶解在乙醇中,使用三甲胺(TEA)作为端帽剂制备,形成离子寡聚物而非磷酸锰结晶(图1a)。MnP的电喷雾电离质谱(ESI-MS)显示其以聚合状态存在(图1c)。粉末X射线衍射(XRD)表明MnP为非晶态(图1d)。MnP可与有机聚合物共聚形成复合材料,提高负载效率和稳定性,减少毒性。
PC6AB聚合物由聚(环氧乙烷)(PEO)片段和含有C6A、Bn和氨基乙基(AMA)甲基丙烯酸酯单体合成,其氨基可通过氢键与MnP偶联(图S5)。PC6AB-MnP的杂化通过将MnP加入PC6AB溶液中实现(图1e)。凝胶渗透色谱法(GPC)测得PC6AB-MnP的重量平均分子量为25.1 kDa。ATR-FTIR显示PC6AB与MnP间形成氢键(图1f)。拉曼光谱进一步确认了这种氢键介导的相互作用(图1g)。粉末XRD和差示扫描量热法(DSC)分析表明形成了新的配位复合物(图1h、图1i)。扫描电子显微镜(SEM)显示了无机寡聚物和有机聚合物的融合(图1j)。
通过自组装制备两种纳米颗粒:NP(纯PC6AB聚合物)和NP-MnP(与MnP偶联的PC6AB聚合物)。ICP-OES测得NP-MnP中MnP的包封效率为86.1%(图1k)。元素映射证实了NP-MnP中存在锰、氮和氧元素(图1l)。透射电子显微镜(TEM)显示NP-MnP和NP在pH 7.4时具有球形形态。纳米颗粒在低pH下降解导致荧光发射显著增加,不同pH下溶液的近红外一区(NIRI)显示出明显的荧光转变(图1m)。MnP作为T1加权MRI的造影剂,最佳成像浓度约为0.25–1.00 mm(图1n)。图1o显示MnP-NP的MRI具有pH依赖性,随着pH值降低,信号强度增加。体外MRI和NIRI研究证实了纳米颗粒的酸响应特性,MnP-NP可用作酸增强荧光/磁性成像探针。
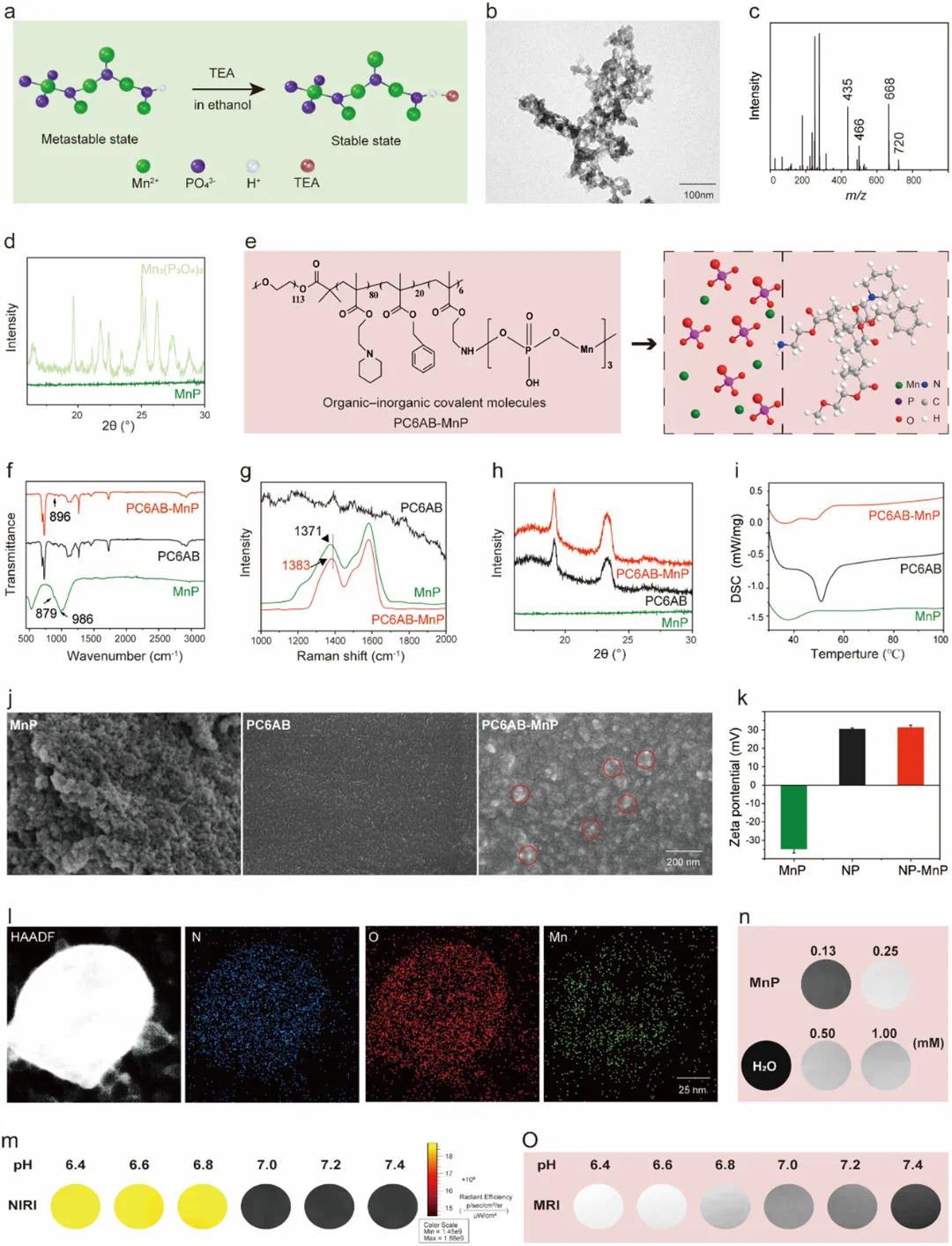
图1 NP-MnP的表征。(a)MnP寡聚物封端策略及反应条件示意图;(b)MnP的TEM图像,展示形态细节;(c)MnP的质量光谱;(d)MnP和Mn₃(PO₄)₂的XRD图谱;(e)PC6AB-MnP杂化分子结构示意图;(f)MnP、PC6AB和PC6AB-MnP的ATR-FTIR光谱;(g)MnP、PC6AB和PC6AB-MnP的拉曼光谱;(h)MnP、PC6AB和PC6AB-MnP的XRD图谱;(i)MnP、PC6AB和PC6AB-MnP的DSC图谱;(j)MnP、PC6AB和PC6AB-MnP的SEM图像,红色圆圈标示聚集的MnP;(k)MnP、NP和MnP-NP的zeta电位,数据为平均值±标准差(n=3);(l)NP-MnP的元素分布图;(m)NP-MnP在pH 6.4、6.8、7.0、7.2和7.4时的近红外光谱;(n)MnP在不同浓度下的T1加权MRI;(o)NP-MnP在pH 6.4、6.8、7.0、7.2和7.4下的T1加权MRI
(2)pH依赖性纳米激动剂的膜溶解选择性
PC6AB可在酸性肿瘤微环境中选择性破坏质膜,在正常组织中毒性小。在生理pH环境中,PC6AB自组装成中性纳米颗粒,膜裂解模块被屏蔽,膜溶解活性小(“OFF”状态)。在酸性肿瘤微环境中,NP-MnP通过质子化激活膜裂解模块,与肿瘤细胞膜上的磷脂酰丝氨酸结合,实现对肿瘤细胞和免疫细胞的特异性识别。实验表明,在pH 7.4时,NP-MnP对GL261细胞和BV2细胞毒性小(图2a,b)。在pH 6.8时,NP-MnP对GL261细胞毒性显著高于BV2细胞,表现出剂量和时间依赖性(图2c,d)。SEM和TEM结果显示,在pH 6.8时,NP-MnP使GL261细胞膜出现孔洞和细胞内容物释放,而BV2细胞膜无明显变化(图2e,f)。CLSM观察到,在pH 6.8时,NP-MnP-Cy5使GL261细胞肿胀、膜完整性受损,而BV2细胞形态和膜完整性不受影响(图2g,h)。脂质体实验表明,在pH 6.8时,模拟肿瘤细胞膜的脂质体与NP-MnP孵育后荧光斑点显著减少,表明膜破裂和染料泄漏,而模拟正常细胞膜的脂质体无明显变化(图2i-k)。这些结果证实了NP-MnP对肿瘤细胞膜的靶向破坏和膜溶解选择性。
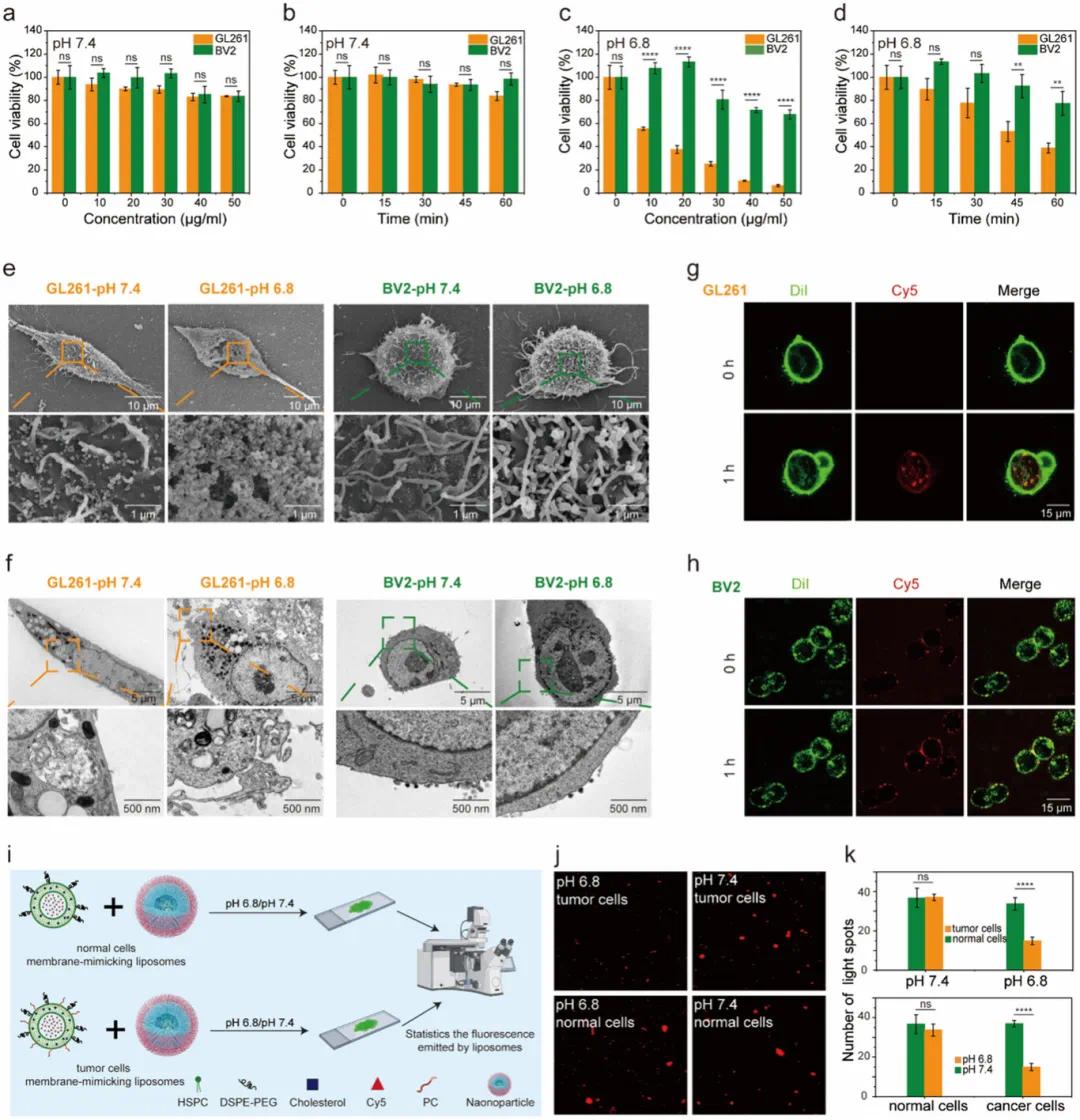
图2 NP-MnP的pH依赖性膜溶解选择性。(a)NP-MnP对GL261细胞和BV2细胞在pH 7.4下孵育1小时后的浓度依赖性细胞毒性;(b)NP-MnP对GL261细胞和BV2细胞在pH 7.4、浓度为25µg mL⁻¹下的时间依赖性细胞毒性;(c)NP-MnP对GL261细胞和BV2细胞在pH 6.8下孵育1小时后的浓度依赖性细胞毒性;(d)NP-MnP对GL261细胞和BV2细胞在pH 6.8、浓度为25µg mL⁻¹下的时间依赖性细胞毒性;(e)GL261细胞和BV2细胞在pH 7.4或6.8、用NP-MnP(50µg mL⁻¹)处理1小时后的SEM图像;(f)GL261细胞和BV2细胞在pH 7.4或6.8、用NP-MnP(50µg mL⁻¹)处理1小时后的TEM图像;(g)GL261细胞在pH 6.8、用NP-MnP-Cy5(50µg mL⁻¹)在不同时间点(0和1小时)处理后的图像;(h)BV2细胞在pH 6.8、用NP-MnP-Cy5(50µg mL⁻¹)在不同时间点(0和1小时)处理后的图像;(i)用于模拟不同细胞膜的脂质体模型示意图,NP-MnP的膜溶解活性通过观察脂质体在添加NP-MnP前后的荧光变化来评估;(j)在pH 7.4或6.8条件下添加NP-MnP后,正常细胞和肿瘤细胞膜模拟脂质体的图像;(k)确定每个视野的斑点计数并用于统计分析(n=3个视野)
(3)体外激活STING通路
免疫疗法改变了癌症治疗,但胶质母细胞瘤因免疫功能受损而高度免疫抑制。由锰和STING激动剂组成的纳米激动剂可提高胶质瘤抗肿瘤疗效,解决STING激动剂的降解和脱靶毒性问题。锰是cGAS-STING途径的激活剂。实验表明,MnP比MnCl₂更能上调P-TBK1、P-IRF3和P-STING的表达水平,且STING表达下降表明其磷酸化(图3a)。免疫荧光观察到MnP比MnCl₂更强地激活STING途径(图3b)。细胞毒性实验显示MnP在有效浓度范围内对GL261细胞和BV2细胞无明显毒性(图3c)。全基因组RNA测序分析显示,MnP处理的细胞与对照组相比有492个差异表达基因,其中229个上调,263个下调(图3d)。热图显示MnP处理的细胞中Ifnb1、Isg15和Cxcl10等基因上调(图3e),表明MnP通过诱导干扰素产生刺激免疫激活。
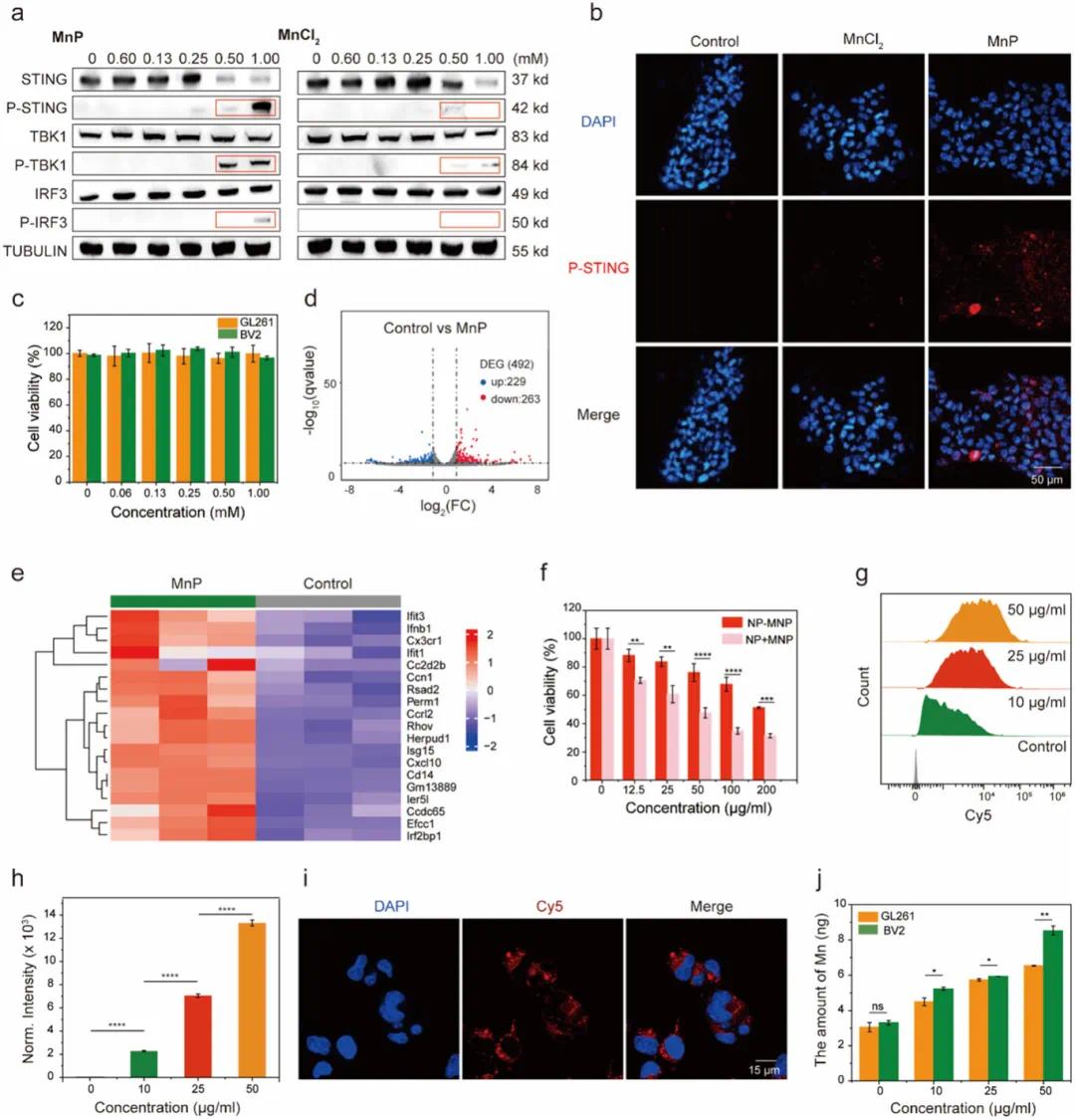
图3.MnP激活了cGAS-STING通路,并在体外促进了纳米激动剂的细胞内摄取。(a)经MnCl₂或MnP处理后,STING通路相关蛋白表达水平的浓度依赖性变化,通过蛋白质印迹分析确定;(b)治疗后P-STING表达的CLSM图像;(c)MnP对GL261细胞和BV2细胞的浓度依赖性细胞毒性,数据表示为均值±标准差(n=3),统计分析采用双因素方差分析,P值大于0.05表示无显著差异;(d)火山图显示PBS处理组和MnP处理组之间的差异表达基因;(e)PBS和MnP处理细胞的基因表达热图;(f)在pH 7.4条件下,NP-MnP或NP+MnP在孵育1小时后的浓度依赖性细胞毒性(NP-MnP:由共聚化的PC6AB-MnP自组装形成的纳米颗粒,NP+MnP:由PC6AB自组装形成的纳米颗粒,添加等量的MnP);(g)NP-MnP-Cy5在BV2细胞中浓度依赖性摄取的代表性流式细胞术图谱;(h)NP-MnP-Cy5在BV2细胞中浓度依赖性摄取的半定量;(i)BV2细胞与NP-MnP-Cy5孵育的代表性CLSM图像;(j)通过ICP-MS测量了用NP-MnP(10、25和50µg mL⁻¹)处理的GL261和BV2细胞内的锰(Mn)摄取量
Mn²⁺可在磷酸盐溶液中刺激免疫反应,但在生理盐水中无效,且易聚集沉淀失去佐剂活性。为解决此问题,用Mn²⁺、磷酸盐和TEA合成了MnP,TEA的加入稳定了磷酸锰,增强了其激活STING通路的有效性,且MnP的纳米颗粒结构提高了细胞摄取效率,与MnCl₂相比,STING通路激活更有效。实验显示,添加MnP的纳米颗粒细胞毒性更高(图3f),而MnP与有机聚合物聚合形成的纳米颗粒在生理环境下包封在疏水核中,表现出低毒性。
纳米激动剂在BV2小胶质细胞上的细胞内递送和免疫刺激作用研究表明,BV2细胞对NP-MnP-Cy5的摄取呈浓度依赖性(图3g,h)。共聚焦激光扫描显微镜(CLSM)监测到显著的细胞内内化(图3i)。电感耦合等离子体质谱法(ICP-MS)测量结果显示,BV2细胞比GL261细胞吸收了更多的锰,且随时间趋势更明显(图3j)。分析认为,BV2细胞中锰含量较高是PC6AB治疗诱导肿瘤细胞死亡的结果,而非MnP对免疫细胞的固有特异性。肿瘤细胞死亡后,免疫细胞被招募到肿瘤部位摄取MnP以增强免疫激活,且肿瘤细胞对MnP的摄取也可触发免疫激活反应,P-STING蛋白水平上调表明MnP激活了肿瘤细胞中的STING通路。
开环-无机共聚反应制备的含有锰和STING激动剂ADU-S100的纳米颗粒(NP-MnP-ADU)与免疫细胞中的cGAS形成复合物,产生强烈的抗癌免疫反应(图4a)。免疫荧光共聚焦激光扫描显微镜观察到与NP-MnP-ADU共培养的细胞中P-TBK1、P-IRF3和P-STING的上调表达(图4b)。Western blot数据显示,NP-MnP-ADU处理的BV2细胞中cGAS-STING通路的主要成分表达水平上调(图4c)。NP-MnP-ADU在肿瘤微环境中解体,PC6AB特异性裂解GL261细胞膜产生免疫原性,协同MnP和ADU激活BV2细胞的STING通路,产生显著的免疫激活效应。
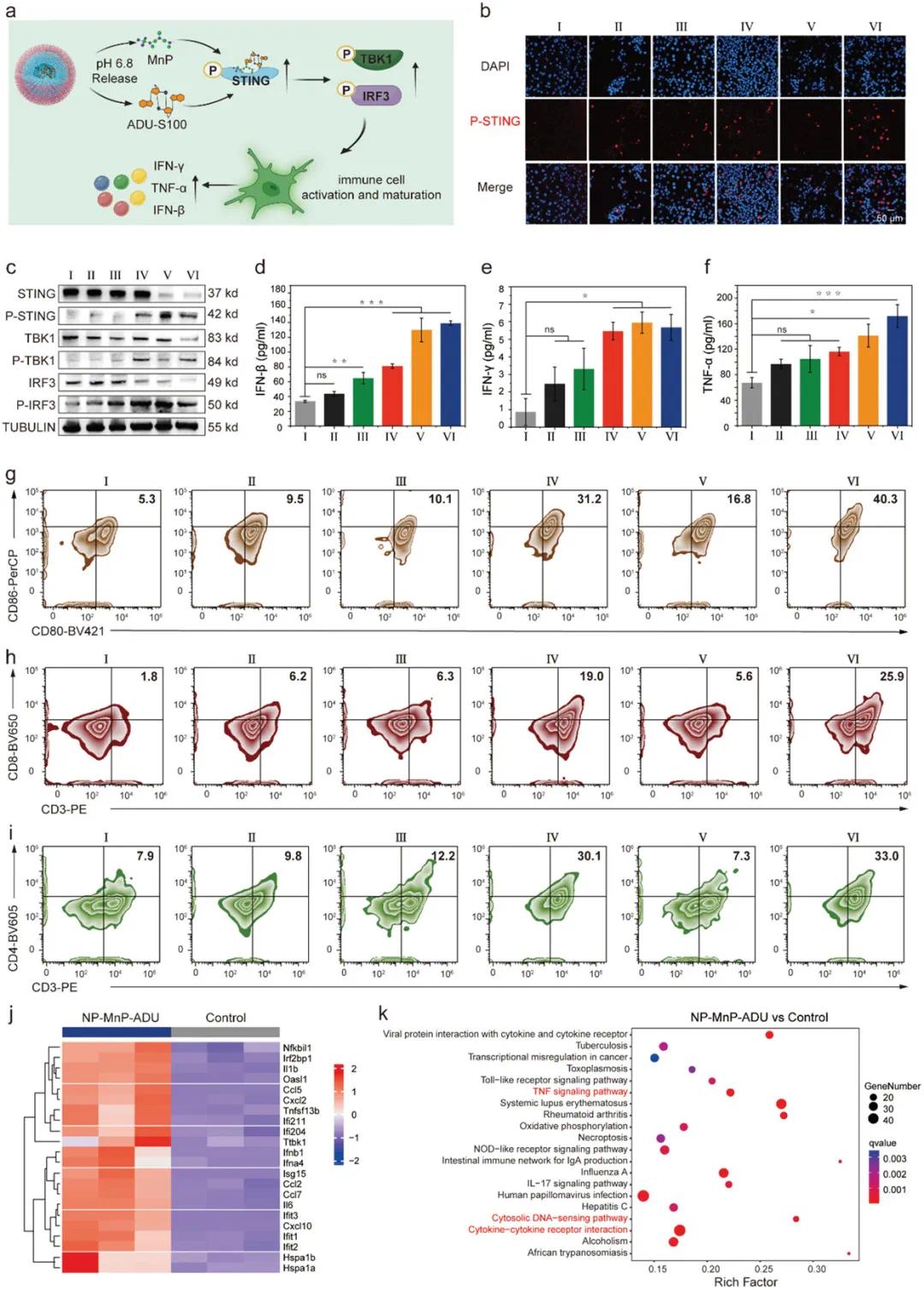
图4 纳米激动剂在体外刺激cGAS-STING通路介导的免疫激活。(a)纳米激动剂激活STING通路的机制示意图;(b)不同处理后BV2细胞中P-STING免疫荧光的CLSM图像;(c)不同处理后用GL261细胞上清液处理的BV2细胞中STING、P-STING、TBK1、P-TBK1、IRF3和P-IRF3表达水平的Western blot分析;(d-f)上述共培养体系中不同处理后免疫刺激细胞因子(包括IFN-β(d)、IFN-γ(e)和TNF-α(f))的分泌水平;(g-i)不同处理后与GL261细胞共孵育的BV2细胞中CD80+/CD86+(g)、CD3+/CD4+(h)和CD3+/CD8+(i)表达水平的代表性流式细胞术图像,不同处理包括:(I)对照组,(II)NP,(III)MnP,(IV)NP-MnP,(V)ADU和(VI)NP-MnP-ADU,所有流式细胞术实验均独立重复三次,结果相似;(j)用NP-MnP-ADU和PBS处理的细胞中基因表达的heat map;(k)对比NP-MnP-ADU处理组和PBS处理组细胞的差异表达基因进行KEGG分析,所有数据以均值±标准差(n=3)表示
为验证纳米激动剂能否增强肿瘤特异性免疫,设计了GL261肿瘤细胞和BV2免疫细胞的共培养系统模拟肿瘤微环境。ELISA测定显示,与对照组相比,NP-MnP-ADU处理下IFN-β、IFN-γ和TNF-α水平显著增加,表明STING通路被激活(图4d,f)。NP-MnP-ADU处理使BV2细胞中CD80/CD86阳性细胞数量显著增加(图4g),表明BV2细胞成熟度增强。共培养体系中,CD3+/CD4+T细胞和CD3+/CD8+T细胞数量显著增加(图4h,i),表明BV2细胞采取类似抗原呈递细胞的表型。RNA测序结果显示,NP-MnP-ADU处理的细胞中Ifnb1、Cxcl2和Ccl5基因上调(图4j),表明其诱导细胞因子和干扰素释放。GO分析显示,NP-MnP-ADU处理影响与IFN-β应答、细胞因子产生调控和免疫反应相关的通路中的基因表达(图S17)。KEGG富集分析鉴定出TNF信号通路、细胞质DNA传感通路和细胞因子-细胞因子受体相互作用等关键生物学通路(图4k),表明NP-MnP-ADU通过DNA传感机制激活STING通路,诱导细胞因子和干扰素释放,发挥抗肿瘤免疫作用。
(4)体内抗肿瘤作用
纳米激动剂NP-MnP-ADU在GL261原位胶质瘤小鼠模型中的抗肿瘤疗效得到进一步研究。该纳米激动剂由具有膜溶解活性的PC6AB与MnP耦合而成,封装了STING激动剂ADU。通过将GL261细胞植入小鼠尾状核建立动物模型,肿瘤植入后五天,小鼠每五天接受PBS、NP、MnP、NP-MnP、ADU或NP-MnP-ADU的治疗,共15天(图5a)。纳米激动剂通过脑内注射(CED)以0.75 mg/kg的剂量递送,有效跨越血脑屏障并显示出高生物相容性。研究还全面监测了纳米激动剂在全身给药后对接种GL261肿瘤的C57BL/6小鼠模型的毒性。结果显示,各组小鼠的关键肝指标(丙氨酸氨基转移酶,ALT和天冬氨酸氨基转移酶,AST)和肾指标(尿素和尿酸,UA)均在正常范围内,无显著变化,表明纳米激动剂未诱导肝或肾毒性(图5b–e)。此外,不同组小鼠的体重变化微乎其微(图5g),表明CED治疗比腹腔注射更安全,且未检测到可观察的毒性。
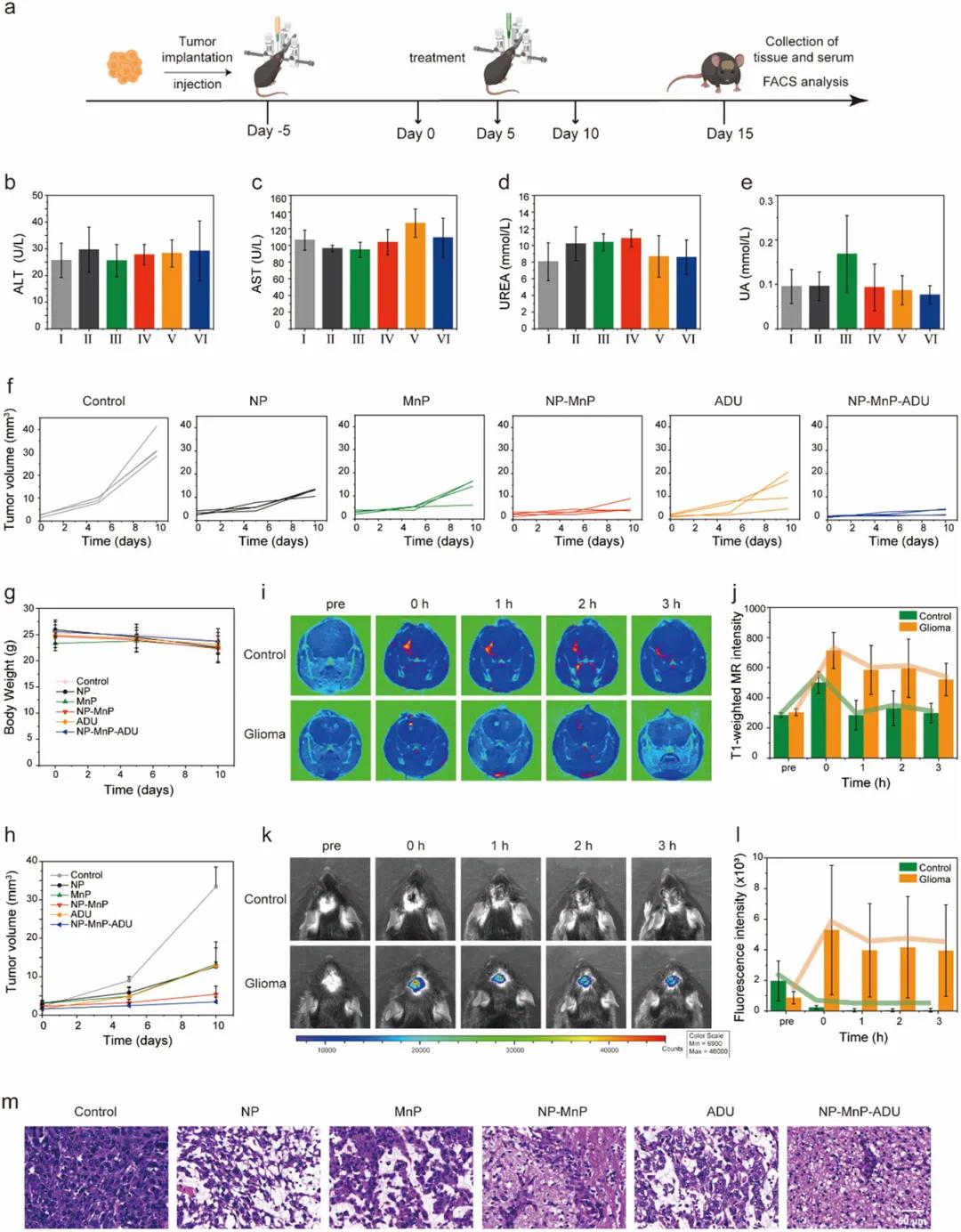
图5 局部肿瘤内给予纳米激动剂消除了已建立的肿瘤。(a)建立和治疗小鼠模型的时序示意图;(b-e)不同治疗后48小时血清中ALT(b)、AST(c)、UREA(d)和UA(e)的浓度,以评估其肝毒性和肾毒性,不同处理包括:(I)对照组,(II)NP,(III)MnP,(IV)NP-MnP,(V)ADU和(VI)NP-MnP-ADU,所有数据以均值±标准差(n=4)表示,采用单因素方差分析法进行统计分析,P值大于0.05表示无显著差异;(f)不同治疗后小鼠的肿瘤生长抑制曲线;(g)治疗期间小鼠的体重变化;(h)不同治疗后荷瘤小鼠的肿瘤体积监测;(i)通过CED单剂量给予NP-MnP-Cy5后健康和荷瘤小鼠的实时MRI图像;(j)通过CED单剂量给予NP-MnP-Cy5后MRI信号强度的变化;(k)通过CED单剂量给予NP-MnP-Cy5后健康和荷瘤小鼠的实时荧光图像;(l)通过CED单次给药NP-MnP-Cy5后荧光信号强度变化;(m)不同处理后脑组织样本的H&E染色结果,所有数据以均值±标准差表示(n=4)
NP-MnP-ADU在小鼠GL261肿瘤模型中显示出显著的抗肿瘤效果。PBS处理的小鼠肿瘤呈指数增长,20天后肿瘤大小增加到约32.6 mm³。NP、ADU和MnP治疗中等程度地抑制了肿瘤进展,平均肿瘤大小约为13 mm³,三者之间肿瘤大小无显著差异(图5f)。相比之下,NP-MnP-ADU治疗显示出最显著的肿瘤抑制效果,平均最终肿瘤大小约为3.42 mm³(图5h)。H&E染色显示纳米激动剂治疗期间癌细胞出现明显的核碎片化和核溶解(图5m),表明NP-MnP-ADU通过整合化疗和免疫疗法具有强大的抗肿瘤疗效。
为监测NP-MnP-ADU在肿瘤组织中的分布及其pH响应成像,评估了CED单剂量注射NP-MnP-Cy5(3µL)后胶质瘤小鼠的T1加权MRI和荧光图像。T1加权MRI显示,注射NP-MnP-Cy5后,GL261肿瘤模型小鼠的肿瘤实现了快速对比增强(图5i),而健康小鼠的T1对比度未显示任何增强,表明pH触发的锰释放对肿瘤探测至关重要。注射后,对比度在10分钟内迅速增加并维持约3小时,具有足够的肿瘤特异性,而健康小鼠的信号几乎未改变(图5j)。荧光成像显示,NP-MnP-Cy5在肿瘤部位的荧光信号强度显著高于对照组,而健康小鼠中未出现明显的NP-MnP-Cy5荧光信号(图5k,l)。48小时后,处死小鼠并对切除的主要器官进行成像,以分析NP-MnP-Cy5的代谢途径。
(5)NP-MnP-ADU 激活抗肿瘤免疫
NP-MnP-ADU治疗显著增强抗肿瘤免疫反应。流式细胞术分析显示,NP-MnP-ADU治疗的GL261肿瘤小鼠中CD80+/CD86+表达是对照组的4.3倍(图6a)。治疗后,肿瘤中CD4+T细胞和CD8+T细胞数量显著增加(图6b,c)。此外,NP-MnP-ADU治疗增加了促炎M1巨噬细胞表型(图6d),表明其可介导M2巨噬细胞向M1表型极化,减轻免疫抑制。血清中IFN-β、IFN-γ和TNF-α水平显著增加,而IL-10降低(图6e–h),表明促炎细胞因子介导了抗肿瘤免疫反应。免疫荧光成像显示肿瘤组织中P-STING、P-TBK1和P-IRF3蛋白过表达(图6i),表明免疫反应通过cGAS-STING通路激活。NP-MnP-ADU通过激活cGAS-STING通路、促进T细胞激活和增加M1巨噬细胞比例,增强免疫细胞反应并抑制肿瘤生长。
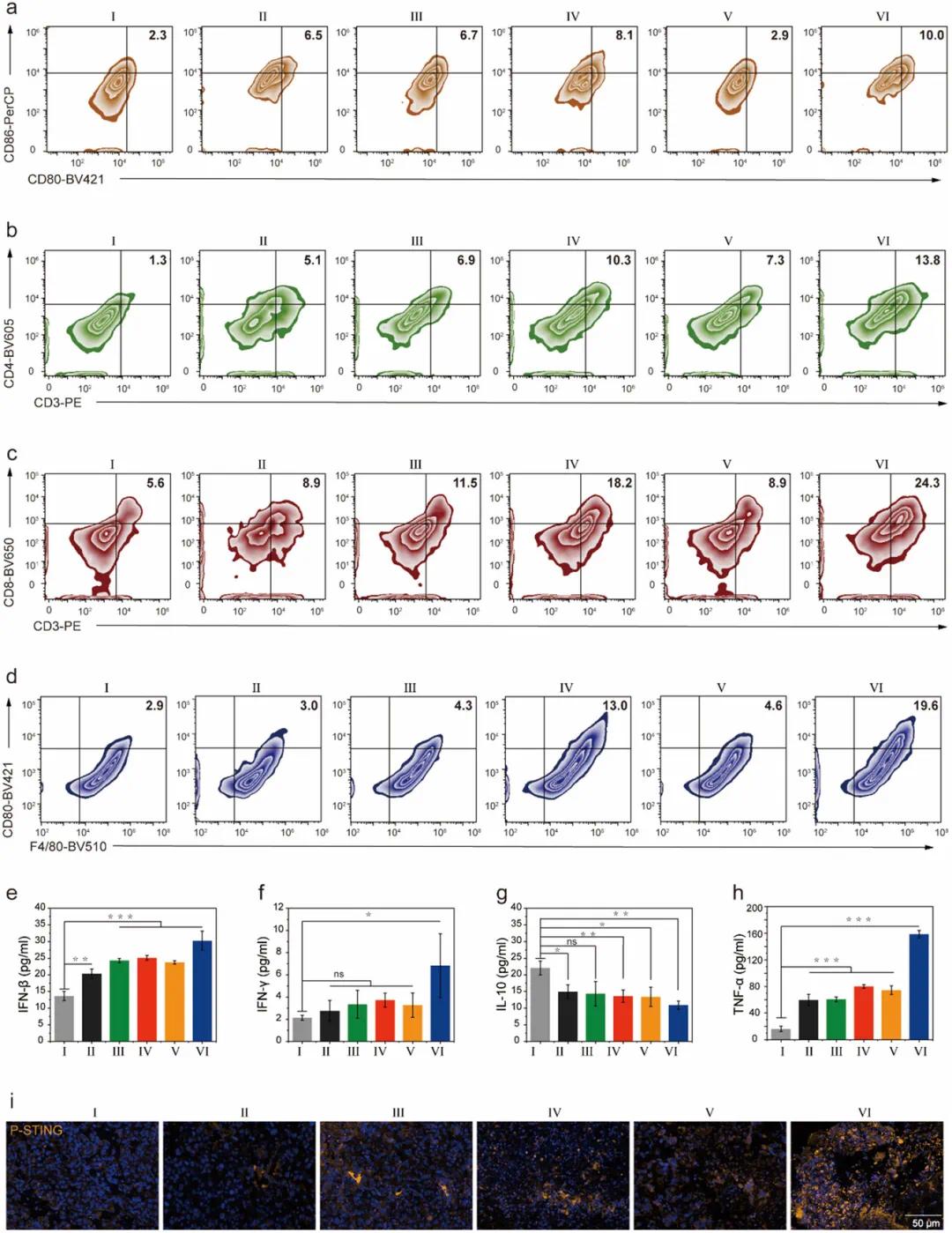
图6 纳米激动剂激活cGAS-STING通路促进细胞因子释放和免疫系统激活。(a-d)体内治疗后GL261肿瘤组织中CD80+/CD86+、CD3+/CD4+、CD3+/CD8+和F4/80/CD80+表达水平的代表性流式细胞术图像;(e-h)不同治疗后血清中IFN-β、IFN-γ、IL-10和TNF-α的分泌水平;(i)不同治疗后肿瘤中P-STING表达水平的免疫荧光分析,黄色:P-STING,蓝色:细胞核。不同处理包括:(I)对照,(II)NP,(III)MnP,(IV)NP-MnP,(V)ADU和(VI)NP-MnP-ADU。流式细胞术实验独立重复3次,结果相似,数据以均值±标准差(n=3)表示
本研究通过将无机聚合物与有机聚合物共聚激活STING通路并逆转免疫抑制,体内实验未见明显毒性。该有机-无机杂化聚合物方法拓展了金属离子在生物医学领域的应用,解决了金属离子循环时间短、急性毒性高的问题,为未来工艺和应用提供了有前景的平台。体内抗肿瘤免疫反应结果表明,NP-MnP比MnP诱导了更强的免疫激活效应,证实了NP和MnP在刺激免疫细胞成熟方面的协同效应。这种协同效应可能源于NP的膜溶解活性,该活性诱导免疫原性并释放大量肿瘤来源的双链DNA(dsDNA)到肿瘤微环境中,增强了肿瘤模型的免疫原性,为临床免疫治疗提供了新机遇。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

