
小胶质细胞在中枢神经系统中维持免疫稳态,其在AD病理中有Aβ激活型和正常型两种状态,Aβ激活型小胶质细胞释放促炎因子和ROS引发炎症,正常型分泌保护性介质减轻炎症并促进神经修复及Aβ清除。
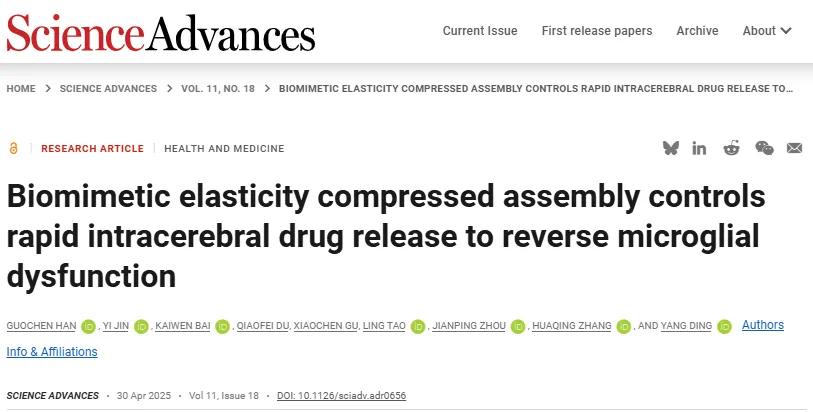
针对上述问题,中国药科大学丁杨、张华清、周建平等人开发的生物模拟弹性压缩组装体,以温敏性聚合物为基质,将疏水性姜黄素加载到超小CeO₂纳米酶上,经PDA外壳和apoA-I修饰,实现脑内靶向递送和ROS触发的药物爆发释放。在AD病变部位,该组装体能快速释放Cur和PCeO₂,Cur可高浓度将Aβ激活型小胶质细胞转变为正常状态并增强其吞噬功能,CeO₂持续抗氧化防止小胶质细胞线粒体在吞噬Aβ后受损。相关成果2025年4月30日发表于《Science Advances》。(DOI:10.1126/sciadv.adr0656)。
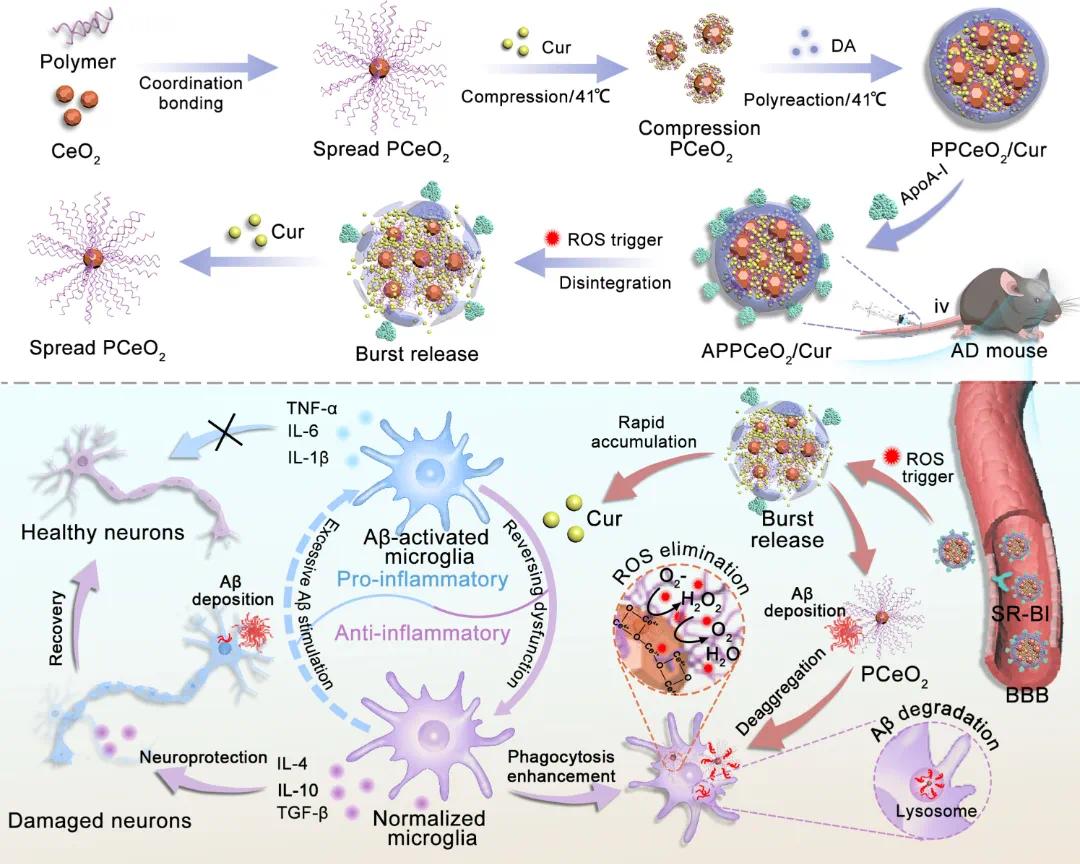
图1 研究示意图
(1)生物模拟组装的弹性压缩和扩散的制备和表征
合成温敏性聚合物pNIPAAm-co-pAAm,其低临界溶液温度(LCST)为41℃。在LCST时,聚合物链被压缩,疏水区域在CeO₂核上形成聚合物壳(图2A)。热收缩过程在37℃和41℃之间可逆(图2B)。为减少药物泄漏,设计PDA自聚合热封Cur负载的PCeO₂,形成PPCeO₂/Cur,尺寸从约28 nm增至约51 nm(图2C)。通过迈克尔加成反应,将apoA-I接枝到PPCeO₂/Cur表面,形成APPCeO₂/Cur,尺寸约62 nm,在含10%血清的PBS中稳定性更好(图2C和D)。穿过血脑屏障后,APPCeO₂/Cur的PDA外壳会被ROS特异性降解,使PPCeO₂核心伸展弹性聚合物链实现快速药物释放。制备不同厚度的APPCeO₂/Cur纳米颗粒,发现9 nm外壳的Cur释放速度比16 nm的更快(图2E)。具有9 nm外壳的APPCeO₂/Cur纳米颗粒在0.1 mM H₂O₂中孵育时,粒径在最初2小时内略有减小且分布均匀,8小时后粒径分布分为三部分(图2F)。透射电子显微镜(TEM)图像显示,APPCeO₂/Cur在H₂O₂中孵育8小时后,壳核结构解聚成碎片形态(图2G和H)。
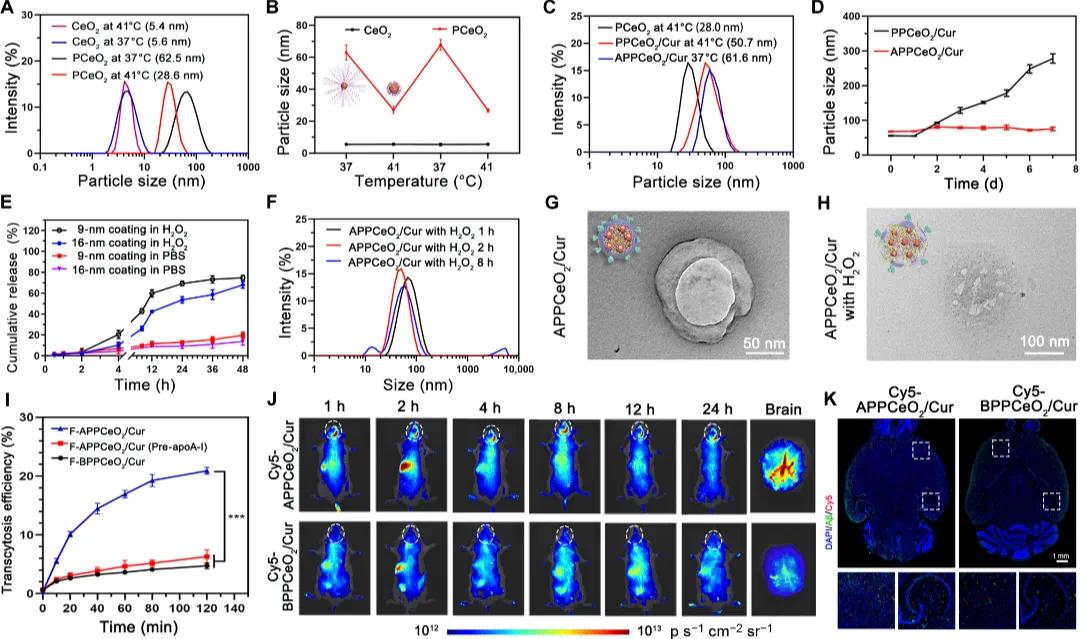
图2 APPCeO₂/Cur的表征。(a)CeO₂和PCeO₂在37°和41°C时的粒径分布;(b)CeO₂和PCeO₂在循环加热和冷却过程中的尺寸变化(n=3);(c)PCeO₂、PPCeO₂/Cur和APPCeO₂/Cur的粒径分布;(d)PPCeO₂/Cur和APPCeO₂/Cur在含10%血清的介质中的粒径变化(n=3);(e)不同厚度的APPCeO₂/Cur在H₂O₂(0.1 mM)或PBS(pH 7.4,0.01 M)中的Cur释放曲线(n=3);(f)在1、2和8小时内用H₂O₂(0.1 mM)处理的APPCeO₂/Cur的粒径分布;(g)APPCeO₂/Cur的TEM图像;(h)用0.1 mM H₂O₂处理的APPCeO₂/Cur的TEM图像;(i)APPCeO₂/Cur的BBB跨细胞转运效率(n=3),单因素方差分析结合Tukey-Kramer事后检验;(j)用Cy5标记的APPCeO₂/Cur和BPPCeO₂/Cur治疗的AD小鼠的代表性图像;(k)用Cy5标记的APPCeO₂/Cur和BPPCeO₂/Cur治疗的脑切片的代表性荧光图像
(2)生物启发的血脑屏障穿透和脑内蓄积
ApoA-I可介导HDL高效递送至大脑。图2I显示,F-APPCeO₂/Cur的跨细胞转运效率约为20.9%,是F-BPPCeO₂/Cur组(约4.7%)的4.4倍,表明ApoA-I修饰可促进APPCeO₂/Cur穿越血脑屏障。为研究血脑屏障转胞吞能力和脑内蓄积,将Cy5标记的ApoA-I和BSA偶联到PPCeO₂/Cur上,得到Cy5-APPCeO₂/Cur和Cy5-BPPCeO₂/Cur,并给予AD模型小鼠,进行活体荧光成像(图2J)。结果显示,Cy5-APPCeO₂/Cur在脑区有强荧光信号,而Cy5-BPPCeO₂/Cur荧光微弱且随时间几乎不变。脑切片荧光成像(图2K)显示,Cy5-APPCeO₂/Cur组中,纳米颗粒与Aβ斑块分布区域显著重叠,尤其在大脑皮层和海马区。
(3)通过爆发式药物释放实现微胶球状态转换
Cur以浓度依赖性方式使小胶质细胞正常化,设计爆发式药物释放机制对实现这一目标至关重要(图3A)。模拟AD脑中ROS触发的爆发释放,不同浓度Cur的APPCeO₂/Cur被0.1 mM H₂O₂预处理后与Aβ激活的胶质共孵育。CD206用于标记归一化的胶质(图3B)。在PCeO₂、PPCeO₂和APPCeO₂处理组中,CD206表达无显著影响。低剂量(1 μg/ml,L)或中剂量(5 μg/ml,M)Cur的APPCeO₂/Cur处理组中,CD80水平略有下降,CD206表达增加。高浓度(10 μg/ml,H)Cur的APPCeO₂/Cur处理组中,CD206表达显著增加,CD80下降。定量分析显示,Aβ激活的小胶质细胞(CD80⁺)比例从3.7%降至23.6%,正常小胶质细胞(CD206⁺)比例从3.7%增至18.7%,在APPCeO₂/Cur (H) (Pre-H₂O₂)组中增加五倍。高剂量Cur高效调节Aβ激活的小胶质细胞至正常小胶质细胞。
使用ELISA检测培养上清液中的促炎因子,不同组的条件培养基用于与SH-SY5Y细胞共孵育(图3C)。如图3D,随着Cur浓度增加,APPCeO₂/Cur (L)–、APPCeO₂/Cur (M)–和APPCeO₂/Cur (H)–处理组的促炎细胞因子水平依次降低,抗炎因子IL-4、TGF-β和IL-10水平分别增加60.8%、80.2%和98.2%。细胞因子分泌趋势与小胶质细胞状态转变一致,证实表型转变减轻炎症反应。如图3E,与PBS组条件培养液共培养后,SH-SY5Y细胞活力降至52.0%,表明Aβ毒性和炎症因子加剧神经元损伤。PCeO₂、PPCeO₂和APPCeO₂组条件培养液孵育的SH-SY5Y细胞存活率高于PBS组。小胶质细胞状态调控改善炎症微环境并恢复神经元损伤。此外,表型调控后小胶质细胞的Aβ吞噬能力增强,APPCeO₂/Cur (H) (Pre-H₂O₂)表现出更高的Aβ细胞内化效率(图3F)。
图3 巨噬细胞受曲美他嗪调节的表征。(a)巨噬细胞受曲美他嗪爆发式释放调节的示意图;(b)巨噬细胞与不同浓度的曲美他嗪纳米颗粒孵育48小时后,Aβ激活巨噬细胞生物标志物CD80和正常巨噬细胞生物标志物CD206的表达;(c)实验设计示意图,包括炎症细胞因子分析和SH-SY5Y条件培养;(d)通过ELISA检测BV-2细胞分泌的促炎细胞因子(如TNF-α、IL-1β和IL-6)和抗炎细胞因子(如IL-4、IL-10和TGF-β)的水平(n=3);(e)炎症改善后的神经保护作用(n=6);(f)不同制剂处理后Aβ激活巨噬细胞的Aβ细胞摄取效率(n=3)
(4)分解Aβ斑块以促进小胶质细胞介导的Aβ清除
Aβ的亲和力是Aβ捕获和去聚合的基础。分子建模实验通过对接计算和分析聚合物在PCeO₂表面上的单元与Aβ肽的氨基酸残基之间的相互作用,表明Aβ被结合在Aβ单体的螺旋结构、寡聚物和纤维的β片结构中的聚合物片段上。图4A显示了对接聚合物链的50个构象中最好的对接分数。PCeO₂装配对Aβ单体和寡聚体的结合亲和力显著增加,亲和力值分别为5.12×10⁻⁷和3.03×10⁻⁷M(图4B)。使用ThT检查PCeO₂对Aβ纤维素的解聚作用,图4C显示PBS组因Aβ纤维素中丰富的β折叠结构显示出最大的ThT荧光,而PCeO₂组荧光强度显著降低(约33%),仅用聚合物处理的组降低了17%,验证了聚合物在Aβ斑块中的解聚能力及PCeO₂的多价结合可加速Aβ斑块分解。
为探索PCeO₂引起的斑块解聚是否会减弱“扬尘”效应,应用膜联蛋白V-FITC/PI染色检测神经细胞凋亡(图4D)。Aβ寡聚体组凋亡率为49.98%,Aβ纤维组凋亡率为37.01%。而用PCeO₂处理的SH-SY5Y细胞凋亡率分别降至4.11%和4.02%,表明PCeO₂能有效防止由“扬尘”效应引起的神经元凋亡。为研究促进Aβ解聚后PCeO₂的Aβ清除效果,检测了Aβ摄取能力。图4E显示,即使在PCeO₂帮助下有更多Aβ₁₋₄₂内吞到小胶质细胞中,仍检测到最低的细胞内Aβ₁₋₄₂水平。共聚焦激光扫描显微镜进一步探索Aβ的降解过程,与PCeO₂共孵育的FAM-Aβ在细胞膜上荧光弱,细胞内荧光强,且FAM-Aβ与溶酶体共定位,证实PCeO₂通过小胶质细胞的溶酶体网络促进Aβ降解。
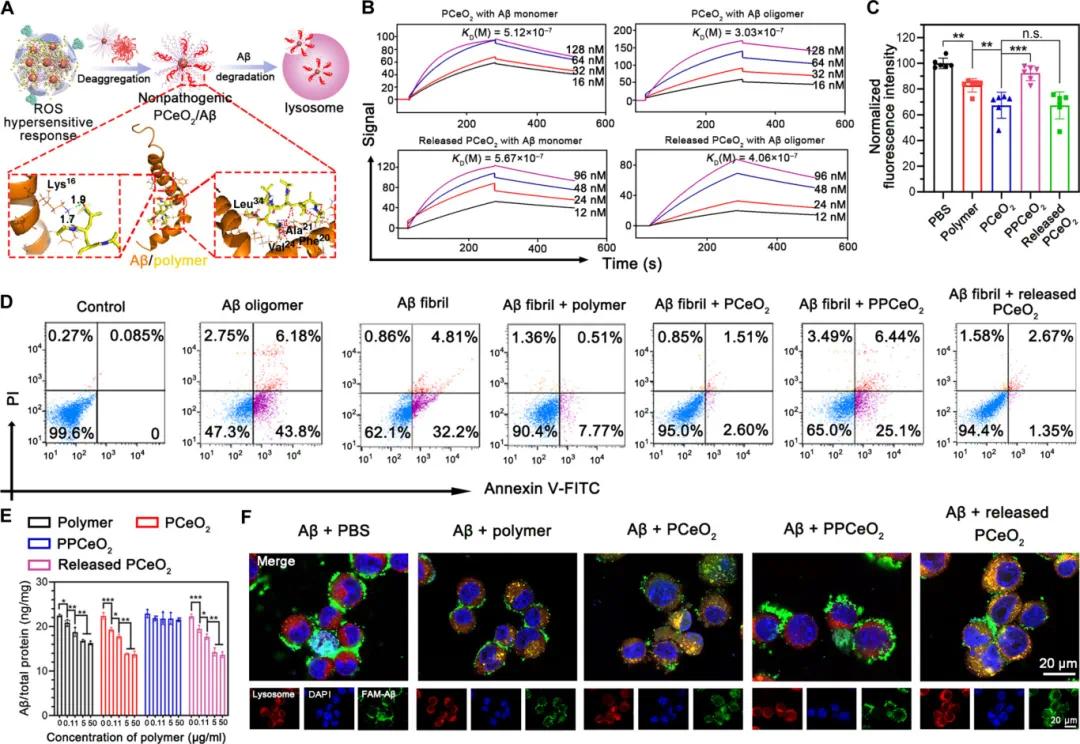
图4 APPCeO₂/Cur促进Aβ斑块解聚和清除的表征。(a)APPCeO₂/Cur促进Aβ斑块解聚和清除的方案,聚合物链与Aβ肽的疏水和亲水残基相结合;(b)SPR测定PCeO₂和释放的PCeO₂与Aβ单体(或寡聚体)的结合亲和力;(c)采用ThT荧光测定法监测Aβ沉积物的解聚(n=6);(d)流式细胞术分析多种制剂处理后的SH-SY5Y细胞凋亡分析;(e)ELISA检测多种制剂处理后小胶质细胞中的Aβ含量(n=3);(f)4小时后不同制剂处理后的BV-2细胞中FAM-Aβ的代表性图像,释放的PCeO₂代表H₂O₂预处理和通过超滤离心去除Cur
(5)消除活性氧和预防线粒体损伤
Aβ诱导的小胶质细胞活化产生过多ROS,导致线粒体功能障碍,减弱吞噬和降解能力。APPCeO₂/Cur组装体释放的CeO₂纳米酶通过Ce³⁺和Ce⁴⁺原子的电子转移消除ROS(图5A)。XPS分析显示,PCeO₂的Ce³⁺组分在聚合物配位改性后几乎不变,且在H₂O₂耗尽后可恢复还原态,表明其抗氧化特性不受影响(图5B和C)。DCFH探针检测结果显示,与PCeO₂组孵育的荧光强度最弱,与CeO₂组相同,表明ROS清除效果显著(图5D)。细胞水平上,Aβ刺激的BV-2细胞表现出强绿色荧光,而CeO₂组细胞内绿色荧光减少,ROS水平比PBS组降低55.6%(图5E和F)。JC-1检测显示,CeO₂处理后BV-2细胞线粒体膜电位恢复,红绿荧光比增加到2.7,表明CeO₂通过清除ROS阻止膜电位去极化(图5G)。
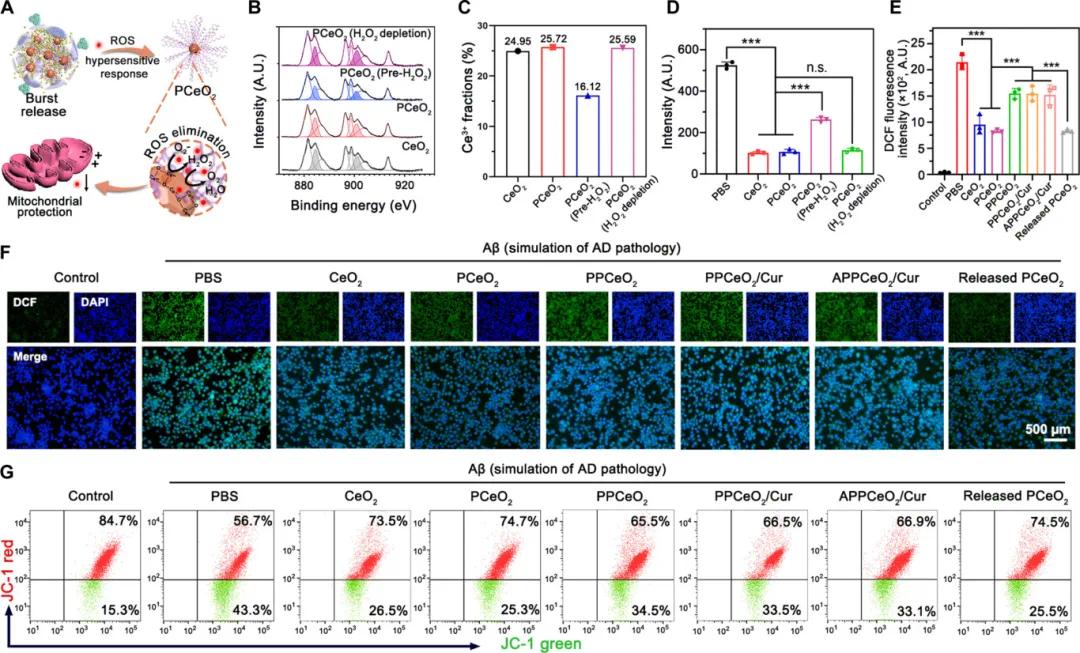
图5 CeO₂的ROS清除及线粒体保护表征。(a)CeO₂在组装和线粒体保护中的ROS清除示意图;(b)Ce 3d轨道的XPS分析显示Ce³⁺(阴影)和Ce⁴⁺的结合能水平,A.U.为任意单位;(c)Ce³⁺在CeO₂表面的百分比定量;(d)用于展示CeO₂在ROS清除中的酶活性的荧光强度(n=3);(e)Aβ刺激的BV-2细胞在用不同制备物孵育后的细胞内ROS水平分析(n=3);(f)不同制备物孵育后Aβ刺激的BV-2细胞内ROS水平的代表性图像;(g)Aβ存在和不同制备物处理下BV-2细胞的线粒体膜电位。PCeO₂(Pre-H₂O₂)和PCeO₂(H₂O₂耗竭)分别指H₂O₂预处理和H₂O₂耗竭5天后的情况,释放的PCeO₂代表H₂O₂预处理和通过超滤离心去除Cur
(6)恢复AD小鼠模型的记忆障碍和认知缺陷
选择8个月大的APPswe/PSEN1dE9(C57BL/6)转基因小鼠,存在认知障碍和早期淀粉样病变。动物每3天静脉注射给予APPCeO₂/Cur(曲酸剂量5 mg/kg)、PCeO₂和APPCeO₂(相当于CeO₂浓度),持续4周(图6A)。用莫里斯水迷宫(MWM)和筑巢行为实验评估空间学习和记忆性能改善效果。图6B显示,APPCeO₂治疗的AD小鼠逃避潜伏期时间比PCeO₂治疗小鼠减少26.84秒,目标象限百分比时间和平台穿越次数更多(图6C),表明APPCeO₂组装体因高效BBB渗透和ROS清除改善动物记忆和认知。观察AD小鼠筑巢行为评估海马功能,图6D显示APPCeO₂/Cur治疗组AD小鼠筑巢能力积极,巢中有组织碎片。图6E显示,APPCeO₂/Cur治疗的AD小鼠得分略低于野生型小鼠,显著高于生理盐水治疗的小鼠,进一步证实APPCeO₂/Cur可减轻AD小鼠模型中的认知和记忆缺陷。
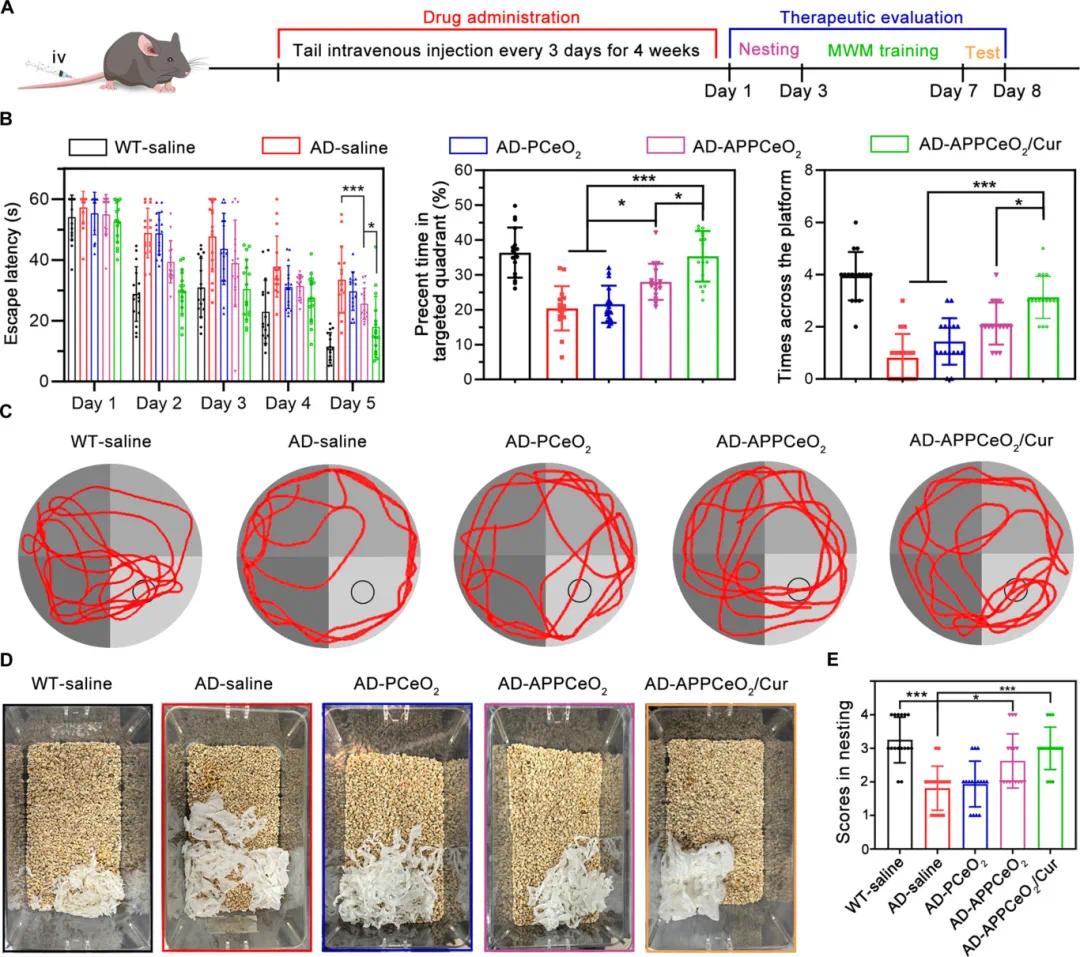
图6 药物给药及治疗效果评估。(a)药物给药时间进程和治疗效果评估;(b)野生型和阿尔茨海默病小鼠在注射生理盐水、PCeO₂、APPCeO₂和APPCeO₂/Cur后的逃避潜伏期、目标象限停留百分比和穿越平台的次数(n=16);(c)小鼠在Morris水迷宫中的典型路径追踪图;(d)小鼠筑巢行为的典型图像;(e)筑巢行为评分(n=16)
(7)恢复小胶质细胞功能障碍和改善炎症微环境,降低淀粉样蛋白病理和氧化应激调节
为证明APPCeO₂/Cur组装在小胶质细胞状态中的作用,分析了APP/PS1转基因小鼠小胶质细胞状态的免疫荧光图像。图7A显示,APPCeO₂/Cur处理时,CD80荧光强度减弱,CD206荧光强度升高(CD206阳性小胶质细胞增加到45.4%),表明APPCeO₂/Cur组装可有效逆转小胶质细胞状态。图7B显示,接受APPCeO₂治疗的AD小鼠中TNF-α和IL-1β水平下降,抗炎细胞因子变化较小。进一步探索不同治疗的AD小鼠中Aβ水平,结果表明AD组和PCeO₂组Aβ水平相似(图7C和D),APPCeO₂组Aβ水平显著降低。为阐明小胶质细胞捕获和Aβ降解过程,进行了免疫荧光分析。图7E和F显示,与浸润在Aβ斑块附近的小胶质细胞(红色)及APPCeO₂处理小鼠中CD68吞噬体分布相比,APPCeO₂/Cur治疗显著瓦解Aβ斑块,通过上调CD68表达和改善小胶质细胞功能障碍实现。结果表明,模拟APPCeO₂/Cur组装的apoA-I可同时释放Cur和PCeO₂治疗元素,分别重新调整小胶质细胞功能障碍和促进Aβ清除,共同改善研究小鼠的AD病理。
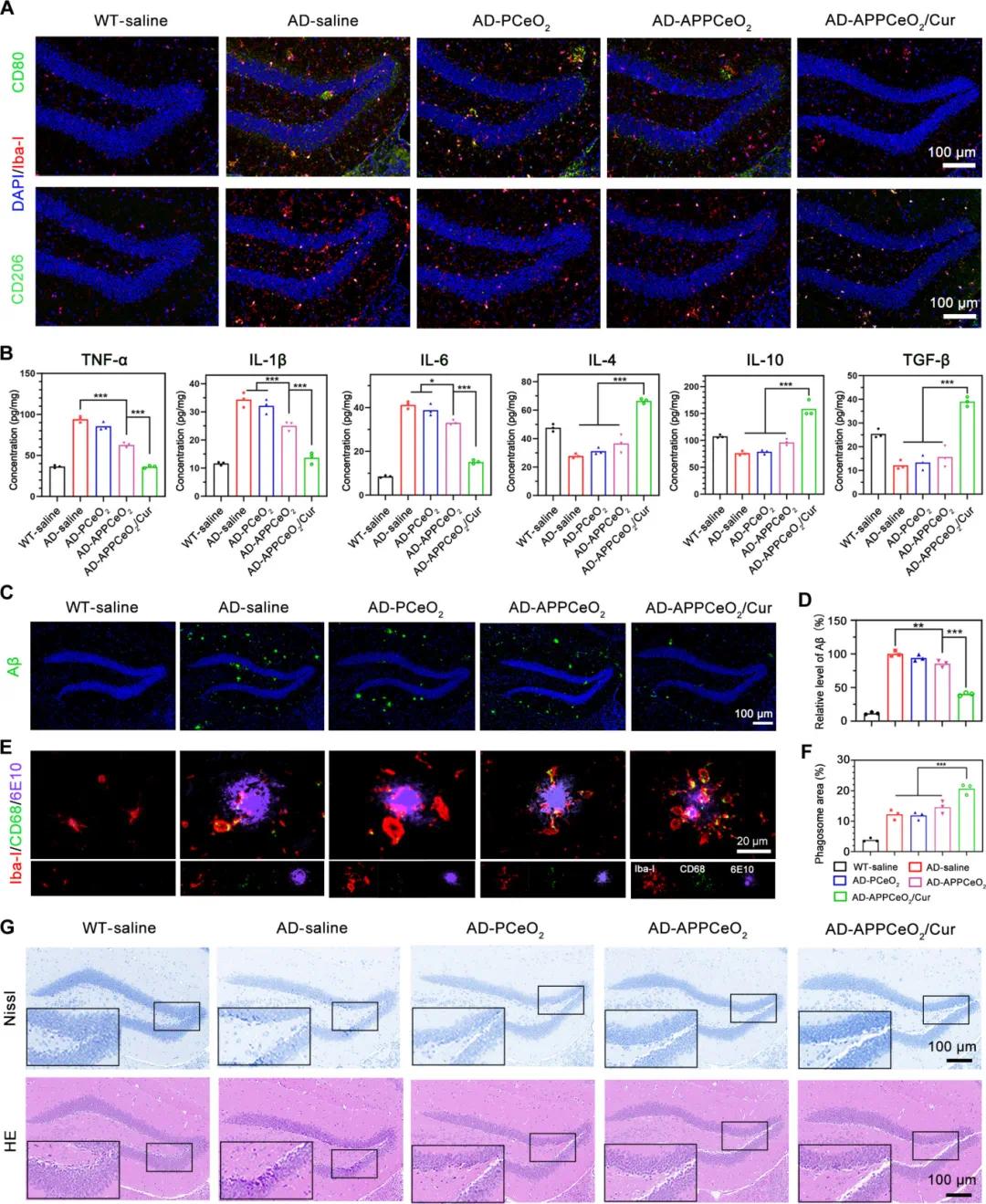
图7 小胶质细胞状态及Aβ水平的检测。(A)不同配方处理后海马中CD80和CD206的免疫染色,绿色为CD80或CD206抗体染色的Aβ激活或正常小胶质细胞标记,红色为Iba-1染色的小胶质细胞,蓝色为DAPI染色的细胞核,标尺100μm;(B)不同制剂处理的脑中TNF-α、IL-1β、IL-6、IL-4、IL-10和TGF-β水平由ELISA试剂盒测定(n=3);(C)不同配方处理4周后小鼠海马中Aβ斑块的免疫染色,绿色为6E10抗体染色的Aβ,蓝色为DAPI染色的细胞核,标尺100μm;(D)不同配方处理下正常和AD小鼠脑中Aβ水平的免疫荧光染色定量分析(n=3);(E)不同制剂处理后小胶质细胞中Aβ吞噬的代表性图像,绿色为CD68抗体染色的吞噬体,红色为Iba-1染色的小胶质细胞,紫色为6E10抗体染色的Aβ,标尺20μm;(F)吞噬体定量(n=3);(G)不同制剂处理后海马区的HE和尼氏染色代表性图像
(8)改善神经元损伤
为评估各种制剂改善神经元损伤的疗效,进行了尼氏染色和苏木精 - 伊红(HE)染色以监测脑中受损神经元。图7G和图S34、S35显示,APPCeO₂/Cur治疗组受损神经元有所改善,PPCeO₂治疗组未呈现明显改善,表明Cur调节小胶质细胞功能障碍对神经疾病恢复和神经损失至关重要。PPCeO₂/Cur治疗后,AD小鼠海马体和皮质中的神经元萎缩、核固缩和细胞质浓缩均显著改善。
研究团队开发了一种生物模拟弹性压缩组装体,能响应脑内ROS实现Cur和CeO₂纳米酶的快速释放,用于逆转小胶质细胞功能障碍和治疗AD。该组装体以温敏性聚合物pNIPAAm-co-pAAm为基础,在高于LCST(41℃)时压缩负载疏水性Cur,并通过多巴胺自聚合形成PDA壳增强稳定性,同时用ApoA-I修饰提升BBB穿越能力和脑内靶向性。在ROS触发下,PDA壳降解,诱导Cur和PCeO₂爆发释放。实验表明,该组装体在AD小鼠模型中显著增强小胶质细胞介导的Aβ清除、神经保护和ROS消除效果。高浓度Cur可将Aβ激活的小胶质细胞转变为正常状态,促进Aβ吞噬和抗炎因子分泌;CeO₂纳米酶持续清除ROS,防止小胶质细胞线粒体损伤。体内实验显示,经APPCeO₂/Cur治疗的AD小鼠记忆力和认知能力显著改善,Aβ沉积和炎症因子水平降低,神经元损伤减轻。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

