
牙周炎是一种感染性疾病,以牙周组织进行性破坏为特征,由微生物群失调引发,全球约19%的成人受其困扰,且与多种全身性疾病相关。其病理特点是微生物群失调与炎症反应形成恶性循环,相互强化。现有临床治疗主要依靠机械清创辅以抗菌药物,但因解剖因素、副作用和多重耐药性,疗效有限。

上海交通大学周明良、蒋欣泉团队提出一种基于工程化巨噬细胞膜伪装的纳米诱饵(LMCNDs)治疗牙周炎的策略。LMCNDs将重组人抗菌肽LL-37锚定于富含Toll样受体的巨噬细胞膜上,并结合级联催化系统(包括L-氨基酸氧化酶和中空二氧化锰)。该策略通过巨噬细胞膜伪装增强细菌靶向性和组织保留能力;LL-37破坏细菌膜完整性,实现高效杀菌;级联催化系统加速氧气生成、扰乱病原菌代谢,改善缺氧微环境。同时,LMCNDs触发NF-E2相关因子-2(NRF2)核转位,减轻氧化应激,调控巨噬细胞极化,促进成骨细胞成骨分化。相关成果于2025年4月10日以《Engineered Macrophage Membrane-Camouflaged Nanodecoys Reshape the Infectious Microenvironment for Efficient Periodontitis Treatment》为题发表于《ACS Nano》。(DOI:10.1021/acsnano.4c14305)。
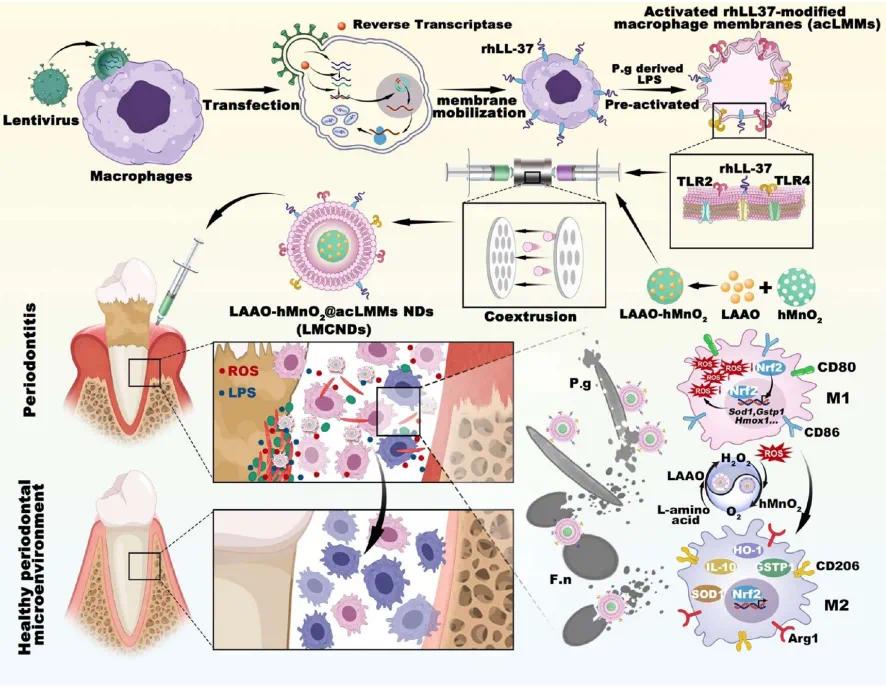
研究示意图
(1)LMCNDs 的制备与表征
为制备重组人LL-37(rhLL-37)修饰的活化巨噬细胞膜,将设计的慢病毒载体转染RAW264.7细胞,并用牙龈卟啉菌源性脂多糖(LPS)处理(图1A)。免疫染色结果显示,慢病毒转染的RAW264.7细胞(RawrhLL-37OE)表面LL-37水平升高,LPS处理增强巨噬细胞中TLR2/4的表达,且LPS孵育略微增加细胞质中LL-37的表达(图1B)。收集rhLL-37修饰的巨噬细胞膜(acLMMs),通过聚碳酸酯多孔膜反复挤压制备acLMM囊泡。LMCNDs的核心是载有L-氨基酸氧化酶(LAAO)的中空二氧化锰(hMnO₂),其LAAO负载效率和容量分别为50.1±5.19%和326.3±35.52 μg/mg。通过超声和连续挤压acLMM囊泡与LAAO−hMnO₂纳米颗粒(NPs)的混合物获得LMCNDs。透射电子显微镜(TEM)显示LAAO−hMnO₂NPs呈典型球形且具有空心结构,LMCNDs呈均匀且单分散的球形“核壳”形态,TEM元素映射观察到LMCNDs外层中的碳、氧、氮和锰元素,证实了LAAO−hMnO₂核心的成功封装(图1C)。LMCNDs的zeta电位与acLMMs相近,与LAAO−hMnO₂有显著差异,表明细胞膜成功包覆于载体上(图1D)。动态光散射(DLS)显示,acLMM囊泡的平均直径为162.46nm,LAAO−hMnO₂的尺寸因acLMMs的包覆从130.06增加到179.3nm(图1E)。WB结果显示,慢病毒转染和LPS刺激显著增强巨噬细胞中LL-37、TLR2和TLR4的表达,acLMM囊泡和LMCNDs的蛋白谱与活化巨噬细胞高度相似,表明保留了LL-37和病原体靶向受体。这些结果表明修饰后的巨噬细胞膜成功装饰于纳米颗粒,并保留了纳米诱饵精准递送的关键受体。
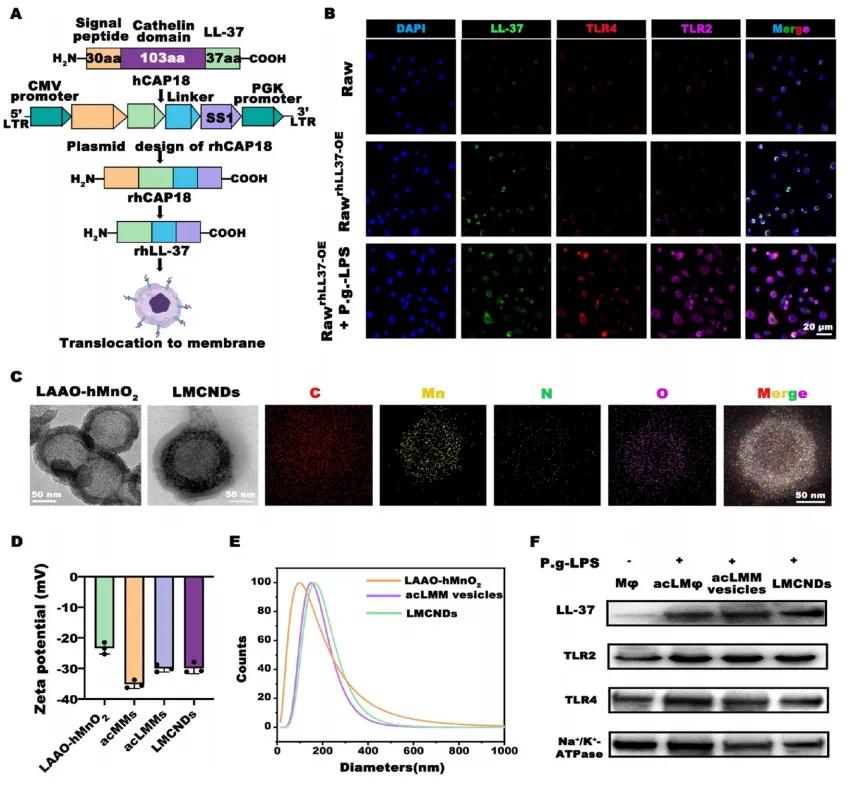
图1 LMCNDs的制备与表征。(a)rhLL-37质粒设计及LMCNDs制备示意图;(b)免疫染色评估不同巨噬细胞蛋白水平,RAW264.7细胞转染慢病毒后记为RawLL-37OE;(c)透射电子显微镜(TEM)及元素映射观察结果;(d)LAAO−hMnO₂纳米颗粒、活化巨噬细胞膜(acMMs)、经LL-37修饰的活化巨噬细胞膜(acLMMs)及LMCNDs的Zeta电位;(e)通过动态光散射(DLS)测量的平均粒径;(f)通过西方印迹分析表面蛋白谱
(2)LMCNDs 的生物相容性与催化性能评估
研究人员评估了LMCNDs的生物安全性、产氧能力及活性氧(ROS)清除能力。在L929细胞、MC3T3细胞和RAW264.7细胞中测试发现,acLMMs具有剂量依赖性的轻微细胞毒性,2 mg/mL以下的acLMMs对细胞活力几乎无影响,后续实验采用1 mg/mL的acLMMs制备样品(图2A)。优化LAAO−hMnO₂纳米颗粒浓度时,增加LAAO−hMnO₂可加速氧气生成,但包载于acLMMs中会降低细胞活力,超过200 μg/mL时显著诱导细胞凋亡,因此选择200 μg/mL和1 mg/mL分别为LMCNDs的纳米颗粒核心和细胞膜包覆层的最佳浓度(图2B、图2C)。LMCNDs在80分钟内可清除近80%的H₂O₂,且细胞膜包覆层未干扰hMnO₂介导的催化反应(图2D)。200 μg/mL的LAAO−hMnO₂包载于acLMMs中可中和细胞内ROS,具有满意的生物安全性(图2E)。LMCNDs在生理温度下保持稳定的催化能力,反应速率与LAAO相当,且在反应后期催化速率超过LAAO(图2F)。pH变化对H₂O₂分解影响较小,不同pH下L-Trp的氧化程度虽有波动,但几乎有一半被催化(图2G、图2H)。LMCNDs在H₂O₂和L-Trp混合溶液中产氧能力更强,归因于LAAO提供的过量局部H₂O₂(图2I)。在缺氧条件下,LMCNDs因封装的hMnO₂持续供应氧气,继续消耗L-Trp,而LAAO组中L-Trp浓度保持在总量的近90%(图2J)。
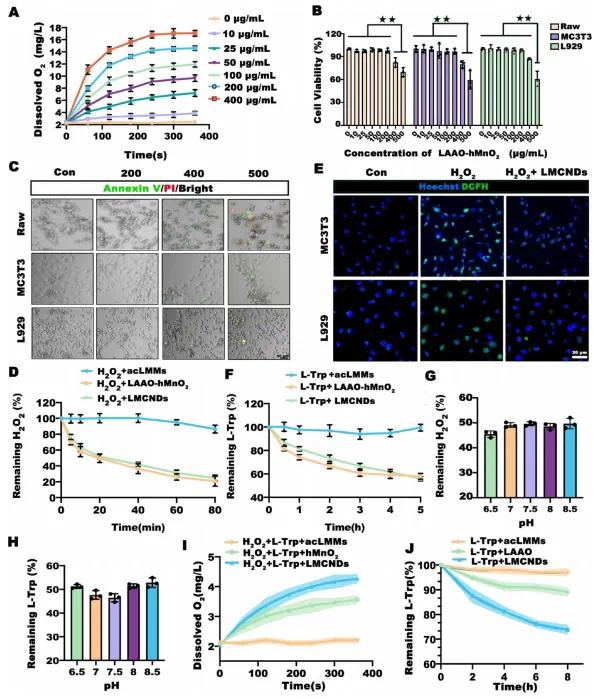
图2 LMCNDs的生物相容性与催化性能评估。(a)不同浓度LAAO−hMnO₂的产氧能力;(b)封装不同剂量LAAO−hMnO₂的LMCNDs的生物相容性;(c)用不同浓度LAAO−hMnO₂处理的细胞凋亡情况;(d)LMCNDs对H₂O₂的清除能力;(e)DCFH染色评估细胞内ROS水平;(f)不同样品的L-Trp消耗量;(g)不同pH条件下LMCNDs的催化效率;(h)不同pH条件下LMCNDs的催化效率;(i)不同样品催化的O₂产生量;(j)在37°C、pH=7.4的缺氧条件下,不同组L-Trp浓度的变化
(3)LMCNDs 的抗菌特性
临床前实验和临床试验结果表明,微生物群生物膜可能在24小时内迅速形成,强调了药物保留时间超过24小时的重要性。为评估LMCNDs在牙周袋中的保留情况,将FITC标记的纳米颗粒用acLMMs包裹后注入患有牙周炎的小鼠牙龈袋中。水凝胶组中,FITC标记的纳米颗粒在12小时内迅速减少,48小时后荧光信号消失;LMMs涂层延长了纳米颗粒在组织中的保留时间至24小时,但48小时后几乎无法检测;而acLMMs包裹的纳米颗粒在组织中的保留时间显著延长至48小时,表明其具有高效的细菌结合能力(图3A)。与四环素纤维和米诺环素软膏等商业产品相比,LMCNDs实现了更高的组织保留效率且临床操作更便捷。体外测试表明,acLMMs显著增强了对牙龈卟啉单胞菌(P.g.)和福赛拟杆菌(F.n.)的抗菌效果,且呈剂量依赖性,在2 mg/mL时达到峰值(图3B、C)。LAAO−hMnO₂的协同作用进一步提高了抗菌效果,使1 mg/mL的acLMMs(即LMCNDs)的抗菌活性提升至与2 mg/mL的acLMMs相当的水平。高分辨率荧光显微镜和透射电子显微镜(TEM)揭示了LMCNDs的作用机制:LMCNDs通过TLR2、TLR4和LPS之间的特异性亲和力粘附到细菌上,再通过rhLL-37介导的膜融合整合到细菌膜中,最终通过rhLL-37的成孔效应破坏细菌膜完整性导致细胞裂解(图3D、E)。此外,LMCNDs对生物膜形成有显著抑制效果,与对照组相比,acLMMs和LMCNDs组中表示死亡微生物的红色荧光信号比例显著增加,生物膜厚度急剧减少(图3F、G)
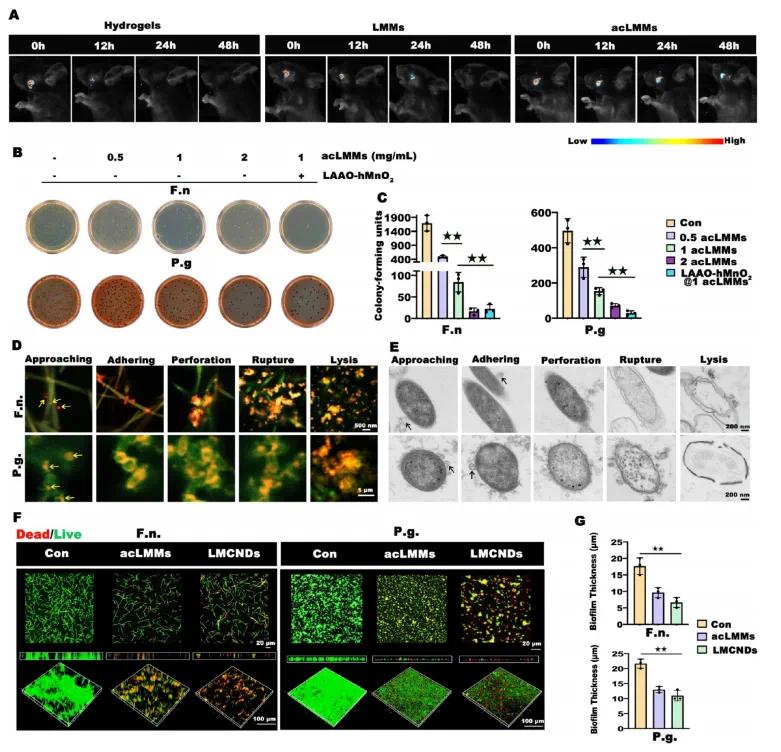
图3 LMCNDs的抗菌特性。(a)通过活体成像系统测试FITC标记的纳米颗粒在不同涂层下的牙周袋保留情况,涂层包括水凝胶、GelMA、LMMs、acLMMs;(b)不同样品对P.g.和F.n.的体外抗菌效果;(c)P.g.和F.n.的菌落形成单位计数;(d)通过高分辨率荧光显微镜观察LMCNDs的杀菌过程,箭头指示LMCNDs;(e)通过TEM观察LMCNDs的杀菌过程,箭头指示LMCNDs;(f)不同处理对细菌生物膜的死/活染色;(g)生物膜厚度分析
(4)LMCNDs 对巨噬细胞极化及成骨细胞成骨分化的调节作用
LMCNDs在脂多糖(LPS)刺激下可逆转M1/M2巨噬细胞比例(图4A)。LPS使巨噬细胞中M1标志物iNOS显著上调,acLMMs抑制M1极化并增强M2标志物CD206表达。LMCNDs孵育使M2标志物最显著上调,M1标志物最显著下调,成功实现巨噬细胞表型转变。巨噬细胞基因表达谱进一步证实了LMCNDs的免疫调节作用(图4B)。研究人员提取经LPS处理(有或无LMCNDs)的巨噬细胞培养液,与成骨培养液混合制成条件培养液(CM),诱导成骨细胞成骨分化。结果显示,与对照组相比,LPS组细胞外基质矿化受损,ALP和ARS染色较浅;LPS + LMCNDs组染色最深(图4D)。ALP定量分析表明LMCNDs挽救了炎症微环境对钙沉积和矿化结节形成的负面影响(图4E)。qPCR分析显示,成骨标志物在LPS组中下调,但在LPS + LMCNDs组中恢复(图4F)。这些结果表明LMCNDs通过重塑巨噬细胞表型,重构炎症微环境,挽救了成骨细胞的成骨分化潜能。
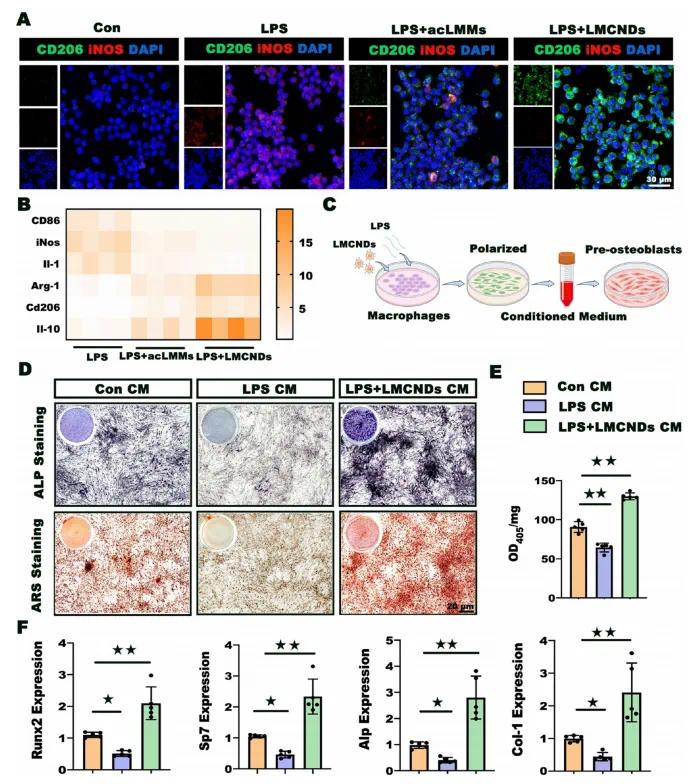
图4 LMCNDs对巨噬细胞极化及成骨细胞成骨分化的调节作用。(a)通过免疫染色检测巨噬细胞中M1标志物(iNOS)和M2标志物(CD206)的表达;(b)不同条件下巨噬细胞表面标志物的表达谱;(c)制备用于成骨诱导的条件培养液(CM);(d)经不同CM诱导7天和14天后成骨细胞的ALP和ARS染色;(e)ALP活性定量分析;(f)成骨相关基因表达的qPCR分析
(5)LMCNDs 介导的巨噬细胞极化机制
LMCNDs在感染微环境下恢复巨噬细胞极化平衡的机制研究显示,对LPS诱导的RAW264.7细胞(有或无LMCNDs处理)进行RNA测序分析,发现LPS组和LPS+LMCNDs组基因表达模式存在明显差异,LPS+LMCNDs组有1229个基因上调、752个基因下调(变化倍数>2,p<0.05)(图5A)。具体表现为M2型巨噬细胞标志物显著上调,M1型标志物水平明显下降。LPS+LMCNDs组中抗氧化通路显著增强(图5B),提示LMCNDs的免疫调节效应可能源于抗氧化相关基因的上调。图5C列出了抗氧化通路中的特定基因,其中一些富集基因是NRF2的下游靶标。NRF2对抵御氧化/外来物质应激至关重要,可缓解炎症。PPI分析发现35个基因中有15个与NRF2相互作用(图5D),推测LMCNDs通过激活NRF2触发抗氧化进程,重新编程M1/M2巨噬细胞比例。免疫荧光染色和共定位分析显示,添加LMCNDs后,巨噬细胞中NRF2的核信号明显增加(图5E),且随孵育时间延长,NRF2核水平上升,细胞质中NRF2水平下降(图5F)。用NRF2抑制剂ML385阻断NRF2激活后,LMCNDs诱导的抗氧化蛋白HO-1上调显著受阻(图5G)。在LPS刺激下,无论是否存在LMCNDs,巨噬细胞中ROS水平失控(图5H),导致巨噬细胞M2转化受阻(图5I)。综上,LMCNDs通过触发NRF2核转位对抗氧化应激,规范感染微环境,助力巨噬细胞从M1向M2转化。
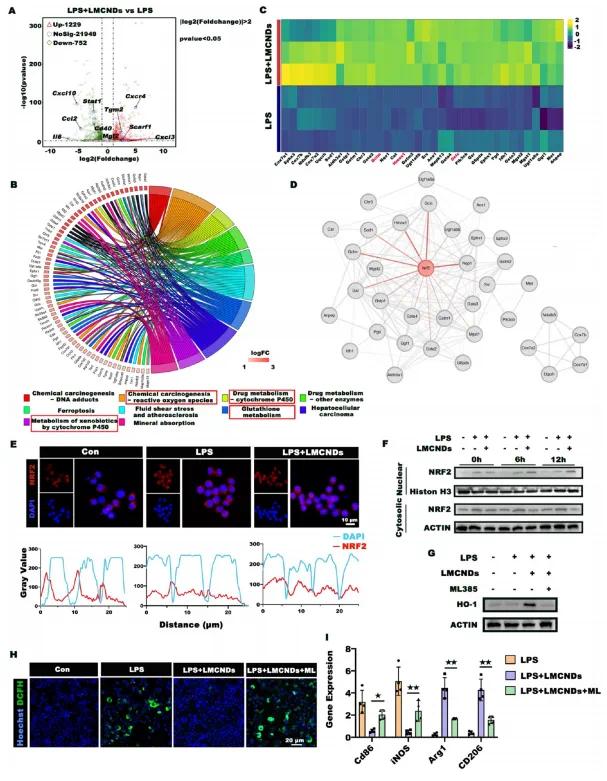
图5 LMCNDs介导巨噬细胞极化的机制。(a)展示LPS+LMCNDs组与LPS组之间差异基因的火山图;(b)KEGG通路分析显示LPS+LMCNDs组中富集的前15条通路;(c)KEGG通路分析显示与富集通路相关的上调基因,部分NRF2下游靶标基因以红色突出显示;(d)与抗氧化途径相关的基因的蛋白-蛋白相互作用分析;(e)免疫荧光染色及共定位分析显示不同处理后巨噬细胞中NRF2与细胞核的共定位;(f)细胞分级实验及西方印迹确定NRF2的亚细胞定位;(g)加入NRF2抑制剂ML385后,HO-1蛋白水平变化;(h)不同处理组巨噬细胞内ROS水平;(i)不同条件下巨噬细胞极化诱导情况
(5)LMCNDs 在小鼠牙周炎模型中的治疗效果
小鼠在放置围绕上颌第二磨牙的细菌斑块保留结扎线前进行了7天的适应,并待其患上牙周炎(图6A)。随后每只小鼠每2天分别接受一次PBS(对照组)、acLMMs(acLMMs组)或LMCNDs的局部注射,持续2周,第14天收集样本进行放射学和组织学分析。研究人员收集心脏、肝脏、脾脏、肺和肾脏进行苏木精-伊红(H&E)染色,未观察到acLMMs或LMCNDs处理的小鼠有明显形态变化或炎症反应,表明纳米诱饵具有可接受的生物安全性。结扎模型中观察到显著的水平向牙槽骨吸收,表现为骨体积减少和CEJ−ABC距离增加。与对照组相比,acLMMs组骨丢失部分减少,但牙槽骨高度仍位于牙根的尖部三分之一处。LMCNDs组显示出最显著的骨再生,挽救了颊侧或腭侧的骨丢失,牙槽骨高度恢复到根分叉水平(图6B、图6C)。H&E和Masson三色染色显示,对照组中牙周炎导致大量牙槽骨吸收和纤维变形降解,牙周韧带排列稀疏紊乱;而生物材料治疗的小鼠牙周组织恢复,LMCNDs组表现出最强的骨再生,牙根与牙槽骨之间通过紧密、有组织的牙周韧带建立连接(图6D)。免疫荧光染色显示,对照组小鼠中iNOS+细胞显著积累,acLMMs给药轻微降低M1与M2比例,而LMCNDs进一步扭转巨噬细胞和炎症的恶性循环,使平衡向促进修复的表型倾斜(图6E)。LMCNDs的免疫调节和ROS清除效应重塑牙周袋中的炎症微环境,治疗后牙周微环境中的主要促炎因子表达下降,且LMCNDs组中明显的ALP阳性信号表明牙周硬组织的再生。这些结果证明LMCNDs具有显著的免疫调节能力,可促进牙周组织再生。
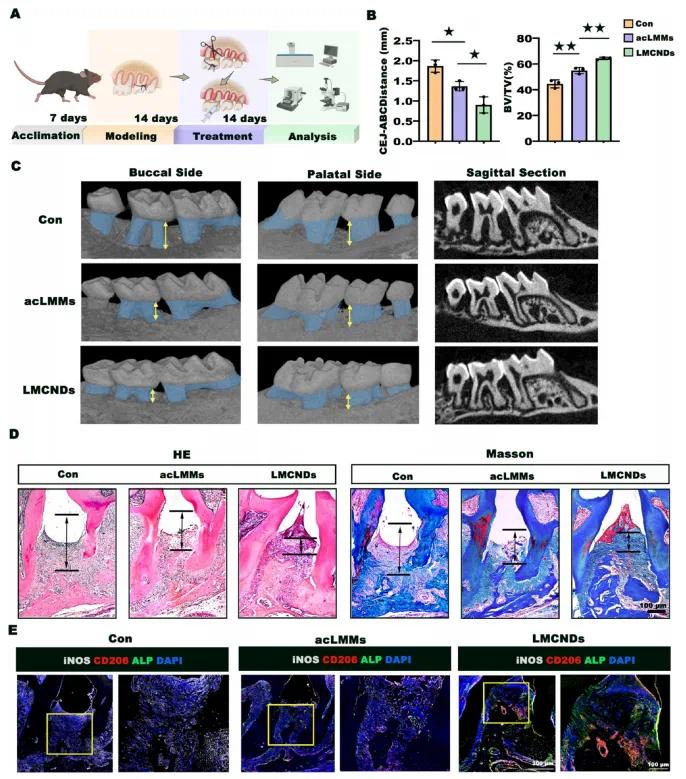
图6 LMCNDs在小鼠牙周炎模型中的治疗效果。(a)建立小鼠牙周炎模型及治疗流程示意图;(b)各组小鼠牙槽骨再生情况的定量分析;(c)通过微CT扫描观察小鼠牙槽骨情况;(d)收集样本的H&E和Masson三色染色,箭头指示CEJ−ABC距离;(e)牙周组织的多重免疫荧光染色
文献报道了一种基于工程化巨噬细胞膜伪装的纳米诱饵(LMCNDs)的牙周炎治疗策略。牙周炎是微生物群失调与宿主炎症反应形成恶性循环的感染性疾病,传统治疗方法效果有限。LMCNDs通过将重组人抗菌肽LL-37锚定在富含Toll样受体的巨噬细胞膜上,并结合级联催化系统(包括L-氨基酸氧化酶和中空二氧化锰),重塑牙周炎微环境。 LMCNDs的制备涉及将重组人LL-37修饰的活化巨噬细胞膜与LAAO−hMnO₂复合酶结合,形成“核壳”结构。这种设计提高了纳米颗粒的细菌靶向性和组织保留能力,LL-37破坏细菌膜完整性实现高效杀菌,级联催化系统加速氧气生成、扰乱病原菌代谢,并触发NRF2核转位减少氧化应激反应,促进巨噬细胞从M1向M2极化,增强成骨细胞的成骨分化。在小鼠牙周炎模型中,LMCNDs显著减少牙槽骨丢失、促进骨再生并重塑炎症微环境,表现出良好的生物相容性、抗菌活性和免疫调节能力。 尽管LMCNDs在临床应用方面面临成本高和生产纯化过程耗时等挑战,但其在牙周炎治疗领域的潜力巨大,未来有望通过研究和技术创新克服这些障碍,推动其临床转化。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

