
全球糖尿病患者超5.37亿,预计2045年达7.83亿,其中约25%并发糖尿病足溃疡(DFUs)。目前超50%的DFUs难以愈合,亟需创新疗法。DFUs发病与免疫失调和炎症密切相关,巨噬细胞极化失衡(M1向M2转换受阻)是关键因素,导致愈合延迟和感染风险增加。生物材料(如水凝胶)在免疫调节中应用广泛,但现有水凝胶多仅靶向ROS,忽视DFUs的缺氧问题。兼具供氧和ROS清除功能的水凝胶有望更有效促进DFUs愈合。

针对上述问题,温州医科大学沈建良团队开发一种免疫调节水凝胶(RGH2),其由钌修饰的异黑素纳米颗粒(Ru@allomelanin)、苯硼酸修饰的甲基丙烯酸化明胶(GelMA-PBA)和硝基苯接枝的透明质酸(HANB)组成。不仅能够清除ROS,还能通过类过氧化氢酶活性将过氧化氢转化为水和氧气,从而同时实现ROS清除和供氧功能。此外,RGH2通过葡萄糖敏感的硼酸酯键和紫外线触发的亚胺键增强了对复杂糖尿病伤口环境的响应性。在动物实验中,RGH2显著促进了巨噬细胞向M2表型的极化,有效治疗了糖尿病慢性伤口。该文章于2025年3月31日以《Hyperthermia-enhanced immunoregulation hydrogel for oxygenation and ROS neutralization in diabetic foot ulcers》为题发表于《CellBiomaterials》(DOI:10.1016/j.celbio.2025.100020。
研究示意图
(1)RU@Allomelanin纳米颗粒的分析
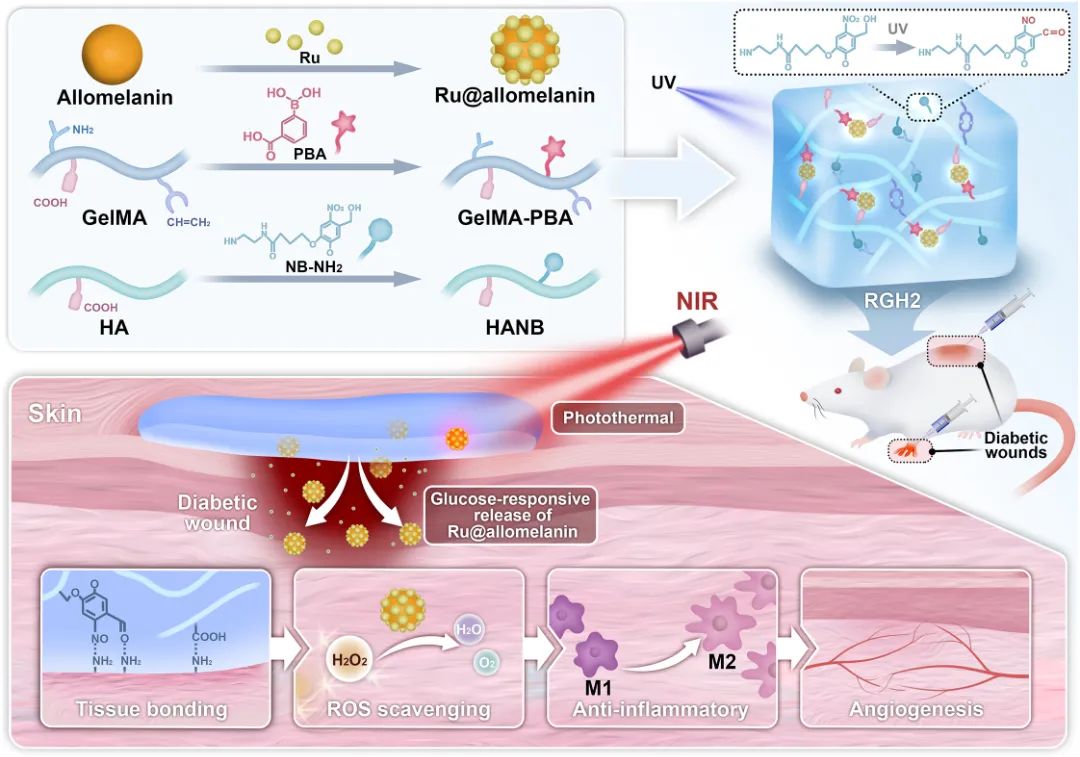
采用自聚合法制备异黑素纳米球,用于螯合和还原三氯化钌,实现钌纳米材料的原位固定。扫描电子显微镜(SEM)分析(图1A和1B)显示异黑素球呈均匀球形,直径约200纳米,Ru纳米点均匀分布。透射电子显微镜(TEM,图1C)和元素映射(图1D)证实O、C和Ru元素均匀存在,表明合成成功。研究发现,Ru@异黑素纳米粒子在近红外光下具有显著光热效应(图1E-1H):不同浓度下暴露于0.5 W/cm²的808 nm激光10分钟,温度分别升至37.7°C、43.4°C和47.4°C(图1E);1 mg/mL浓度下,温度随NIR功率增加而升高(图1F);光热转换效率为43.1%(图1G),且在多次循环中表现出优异稳定性(图1H)。红外摄像机图像(图1I)显示其升温明显高于磷酸盐缓冲溶液。此外,Ru@异黑素纳米粒子可作为纳米酶,催化H₂O₂分解释放氧气(图1J),且在NIR照射下产氧能力增强(图1K和1L)。在ROS清除实验中,光诱导微热处理显著提高了自由基清除效率(图1M-1O)。
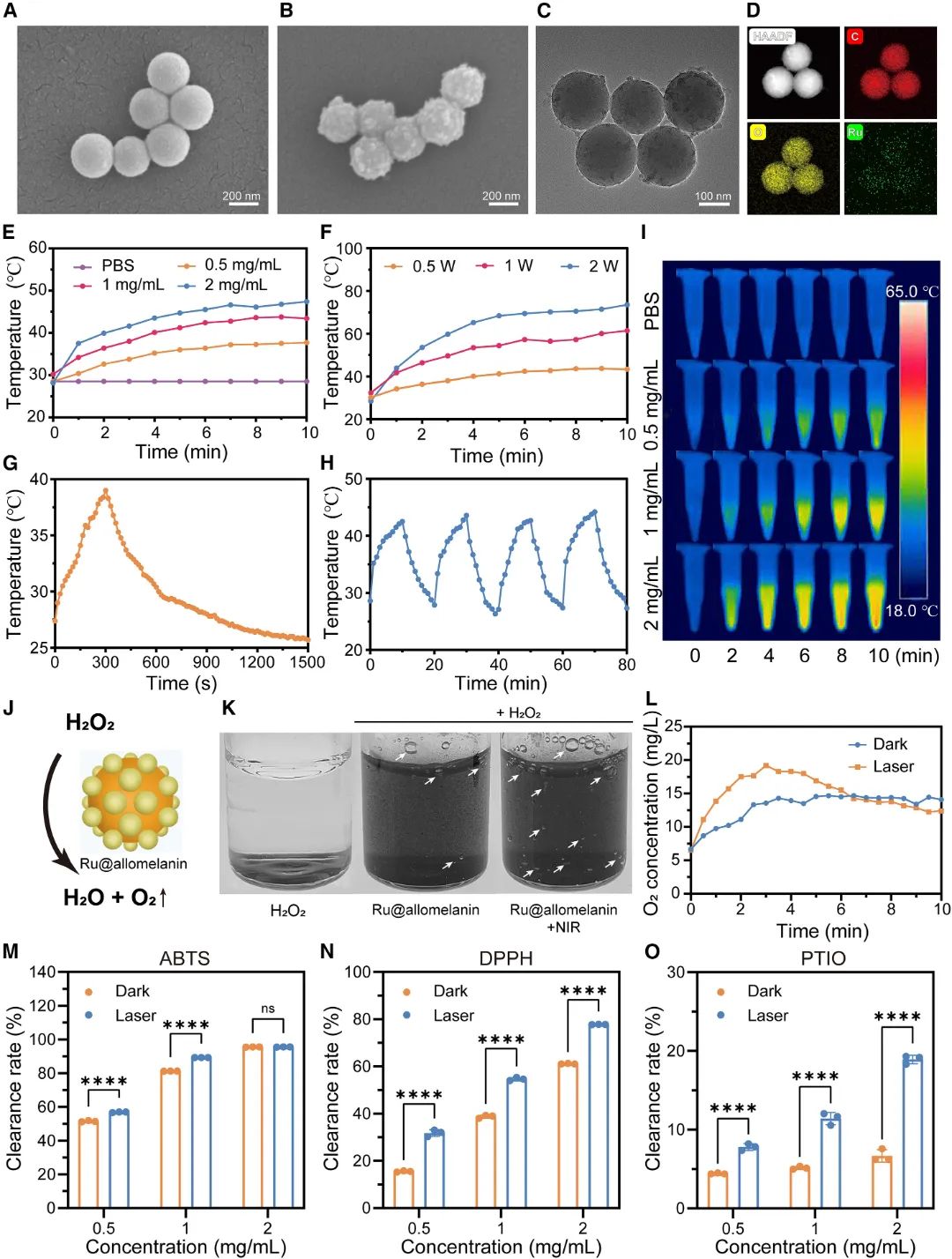
图1 RU@Allomelanin纳米颗粒的分析。(A, B)Allomelanin(A)和 Ru@Allomelanin(B)的 SEM 图像;(C)Ru@Allomelanin 的 TEM 图像;(D)Ru@Allomelanin 中 C、O 和 Ru 的元素分布;(E)不同浓度 Ru@Allomelanin 的温度变化曲线;(F)不同 NIR 条件下 Ru@Allomelanin(1 mg/mL)的热成像;(G)计算 PCE 时 RGH₂ 水凝胶的温度变化;(H)Ru@Allomelanin(1 mg/mL)在 808 nm NIR 下的光稳定性测试(1 W/cm²,4 个周期);(I)不同浓度 PBS 和 Ru@Allomelanin 的热成像;(J)氧气生成过程示意图;(K)在 0.5 W/cm² 808 nm NIR 激光下 O₂ 气泡生成(白色箭头);(L)在黑暗和激光条件下(H₂O₂ 浓度 1 mM)Ru@Allomelanin(1 mg/mL)产生的 O₂ 浓度;(M-O)光热处理时对 ABTS(M)、DPPH(N)和 PTIO(O)自由基的抗氧化活性测试(有无 Ru@Allomelanin 纳米颗粒)
(2)RGH2水凝胶的开发与分析
研究人员开发了一种用于糖尿病伤口愈合的RGH₂水凝胶,由GelMA-PBA、HANB改性的HA和Ru@allomelanin纳米粒子组成。通过将Ru@allomelanin分散在GelMA-PBA和HANB混合物中,加入光引发剂LAP后暴露于紫外线(365 nm,5 W/cm²)30秒,制备出一体式水凝胶贴剂。化学组成通过¹H NMR和FTIR验证(图2A-2C):GelMA-PBA和HANB的特征峰表明合成成功,Ru@allomelanin的红外光谱中–OH峰降低,证实Ru金属沉积。水凝胶的剪切强度测试显示,10% GelMA-PBA加1% HANB配方的应力水平最高,达到32.6 kPa(图2D)。流变行为评估表明,水凝胶在约20%应变处G"和G'交集,表明网络凝聚力转变(图2E);在1%应变时模量稳定,而在400%应变下G'下降、G"上升,显示高变形后的结构恢复能力(图2F)。RGH₂的自修复能力在10分钟内实现分离部分的重新连接(图2G),其粘弹性在0.1至10 Hz范围内G'超过G"(图2H)。粘度随剪切速率增加而下降(图2I),支持其注射应用的可行性。冻干水凝胶的吸水性能在360分钟趋于稳定,且RGH₂的持液能力优于RGH₀(图2J、2L)。SEM分析显示,RGH₀和RGH₂均具有三维多孔基质,RGH₂因Ru@allomelanin的存在而更粗糙(图2K、2M)。
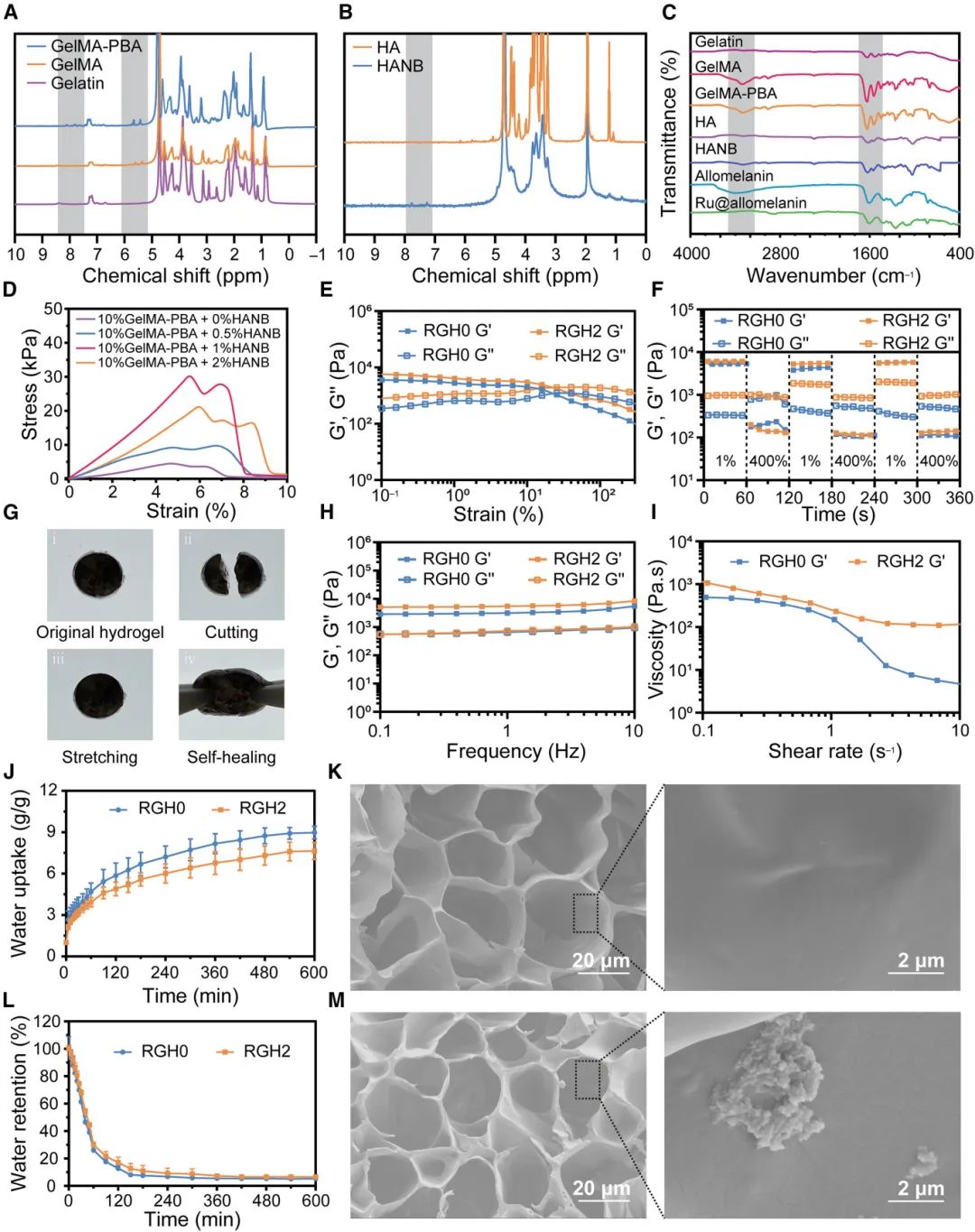
图2 表征 RGH₂ 水凝胶特性。(A)明胶、GelMA 和 GelMA-PBA 的¹H NMR 光谱;(B)HA 和 HANB 的¹H NMR 光谱;(C)凝胶前体的 FTIR 光谱;(D)猪皮肤试验中粘合剂的应力-应变曲线;(E)1 Hz 时不同应变下 G′和 G″的变化;(F)步进应变测试时的水凝胶行为;(G)RGH₂ 的自修复照片;(H)1% 应变下 G′和 G″随时间的变化;(I)RGH₀ 和 RGH₂ 在不同剪切速率下的粘度流变分析;(J, L)RGH₂ 和 RGH₀ 的吸水量(J)和保留量(L)比较;(K, M)SEM 图像展示不同放大倍数下的 RGH₀(K)和 RGH₂(M)
(3)RGH2水凝胶的毒性、光热和自由基清除性能评估
本研究通过细胞-水凝胶共培养法验证了RGH₂水凝胶的生物相容性。将RS1细胞和RAW264.7细胞与水凝胶共孵育48小时后,细胞活/死染色(图3A)显示大多数细胞存活,表明水凝胶支持细胞附着和增殖。随后,通过CCK-8检测细胞活力(图3B和3C),结果显示水凝胶与对照组之间无显著差异,证实其无毒特性。水凝胶的光热特性通过改变Ru@allomelanin含量或NIR密度进行评估。不同浓度的Ru@allomelanin水凝胶在808 nm NIR照射下温度上升与浓度成正比(图3D),例如RGH₂温度可达44.6°C(图3E)。此外,RGH₂水凝胶的加热性能随NIR功率密度增加而升高(0.5 W/cm²至2 W/cm²,温度从44.6°C升至81.9°C,图3F),其光热转换效率(PCE)也进行了评估(图3G),且在多次激光切换周期中表现出优异的光热稳定性(图3H)。水凝胶的ROS清除能力通过ABTS、DPPH和PTIO检测。ABTS测试(图3I)显示,RGH₂在NIR照射下清除效率显著高于RGH₀,达到89.4%。DPPH测试(图3J)中,RGH₂的清除效果是RGH₀的2倍。PTIO测试(图3K)也证实了RGH₂在清除ROS方面表现出卓越的潜力。
图3 RGH₂ 水凝胶的毒性、光热效应和自由基清除能力。(A)不同处理条件下 48 小时后 RS1 和 RAW264.7 细胞的钙黄绿素-AM/PI 染色;(B, C)CCK-8 法评估 RGH₀ 和 RGH₂ 水凝胶对 RS1 和 RAW264.7 细胞的细胞毒性;(D)不同处理水凝胶的热成像照片;(E)不同水凝胶的温度升高曲线;(F)RGH₂ 水凝胶温度随 NIR 激光功率变化的曲线;(G)用于 PCE 计算的 RGH₂ 水凝胶温度变化曲线;(H)光稳定性测试示意图;(I-K)有光或无光条件下,RGH₂ 水凝胶对 ABTS(I)、DPPH(J)和 PTIO(K)自由基的清除能力
(4) 评估RGH2水凝胶的抗氧化特性、细胞迁移、血管生成和缺氧调节
图4A和4B显示,H₂O₂处理显著抑制了RS1细胞和RAW264.7巨噬细胞的增殖,而水凝胶预处理5小时后,细胞存活率显著提高。共聚焦荧光成像(图4C)表明,水凝胶处理降低了H₂O₂诱导的细胞内ROS水平。划痕试验(图4D)显示,RGH₂组在12小时时的划痕愈合率达到55.96%,显著优于H₂O₂组(8.08%)。此外,水凝胶显著增强了人脐静脉内皮细胞(HUVEC)的血管生成能力,分支点数量是H₂O₂组的2倍(图4E)。免疫荧光(图4F)和蛋白质印迹分析(图4G)表明,水凝胶通过Ru@allomelanin纳米颗粒催化H₂O₂分解为氧气,有效减轻了细胞缺氧并降低了HIF-1α表达。
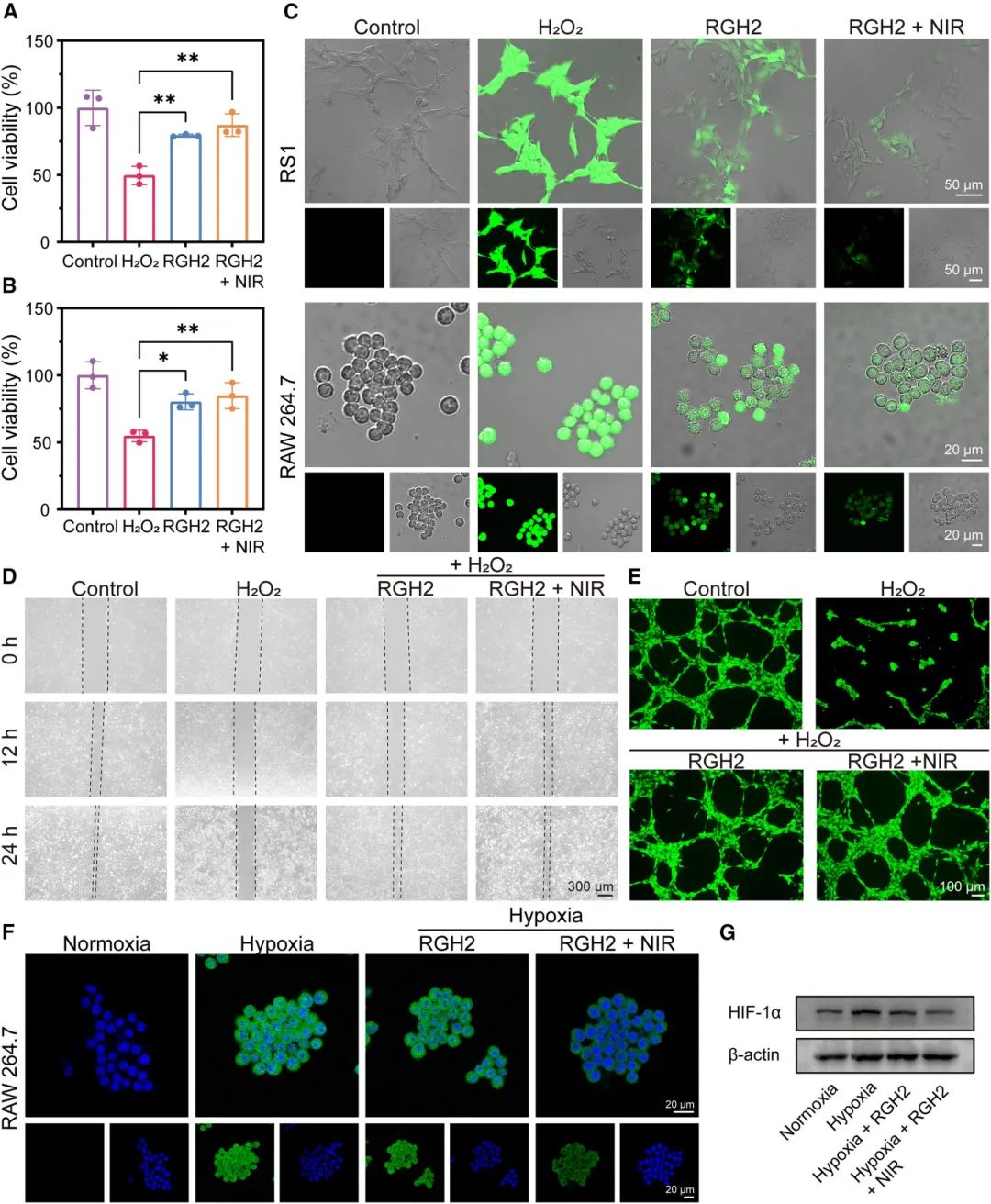
图4 RGH₂ 水凝胶体外对 ROS 中和、血管生成及缓解缺氧的影响。(A, B)RS1(A)和 RAW264.7(B)细胞在含水凝胶和 H₂O₂ 溶液中的存活率;(C)通过 DCFH-DA 评估水凝胶清除细胞内 ROS 的能力;(D)划痕实验中 RS1 细胞迁移的延时照片(划痕前后 24 小时);(E)不同治疗方法下的血管形成图像;(F)通过免疫荧光染色评估 HIF-1α 表达;(G)通过蛋白质印迹分析定量巨噬细胞中的 HIF-1α 蛋白
(5)RGH2水凝胶对巨噬细胞免疫调节作用的研究
巨噬细胞通常会分化为修复性M2表型或促炎性M1表型,本研究以脂多糖(LPS)和干扰素-γ(IFN-γ)作为比较基准,评估了RGH2水凝胶对RAW264.7细胞的影响。首先,通过用异硫氰酸荧光素修饰的鬼笔环肽染色F-肌动蛋白来追踪处理后细胞形态的变化,同时分别使用CD86/CD206标记物检测M1和M2巨噬细胞。如图5A所示,在24小时内,M1群中的RAW264.7巨噬细胞呈现出类似伪足的延伸,而M2群中的巨噬细胞则呈现圆形形态,这表明细胞向M2表型极化转变。在炎症环境下,CD206(M2型标记物)和CD86(M1型标记物)的免疫荧光标记证实了巨噬细胞的极化(图5B)。流式细胞术分析(图5C)显示,与基准组相比,使用RGH2水凝胶治疗后,CD206阳性(M2型)巨噬细胞显著增加,而CD86阳性(M1型)巨噬细胞减少。此外,通过蛋白质印迹法进行蛋白质定量(图5D-5G)显示,CD206和CD86蛋白表达水平(治疗前M1/M2比率为264.6%,治疗后降至86.2%)与免疫荧光染色结果一致,证实了观察到的趋势。
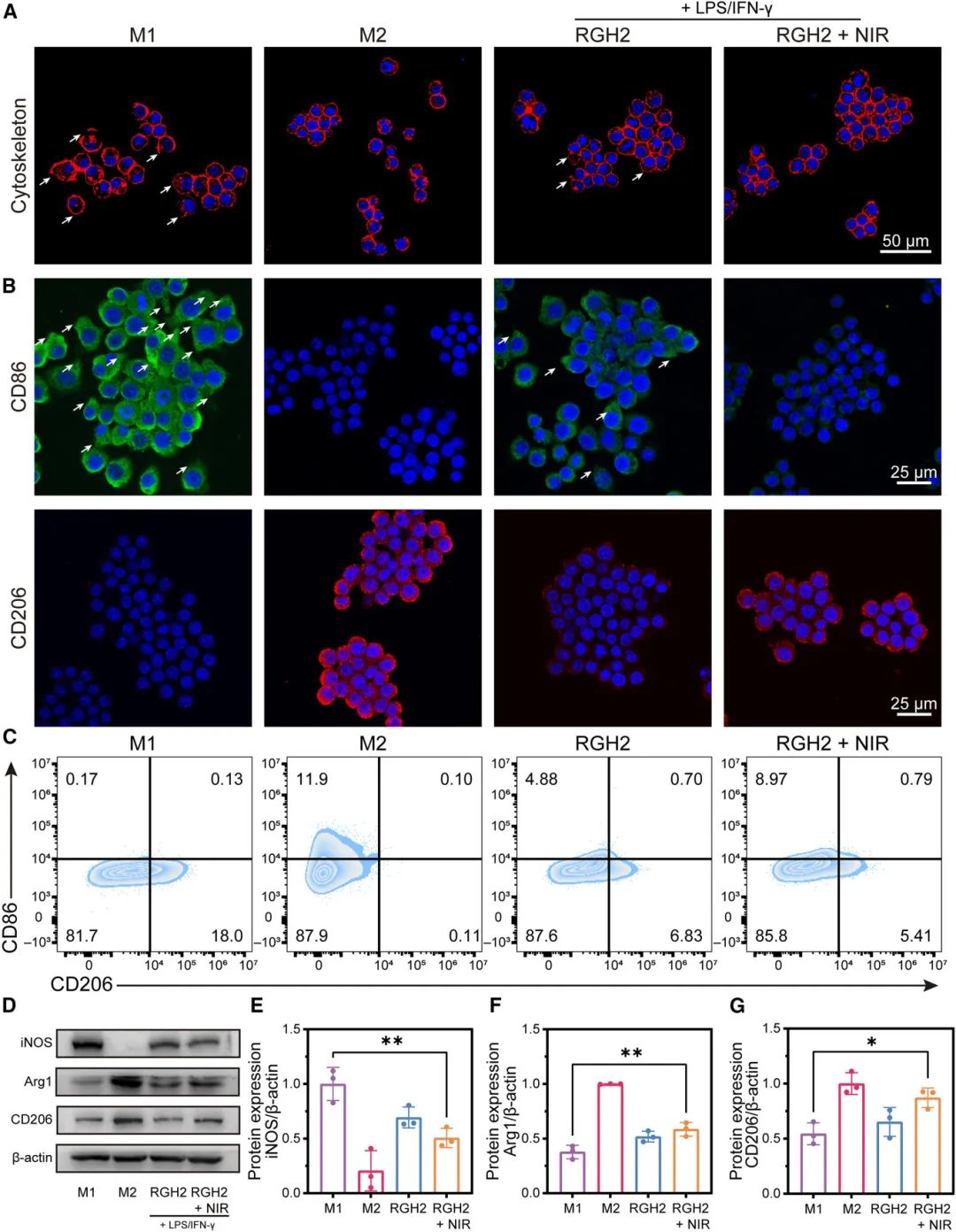
图5 RGH₂ 水凝胶体外免疫调节评价。(A)RAW264.7 巨噬细胞的显微荧光图像(细胞骨架:TRITC-鬼笔环肽,细胞核:DAPI);(B)炎症刺激 48 小时后,RAW264.7 细胞的 CD206(红色)和 CD86(绿色)荧光标记图像;(C)流式细胞术检测 CD86⁺ 和 CD206⁺ 水平(48 小时炎症刺激);(D)通过蛋白质印迹法评估巨噬细胞中的 iNOS、Arg-1 和 CD206 蛋白水平;(E-G)iNOS(E)、Arg-1(F)和 CD206(G)的蛋白表达水平
(6)RNA测序分析评估RGH2水凝胶中的免疫调节机制
为了鉴定对炎症治疗至关重要的基因,研究人员对RAW264.7细胞(归类为RGH₂和M1型)进行了RNA测序和转录组分析(图6)。结果显示,RGH₂处理的细胞与M1型细胞之间存在显著的基因表达差异。火山图和热图显示了968个差异表达基因(DEG),其中393个基因上调,575个基因下调(图6A)。弦图(图6B)显示,下调基因包括IL-6、IL-1β和TNF-α等促炎细胞因子。基因集富集分析(GSEA)表明,RGH₂处理的细胞中NF-κB和TNF-α信号通路被抑制(图6C)。基因本体(GO)和京都基因与基因组百科全书(KEGG)分析进一步揭示了与炎症相关的潜在途径(图6D和6E)。GO分析显示,基因表达差异与免疫系统活动、炎症反应以及细胞对LPS、IL-4和IFN-2的反应密切相关(图6E)。KEGG分析显示,NF-κB、细胞因子-细胞因子受体相互作用、TNF-α、Toll样和IL-17信号通路在RGH₂处理后发生显著变化,其中NF-κB和TNF-α通路显著增强(图6D)。这些结果表明,RGH₂通过调节TNF通路缓解氧化应激和缺氧,促进巨噬细胞从M1型向M2型转变,为糖尿病足溃疡(DFU)的治疗提供了潜在策略。此外,研究还发现TNF-α在免疫系统中具有广泛作用。TNF-α在感染、损伤或刺激下由免疫细胞分泌,激活TNFR1后整合NF-κB和丝裂原活化蛋白激酶(MAPK)通路,驱动炎症相关基因转录。测序结果显示,多个NF-κB相关基因(如Ptgs2、IL-1β、IL-6、IL-15、TNF、Ccl2、Ccl5、Cxcl1、Cxcl2和Cxcl3)在炎症诱导下表达上调(图6F)。
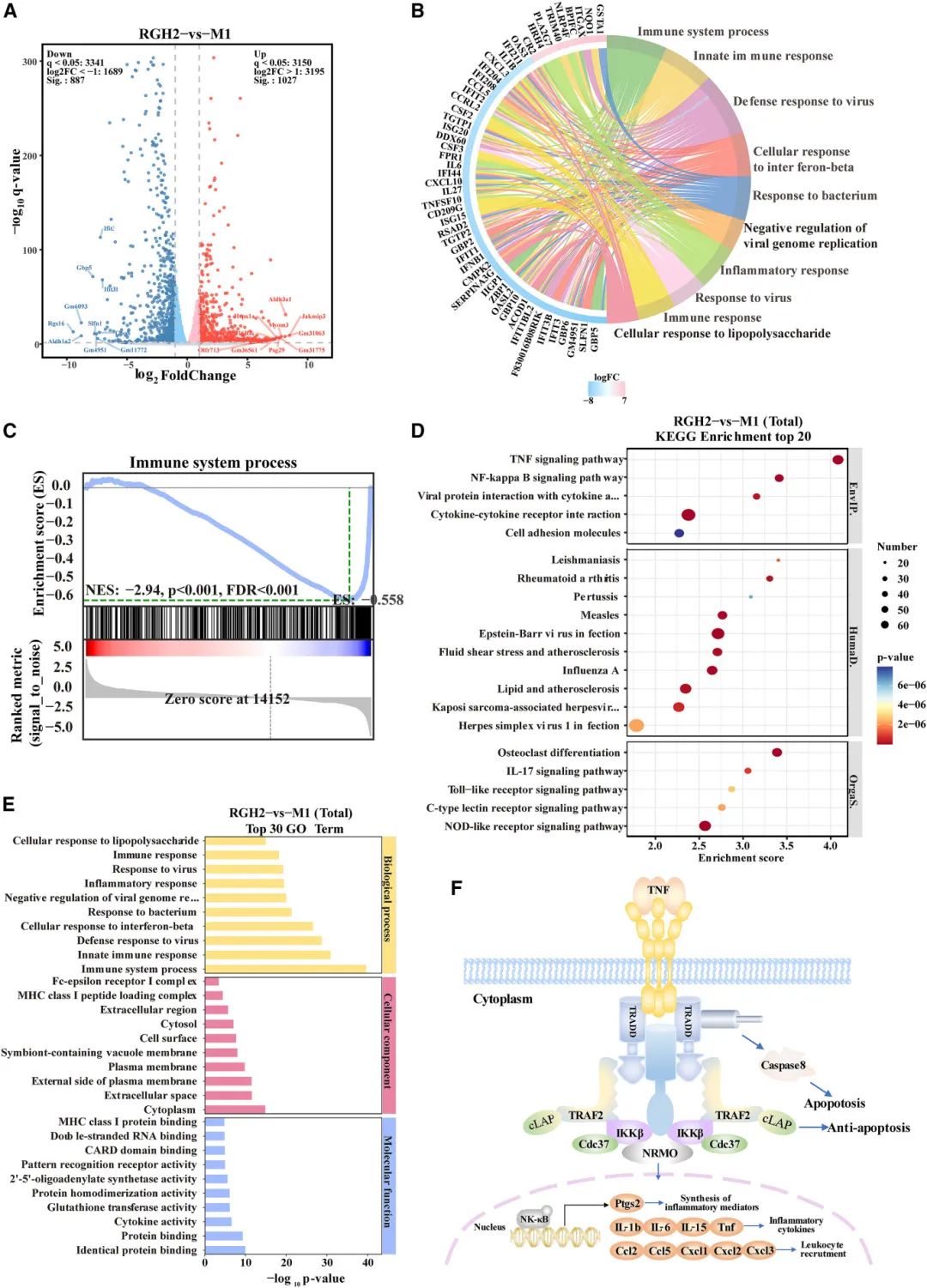
图6 RGH₂ 水凝胶处理后 RAW264.7 细胞的转录组评估。(A)M1 与 RGH₂ 组差异基因表达的火山图;(B)主要 10 个基因及其 GO 富集项的弦图;(C)免疫系统相关基因集的 GSEA;(D)对照组与 RGH₂ 组 DEG 的 KEGG 通路分析;(E)RAW264.7 细胞中 DEG 的 GO 术语(点大小和颜色分别表示富集基因数量和 p 值分布);(F)RGH₂ 通过 TNF 通路减少巨噬细胞炎症的影响
(7)RGH2水凝胶对背部皮肤伤口的愈合作用
研究评估了RGH₂水凝胶对糖尿病大鼠背部皮肤伤口的愈合能力(图7)。实验中,将RGH₂水凝胶涂抹在圆形伤口上,分为PBS(阴性对照)、3M水凝胶(阳性对照)和RGH₂+NIR组。结果显示,接受RGH₂和RGH₂+NIR治疗的伤口在第3天尺寸明显减小,到第7天,RGH₂+NIR组伤口尺寸减少量达其他组的20.68%。至第14天,PBS和3M组伤口面积仍扩大,而RGH₂组伤口面积缩小至13.0%,RGH₂+NIR组伤口面积缩小至10.8%(图7B-7D)。组织学分析表明,RGH₂+NIR治疗的伤口愈合更全面,H&E染色显示强健的肉芽组织和发育良好的表皮(图7E)。Masson染色突出了胶原蛋白沉积(图7F和7I),免疫组织化学染色显示RGH₂+NIR组IL-6水平显著降低(图7G和7J),CD34染色显示该组新生血管形成最为显著(图7H和7K)。这些结果表明,RGH₂+NIR治疗显著促进了伤口愈合和新生血管生成。
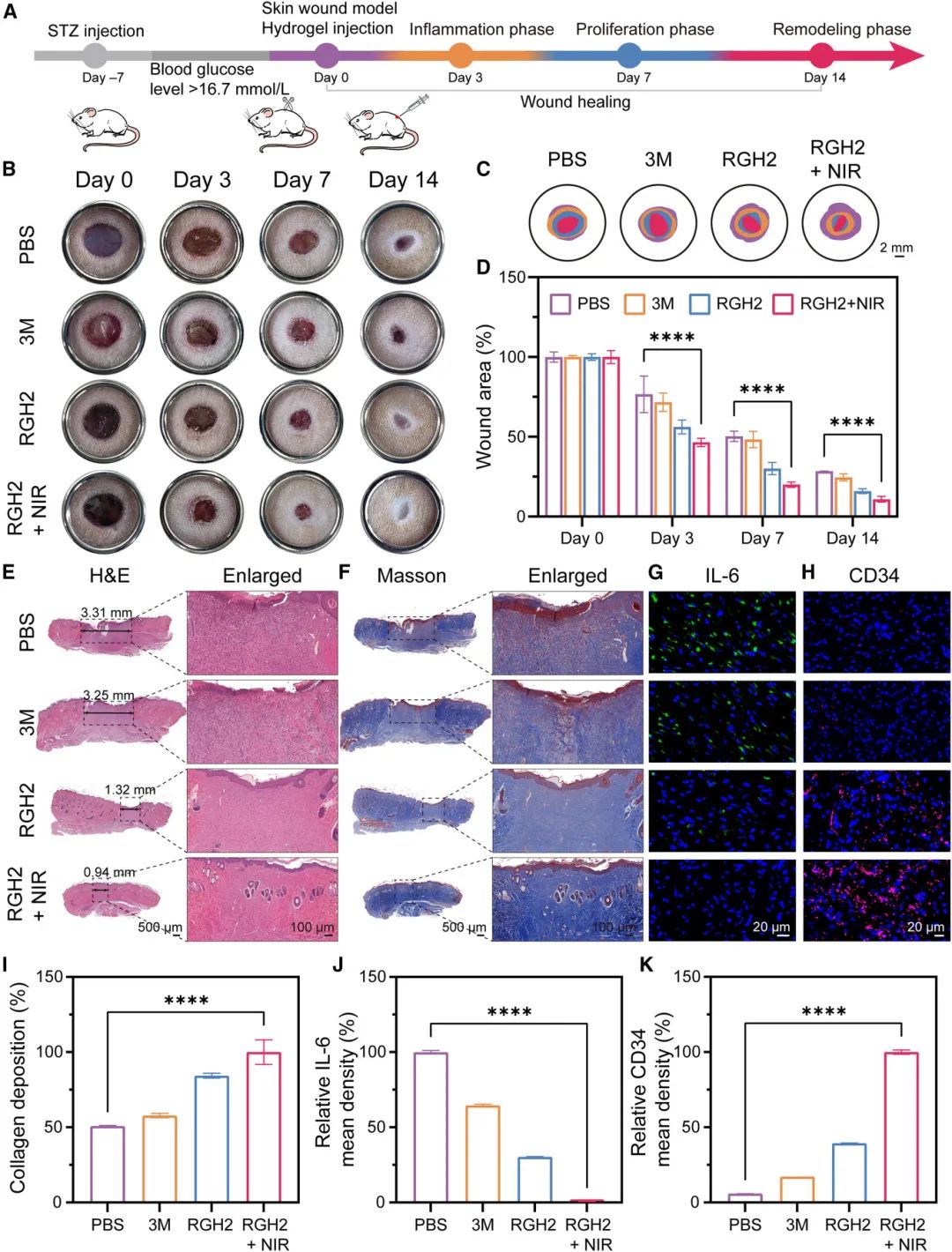
图7 RGH₂ 对背部皮肤伤口愈合效果的评估。(A)伤口形成和愈合过程的示意图;(B)不同药物处理的糖尿病大鼠全层皮肤伤口图像(PBS、3M、RGH₂ 和 RGH₂+NIR);(C)伤口愈合阶段说明;(D)不同组糖尿病大鼠背部伤口大小的定量分析;(E)皮肤切片的 H&E 染色图像;(F)第 14 天伤口区域的 Masson 染色;(G, H)患处大鼠皮肤组织的组织学分析(IL-6 染色:G,CD34 染色:H);(I)糖尿病伤口中胶原蛋白积累的定量数据;(J, K)糖尿病伤口中 IL-6(J)和 CD34(K)的平均荧光强度评估
(8) RGH2水凝胶对DFU伤口的愈合作用
研究进一步评估了RGH₂水凝胶对大鼠糖尿病足溃疡(DFU)伤口愈合的影响(图8)。实验中,使用活检穿刺器在大鼠足部制造直径为5毫米的圆形伤口,并涂抹50毫克测试样本。随后对伤口部位进行808 nm NIR照射(0.5 W/cm²,5分钟),温度升至约44.6°C。结果显示,接受RGH₂和RGH₂+NIR治疗的组伤口愈合速度更快(图8B)。到第7天,3M水凝胶组伤口面积为41.7%,PBS组为45.5%,而RGH₂+NIR组伤口几乎完全闭合,残留伤口面积仅为15.6%(图8C和8D)。
组织学分析表明,RGH₂+NIR组的愈合效果显著优于对照组。H&E染色(图8E)显示,RGH₂+NIR组再生皮肤组织结构完整,包括完全修复的上皮层和真皮层,且新血管增加。Masson染色(图8F和8I)显示,RGH₂+NIR组胶原纤维排列密集且整齐,表明胶原沉积增强。IL-6免疫荧光染色(图8G和8J)显示,RGH₂+NIR组炎症期较短,IL-6表达降低。CD34染色(图8H和8K)显示,RGH₂+NIR组新生血管增殖显著高于其他组,有助于伤口愈合。
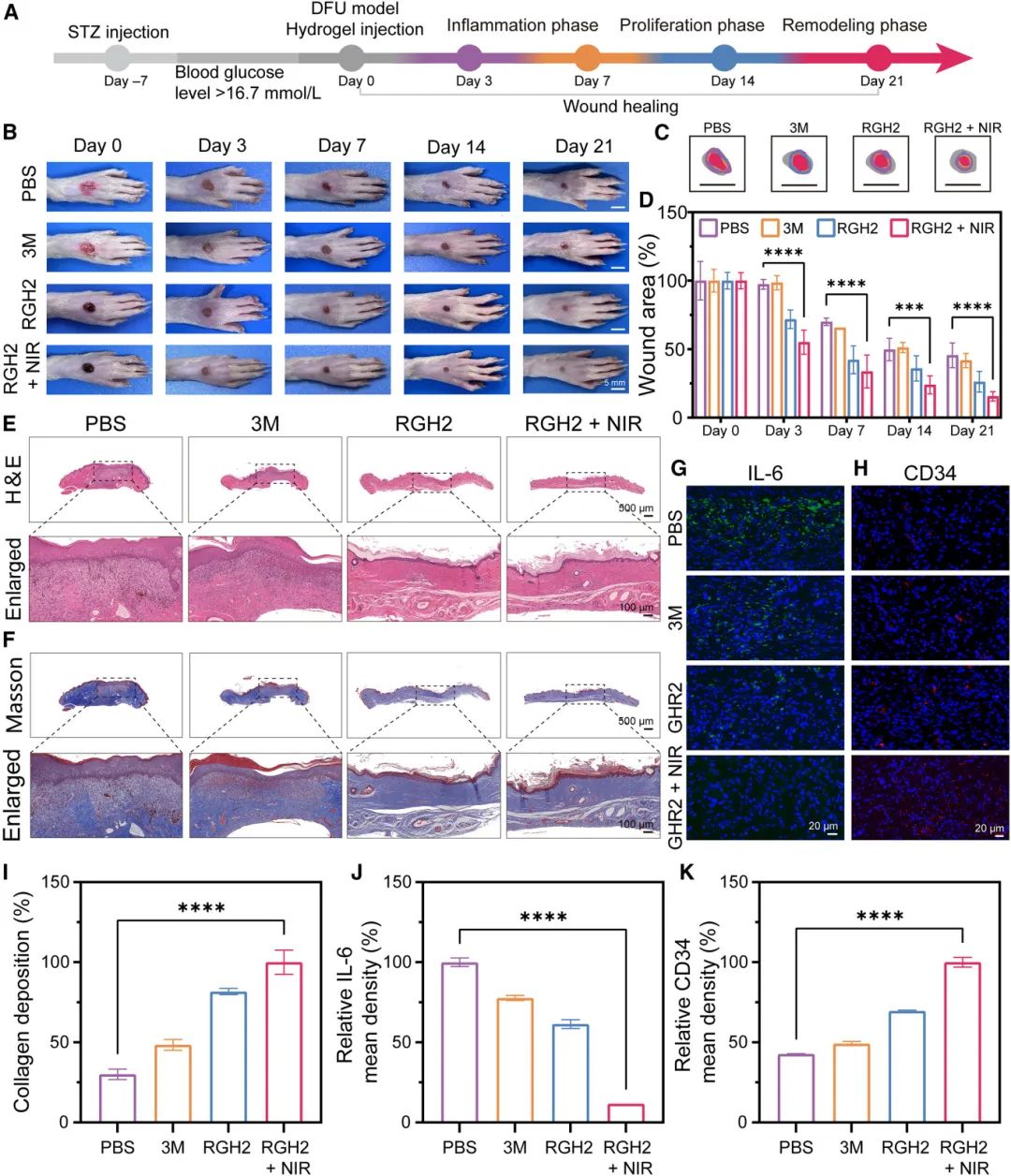
图8 RGH₂ 水凝胶对糖尿病大鼠 DFU 创面愈合的体内免疫调节作用。(A)伤口诱导及愈合轨迹示意图;(B)不同治疗组大鼠 DFU 进展图像;(C)DFU 伤口愈合阶段图解(比例尺:5 mm);(D)不同 DFU 类别伤口尺寸的数值评估;(E, F)第 21 天 DFU 患处的组织病理学检查(H&E 染色:E,Masson 染色:F);(G, H)DFU 伤口组织切片中 IL-6(G)和 CD34(H)的免疫荧光分析;(I)DFU 伤口中胶原蛋白积累的定量分析;(J, K)DFU 伤口中 IL-6(J)和 CD34(K)的平均荧光强度评估
本研究开发了一种名为RGH2的混合水凝胶系统,该系统包含Ru@allomelanin纳米颗粒、GelMA-PBA和HANB。RGH2通过其产氧和中和ROS的双重功能,有效降低高血糖环境中的高ROS水平,从而引导巨噬细胞向M2表型转变并减轻炎症。体外实验和转录组分析均表明RGH2能够阻断ROS-炎症反馈回路,从而降低M1/M2巨噬细胞比例。此外,在糖尿病大鼠模型中进行的体内实验中,将RGH2水凝胶应用于背部皮肤、糖尿病足溃疡(DFU)伤口和口腔黏膜,证实了其能够有效打破缺氧引起的炎症和ROS累积的持续循环。这种干预措施有助于减轻炎症、增强胶原合成和加快血管再生,从而改善伤口愈合效果。在近红外触发的高温(44.6°C)的进一步增强下,RGH2水凝胶的性能显著提高,使其成为治疗糖尿病患者伤口的非常有前景且合适的治疗选择。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

