
胶质母细胞瘤(GBM)是中枢神经系统最常见且恶性程度最高的原发性肿瘤,占胶质瘤的约50%。手术切除是目前的主要治疗手段,但因肿瘤高度侵袭性,难以完全切除,常导致复发。免疫疗法虽为治疗带来新希望,但GBM组织的免疫抑制性微环境(TME)限制了其疗效。此外,肿瘤的基因组不稳定性使其高度异质,个性化肿瘤疫苗成为新策略,但免疫原性有限。因此,研究如何改变GBM的免疫抑制性TME、增强免疫反应及提高疫苗疗效成为关键。

为此,重庆医科大学刘国栋主任、重庆大学蔡开勇教授和漆超副教授研究开发了一种新型自体纳米疫苗,通过免疫原性多米诺效应将免疫抑制性微环境转化为活跃的免疫景观,从而靶向残余肿瘤细胞并预防GBM复发。该纳米疫苗通过将脂多糖(LPS)和胶质母细胞瘤细胞裂解物(GCL)共载入层状双氢氧化物(LDH)纳米片中制成,随后将其整合到可注射的海藻酸水凝胶中,形成LLGA-Gel。该纳米疫苗利用GCL的免疫原性潜力以及LPS的免疫刺激特性,诱导细胞焦亡性细胞死亡,增强树突状细胞成熟,并促进巨噬细胞向M1表型极化;这些效应最终导致肿瘤部位CD8+T细胞浸润增加和Foxp3+Treg细胞减少。体内实验表明,这种纳米疫苗不仅增强了免疫原性细胞死亡的疗效,而且显著增强了免疫反应,从而显著降低了同种异体GBM的术后复发。这项研究强调了纳米技术增强的免疫疗法在开发针对GBM的有效纳米疫苗方面的前景。该文章于2025年2月3日以《Autologous Nanovaccine Induces Immunogenic Domino Effect to Prevent Postoperative Recurrence of Orthotopic Glioblastoma》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202412040)。
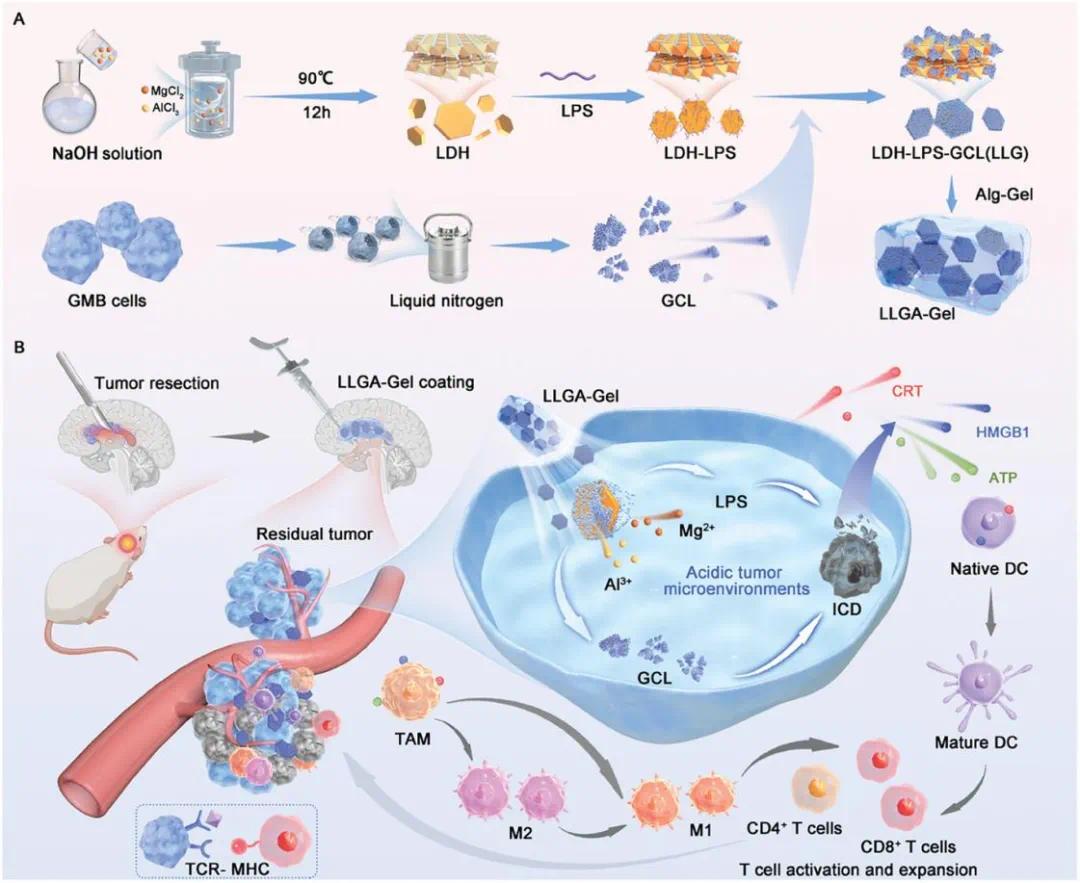
研究示意图
(1)纳米疫苗的制备与表征
采用水热法合成的MgAl-LDH纳米片为六边形薄片,直径约200 nm(SEM,图2A;TEM,图2B)。元素映射(图2B)和XPS(图2D)证实其主要元素为Al、Mg、O,且均匀分布。AFM(图2C)分析显示其厚度约4 nm。脂多糖的紫外-可见吸收光谱在259 nm处有特征峰,加载后显著降低(图2E),FT-IR光谱在≈2350 cm⁻¹处有特征峰,LDH-LPS中保留(图2F),表明脂多糖成功加载。Zeta电位测试(图2G)显示LDH纳米片在水中带弱负电荷,加载LPS后负电荷显著增加,用GCL包覆后LLG的Zeta电位逆转至≈+13 mV。Bradford蛋白质测定法用于测量GCL的包封效率。XRD图谱(图2H)显示LLG的衍射峰与LDH相似,与氢氧化镁铝的标准卡片特征峰一致(PDF#35-0965,Mg₆Al₂(OH)₁₈·4.5H₂O),说明LPS和GCL的加载对LDH的结晶无影响。
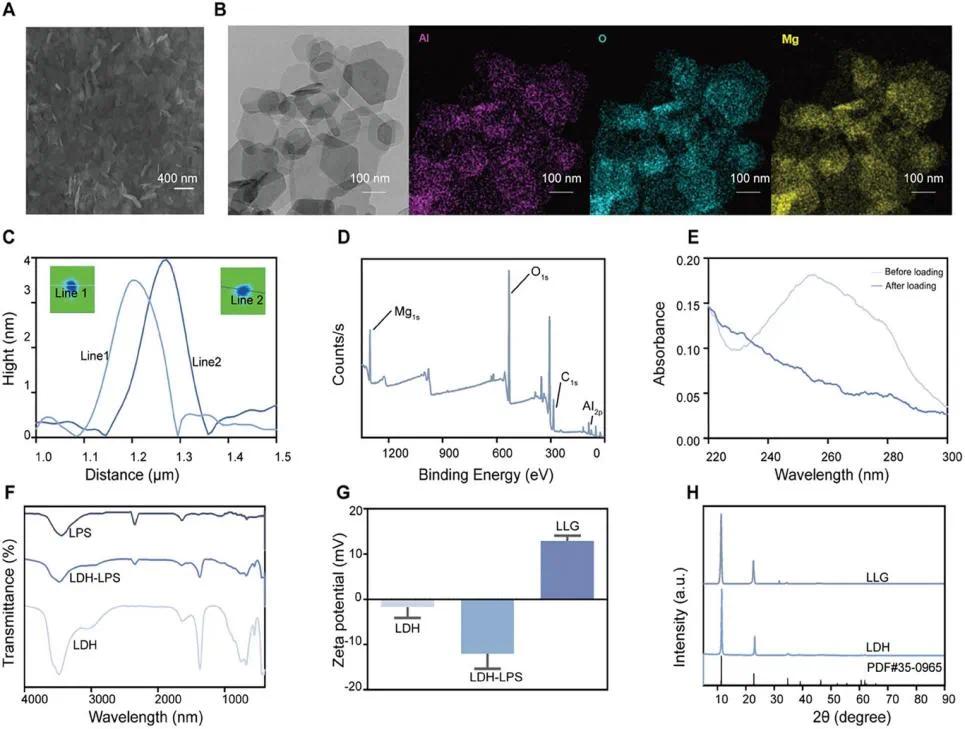
图1 MgAl-LDH的表征。(A)代表性扫描电子显微镜(SEM)图像;(B)透射电子显微镜(TEM)图像和MgAl-LDH的元素映射;(C)原子力显微镜(AFM)图像和MgAl-LDH纳米片在两个不同视角下的厚度;(D)LDH的X射线光电子能谱(XPS)分析;(E)LPS加载前后的紫外-可见光谱;(F)LDH、LPS和LDH-LPS的傅里叶变换红外光谱(FT-IR);(G)LDH、LDH-LPS和LLG的Zeta电位测量(n=3);(H)LDH、LLG和标准镁铝氢氧化物卡片(PDF#35-0965,Mg₆Al₂(OH)₁₈·4.5H₂O)的X射线衍射(XRD)图谱
(2)细胞焦亡与LLG纳米疫苗的抗肿瘤效果和免疫原性细胞死亡(ICD)机制
前期研究已证实LPS可启动炎症小体形成,炎症小体激活caspase-1,进而切割gasdermin D(GSDMD),其N端片段转移到细胞膜形成孔洞,导致细胞肿胀、裂解,引发细胞焦亡。本研究旨在验证LLG纳米疫苗的体外抗肿瘤效果。选用GL261胶质瘤细胞为肿瘤细胞模型,HT22神经元细胞为正常细胞模型,采用CCK-8试剂盒评估LLG的细胞毒性及生物安全性。结果显示,LPS对GL261细胞的细胞毒性呈浓度依赖性,LDH加载后增强(图3A)。LLG处理后,GSDMD切割水平升高,N端带增加(图3B),这源于LDH促进GL261细胞对LPS的摄取,GCL的加载进一步增强此作用(图3D、E)。因此,LLG在相同浓度下抗肿瘤效果最佳。Caspase-1抑制剂Z-VAD-FMK显著增加细胞存活率(图3C),证实caspase-1介导的GSDMD激活是细胞焦亡的关键。此外,LLG在80 µg/mL浓度下对HT22神经元细胞无明显细胞毒性(图3A),因其摄取量低(图S4A、B,支持信息)。这表明LLG纳米疫苗可选择性靶向并消除肿瘤细胞,而不影响正常神经细胞,最大限度地提高治疗效果并减少对健康脑组织的损害。
细胞焦亡以细胞肿胀、细胞膜破裂为特征,释放细胞内容物激活炎症反应,被视为免疫原性细胞死亡(ICD)。推测LPS诱导的细胞焦亡可促进GL261细胞释放抗原物质,激活肿瘤免疫原性。ICD的标志包括细胞表面钙网蛋白(CRT)外翻、ATP分泌和高迁移率族蛋白B1(HMGB1)释放。LLG处理后,GL261细胞表面CRT信号最强(图3F、G),而其他组信号较低。ATP和HMGB1水平在各治疗组均升高,LLG处理效果最显著(图3I、J)。HMGB1的免疫荧光染色显示其从细胞核到细胞质的转位及细胞外释放(图3H)。这些结果表明LLG通过携带肿瘤裂解物,触发广泛的抗原释放,增强免疫原性。
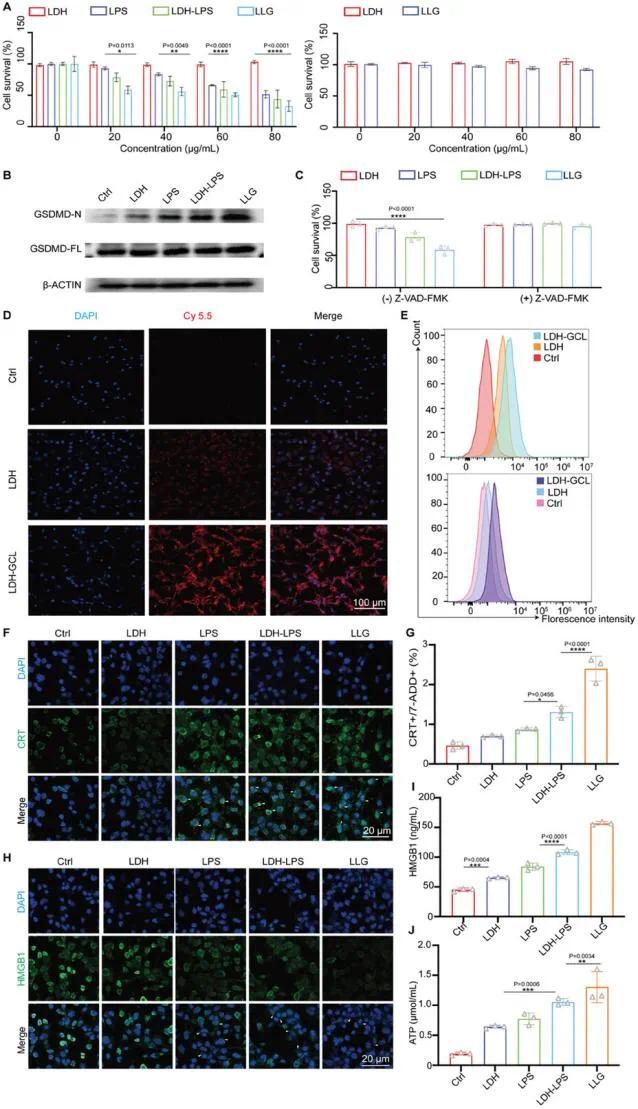
图2(A)不同样本处理24小时后GL261和HT22细胞的存活率(n=3);(B)GL261细胞的GSDMD和β-ACTIN的Western blot分析;(C)GL261细胞存活率(24小时,有无Z-VAD-FMK,n=3);(D)GL261细胞与LDH和LDH-GCL共孵育4小时的CLSM图像(Cy5.5标记,DAPI染色);(E)GL261和HT22细胞与LDH和LDH-GCL共孵育4小时的流式细胞术分析;(F)GL261细胞中CRT分布的CLSM图像(LDH、LPS、LDH-LPS和LLG处理);(G)GL261细胞CRT暴露的流式细胞术定量分析(n=3);(H)GL261细胞内HMGB1分布的CLSM图像(LDH、LPS、LDH-LPS和LLG处理);(I)GL261细胞HMGB1释放谱(n=3);(J)GL261细胞细胞外ATP分泌(n=3)
(3)LLG促进DCs成熟和巨噬细胞极化
DCs和巨噬细胞对LDH-GCL的摄取显著增加(图4A)。与单独的LDH相比,LLG处理组中M1型巨噬细胞数量显著增加(图4B)。LLG处理组中M2型巨噬细胞数量处于最低水平(图4C)。LLG处理组中M1型巨噬细胞的极化效果显著(图4D)。在抗原共存条件下,LLG组中CD80和CD86双阳性DC的数量超过其他组(图4E)。LLG处理组中M1型巨噬细胞的极化效果显著(图4F)。LLG处理组中M2型巨噬细胞数量处于最低水平(图4G)。LLG处理组中CD80和CD86双阳性DC的数量超过其他组,表明LLG具有最佳的DC促成熟功能(图4H)。
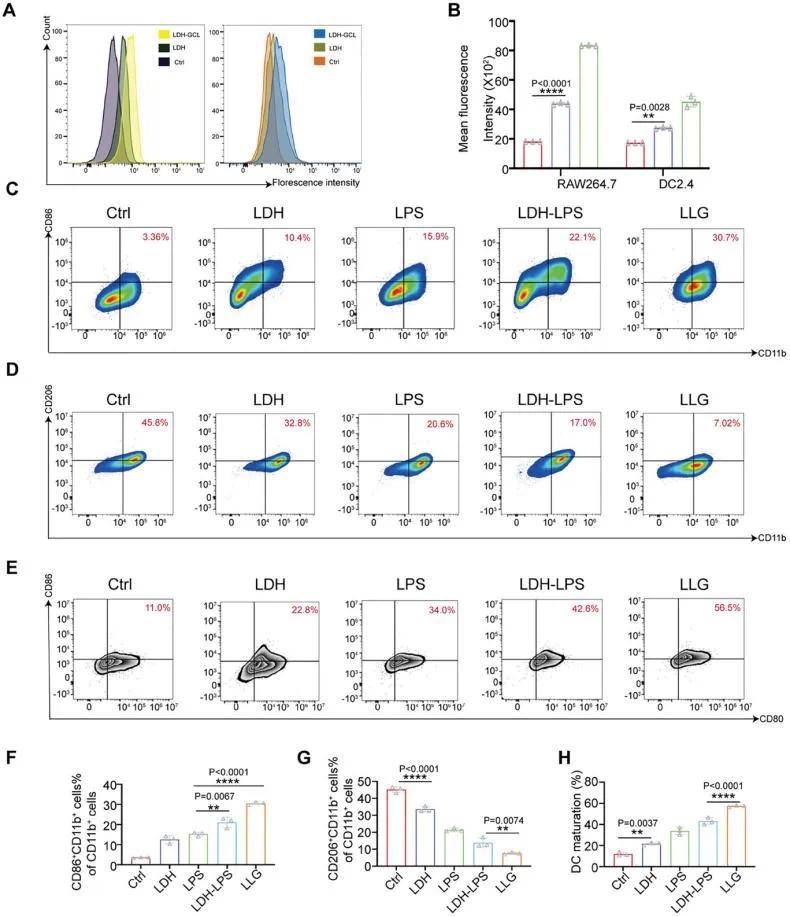
图3(A)流式细胞术分析游离LDH和LDH-GCL在RAW264.7细胞(左)和DC2.4细胞(右)中的细胞摄取;(B)使用游离LDH和LDH-GCL培养的RAW264.7细胞、DC2.4细胞的细胞吞噬定量分析(n=3);(C,D)不同材料处理后RAW264.7细胞中M1巨噬细胞(CD11b⁺CD86⁺,C)和M2巨噬细胞(CD11b⁺CD206⁺,D)的流式细胞术分析;(E)与不同材料预处理的胶质瘤细胞共培养后DC成熟度的流式细胞术分析;(F,G)RAW264.7细胞中M1巨噬细胞(F)和M2巨噬细胞(G)的相对定量(n=3);(H)与预处理的GL261共培养后成熟的DC2.4的相对定量(n=3)
(4)评估同种异体GBM术后复发的预防
为了将LLG纳米疫苗锚定在肿瘤部位,以实现肿瘤疫苗和免疫佐剂的持续缓慢释放,该研究将LLG嵌入Alg-Gel构建LLGA-Gel药物储存库。Alg-Gel和LLGA-Gel均具有均匀且完整的多孔结构。LLGA-Gel在手术切除后第33天对GBM术后复发的抑制作用最强(图5C、D)。与对照组相比,LA-Gel和LLA-Gel对肿瘤复发有一定抑制作用,LLGA-Gel抑制作用最强(图5E)。LLGA-Gel治疗组的脑切片中几乎不存在恶性肿瘤细胞(图5F)。LLGA-Gel组的TUNEL染色显示广泛的DNA断裂和细胞死亡(图5G)。LLGA-Gel组小鼠的中位生存时间延长至103天,对照组为31天(图5H)。除对照组外,治疗过程中小鼠体重无显著变化(图5I)。LLGA-Gel组未观察到肝肾功能指标差异和主要器官严重损伤。
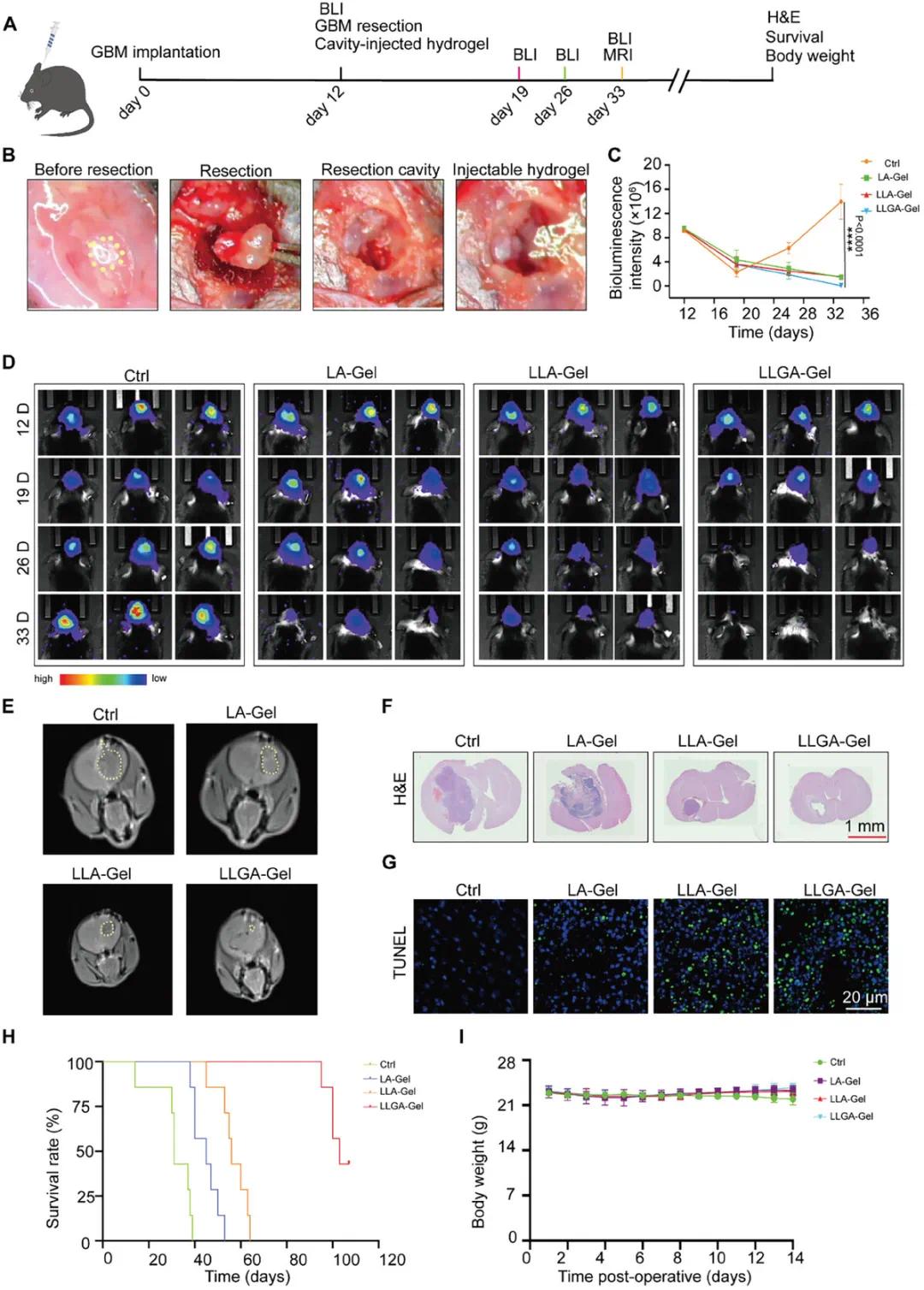
图4(A)实验设计示意图;(B)肿瘤接种后第12天手术切除,黄色圆圈表示颅内骨窗定位点;(C)手术后各组小鼠胶质瘤生物发光信号强度量化(n=3);(D)不同治疗方法手术后胶质瘤小鼠的代表性生物发光图像(n=3);(E)不同水凝胶治疗后小鼠的T₁加权磁共振成像(T₁ W-MRI)图像,黄色圆圈指向肿瘤组织;(F,G)手术后33天各组小鼠脑组织切片的H&E和TUNEL染色;(H)不同治疗方法手术后胶质瘤小鼠的生存曲线(n=8);(I)手术后各组小鼠体重评估(n=8)
(5)LLGA-Gel在体内诱导抗肿瘤免疫反应的疗效
脾脏中CD4+和CD8+ T细胞显著增加(图6A、C),Foxp3+/CD4+ Treg细胞减少(图6B、D)。在LLGA-Gel处理的肿瘤组织中,CD8细胞毒性T细胞和CD4 T细胞浸润显著增加(图6E),Foxp3 Treg细胞减少(图6F)。LLGA-Gel治疗后,肿瘤组织中M1型巨噬细胞显著增加(图6G、J),M2型巨噬细胞减少(图6K),成熟DCs标志物CD80和CD86在总DCs中的表达增强(图6G)。此外,LLGA-Gel治疗显著降低了IL-10和IL-12水平,同时增加了IFN-γ和TNF-α水平(图6I)。
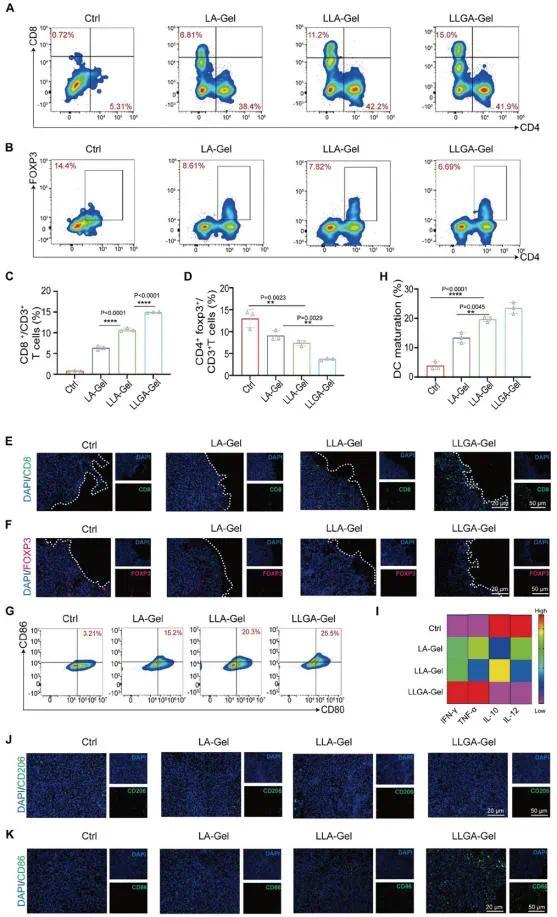
图5(A)术后小鼠脾脏组织中CD3⁺CD8⁺和CD3⁺CD4⁺ T细胞百分比的代表性流式细胞术分析(n=3);(B)术后小鼠脾脏组织中CD3⁺CD4⁺Foxp3⁺ T细胞百分比的流式细胞术分析(n=3);(C)各组小鼠术后脾脏组织中CD3⁺CD8⁺ T细胞比例(n=3);(D)各组小鼠脾脏组织中CD3⁺CD4⁺Foxp3⁺ Tregs数量定量分析(n=3);(E,F)肿瘤中CD8⁺ T细胞(E)和Foxp3⁺ Tregs(F)浸润的免疫荧光检测;(G,H)不同药物治疗后肿瘤组织中成熟树突状细胞百分比的流式细胞术分析(G)和定量分析(H,n=3);(I)不同治疗后肿瘤组织中IL-10、IL-12、IFN-γ和TNF-α的标准化相对表达水平热图;(J,K)不同治疗组肿瘤组织中巨噬细胞M2(J)和M1(K)的免疫荧光图像
自体纳米疫苗的开发和应用代表了胶质母细胞瘤(GBM)治疗领域的一次突破性进展,通过增强免疫原性反应超越了传统治疗方法。 这种纳米疫苗封装了GL261细胞裂解蛋白,便于肿瘤细胞、巨噬细胞和DCs摄取,从而诱导免疫原性细胞死亡,同时最大限度地减少对健康组织的损伤。进入肿瘤微环境后,它触发了靶向的焦亡,启动了多米诺效应,放大了免疫原性肿瘤抗原的存在,并增强了治疗的免疫刺激潜力。补充手术切除,纳米疫苗促进CD8+T细胞浸润,减少Foxp3+Tregs,并促进巨噬细胞向M1表型极化,显著推进DC成熟。 体内实验表明,术后给予LLG纳米疫苗显著预防了GBM复发,将肿瘤部位转变为免疫激活中心,并强调了纳米材料在协调全面和持久抗肿瘤免疫反应中的潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

