
研究背景:
前内侧骨关节炎(AMOA)是一种以膝关节前内侧软骨不可逆损伤为特征的退行性疾病,其治疗面临诸多挑战,目前缺乏有效的靶向治疗方法。传统治疗方法如药物治疗和物理疗法往往效果有限,且难以精准作用于病变部位。微藻因其丰富的生物活性成分、良好的生物相容性和可控性,在生物医学领域显示出巨大潜力。然而,如何将这些微藻有效地递送到特定病变部位并实现局部高浓度药物释放,仍是亟待解决的问题。

针对上述问题,北京大学第三医院田华教授团队研究开发了一种新型磁控微藻基微型机器人(M-CH@QUE),用于精确治疗前内侧骨关节炎(AMOA)。通过将Fe3O4沉积并结合槲皮素负载到小球藻,实现了药物的高效负载和释放。研究表明,M-CH@QUE不仅具有良好的生物相容性和磁响应性能,还能有效减轻氧化应激和炎症反应,促进软骨修复。体内实验进一步证实了其在AMOA小鼠模型中的优异治疗效果,表明M-CH@QUE是一种有前景的新型治疗手段,为未来临床应用提供了有力支持。这些发现为开发基于微藻的多功能治疗平台奠定了基础,并展示了其在生物医学领域的广泛应用潜力。该文章于2025年3月4日以《Magnetically controlled chlorella-based microrobots loaded with quercetin for precision treatment of anteromedial osteoarthritis》为题发表于《Advanced Functional Materials》上(DOI: 10.1002/adfm.202418197)。
(1)磁控微型机器人的特性研究
图1A展示了M-CH@QUE的制备流程,包括固定、渗透和磁化过程。图1B的TEM图像显示小球藻细胞内部成功负载磁性颗粒且细胞结构完整。图1C的SEM图像表明磁性颗粒在细胞内均匀分布。图1D的XRD分析确认了Fe₃O₄晶体结构的存在。图1E的VSM磁滞回线显示M-CH具有优异的超顺磁性。图1F的共聚焦显微镜图像证实磁性颗粒未掩盖小球藻的荧光信号。图1G证明M-CH在PBS中60天内显著降解,具有良好的生物降解性。这些结果表明M-CH@QUE作为新型多功能治疗平台,在生物医学应用中具有潜力。
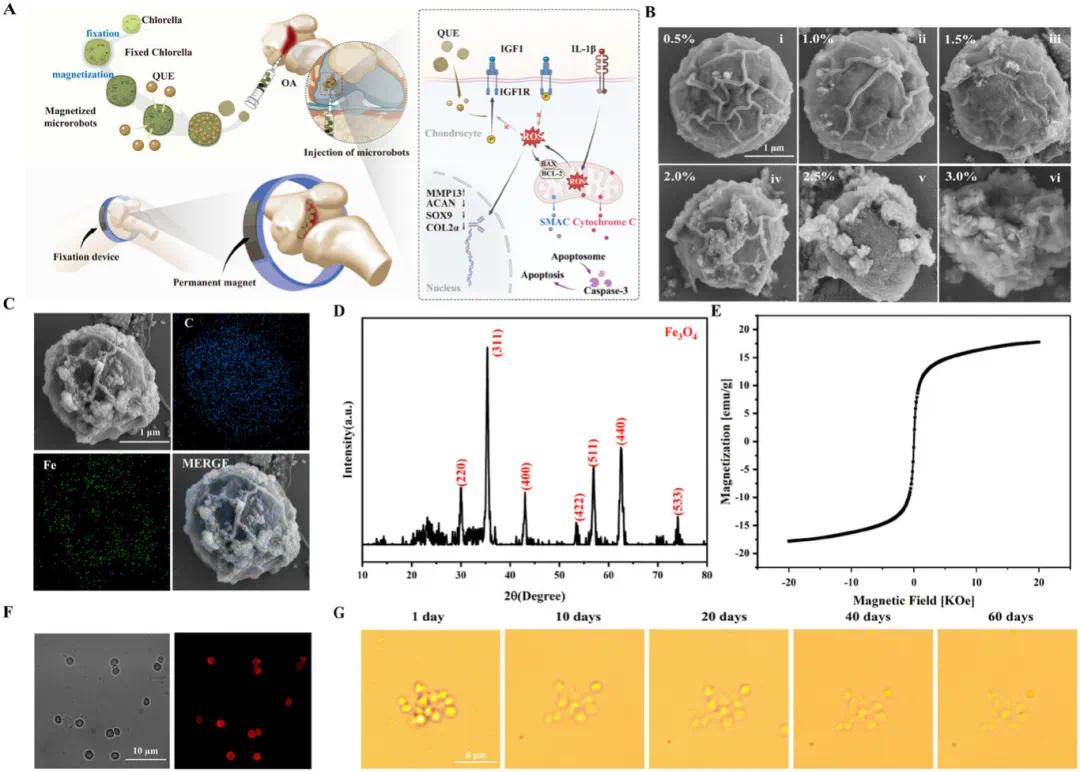
图1 磁控微型机器人的特性研究。(A)M-CH@QUE治疗OA机制的图形摘要:CH通过固定、磁化等工艺制成M-CH。槲皮素(QUE)负载后,通过关节内注射给药,其在关节腔内的分布由半圆形永磁体控制。M-CH@QUE到达关节腔后释放QUE,被软骨细胞吸收,促进IGF-1R磷酸化,抑制NOX2和NOX4表达,调节细胞内ROS水平,保护软骨细胞,抑制凋亡,促进细胞增殖,增强软骨分化;(B)不同Fe₃O₄浓度下M-CH的SEM图像;(C)能量色散X射线分析显示M-CH中存在碳(蓝色像素)和铁(绿色像素);(D)M-CH的XRD分析;(E)M-CH的VSM测试;(F)小球藻的亮场和荧光图像;(G)在PBS中观察到M-CH的逐渐降解
(2)M-CH的细胞相容性和载药量
图2A显示,CCK-8实验结果表明M-CH在10⁶/mL浓度下与软骨细胞共培养3天无显著细胞毒性。图2B、C的流式细胞术结果进一步验证了M-CH的低细胞毒性,并分析了不同条件下的软骨细胞凋亡率。图2D的Calcein-AM和PI染色荧光图像展示了与不同材料共孵育3天后活细胞(绿色)和死细胞(红色)的状态。图2E显示,单独用槲皮素处理软骨细胞的CCK-8实验在第3天也未表现出细胞毒性。图2F表明M-CH在不同初始浓度下具有良好的载药效率。图2G显示M-CH在PBS中可实现槲皮素的持续释放。图2H的阿辛蓝染色结果显示,不同处理条件下软骨细胞分泌的糖胺聚糖有积极变化趋势。这些结果表明M-CH具有良好的生物相容性、可降解性、高效的药物装载及缓释特性,为关节腔内局部给药提供了新策略。
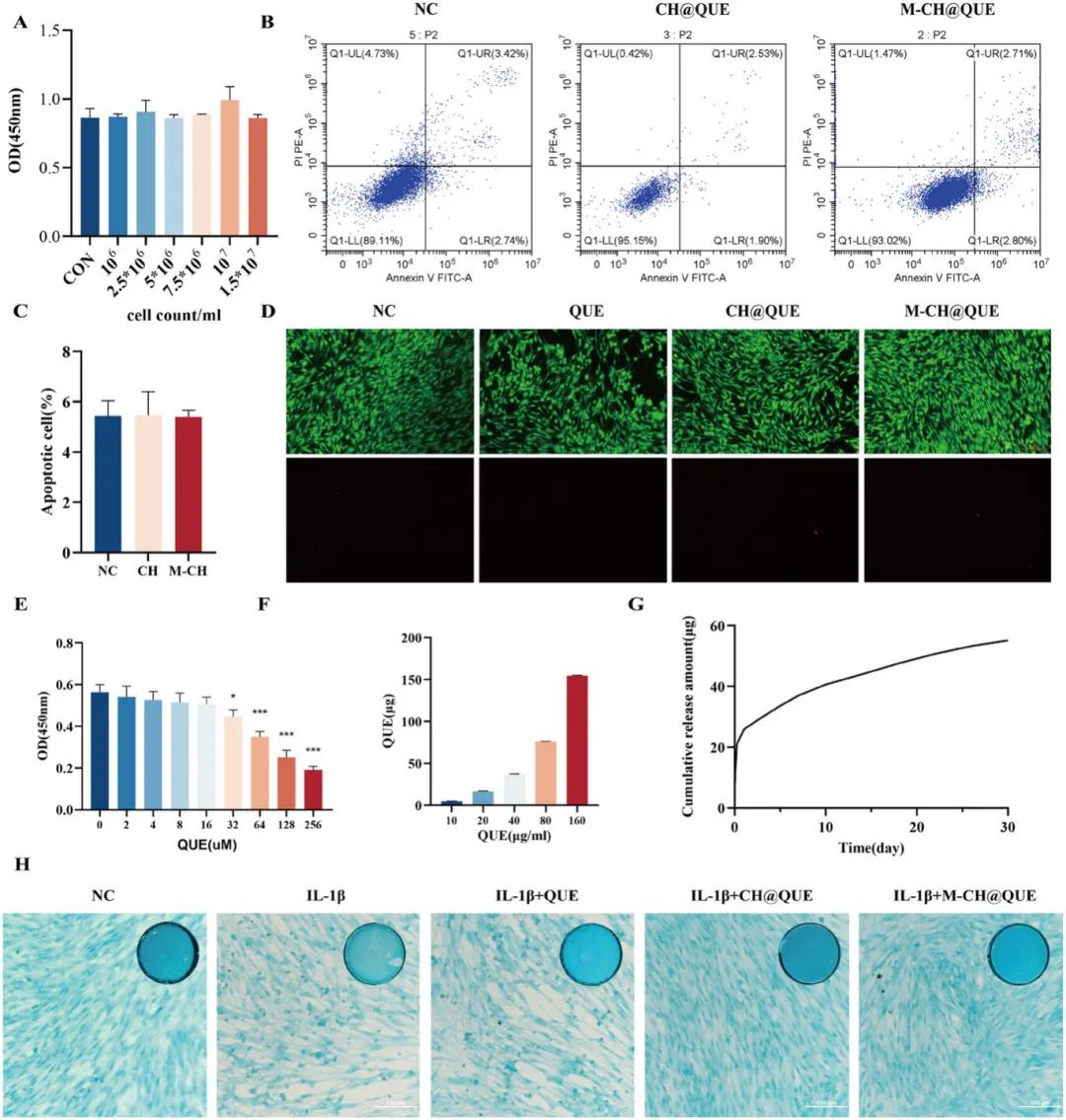
图2 M-CH的细胞相容性和药物负载能力。(A)用M-CH培养3天后的软骨细胞的CCK-8测定结果;(B)软骨细胞的膜联蛋白V-FITC/PI流式细胞术结果;(C)定量分析B中的凋亡率(数据表示为平均值±SD,n=8);(D)软骨细胞的荧光图像(与各种材料共孵育3天后用钙黄绿素-AM和PI染色,红色代表死细胞,绿色代表活细胞);(E)与QUE共孵育的软骨细胞的CCK-8测定(第3天);(F)M-CH在不同初始浓度下的载药效率;(G)在PBS中,QUE从M-CH@QUE的累积释放质量随时间变化;(H)不同条件下软骨细胞的阿尔新蓝染色结果(右上图为肉眼图像,大图为光学显微镜图像,n=3,IL-1β:10 ng/ml,QUE:16 μM,CH@QUE/M-CH@QUE:与CH@QUE或M-CH@QUE共培养,单因素方差分析后Tukey HSD检验,NC:阴性对照,*p<0.05,**p<0.01,***p<0.001)
(3)QUE保护OA软骨细胞作用机制的网络药理学预测
通过SwissTarget数据库筛选出99个QUE潜在靶基因,并与GeneCards中筛选的OA相关基因进行比对,最终找到50个共同基因(图3A)。基于STRING数据库构建的蛋白质-蛋白质相互作用网络(PPI)显示,胰岛素样生长因子1受体(IGF1R)是第10个关联性最强的基因(图3B、C)。进一步分析GSE55457数据集中的差异表达基因(DEGs),鉴定出672个DEGs,并通过火山图展示其分布(图3D)。通过Venn图分析,发现QUE靶基因、OA相关基因和DEGs之间存在5个共有基因(图3E)。ROC曲线评估表明,这5个共有基因具有作为生物标志物的潜力(图3F)。GO/KEGG富集分析显示,QUE与氧化应激相关性显著,提示其可能通过调节氧化应激相关通路发挥治疗作用(图3G)。分子对接实验预测了QUE与IGF1R的结合模式及结合自由能(图3I),并通过表面等离子共振(SPR)技术验证了两者的结合能力,实验结果显示QUE与IGF1R结合后引起显著的共振角度变化,计算得到的解离常数(KD)为1.68E-05 M,表明QUE对IGF1R具有较高的亲和力(图3J、K)。这些结果综合表明,QUE可能通过调节IGF1R及其相关的氧化应激通路来保护软骨细胞,为治疗骨关节炎(OA)提供了新的靶点和机制。
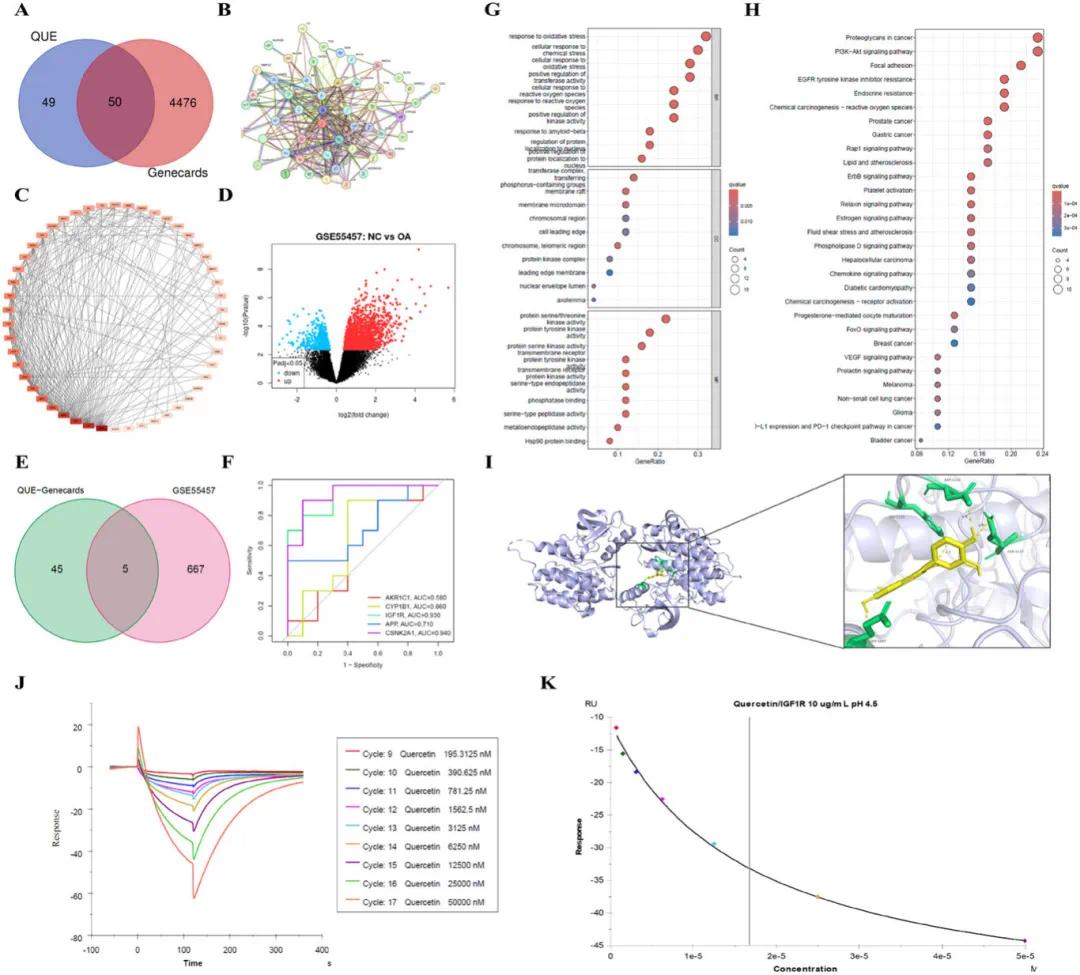
图3 槲皮素在骨关节炎(OA)条件下保护软骨细胞的作用机制的网络药理学预测。(A)槲皮素(QUE)与骨关节炎相关靶点的重叠靶点;(B)预测的抗骨关节炎QUE靶点的蛋白质-蛋白质相互作用(PPI)网络;(C)基于PPI网络中度的基因排名;(D)从GEO数据集(GSE55457)识别的差异表达基因(DEG);(E)QUE、骨关节炎相关靶点和DEG的重叠靶点;(F)来自(E)的5个基因的受试者工作特征(ROC)曲线;(G)前10位基因本体(GO)富集分析结果,涵盖生物过程、细胞组分和分子功能;(H)通过KEGG富集分析的前30个信号传导途径;(I)IGF1R和QUE的分子对接结果;(J)槲皮素与IGF1R的动力学测试曲线;(K)槲皮素与IGF1R的稳态拟合曲线
(4)QUE作用机制的实验验证
首先,通过IL-1β刺激原代软骨细胞,成功建立了体外OA模型,该模型抑制了细胞增殖并促进了凋亡相关蛋白的表达(图S4A-C)。此外,IL-1β刺激还导致活性氧(ROS)过度激活、NOX2和NOX4上调,同时抑制了IGF1R及其磷酸化形式P-IGF1R的表达(图S4D-F)。添加QUE能够显著逆转这些细胞损伤,但Western blot分析显示,QUE并不能逆转IL-1β诱导的IGF1R下调,这表明QUE可能不是直接上调IGF1R表达,而是通过促进IGF1R磷酸化调节氧化应激水平,从而保护软骨细胞。为了验证这一假设,使用了IGF1R磷酸化的特异性抑制剂NVP-AEW541。结果显示,QUE显著改善了由IL-1β抑制的软骨细胞增殖,但这种效应被IGF1R磷酸化抑制剂逆转(图4A)。EdU实验结果也支持了这些发现(图4E)。此外,Annexin V/碘化丙啶双染和流式细胞术分析显示,在存在抑制剂的情况下,QUE的保护效果显著减弱(图4B),Western blot进一步证实了这些结果(图4D)。进一步评估了QUE促进软骨形成的潜力。
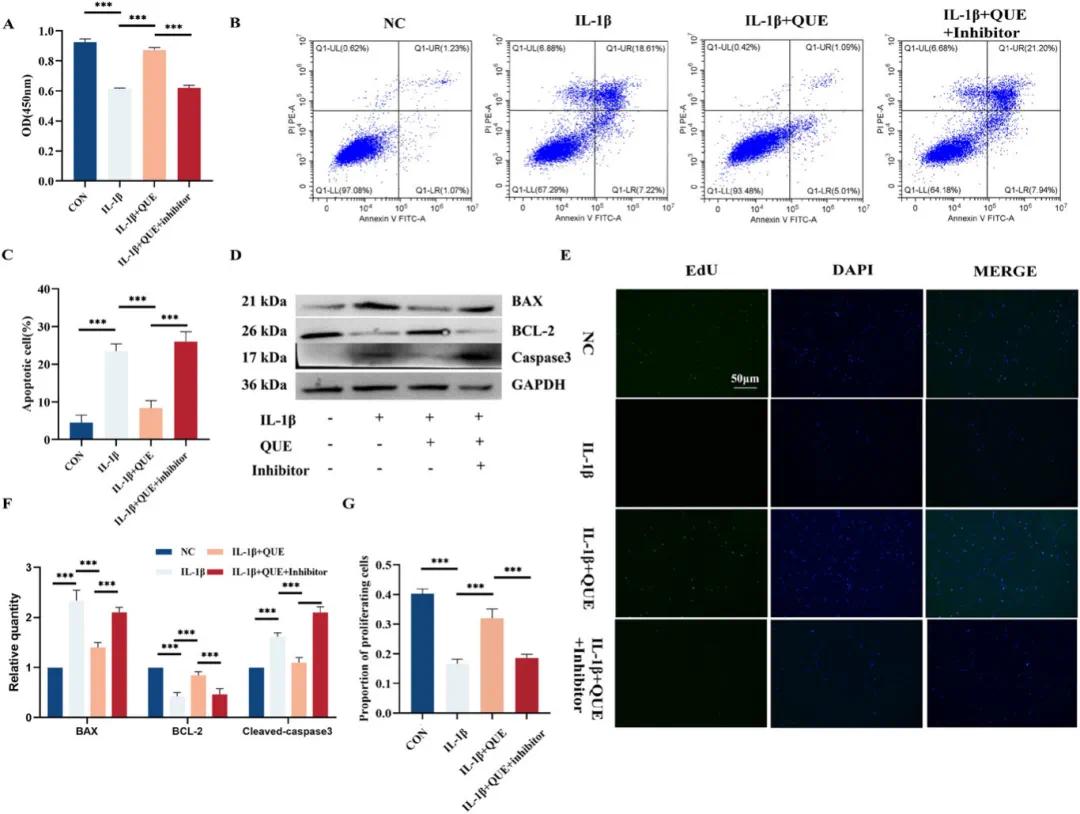
图4 槲皮素通过促进IGF-1R磷酸化促进细胞增殖并抑制凋亡。(A)在不同条件下软骨细胞的存活率(通过CCK-8测定,n=3);(B)流式细胞术数据展示不同条件下软骨细胞的凋亡率;(C)凋亡率的定量分析(n=3);(D)Western blot分析处理后软骨细胞中凋亡相关蛋白的表达(软骨细胞在无血清条件下培养2天,n=3);(E)EdU测定法检测用各种试剂处理24小时后增殖细胞的比例;(F,G)分别对(D)和(E)的结果进行定量分析(n=3)。实验中,槲皮素(QUE)浓度为16 μM,IL-1β浓度为10 ng/mL,抑制剂浓度为10 μM。统计分析采用单因素方差分析后Tukey HSD检验,*p<0.001
阿辛蓝染色显示,抑制剂显著降低了QUE在OA条件下增强软骨形成的能力(图5A)。Western blot结果进一步验证了这一点,表明QUE促进了与软骨形成相关的标记物ACAN、COL2α和SOX9的表达,同时抑制了MMP13的表达,而抑制剂处理则逆转了这些变化(图5B)。此外,先前被QUE抑制的氧化应激水平在加入抑制剂后再次升高,这证实了QUE是通过调节ROS水平、调节IGF1R磷酸化及抑制NOX2和NOX4表达来保护软骨细胞的(图5D, E)。
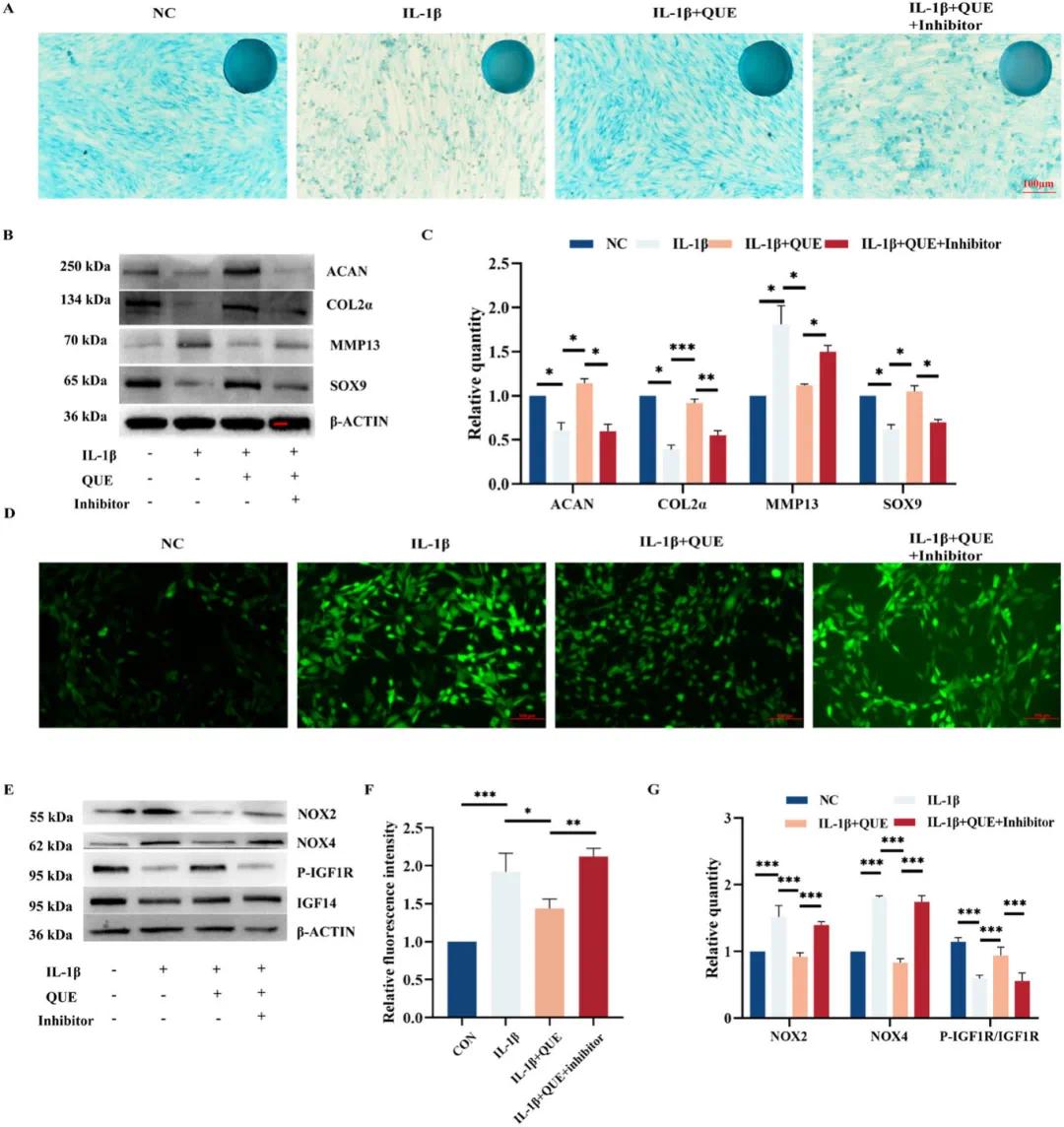
图5 槲皮素作用机制的实验验证。(A)不同实验条件下阿新蓝染色结果的肉眼和光学显微镜图像;(B)不同处理共培养的软骨细胞中软骨形成相关蛋白表达的Western blot结果;(C)(B)的统计结果(n=3);(D)通过DCFH-DA测定法在不同条件下评估软骨细胞中的细胞内ROS水平;(E)软骨细胞中ROS相关蛋白的Western blot结果;(F,G)(D)和(E)的定量结果(n=3)。实验中,槲皮素(QUE)浓度为16 μM,IL-1β浓度为10 ng/mL,抑制剂浓度为10 μM
(5)M-CH的磁致动特性
图6A展示了磁驱动系统的示意图,该系统由控制模块、群操作模块和视觉模块组成。图6B通过M-CH被矩形永久磁铁吸引至Eppendorf管壁一侧的现象,验证了其良好的磁场可控分布特性。在自制磁驱动系统中,图6C显示在4 Hz频率的旋转磁场作用下,分散的微机器人能够快速准确地聚集到系统几何中心并形成稳定群体。图6D记录了M-CH沿预设矩形路径的移动情况,表明其运动迅速且精确,具备稳定的输送能力。图6E和F模拟了M-CH在体外软骨中的定向移动,证明其能在受损软骨区域迅速精准地聚集,为OA疾病模型的应用提供了实验依据。
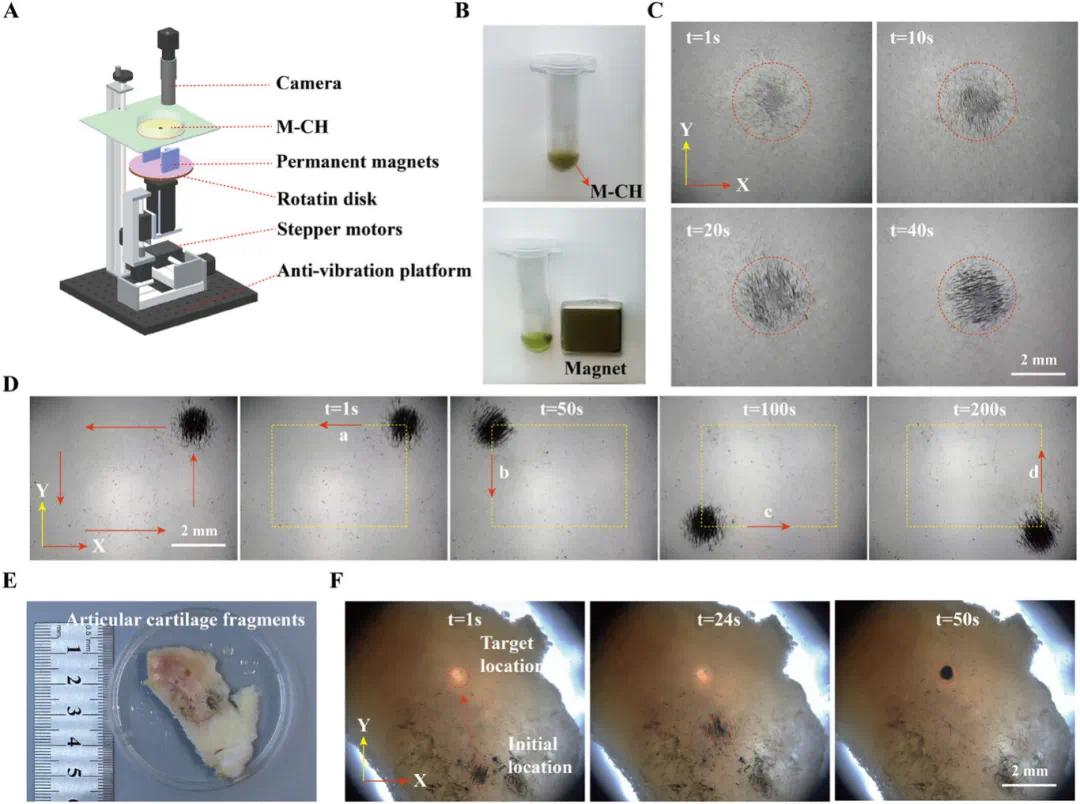
图6 M-CH的磁致动特性。(A)磁致动系统示意图;(B)用永磁体磁化CH并证明其磁特性;(C)自行构建的磁致动系统,用于通过旋转磁场进行迁移率测试(测试期间的聚集体图像);(D)移位照片;(E)软骨中M-CH@QUE的体外递送实验装置;(F)M-CH@QUE在软骨上的积累过程
(6)M-CH @QUE对AMOA的体内治疗作用
首先,通过手术切断前交叉韧带并移除内侧半月板建立了大鼠OA模型,术后两周开始给予关节腔注射QUE、CH@QUE或M-CH@QUE,每四周一次,持续12周(图7A)。为了促进M-CH@QUE在膝关节内侧聚集,使用柔性半圆形磁铁环绕于该组大鼠膝关节周围(图S7)。体外荧光成像显示,M-CH@QUE在OA大鼠体内能更有效地聚集,尤其是在永久磁铁引导下(图7B, C)。利用CatWalk系统评估右后肢功能恢复情况,定量分析接触面积和接触平均强度后发现,M-CH@QUE组在6周和12周治疗后表现出显著改善(图7D-H)。
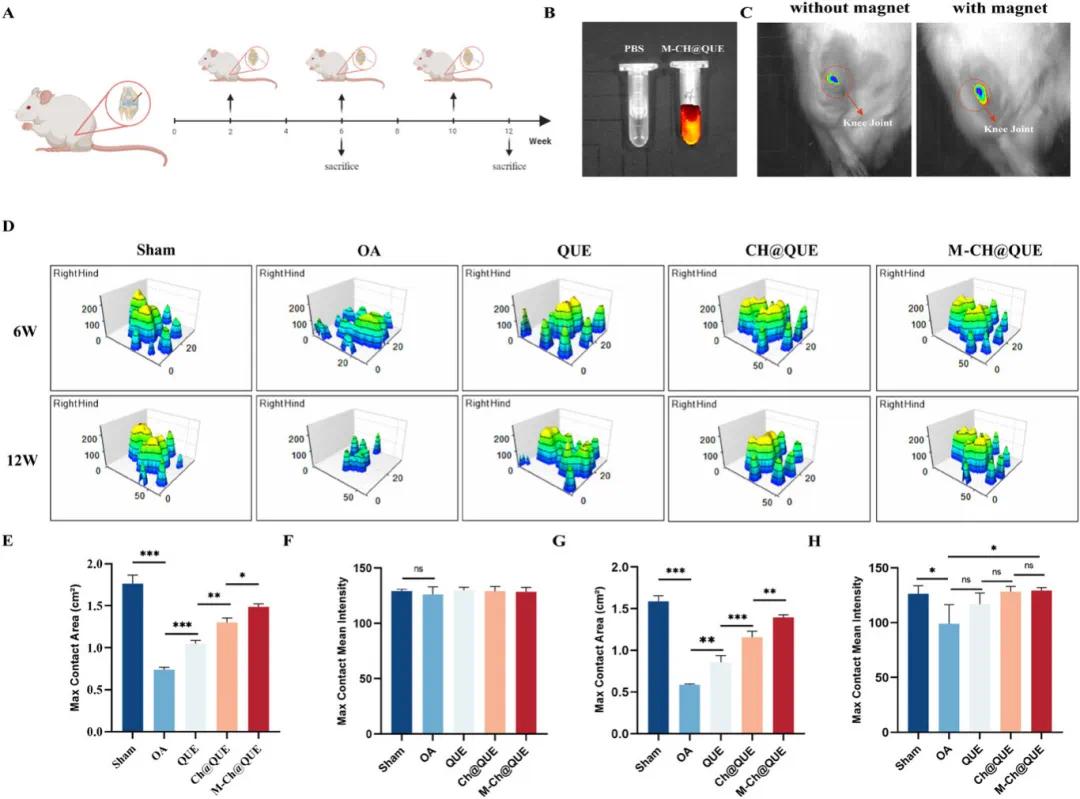
图7 M-CH@QUE在体内对骨关节炎(OA)的治疗作用。(A)动物实验示意图;(B)PBS和M-CH@QUE的体外荧光成像(激发波长:675 nm,发射波长:720 nm,荧光标记:Cy5.5);(C)在有或没有永磁体的OA大鼠中M-CH@QUE的荧光成像;(D)使用CatWalk系统评估右后腿的结果;(E,F)来自(D)的6周时接触面积和接触平均强度的定量分析(n=3);(G,H)来自(D)的12周时接触面积和接触平均强度的定量分析(n=3)。统计分析采用单因素方差分析后Tukey HSD检验,*p<0.05,**p<0.01,***p<0.001
术后12周,通过磁共振成像评估各组大鼠膝关节软骨损伤情况。结果显示,OA组显示出股骨和胫骨关节软骨严重磨损,并且某些区域扩展至软骨下骨;而QUE组虽有轻微改善,但在关节软骨和骨髓腔中的信号增强表明仍然存在软骨磨损和骨髓水肿问题(图 8A)。相比之下,CH@QUE组进一步改善了症状,而M-CH@QUE组表现出了最佳治疗效果,其磁共振图像未显示明显的异常信号。这些结果通过肉眼观察膝关节及H&E染色得到了进一步确认(图 8B, C)。
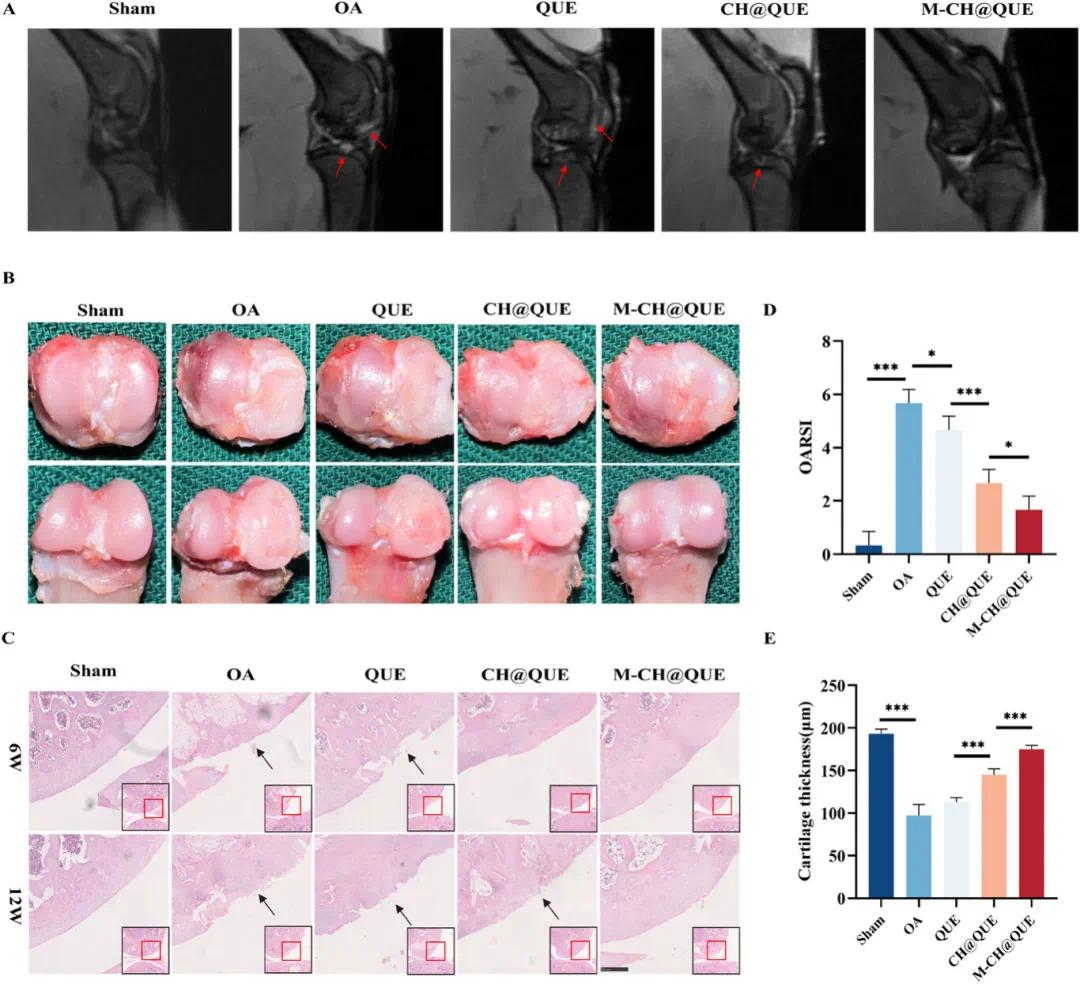
图8(A)膝关节软骨损伤的MRI评估,红色箭头指示受损软骨位置(n=6);(B)各组12周时膝关节软骨的代表性照片;(C)H&E染色评估软骨变性和治疗效果,黑色箭头指示软骨磨损区;(D)使用OARSI评分系统对软骨损伤进行量化(n=6,数据表示为平均值±标准差);(E)各组软骨厚度的定量分析(n=6)。统计分析采用单因素方差分析后Tukey HSD检验,*p<0.05,**p<0.01,***p<0.001
为了更详细地评估软骨磨损情况,研究人员进行了番红O/快绿和甲苯胺蓝染色。结果显示,OA组表现出明显的病理特征,如关节表面侵蚀和软骨退化。虽然QUE组有所改善,但软骨磨损仍较为严重,推测这可能是由于关节内注射频率低和药物浓度不足所致。相比之下,M-CH@QUE组表现出了最佳疗效,其次是CH@QUE组(图9A-F)。使用Mankin评分系统对病理变化进行评估,结果显示M-CH@QUE组在三个治疗组中得分最低,表明其病理变化最轻。此外,研究人员通过Col2免疫组化染色检测软骨中外基质相关蛋白的表达。结果显示,OA组的Col2水平显著降低,阳性染色较弱,反映了合成代谢活动受损。相反,治疗组,尤其是M-CH@QUE组,表现出更强烈的Col2染色和更多的阳性染色软骨细胞,提示其增强了软骨细胞保护和外基质的完整性(图9G)。通过对大鼠软骨中IGF1R、P-IGF1R和NOX4的蛋白表达水平进行评估,体内研究表明,M-CH@QUE能够促进IGF1R的磷酸化,并减少AMOA进展过程中的氧化应激(图9H, I)。总体而言,M-CH@QUE展示了显著的治疗效果。
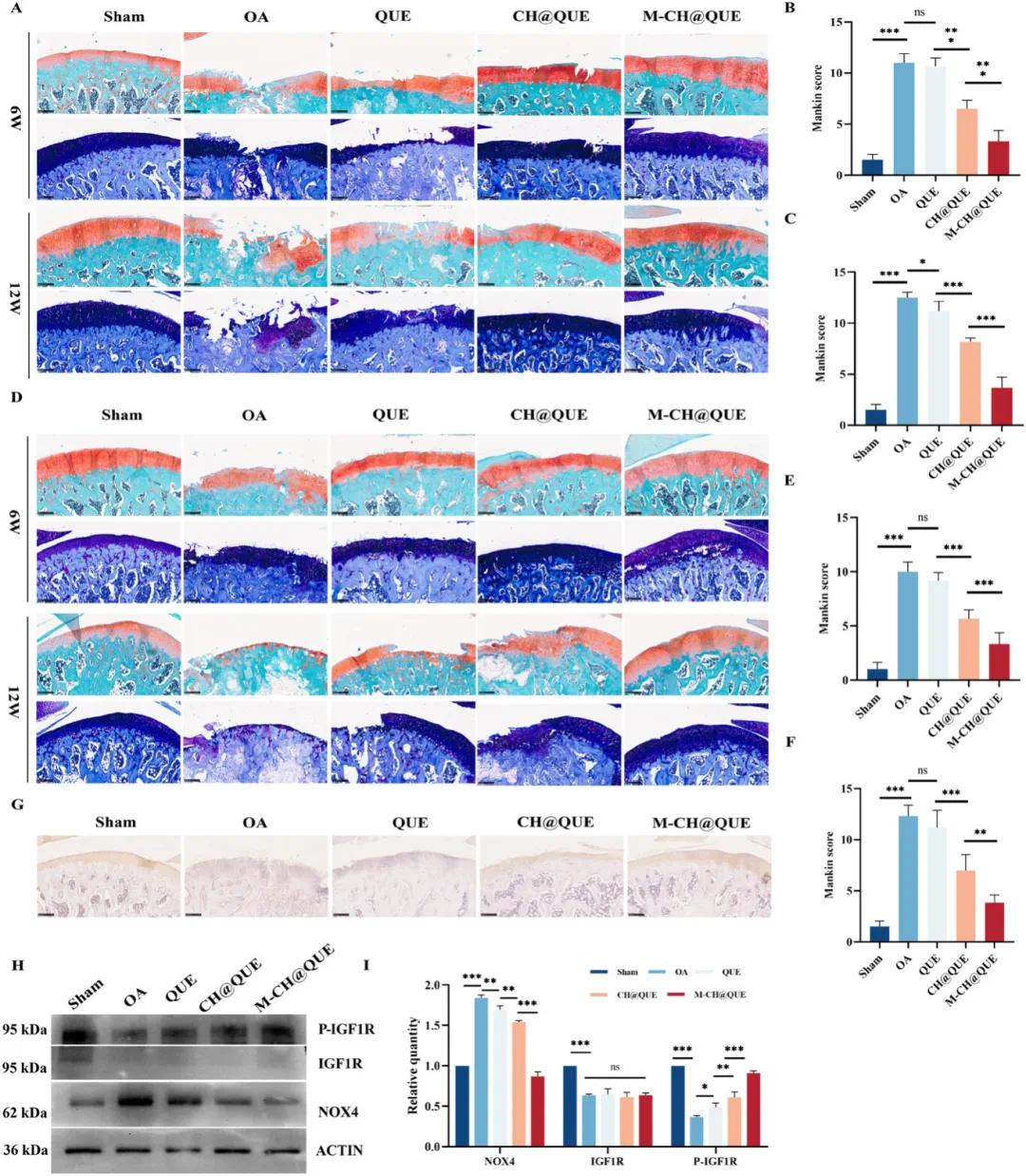
图9(A)大鼠胫骨软骨的番红O-固绿色染色和甲苯胺蓝染色;(B)使用Mankin评分对6周时的大鼠胫骨软骨损伤进行定量分析(数据表示为平均值±标准差,n=6);(C)使用Mankin评分对12周时的大鼠胫骨软骨损伤进行定量分析(数据表示为平均值±标准差,n=6);(D)大鼠股骨软骨的番红O-固绿色染色和甲苯胺蓝染色;(E)使用Mankin评分对6周时的大鼠股骨软骨损伤进行定量分析(数据以平均值±SD表示,n=6);(F)使用Mankin评分对12周时的大鼠股骨软骨损伤进行定量分析(数据表示为平均值±标准差,n=6);(G)用于COL2可视化的免疫组化(IHC)染色;(H)Western blotting分析膝关节软骨中NOX4、IGF-1R和P-IGF-1R的表达;(I)(H)的定量分析(n=3)。统计分析采用单因素方差分析后Tukey HSD检验,ns表示不显著,*p<0.05,**p<0.01,***p<0.001
本研究通过网络药理学预测了QUE保护软骨细胞的作用机制,并通过一系列实验验证了其在体外促进软骨细胞增殖、减少氧化应激及抑制凋亡的效果。进一步地,体内实验表明,M-CH@QUE不仅能够有效聚集于受损软骨区域,还显著改善了大鼠膝关节的结构和功能,减少了软骨磨损和骨髓水肿。 磁共振成像、组织学分析以及免疫组化染色均证实了M-CH@QUE对软骨损伤的最佳修复效果。讨论部分强调了该方法的关键创新点,包括利用磁性控制实现药物的精准递送,提高局部药物浓度的同时减少全身副作用;通过负载天然化合物QUE,增强了生物相容性和治疗效果;并且展示了这种新型微机器人的多功能性及其在靶向治疗中的潜力。这些发现为未来开发更有效的骨关节炎治疗方法提供了新的思路和技术手段。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

