
结直肠癌是常见的恶性肿瘤之一,直肠癌因解剖位置特殊,局部复发率较高,低位直肠癌复发率可达30%,严重影响患者生活质量。局部复发性直肠癌以根治性手术为首选,但手术切除率不足50%,并发症多。放疗作为主要局部治疗手段,疗效受限,主要原因是肿瘤对放疗耐受及正常组织损伤。放疗通过直接破坏DNA或间接生成活性氧(ROS)导致细胞死亡,但肿瘤缺氧会削弱ROS生成,降低放疗效果,同时激活DNA修复和促存活信号,促进肿瘤复发及免疫抑制。针对这一难题,研究提出了利用光合作用产氧缓解缺氧的新策略。
然而传统凋亡通路常被肿瘤逃逸,而由Gasdermin D (GSDMD)介导的焦亡因其强免疫原性,可有效绕过凋亡耐受。临床研究也表明,GSDMD高表达与直肠癌患者预后改善相关。因此,通过缓解缺氧并激活焦亡,有望提升缺氧肿瘤的放疗疗效。

针对上述问题,上海交大张琴团队研究开发了一种注射型温敏水凝胶平台,结合蓝藻与高原子序元素氧化镧(La₂O₃)纳米粒。水凝胶局部释放治疗成分,通过三重机制协同增强放疗:①蓝藻光合作用产氧,缓解肿瘤缺氧,提高放疗敏感性;②La₂O₃纳米粒通过光电效应增强局部辐射剂量,产生活性氧,加重DNA损伤;③联合激活GSDMD和GSDME介导的焦亡,突破传统凋亡耐受。该策略融合“产氧增敏–焦亡诱导”,显著提升放疗效果。该文章于2025年04月26日以《Microbial Photosynthetic Oxygenation and Radiotherapeutic Sensitization Enables Pyroptosis Induction for Combinatorial Cancer Therapy》为题发表于《AM》上。(DOI: org/10.1002/adma.202503138)
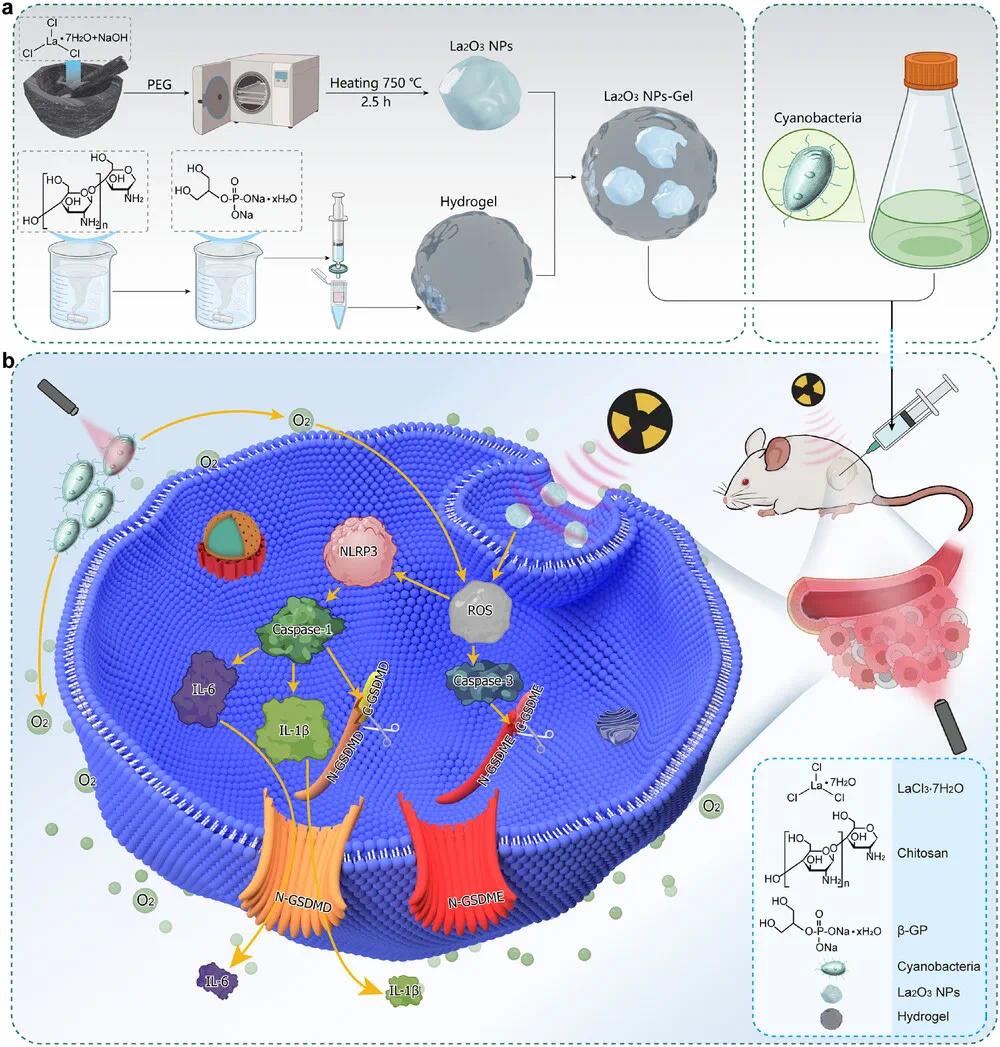
图1 放射增敏La₂O₃ NPs-蓝藻-温敏水凝胶的合成过程及治疗途径示意图。(a)放射增敏La₂O₃ NPs-蓝藻-温敏水凝胶的合成过程;(b)放射增敏La₂O₃ NPs-蓝藻-温敏水凝胶对癌细胞死亡的治疗途径
(1)细胞焦亡相关基因与临床肿瘤大小的相关性
焦亡与肿瘤发展的关系复杂,既有促进也有抑制作用,具体效果取决于肿瘤类型及微环境。研究表明,在直肠腺癌(READ)中,GSDMD作为抑癌因子,其高表达与良好预后相关。GSDME也能抑制结肠癌细胞生长,但在肿瘤组织中常因启动子甲基化(65%)而下调表达。相反,GSDMC在结肠癌中上调,促进细胞增殖与肿瘤形成。本研究将临床结直肠癌样本按5 cm大小分组,通过单细胞RNA测序和UMAP降维(图2a)发现,小肿瘤中GSDMB、GSDMD、IL-18、CASP11、CASP3及NFKB1等焦亡相关基因表达显著高于大肿瘤。此外,炎症趋化因子CXCL1在小肿瘤中也上升。这些结果提示焦亡在结直肠癌发生发展中可能具有抑制作用。
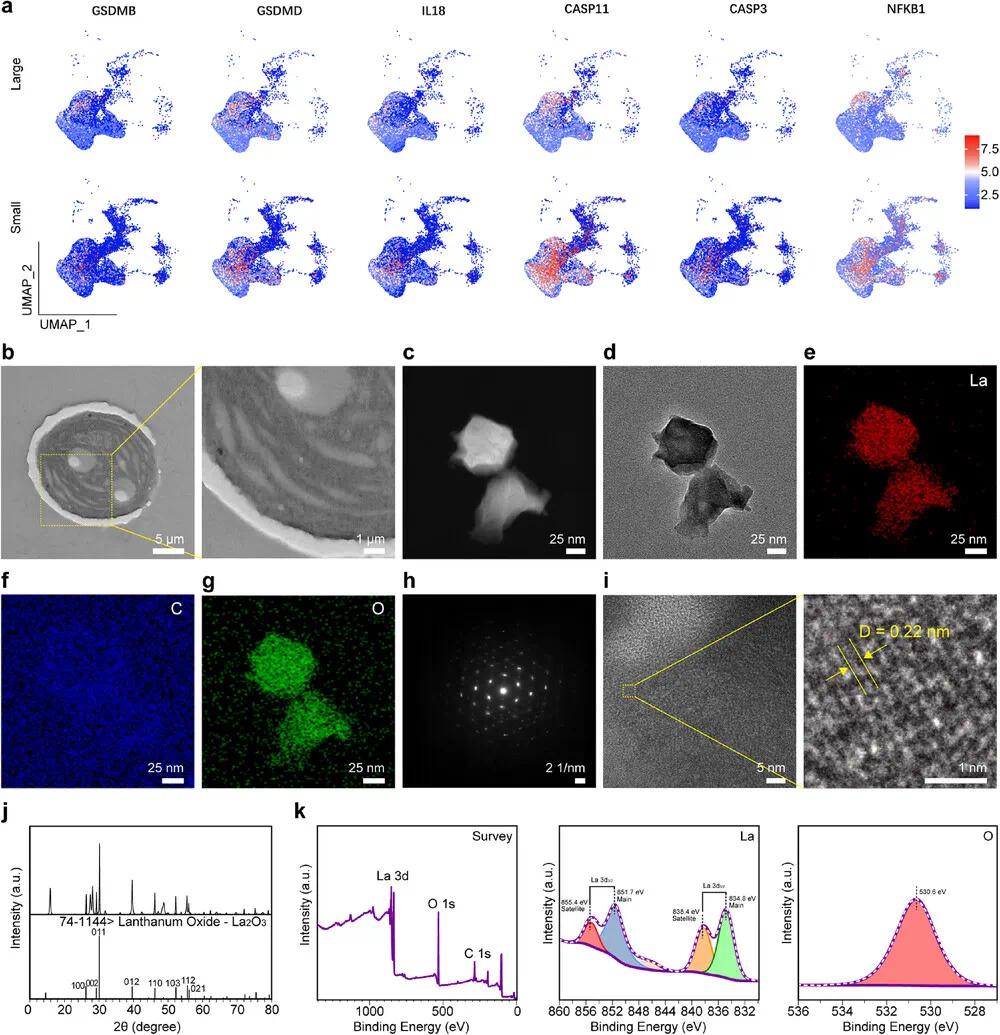
图2 临床肿瘤差异评估及La₂O₃ NPs与蓝藻的表征。(a)不同结直肠肿瘤样本中细胞焦亡相关基因表达谱的UMAP图;(b)蓝藻细胞负染色的Bio-TEM图像及放大图像(比例尺:原始图像5 µm,放大图像1 µm);(c)La₂O₃ NPs的暗场TEM图像;(d)La₂O₃ NPs的明场TEM图像(比例尺25 nm);(e)La₂O₃ NPs的La元素映射图像;(f)C元素映射图像;(g)O元素映射图像(比例尺25 nm);(h)La₂O₃ NPs的SAED图样(比例尺2 1/nm);(i)La₂O₃ NPs的HRTEM图像及放大图像(比例尺:原始图像5 nm,放大图像1 nm);(j)La₂O₃ NPs的X射线衍射图;(k)La₂O₃ NPs的宽扫描、La 3d和O 1s的XPS光谱
(2)蓝藻和La₂O₃ NPs-Gel 的制备与表征
通过生物透射电镜(bio-TEM)结合负染观察(图2b),发现蓝藻呈杆状,表面有由胞外粘性物质(如多糖和蛋白质)形成的膜结构,内部可见类囊体堆叠。La₂O₃纳米粒子(NPs)通过固相反应法合成,具有形貌均一的特点(图2c,d),动态光散射分析显示粒径约为145.17 ± 58.49 nm。元素分析确认其包含La、C、O(图2e–g),SAED图呈现清晰的六方晶系(图2h),高分辨率电镜(HRTEM)显示0.22 nm的晶面间距,对应 La 的(012)晶面(图2i)。X射线衍射进一步确认了其晶体结构(图2j),XPS分析揭示La和O的化学状态(图2k)。为便于加载至可注射热敏水凝胶中,合成过程中用聚乙二醇修饰La₂O₃ NPs。冻干后的水凝胶呈多孔结构(图3a),能量色散光谱显示其含有C、O、Cl、Na元素(图3b–f)。流变学测试表明,空白水凝胶与La₂O₃ NPs-Gel的溶胶-凝胶转变温度分别为31.72°C和32.23°C(图3g,h),在室温(25°C)下为液态(图3i,j),可实现体内快速成胶。FTIR证实了水凝胶中壳聚糖的特征峰(1636 cm⁻¹)(图3k)。体外释放实验表明,在pH 5.5下,La₂O₃ NPs释放更快(图3l),说明该体系可在肿瘤微酸环境中实现控释,减少系统毒性。
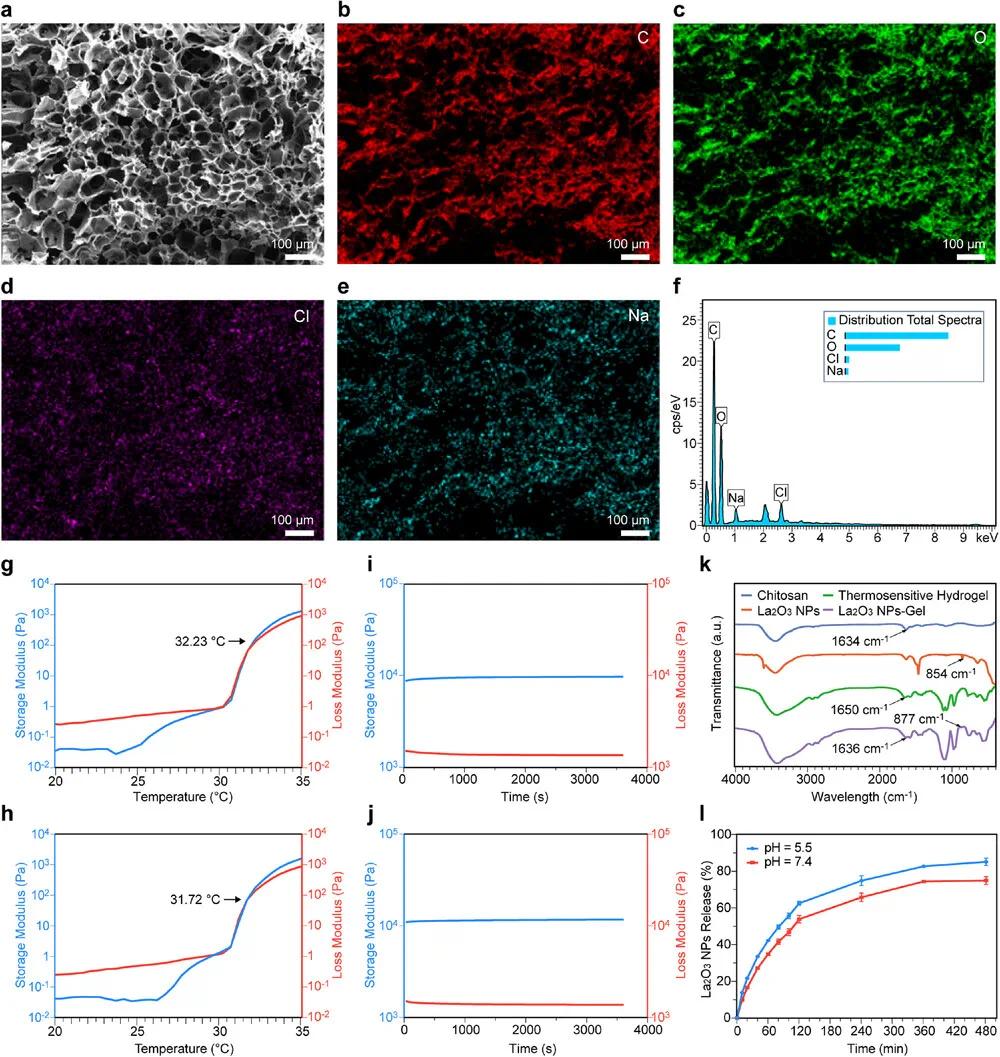
图3 La₂O₃ NPs-Gel的表征。(a)温敏水凝胶的SEM图像(比例尺100 µm)及元素映射图像:(b)C、(c)O、(d)Cl、(e)Na(比例尺100 µm);(f)温敏水凝胶中元素比重分布;(g)温敏水凝胶和(h)La₂O₃ NPs-Gel的储能模量和损耗模量的温度依赖性;(i)温敏水凝胶和(j)La₂O₃ NPs-Gel的储能模量和损耗模量的时间依赖性;(k)壳聚糖、La₂O₃ NPs、温敏水凝胶和La₂O₃ NPs-Gel的FTIR光谱;(l)不同pH值下La₂O₃ NPs-Gel中La₂O₃ NPs的释放比例随时间变化(数据以平均值±标准差表示,n = 3)
(3)蓝藻的光合氧合能力
为改善缺氧的肿瘤微环境并增强放疗敏感性,利用便携式溶解氧(DO)电极测定纯蓝藻悬液在660 nm激光照射下的溶解氧变化(图4a)。在20 mW cm⁻²激光强度下,20分钟内DO浓度最高增加了37 µmol L⁻¹(图4b)。随着激光功率从10到30 mW cm⁻²增加,蓝藻的光合产氧能力也增强,在30 mW cm⁻²时,20分钟内DO上升49 µmol L⁻¹,而在5×10⁷ cells mL⁻¹浓度下,20 mW cm⁻²激光照射20分钟,DO上升56 µmol L⁻¹(图4c)。进一步通过细胞内缺氧探针[Ru(dpp)₃]Cl₂验证蓝藻缓解CT26细胞缺氧的效果。将蓝藻悬液和CT26细胞分别在暗处和1% O₂低氧舱中处理以排除残余氧气后,共孵育并进行激光照射(图4d)。结果显示,仅在蓝藻+激光组,[Ru(dpp)₃]Cl₂红色荧光显著降低,与常氧(21% O₂)条件下相近(图4e)。而单独激光或单独蓝藻处理组仍保持强烈红色荧光,说明缺氧未缓解。结果表明,蓝藻可通过激光激活的光合产氧有效改善细胞缺氧。
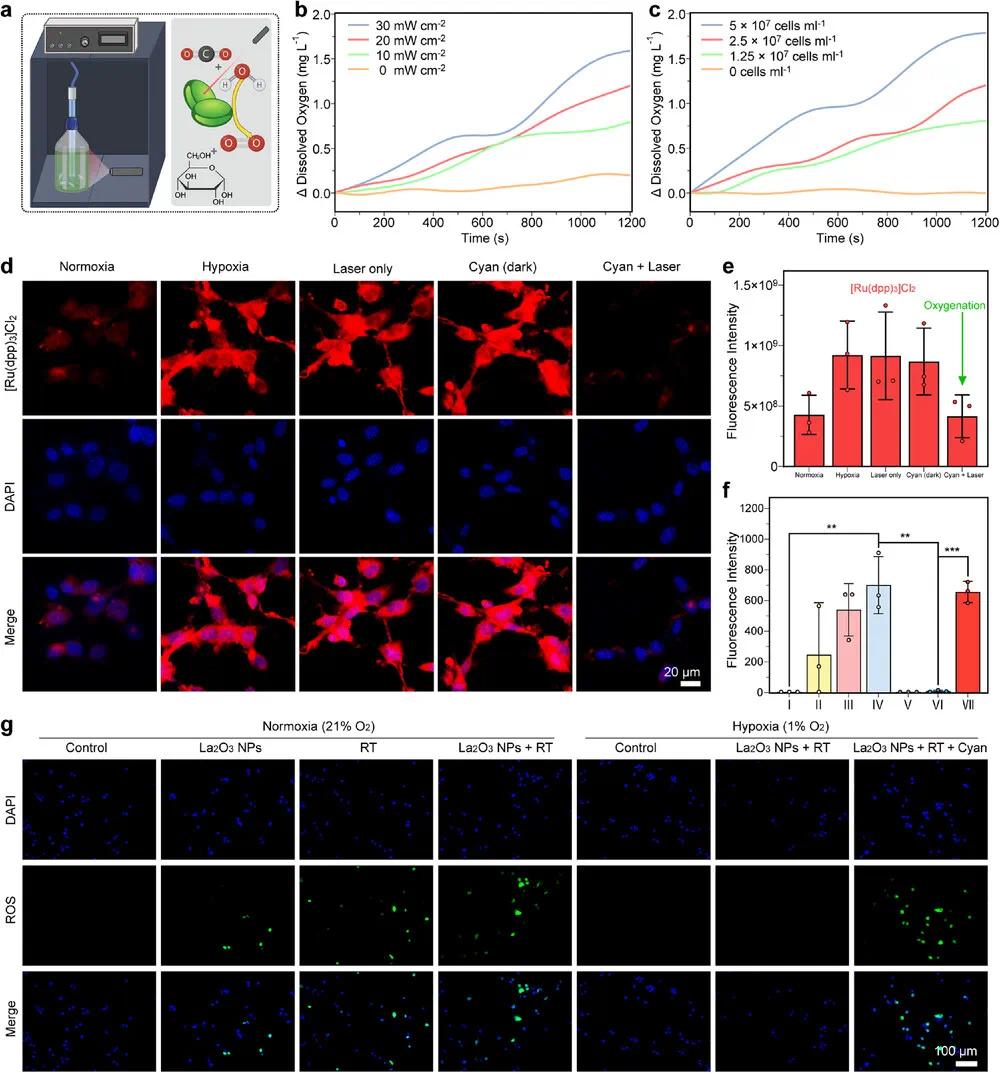
图4 体外光合放氧。(a)溶解氧水平检测示意图;(b)不同激光功率强度下,660 nm激光辐照溶液溶解氧水平变化;(c)不同蓝藻浓度下,660 nm激光辐照溶液溶解氧水平变化;(d)不同处理后,[Ru(dpp)₃]Cl₂染色的CT26细胞的CLSM图像(比例尺20 µm);(e)不同处理后,[Ru(dpp)₃]Cl₂染色的CT26细胞的半定量分析;(f)不同处理后,DCFH-DA染色的CT26细胞的半定量分析(I:对照组,II:La₂O₃ NPs,III:RT组,IV:La₂O₃ NPs + RT组,V:缺氧对照组,VI:缺氧La₂O₃ NPs + RT组,VII:缺氧La₂O₃ NPs + RT + 青色);(g)不同处理后CT26细胞的ROS水平CLSM图像(比例尺100 µm)。数据以平均值±SD(n = 3)表示,采用单因素方差分析(ANOVA)分析(**p < 0.01,***p < 0.001)
(4)安全性评价和细胞毒作用
基于蓝藻独特可靠的产氧能力,进一步在CT26小鼠肿瘤细胞中评估蓝藻联合La₂O₃纳米颗粒(La₂O₃ NPs)与放疗的治疗效果。首先,通过CCK-8检测蓝藻(最高至3×10⁷ mL⁻¹)和La₂O₃ NPs(最高至400 µg mL⁻¹)的细胞相容性。结果显示,低浓度蓝藻毒性较低,而La₂O₃ NPs呈剂量依赖性毒性。共聚焦显微镜观察到Cy5.5标记的La₂O₃ NPs被CT26细胞逐步摄取,8 h达峰值。随后,体外通过CCK-8检测治疗效果。CT26细胞经蓝藻处理(1×10⁷ mL⁻¹)、激光照射(660 nm, 20 mW cm⁻², 15 min)并暴露于La₂O₃ NPs(50 µg mL⁻¹)。常氧下,放疗导致细胞活性依时间下降,24 h死亡率21.3%,72 h为47.0%;联合La₂O₃ NPs后死亡率显著上升。相比之下,缺氧细胞放疗耐受性强,仅31.5%死亡。蓝藻光合产氧联合放疗在缺氧下显著提高死亡率至45.2%,加用La₂O₃ NPs后72 h死亡率达79.7%,显示出出色的放疗增敏和杀瘤潜力。
(5)体外ROS生成
活性氧(ROS)可导致细胞内DNA氧化损伤,引发DNA链断裂,进而诱导细胞凋亡、焦亡和坏死等不同形式的细胞死亡。为探究蓝藻–La₂O₃ NPs体系的放疗增敏机制,使用绿色荧光探针DCFH-DA检测ROS生成(图4f、3g)。在常氧条件下,La₂O₃ NPs组的荧光强度低于放疗(RT)组,但联合RT后,ROS水平较单独La₂O₃ NPs组提升了3.5倍。其机制可能是:La₂O₃ NPs因高原子序数增强局部能量沉积,辐射则破坏线粒体功能,共同促进ROS大量生成。然而,在缺氧条件下,RT+La₂O₃ NPs组几乎失去ROS生成能力,说明氧气对ROS产生至关重要。引入蓝藻光合产氧后,即使在缺氧环境下,也能恢复ROS水平至常氧下的程度(图4f)。结果表明,蓝藻产氧有效缓解肿瘤缺氧,重建ROS介导的放疗增敏,为克服缺氧导致的治疗抗性提供了新策略。
(6)体外放射治疗增敏
利用克隆形成实验进一步评估辐射引起的细胞损伤,在常氧与低氧(1% O₂)条件下培养CT26细胞(图5a)。低氧组的存活率(SF)明显高于常氧组,表明缺氧降低了细胞对放疗(RT)的敏感性(图5b)。即使在低浓度(12.5 µg mL⁻¹)下,La₂O₃ NPs也能显著减少克隆形成,抑制细胞增殖,展现出强放疗增敏效果。La₂O₃ NPs与蓝藻联用时,2 Gy剂量下的SF降至对照组一半,随放疗剂量增加,杀伤效果进一步增强,优于单独La₂O₃ NPs组。进一步研究发现,ROS可能通过促进DNA损伤发挥增敏作用。通过γ-H2AX标记和彗星实验检测DNA双链断裂。常氧下,La₂O₃ NPs+RT组的DNA损伤显著增加(图5d);低氧虽抑制此效应,但蓝藻产氧可显著恢复DNA断裂(图5e)。彗星实验亦显示了不同氧环境下DNA损伤的差异(图5f、4g)。结果验证了La₂O₃ NPs的增敏效果及蓝藻缓解缺氧的能力。
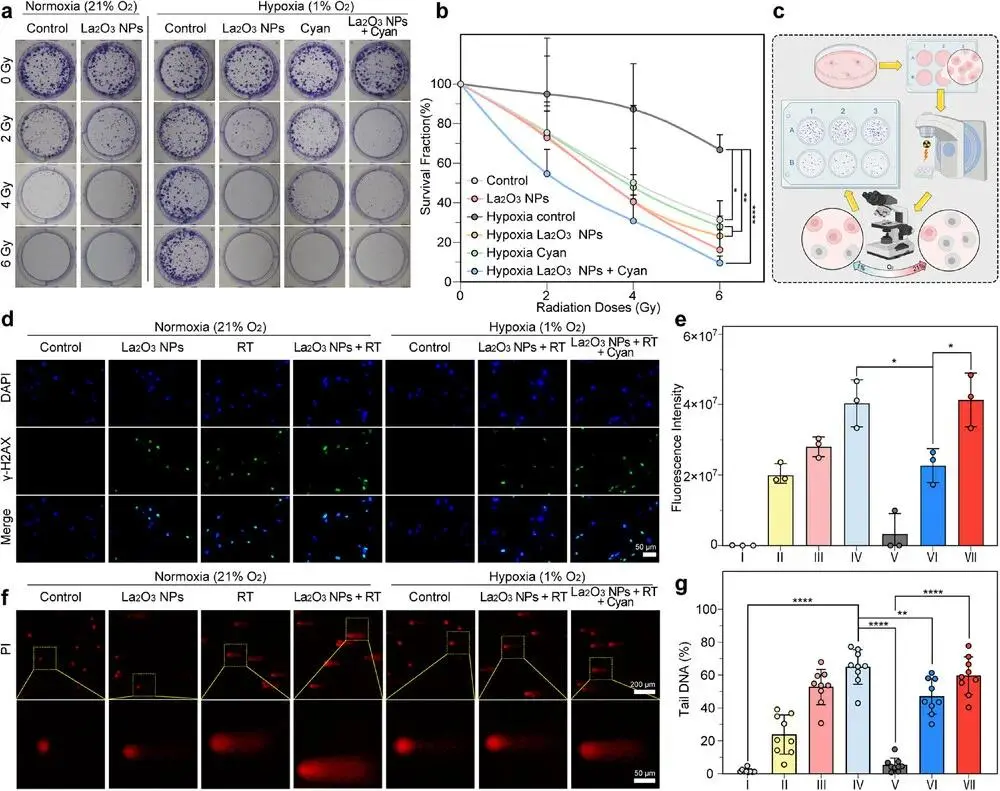
图5 体外放射治疗疗效评估。(a)不同处理后CT26细胞集落形成实验;(b)不同处理(2、4和6 Gy)后存活分数;(c)集落形成检测示意图;(d)不同处理后γ-H2AX染色的CT26细胞CLSM图像(比例尺50 µm);(e)不同处理后γ-H2AX荧光强度的半定量分析(I:对照,II:La₂O₃ NPs,III:RT,IV:La₂O₃ NPs + RT,V:缺氧对照,VI:缺氧La₂O₃ NPs + RT,VII:缺氧La₂O₃ NPs + RT + Cyan);(f)不同处理后彗星实验的CLSM图像(原始图像比例尺200 µm,放大图像比例尺50 µm);(g)不同处理后彗星实验尾部DNA百分比的半定量分析(I:对照组,II:La₂O₃ NPs,III:RT,IV:La₂O₃ NPs + RT,V:缺氧对照组,VI:缺氧La₂O₃ NPs + RT,VII:缺氧La₂O₃ NPs + RT + 青色)。数据以平均值±SD表示(每组n = 3;彗星实验n = 3生物学重复,每个重复3技术重复),采用单因素方差分析(ANOVA)分析(*p < 0.05,**p < 0.01,****p < 0.0001)
(7)RNA转录组分析
为探究La₂O₃ NPs-蓝藻平台在缺氧环境下的抗癌机制,进行了转录组分析。结果显示,La₂O₃ NPs + RT + Cyan组有2298个差异表达基因(DEGs),包括1398个下调和900个上调(图6a-c)。GO分析显示,该组合上调了氧化应激相关通路,抑制了缺氧响应通路,表明蓝藻产氧改善了细胞氧合状态(图6d)。此外,炎症相关通路如NF-κB信号通路也被显著激活,提示ROS通过激活NLRP3炎症小体,促进caspase-1活化,诱导细胞焦亡(图6e-g)。GSEA分析进一步验证了炎症反应增强(图6e,f),并观察到与细胞焦亡相关的基因(如caspase-1、caspase-3、GSDMD、GSDME)明显上调(图6h)。总体结果表明,La₂O₃ NPs + RT + Cyan平台通过ROS激活NOD样受体和NF-κB通路,诱导GSDMD/GSDME裂解,形成膜孔并释放IL-1β,最终引发肿瘤细胞焦亡。
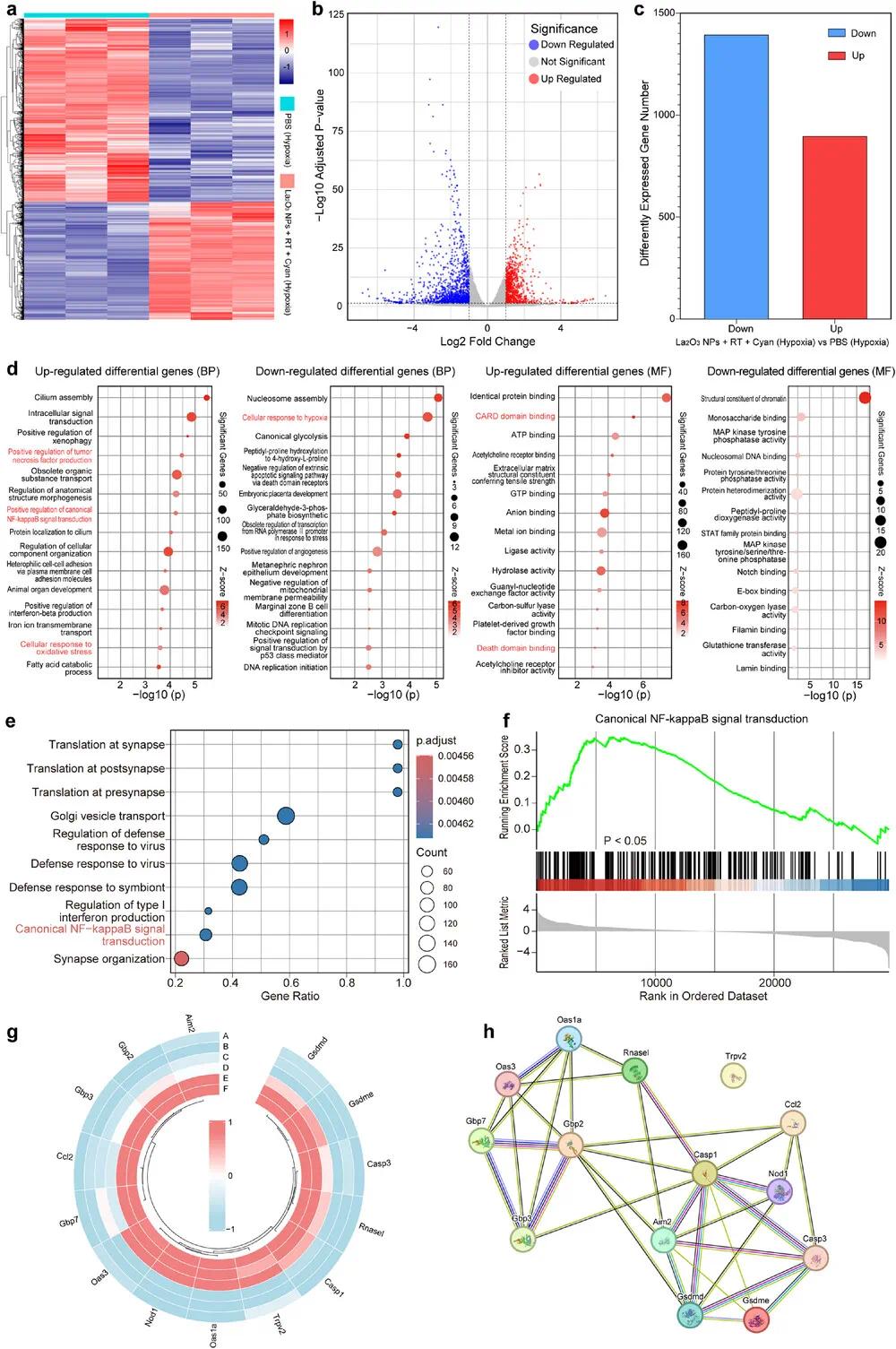
图6 不同处理后CT26细胞RNA-seq转录分析。(a)热图、(b)火山图、(c)直方图揭示缺氧条件下RT+La₂O₃NPs+Cyan和PBS处理的CT26细胞中上调或下调的基因;(d)缺氧条件下RT+La₂O₃NPs+Cyan和PBS处理的CT26细胞中差异表达基因的GO分析(BP和MF类别);(e)差异表达基因的基因集富集分析;(f)典型NF-κB信号转导的GSEA富集图;(g)基于功能基因交叉的环形数值热图(A–C:缺氧对照组;D–F:缺氧RT+La₂O₃NPs+青色组);(h)功能基因的蛋白质-蛋白质相互作用网络
(8)体外细胞焦亡
为了进一步明确La₂O₃ NPs + RT + Cyan平台在缺氧环境下诱导焦亡的机制,采用Annexin-V/PI染色结合共聚焦显微镜明场成像(图7a)区分坏死、凋亡与焦亡。La₂O₃ NPs组细胞出现典型焦亡特征,如细胞肿胀和膜起泡。在常氧下,La₂O₃ NPs + RT组焦亡显著,而缺氧抑制了该过程,加入蓝藻氧合后焦亡恢复接近常氧水平。通过Western blot检测不同条件下GSDMD与GSDME及其剪切片段(图7b),发现La₂O₃ NPs浓度升高促进GSDMD剪切,且放疗可增强该效应(图7c)。高浓度La₂O₃ NPs还促进了GSDME剪切(图7d),表明平台可激活经典与非经典焦亡路径。进一步分析表明,缺氧降低N-GSDMD与N-GSDME水平(图7f,g),而蓝藻系统可逆转该抑制。NLRP3表达趋势也支持La₂O₃ NPs经ROS-NLRP3-GSDMD途径诱导焦亡。流式细胞术数据显示,La₂O₃ NPs + RT + Cyan组焦亡率达9.6%(图7i,j),并伴随凋亡增加,表明蓝藻氧合有助于增强细胞死亡与治疗效果。
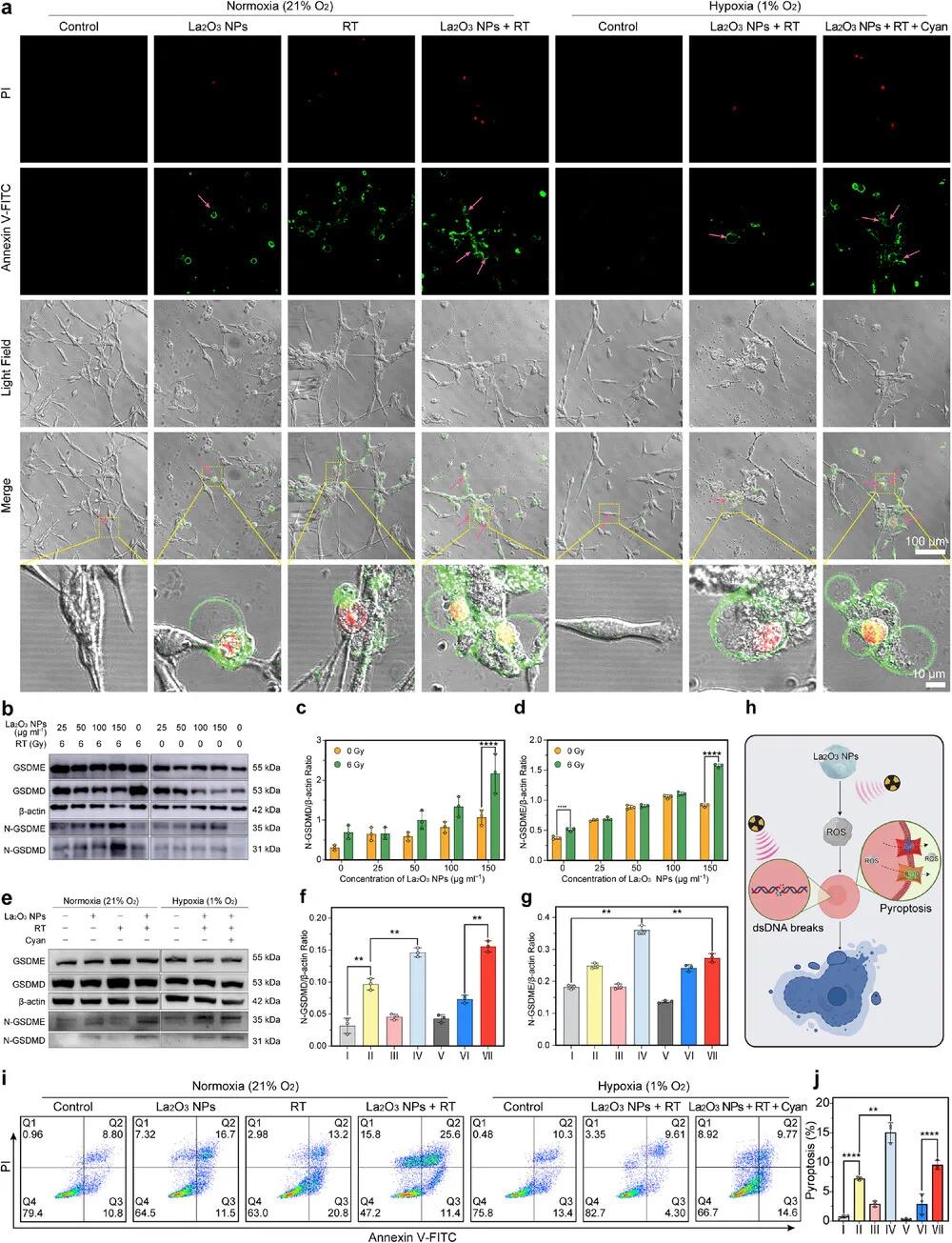
图7 体外细胞焦亡。(a)CT26细胞放疗(6 Gy)72小时后Annexin-V&PI染色的CLSM图像(粉色箭头:大气泡;比例尺:原始图像100 µm,放大图像10 µm);(b)放疗后72小时,不同La₂O₃浓度下GSDMD和GSDME全长及N端片段表达;(c)N-GSDMD和(d)N-GSDME的半定量分析;(e)不同处理后72小时,GSDMD和GSDME表达;(f)N-GSDMD和(g)N-GSDME的半定量分析(I:对照,II:La₂O₃ NPs,III:RT,IV:La₂O₃ NPs + RT,V:缺氧对照,VI:缺氧La₂O₃ NPs + RT,VII:缺氧La₂O₃ NPs + RT + 青色);(h)RT-La₂O₃ NPs诱导的细胞焦亡形态示意图;(i)不同处理后Annexin V-FITC&PI染色的细胞死亡流式分析;(j)细胞焦亡百分比。数据以平均值±SD(n = 3)表示,采用单因素方差分析(ANOVA)分析(**p < 0.01,****p < 0.0001)
(9)体内肿瘤放射治疗
在动物实验前,评估了La₂O₃ NPs的溶血性,结果显示Cyan + La₂O₃ NPs系统具有良好生物相容性。急性与慢性毒性检测表明,主要脏器及血液指标无异常。药代动力学研究发现,温敏水凝胶能有效将药物局限于肿瘤区,注射8天后荧光强度仍保留41.1%(图8a,b)。这种缓释行为归因于水凝胶的膨胀扩散机制和壳聚糖的可降解性,减少了系统暴露,延长了局部药物作用时间。
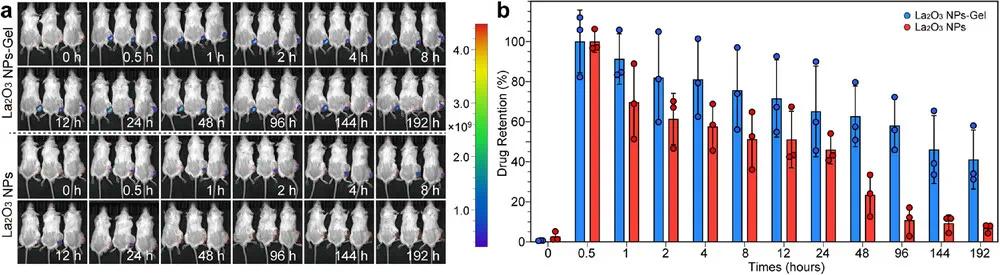
图8 药物代谢分析。(a)BALB/c小鼠CT26肿瘤异种移植瘤瘤内注射La₂O₃纳米颗粒和La₂O₃纳米颗粒-凝胶后的体内荧光成像;(b)瘤内注射药物滞留率的半定量分析。数据以平均值±标准差(n=3)表示
在LLC和CT26移植瘤模型中评估了治疗效果。各组小鼠体重稳定(图9b, 10b)。La₂O₃ NPs-Gel单独即可抑制肿瘤生长,联合蓝藻后进一步增强放疗增敏作用,14天后肿瘤体积明显缩小(图9c–e, 10c–e)。La₂O₃ NPs-Gel + RT + Cyan组的抑瘤率分别达94.68%和95.48%,优于其他组。肉眼观察也验证了蓝藻光合作用缓解缺氧、提升增敏效果(图9f, 10f)。
组织学分析显示主要器官无明显损伤(图9g, 10g)。肿瘤切片Ki-67和TUNEL染色表明肿瘤增殖减少、凋亡增加(图9h,k, 10h,k)。RT + Cyan + La₂O₃ NPs-Gel组中N-GSDMD和N-GSDME表达上升,且IL-6、IL-1β释放增加(图9i–m, 10i–m),提示有效诱导焦亡。NLRP3上调进一步验证了焦亡机制(图9n, 10n)。综合证实该系统通过双重增敏增强抗肿瘤效果。
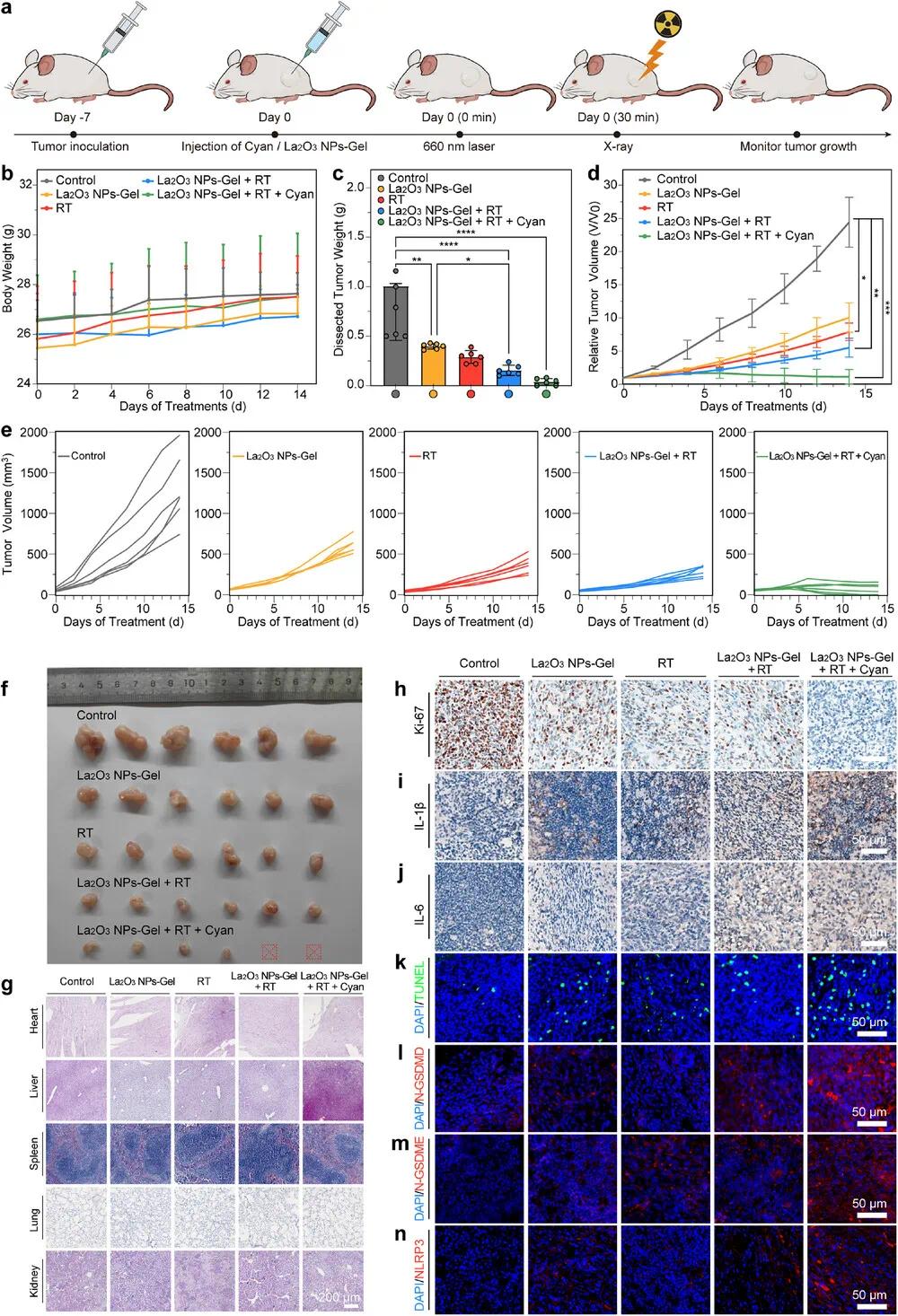
图9 RT-蓝藻-La₂O₃ NPs-Gel体系体内抗CT26肿瘤疗效。(a)生物放射治疗与抗肿瘤治疗时间示意图;(b)CT26肿瘤小鼠体重变化曲线(n=6);(c)各组肿瘤平均重量(n=6);(d)CT26肿瘤生长曲线(每2天记录一次,n=6);(e)不同治疗后肿瘤生长曲线(PBS、La₂O₃ NPs-Gel、RT、RT + La₂O₃ NPs-Gel、RT + La₂O₃ NPs-Gel + Cyan,n=6);(f)各组解剖肿瘤照片(n=6);(g)治疗后第14天小鼠主要器官H&E染色(比例尺200 µm);(h)Ki-67、(i)IL-1β、(j)IL-6免疫组织化学染色(比例尺50 µm,n=3);(k)TUNEL、(l)N-GSDMD、(m)N-GSDME、(n)NLRP3免疫荧光染色(比例尺50 µm,n=3)。数据以平均值±SD表示,采用单向方差分析(ANOVA)分析(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
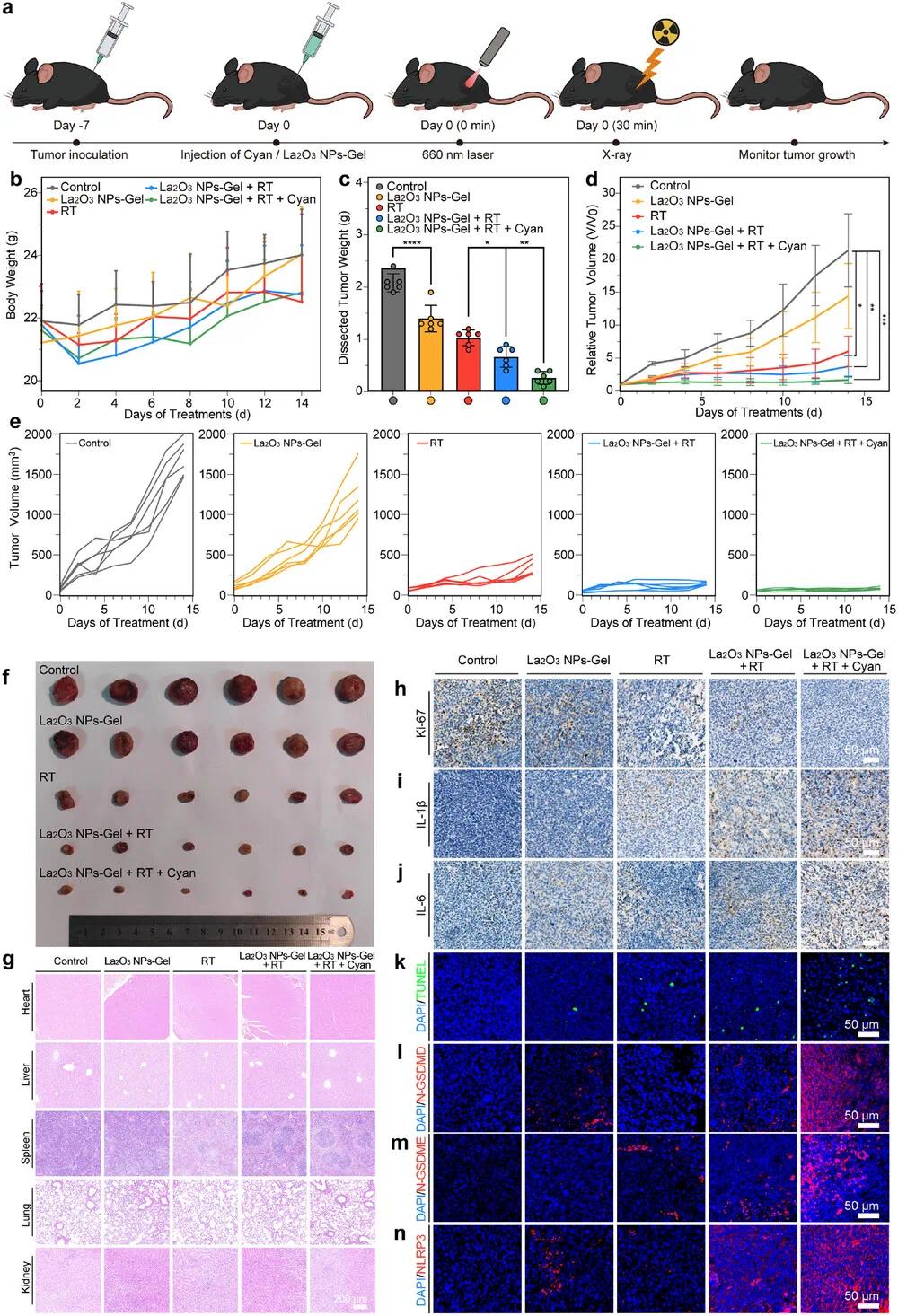
图10 RT-蓝藻-La₂O₃ NPs-Gel体系体内抗LLC肿瘤疗效。(a)生物放射治疗与抗肿瘤治疗时间示意图;(b)LLC肿瘤小鼠体重变化曲线(n=6);(c)各组肿瘤平均重量(n=6);(d)LLC肿瘤生长曲线(每2天记录一次,n=6);(e)不同治疗后肿瘤生长曲线(PBS、La₂O₃ NPs-Gel、RT、RT + La₂O₃ NPs-Gel、RT + La₂O₃ NPs-Gel + Cyan,n=6);(f)各组解剖肿瘤照片(n=6);(g)治疗后第14天小鼠主要器官H&E染色(比例尺200 µm,n=3);(h)Ki-67、(i)IL-1β、(j)IL-6免疫组织化学染色(比例尺50 µm,n=3);(k)TUNEL、(l)N-GSDMD、(m)N-GSDME、(n)NLRP3免疫荧光染色(比例尺50 µm,n=3)。数据以平均值±SD表示,采用单向方差分析(ANOVA)分析(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
本研究设计了结合蓝藻光合作用系统与La₂O₃ NPs的热敏水凝胶平台,通过激光激活蓝藻光合作用缓解肿瘤缺氧,La₂O₃ NPs则增强辐射诱导的ROS生成,并通过ROS–NLRP3–GSDMD通路触发焦亡反应。放疗后,该过程进一步增强,促进IL-1β与IL-6等免疫因子分泌。体内LLC与CT26肿瘤模型实验证实,该双增强放疗平台展现出优异的抗肿瘤效果。该系统有望为治疗缺氧实体瘤提供新思路。尽管结果令人鼓舞,临床转化仍面临挑战,包括蓝藻成分的长期稳定性、纳米颗粒-水凝胶体系的标准化制备,以及患者个体差异问题。该平台除针对结直肠癌外,在缺氧肺癌模型中亦显示良好疗效,提示其有望应用于其他缺氧实体瘤。未来将进一步探索与化疗、免疫检查点抑制剂联用及长期安全性评估。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

