
慢性难治性伤口是全球医疗体系面临的重大挑战,尤其常见于糖尿病、免疫功能低下和感染患者。随着人口老龄化及糖尿病患病率的上升,其发病率不断增长。不同于急性伤口依序经历炎症、增殖和重塑阶段,慢性伤口往往长期停滞于炎症期,伴随细菌生物膜形成、耐药感染、ROS积累及血供不足,显著阻碍组织修复。
为改善愈合效果,研究者开发了多种功能性敷料,具备抗菌、抗氧化、促增殖等作用,并在一定程度上促进了由炎症期向增殖期的转变。然而,这些敷料大多聚焦于单一作用环节,缺乏对愈合全过程的统筹调控,难以实现真正的功能性和无瘢痕修复。
瘢痕形成作为慢性伤口愈合后的常见结局,不仅影响皮肤结构与功能,还严重降低生活质量。目前常见的抗瘢痕策略多以TGF-β为靶点,但其在不同阶段具有双重作用,调控不当反而可能干扰正常愈合。因此,寻找更具特异性的新靶点显得更为关键。

针对上述问题,温州医科大学肖健/李正林联合黑龙江大学李卓合作开发了一种具有分级释放特性的愈合相自适应水凝胶(F/R gel),用于慢性感染伤口的程序化调节。该水凝胶由ε-聚赖氨酸(εPL)与醛基透明质酸(HA-CHO)通过席夫碱反应制备,包裹εPL修饰的缺氧纳米二氧化铈(εPL-CeO_v)与共载碱性成纤维细胞生长因子(bFGF)和c-Jun siRNA的PLGA微胶囊(F/R MCs)。在弱酸性伤口环境中,水凝胶快速降解,优先释放εPL和εPL-CeO_v,实现抗菌和ROS清除,缓解局部炎症。后续阶段,F/R MCs逐步释放bFGF促进血管生成与细胞增殖,同时c-Jun siRNA抑制c-Jun过表达,调控成纤维细胞亚型,进而实现无瘢痕皮肤再生。该水凝胶还具备良好的粘附性和自修复能力,可适应复杂创面。动物模型实验表明,F/R gel可显著加速慢性感染伤口的愈合过程,并有效减少瘢痕形成,展现出良好的治疗潜力。本研究提供了一种有前景的再生策略,强调免疫调节和成纤维细胞亚型的调控,以实现无疤痕伤口修复。该文章于2025年4月20日以《A dynamically phase-adaptive regulating hydrogel promotes ultrafast anti-fibrotic wound healing》为题发表于《Nature Communication》上(DOI:10.1038/s41467-025-58987-w)。
(1)F/R 凝胶的制备与表征
F/R凝胶通过阳离子抗菌肽ε-聚赖氨酸(εPL)与醛基透明质酸(HA-CHO)之间的可逆席夫碱反应形成网络结构,CeOv纳米酶和负载bFGF/c-Jun siRNA的PLGA微胶囊(F/R MCs)均匀分布其中(图1a)。F/R MCs经W/O/W双乳液法制备,平均粒径为6.23 ± 2.70 μm,表面光滑(图1d),bFGF与c-Jun siRNA成功封装(图1e)。体外药物释放曲线表现为持续释放(图2k)。免疫荧光结果证实F/R MCs可有效下调成纤维细胞中c-Jun蛋白表达(图1f)。
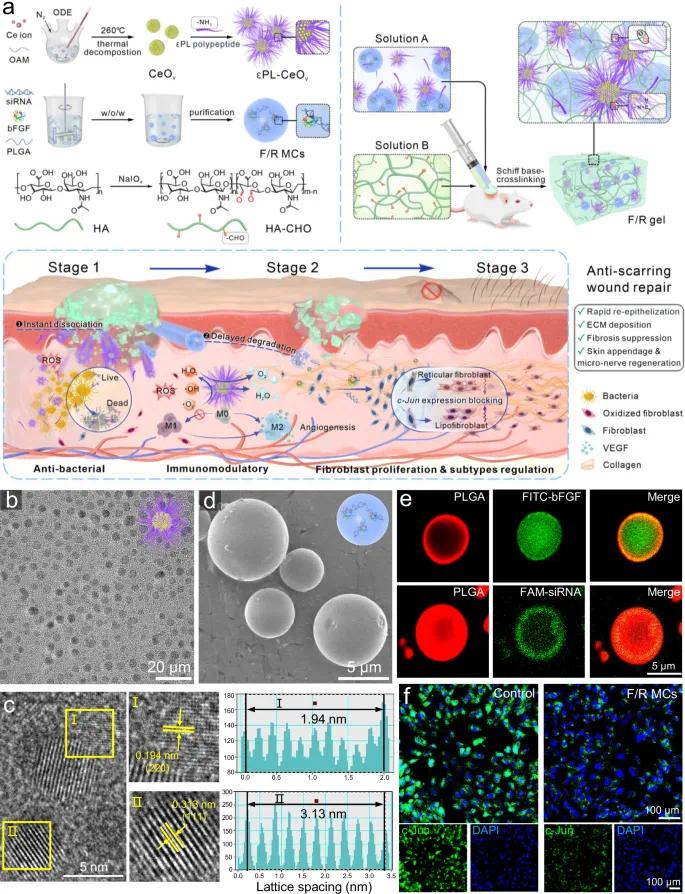
图1 F/R凝胶的制备及表征。(a)F/R凝胶制备示意图;(b)CeOv纳米粒子的TEM图像;(c)CeOv纳米粒子的HRTEM图像及晶格分析;(d)F/R MCs的SEM图像;(e)F/R MCs的CLSM图像,显示FITC标记的bFGF和FAM标记的siRNA(绿色)装入尼罗红标记的PLGA微囊(红色);(f)荧光染色3T3细胞中c-Jun的表达(绿色)
HA-CHO中的醛基与εPL链(自由εPL或εPL-CeOv)中的氨基可迅速发生席夫碱反应,数秒内形成F/R水凝胶(图2a)。Ce元素均匀分布于网络中(图2b)。流变学数据显示约3秒形成稳定三维结构(图2c)。在0%–1000%剪切应变范围内,储能模量(G’)与损耗模量(G”)随应变升高而下降,G”与G’的交点在770%左右,表现出剪切变稀特性(图2d)。当应变恢复至1%时,凝胶回复至弹性主导状态,且该过程可反复循环,表现出良好的注射性和自愈合性能(图2e, f)。凝胶可稳定黏附于皮肤及不同类型的小鼠新鲜伤口表面(图2g),并具备良好拉伸性能(图2h–j)。
F/R凝胶网络主要由席夫碱键和静电作用形成,可在微酸性环境下优先解离,快速释放小分子εPL和超小εPL-CeOv,实现抗菌与免疫调节功能。相比之下,PLGA微胶囊(F/R MCs)因粒径大、降解慢,其载药(bFGF/siRNA)释放延后,用于后续组织再生(图2k)。在中性PBS中,εPL-CeOv于前6天释放量达91.13%;bFGF与siRNA分别在第7天累积释放至约85%和74.48%。酸性环境(pH=4.5)可加速εPL-CeOv释放,符合席夫碱键的酸敏特性。
该凝胶体系具有分级递药特性:①抗菌组分(自由εPL和εPL-CeOv)优先释放用于抑菌;②CeOv纳米酶随后释放,清除ROS并调节炎症;③bFGF与c-Jun siRNA在后期释放,促进血管新生、细胞增殖,并调控成纤维细胞亚型,实现对不同创伤愈合阶段的按需精准治疗,有望实现快速抗瘢痕愈合(图2l)。
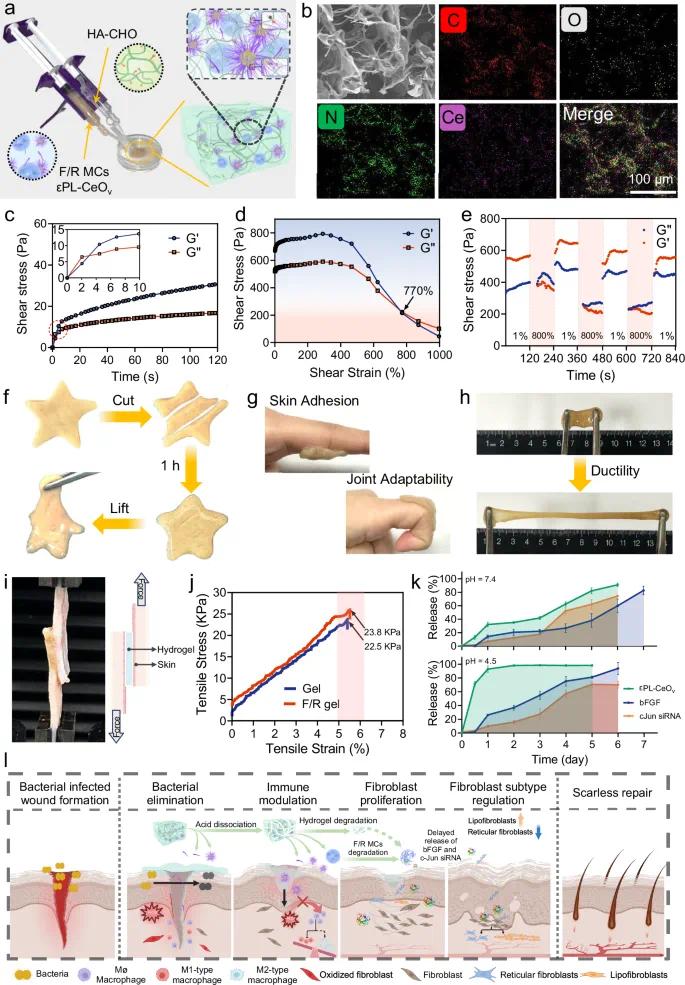
图2 F/R凝胶的表征。(a)凝胶制备示意图;(b)F/R凝胶的SEM图像及元素分布;(c)时间扫描流变图;(d)交变阶跃应变从1%切换到800%时的流变变化;(f)凝胶的自愈合过程;(g)粘附性;(h)可拉伸性;(i)使用猪皮的代表性图片;(j)拉伸应变测试;(k)F/R凝胶组分在中性PBS(pH=7.4)和酸性PBS(pH=4.5)中的体外释放特性;(l)无疤痕伤口愈合过程中F/R凝胶动态相位适应性调节功能的示意图
(2)F/R 凝胶的抗菌和抗生物膜活性
F/R凝胶对耐药菌感染伤口具有显著抗菌效果。以大肠杆菌(E. coli)、金黄色葡萄球菌(S. aureus)及耐甲氧西林金黄色葡萄球菌(MRSA)为模型菌株,环丙沙星(CIP)作为阳性对照,通过菌落计数及活死细菌染色评估其杀菌能力。εPL-CeOv、空白Gel及F/R凝胶均显著降低菌落数,效果与CIP相当(图3a, b),其中空白Gel的抑菌效果源于基质中的εPL。F/R凝胶对革兰阴性菌和阳性菌均有抑制作用,对E. coli与S. aureus的抑菌率达89%,对MRSA的杀灭率近95%。活死菌染色验证其可迅速诱导细菌死亡(图3a, b)。生物扫描电镜(Bio-SEM)观察到细菌形态破坏,如变形、表面皱缩及破裂(图3c)。
F/R凝胶可有效抑制生物被膜形成并破坏成熟生物被膜(图3d)。结晶紫染色结果显示,F/R凝胶对E. coli、S. aureus和MRSA生物被膜的抑制率分别为约95.08%、87.10%和87.89%。此外,凝胶对成熟生物被膜也具有破坏能力,破坏率分别为约82.53%、81.38%和71.35%(图3e),活死菌染色进一步证实其强分散能力(图3e)。对生物被膜厚度、总量、粗糙度及荧光强度的多参数分析显示,F/R凝胶破坏能力优于CIP(图3f, g)。F/R凝胶与空白Gel在破膜效率上无显著差异,说明其抗生物被膜活性主要源自εPL与εPL-CeOv,F/R MCs的加入未削弱该功能。
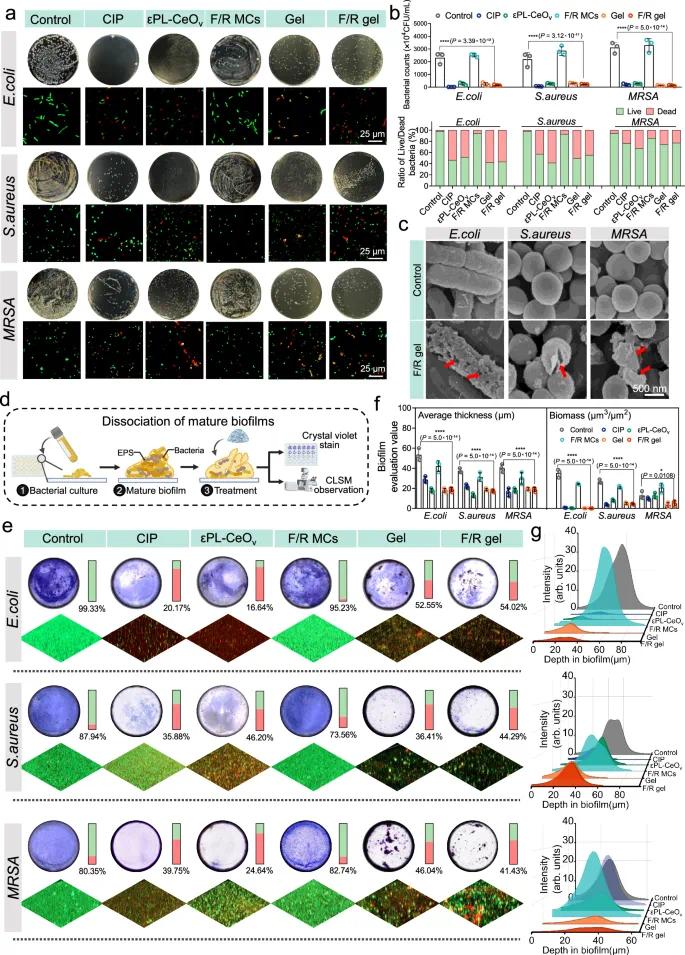
图3 F/R凝胶的体外抗菌和抗生物膜活性。(a)不同处理后细菌菌落及活/死染色检测的代表性图像;(b)菌落总数和活/死细菌的统计分析;(c)F/R凝胶处理前后细菌的扫描电镜图像(红色箭头表示细胞壁破裂变化);(d)F/R凝胶破坏生物膜效果的实验图解;(e)不同处理后成熟生物膜的结晶紫染色和活菌/死菌染色图像;(f)成熟生物膜的生物膜评估值;(g)从(e)中CLSM平面量化的绿色荧光强度与生物膜深度的关系
(3)F/R 凝胶的抗氧化和抗炎活性
F/R凝胶中主要清除ROS的成分为εPL-CeOv,其通过Ce³⁺/Ce⁴⁺的快速氧化还原循环实现电子转移(图4a)。Blank Gel与F/R凝胶的ROS清除效率与纯εPL-CeOv相当,而F/R MCs几乎无清除能力(图4b–f),说明εPL-CeOv与HA-CHO交联未影响其抗氧化性能,且其在凝胶中均匀分布保障了整体抗氧化能力。
为揭示CeOv纳米酶的原子级催化机制,进行了密度泛函理论(DFT)计算。热分解法合成的超小CeOv表面具有丰富的氧空位(图4g),并伴随Ce³⁺/Ce⁴⁺可逆氧化还原对。电荷密度图显示氧空位导致电子重新分布并降低邻近Ce的价态(图4h);Bader电荷分析表明CeOv的Ce价态较完美CeO₂表面降低约0.47 e⁻。CeOv (111)晶面对五种自由基的吸附能分别为:ABTS+•(−3.87 eV)、DPPH•(−3.97 eV)、H₂O₂(−4.83 eV)、•OH(−6.46 eV)、•O₂⁻(−7.46 eV),显著高于CeO₂(图4i),表明其更强的吸附与催化活性。进一步模拟了•O₂⁻歧化反应和H₂O₂分解的关键中间体与反应路径,揭示其具备类似SOD和CAT的仿酶机制(图4j)。
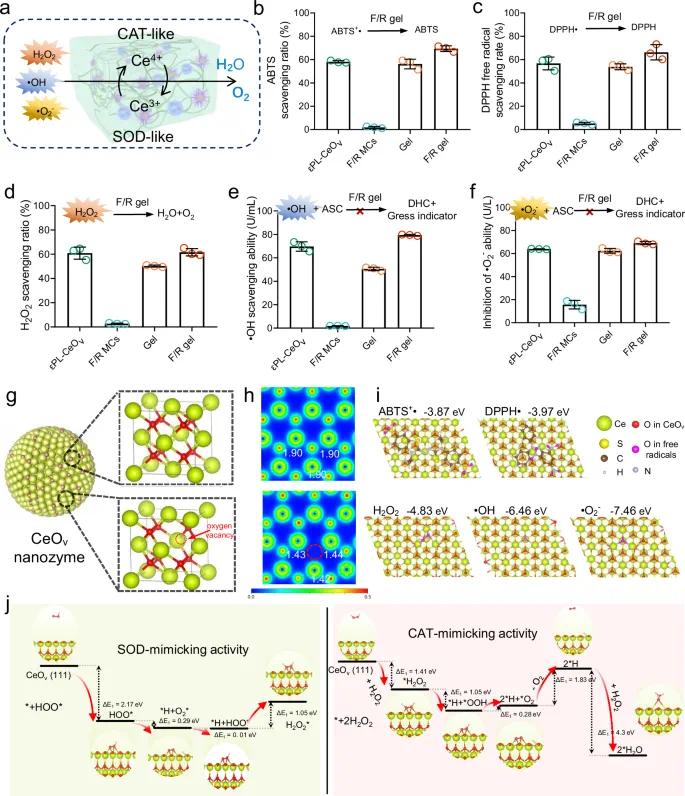
图4 体外抗氧化活性和DFT计算。(a)F/R凝胶清除ROS能力示意图;(b)对ABTS自由基的清除测试;(c)对DPPH自由基的清除测试;(d)对过氧化氢的清除测试;(e)对羟基自由基的清除测试;(f)对超氧阴离子的清除测试(n=3个独立样品);(g)缺氧CeOv纳米酶的粒子模型及单胞构型;(h)CeO2和CeOv的模拟电子密度图,红色虚线圆圈表示表面氧空位;(i)CeOv(111)面上吸附的ABTS⁺⁻、DPPH⁻、H₂O₂、-OH和-O₂⁻自由基的优化结构俯视图;(j)CeOv(111)面上模拟SOD类和CAT类催化过程的反应能量曲线
过量ROS积累可诱发氧化应激与炎症反应,M1型巨噬细胞过度分泌炎症因子又会进一步促进ROS产生,形成持续性炎症–ROS正反馈循环,导致异常伤口愈合。F/R凝胶在细胞水平被验证具有中断该循环的能力,包括清除细胞内ROS、减少ROS损伤及抑制M1型极化(图5a)。在tBHP诱导的3T3和HUVEC氧化应激模型中,F/R凝胶组细胞内ROS强度较tBHP组分别降低超过6倍和2倍(图5b, c)。荧光图像显示,tBHP处理后ROS信号增强,而F/R凝胶处理后ROS水平几乎不可检测(图5d, e)。HPF染色进一步证实其细胞内ROS清除作用,并显著提升细胞活力(图5d)。F MCs与F/R MCs组间无显著差异,表明bFGF具备增殖促进作用;而F/R凝胶中εPL-CeOv同时清除氧化应激,为细胞增殖提供良好微环境。
慢性伤口愈合早期,巨噬细胞易极化为促炎的M1型,分泌TNF-α、IL-1β、IL-6等炎症因子及自由基,导致炎症持续并延缓修复。抑制过度M1型极化有助于缓解炎症并加速愈合。LPS刺激下,巨噬细胞CD86(M1标志物)荧光强度显著升高,表明其极化为M1型(图5f);而F/R凝胶处理后CD86阳性率仅约2.56%,较LPS组下降约6.7倍(图5g)。F/R凝胶中两种成分协同抑制巨噬细胞活化:① bFGF可调控巨噬细胞表面受体表达及促炎因子产生,抑制NF-κB等信号通路;② 抗氧化的εPL-CeOv可清除细胞内ROS,进一步抑制M1极化。
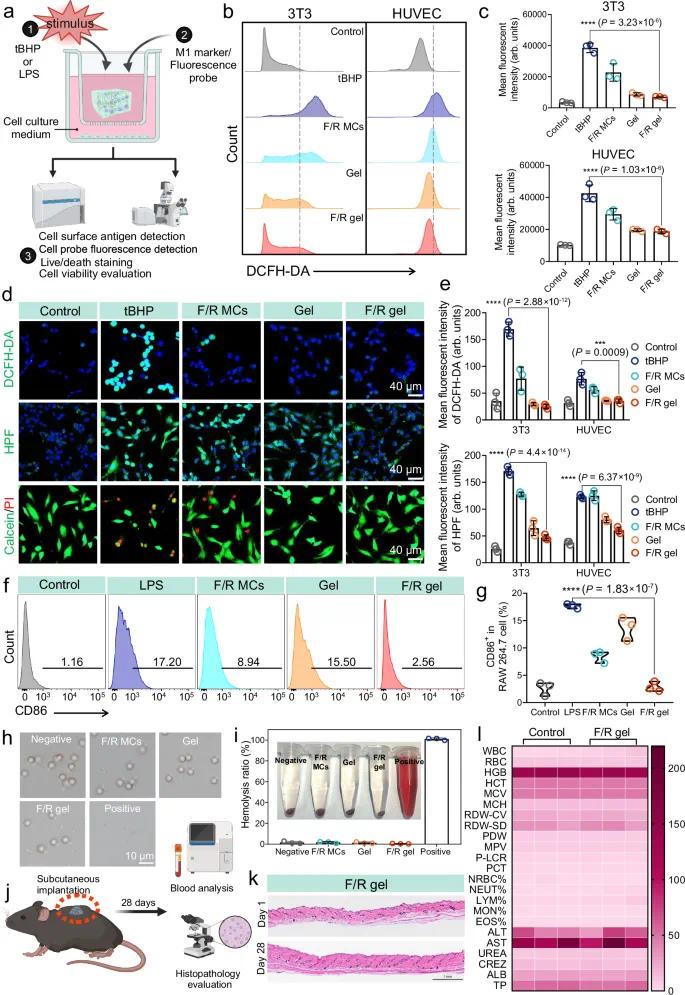
图5 F/R凝胶的细胞内氧化应激消除、巨噬细胞极化效应和生物相容性评估。(a)细胞实验图解;(b)3T3和HUVEC细胞的DCFH-DA荧光流式细胞仪检测;(c)细胞内DCFH-DA荧光强度统计;(d)3T3细胞的DCFH-DA探针、HPF探针及活/死细胞染色荧光图像;(e)相应统计分析;(f)巨噬细胞上CD86标记的流式细胞术;(g)相应统计数据;(h)红细胞显微图像;(i)不同处理后的溶血率;(j)皮下植入试验图解;(k)F/R凝胶植入28天后皮肤组织的H&E染色图像;(l)血常规和生化指标
(4)F/R 凝胶的生物相容性评估
F/R凝胶具有良好生物相容性。溶血实验显示,F/R凝胶处理后红细胞完整,离心上清液澄清透明,溶血率接近0%,与阴性对照相当;而阳性对照(去离子水)组红细胞破裂,溶血率接近100%(图5h, i)。在小鼠皮下移植F/R凝胶30天后,H&E染色显示皮肤及主要器官无炎症反应或组织损伤(图5j, k)。血常规及血清生化指标均在正常范围内(图5l)。
(5)F/R 凝胶促进小鼠感染 MRSA 的慢性伤口快速愈合
为评估F/R凝胶在体内促进慢性感染创面愈合的效果,在C57BL/6小鼠背部建立MRSA感染的全层皮肤缺损模型(直径6.0 mm),并分别给予PBS(Control)、贝复济凝胶(Beifuji)、F/R MCs、空白Gel和F/R凝胶处理(图6a)。F/R凝胶组在第4、7、14天的创面面积最小,显示显著加快的愈合速度(图6b;图6c)。F/R凝胶处理4天后未愈合面积降至约63.25%,第7天降至约32.56%,而对照组同期分别为约89.51%和84.22%。第14天F/R凝胶组创面几乎完全愈合,最接近正常皮肤。整体上,F/R凝胶将愈合时间缩短约6–7天,总愈合周期减少近三分之一。分阶段分析显示,F/R凝胶在愈合早期(第0–7天)显著加快愈合,而后期愈合速率趋缓,有助于避免过度增生。同时,第4和7天,Control、Beifuji及F/R MCs组出现明显感染及生物被膜形成,而Gel与F/R凝胶组感染迹象较轻。培养皿菌落分析显示,F/R凝胶组细菌数量最少,第7天几乎无菌落(图6d, e)。综合数据表明,F/R凝胶处理下创面可在第4–7天顺利过渡至增殖期,而其他组仍处于感染或炎症期。
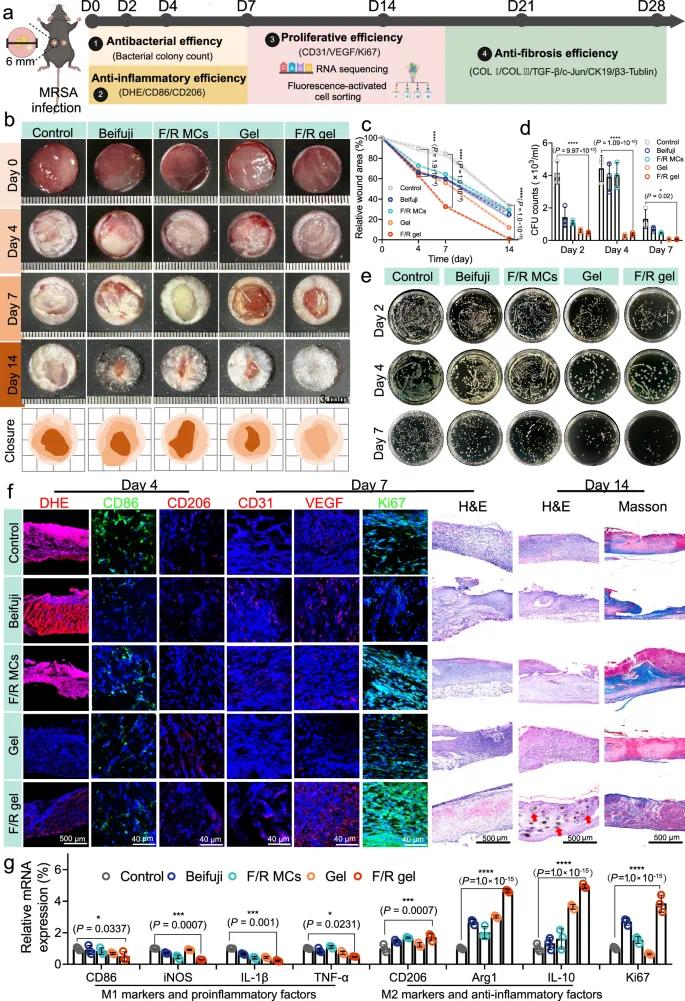
图6 F/R凝胶对小鼠MRSA感染慢性伤口的体内快速愈合效果。(a)小鼠全动物实验过程;(b)第0~14天伤口闭合的光学照片及模拟图;(c)14天内伤口面积变化曲线;(d)第2~7天伤口渗出物的菌落计数检测及(e)代表性图像;(f)DHE、CD86、CD206、CD31、VEGF、Ki67和DAPI的免疫荧光染色、H&E染色及马森染色图像,红色箭头标记新生毛囊;(g)CD86、iNOS、IL-1β、TNF-α、CD206、Arg1、IL-10和Ki67的相对mRNA表达量
为系统评估愈合质量,第4、7、14天分别取组织样本进行免疫荧光与组织病理学分析。第4天,Control、Beifuji及F/R MCs组显示明显的ROS(DHE染色)和M1型巨噬细胞标志物CD86荧光信号,而Gel与F/R凝胶组信号较弱或几乎不可见;M2型标志物CD206则呈相反趋势(图6f)。qRT-PCR结果进一步验证上述趋势(图6g)。F/R凝胶通过抑菌、清除ROS、降低促炎因子,恢复创面氧化还原稳态,促进炎症期向增殖期过渡。第7天H&E染色显示对照组炎症细胞浸润严重,而F/R凝胶组炎症轻微(图6f)。在增殖期(第7天),F/R凝胶组创面CD31和VEGF表达显著上升,提示血管新生活跃(图6f);同时Ki67表达最高,qRT-PCR显示Ki67 mRNA表达较对照组提升近4倍,表明细胞增殖活跃,可能与bFGF释放有关(图6f, g)。值得注意的是,F/R凝胶组第14天再生皮肤中出现新生毛囊和皮脂腺,其他组几乎未见(图6f)。Masson染色进一步显示F/R凝胶组胶原沉积更成熟、排列更有序(图6f)。
(6)F/R 凝胶可抑制小鼠受 MRSA 感染的慢性伤口疤痕的形成
在第28天外观评估与组织病理学分析中,F/R凝胶组再生皮肤表现出更好弹性、色泽均匀、色素沉着减少、组织凹陷更少(图7a)。对照组第21天瘢痕样组织面积约为59.88%,第28天升至64.28%;而F/R凝胶组第21天为17.51%,第28天接近0%(图7b)。色素评分结果显示F/R凝胶组新生皮肤色调更接近正常(L值高,A值低)。
H&E染色分析表明F/R凝胶组表皮厚度(约20.54 μm)接近正常皮肤(约20.57 μm),而对照组厚度增至正常的6倍(图7c, d)。薄表皮更有利于防止结痂或瘢痕形成,维持皮肤功能。F/R凝胶组还观察到大量成熟皮肤附属器形成,数量接近正常水平(图7c, d)。免疫荧光标记CK19进一步证实毛囊生成(图7d),同时再生组织中可见β3-Tubulin阳性的神经束,提示F/R凝胶具有激活神经修复潜力,促进神经重建。皮肤附属结构和神经纤维的有序形成体现出F/R凝胶优越的创面修复质量。
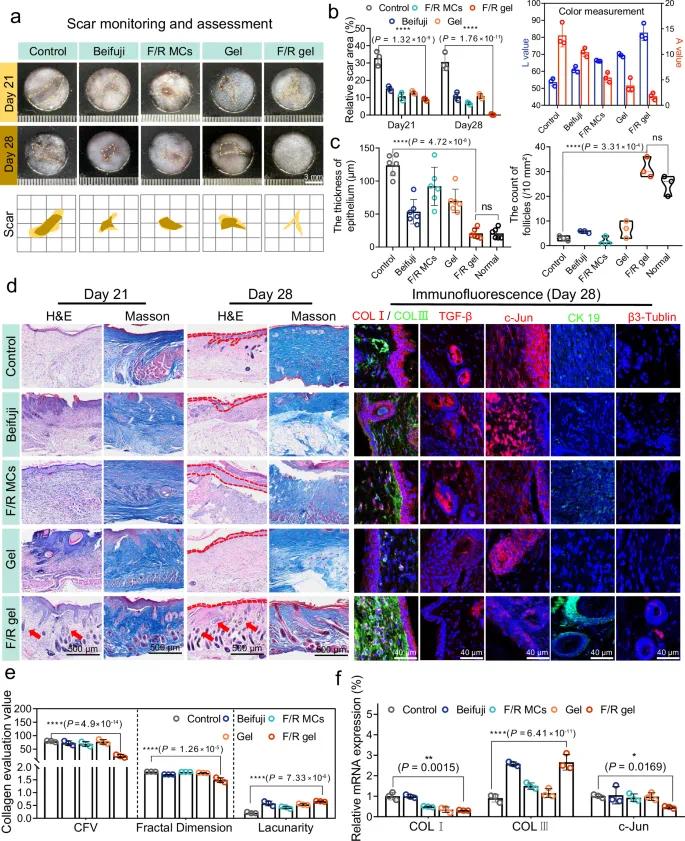
图7 F/R凝胶可缓解小鼠受MRSA感染的慢性伤口纤维化疤痕的形成。(a)第21~28天疤痕面积变化的光学照片及模拟图;(b)治疗后疤痕变化曲线及颜色分析(L值越高颜色越白,A值越高颜色越红);(c)第28天表皮厚度和毛囊数量的H&E染色分析(n=6个独立样本);(d)第21~28天伤口组织的H&E染色、Masson染色及COL I、COL III、TGF-β、c-Jun、CK19、β3-Tublin和DAPI的免疫荧光染色图像;(e)基于组织切片分析的胶原体积比、分形维度值和裂隙度值(n=3个生物独立样本);(f)第28天COL I、COL III和c-Jun的相对mRNA表达量(n=3个生物独立样本)
Masson染色结果显示,F/R凝胶组胶原沉积更成熟,排列更有序且结构更简单(图7d)。统计分析显示F/R凝胶组胶原体积分数(CFV)接近正常皮肤(约23.90% vs. 正常皮肤约20%),而对照组高达78.83%,提示其存在异常胶原沉积与严重纤维化(图7e)。F/R凝胶组的空隙度(lacunarity)较高、分形维度较低,反映出多孔结构及胶原排列均匀。胶原I主要维持组织结构,胶原III与弹性相关。F/R凝胶组中胶原I表达显著降低,胶原III表达上升(图7d–f),表明其具有抑制纤维瘢痕形成的潜力。c-Jun表达在F/R凝胶组显著降低,TGF-β也下调,表明siRNA干预c-Jun与TGF-β信号通路联动抑制瘢痕形成。而F/R MCs组未能有效降低c-Jun表达,可能因自由微胶囊在愈合过程中迅速丢失,凸显凝胶系统的重要性。
(7)荧光激活细胞分拣(FACS)和转录组测序分析
第7天FACS分析结果显示,F/R凝胶组网状成纤维细胞比例显著低于其他对照组,脂肪样成纤维细胞比例则相反(图8a, b)。网状成纤维细胞过多会导致过量胶原沉积和基质重塑紊乱,引发瘢痕形成;而F/R凝胶通过调控愈合过程中成纤维细胞亚群比例,促使脂肪样成纤维细胞增多,有利于无瘢痕修复(图8c)。同时,F/R凝胶组α-SMA(促纤维化肌成纤维细胞标志物)表达保持在较低且稳定水平,其他组则持续升高,提示真皮纤维化发展(图8d, e)。尽管Sca-1(脂肪型成纤维细胞标志物)表达变化不如α-SMA显著,但F/R凝胶组在所有时间点的Sca-1表达均较高,进一步支持其对纤维化调控作用(图8d, e)。
为进一步探究F/R凝胶促进无瘢痕愈合的潜在机制,对第14天创面组织进行转录组分析。所有生物学重复样本间的Pearson相关系数R²均大于0.92,表明数据可靠(图8f)。火山图显示F/R凝胶组共有318个差异表达基因,其中175个上调,143个下调(图8g)。弹性蛋白编码基因Eln在F/R凝胶组显著上调,可能促进创面弹性组织再生(图8h)。此外,与血管再生(Myl7)、肌肉再生(Myog)、毛囊与附属器再生(Sp6、Gsdma3、Elf5)相关的基因也显著上调。与纤维化瘢痕形成相关的基因(如Ugt8a、Il-11、Gcgr、Tgfbr3l)显著下调,c-Jun表达也因siRNA干预而降低。KEGG通路富集分析显示差异基因主要涉及IL-17、NF-κB、JAK-STAT、HIF-1和TGF-β等信号通路,参与调控炎症、免疫、增殖和纤维化等愈合相关过程(图8i)。GO分析表明,这些基因主要富集于细胞对TGF-β刺激的响应等生物过程(图8j)。
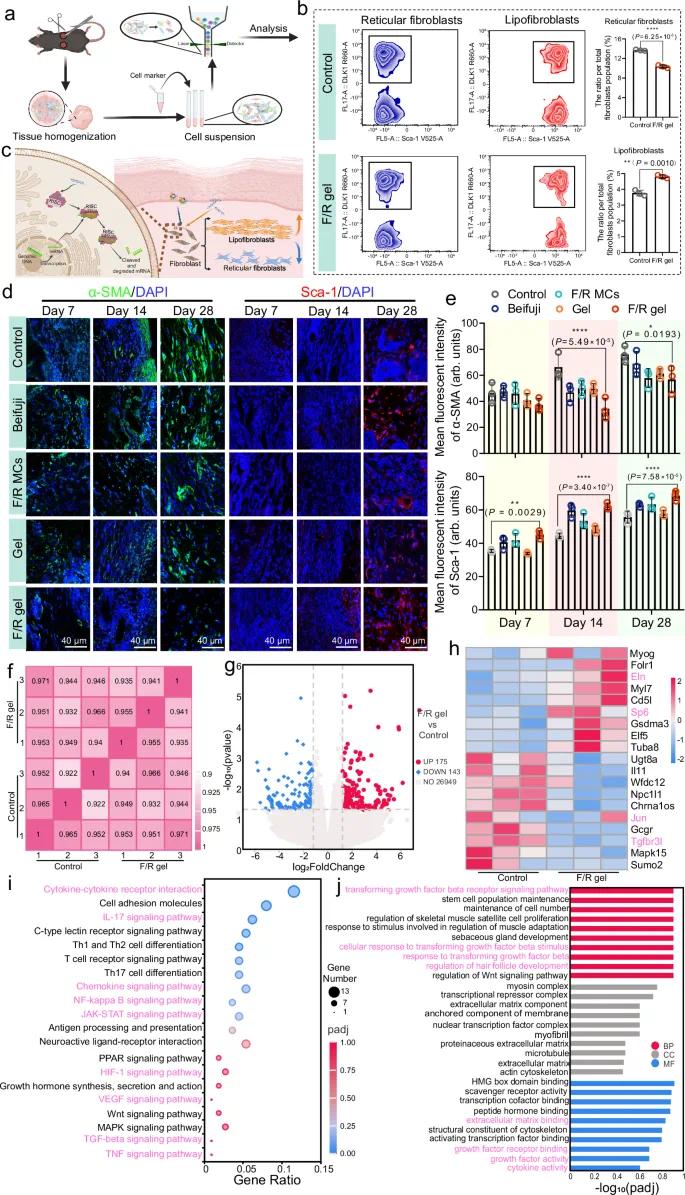
图8 通过FACS和转录组测序分析细胞分子水平的潜在调控机制。(a)伤口组织FACS实验过程示意图;(b)成纤维细胞亚型的荧光激活细胞分选结果;(c)c-Jun沉默策略调控的成纤维细胞亚型示意图;(d)第7、14和28天伤口组织中α-SMA和Sca-1的免疫荧光染色图像;(e)α-SMA和Sca-1信号的平均荧光强度(n=3个生物独立样本);(f)测试样本的皮尔逊相关系数矩阵热图;(g)第14天F/R凝胶组与对照组的火山图;(h)筛选出的参与愈合过程的差异表达基因热图;(i)差异表达基因的KEGG富集分析;(j)差异表达基因的GO富集分析
(8)F/R 凝胶促进兔耳伤口无疤痕愈合
在兔耳瘢痕模型中评估F/R凝胶的抗瘢痕愈合效果。该模型由于缺乏创面收缩,常出现延迟上皮化并形成可重复的增生性瘢痕。通过切除全层皮肤(直径8 mm)并感染MRSA构建感染性创面(图9a)。结果表明,F/R凝胶不仅加快愈合速度,还显著抑制瘢痕形成(图9b)。第14天,F/R凝胶组愈合率达约87.66%,优于所有对照组(图9c);第21天对照组出现明显红色增生性瘢痕,第28天仍未消退,瘢痕面积约为28.3 mm²,占初始创面的56.33%。F/R凝胶组再生组织在形态、色泽和触感上均接近周围正常皮肤。
超声成像、H&E染色、Masson染色和瘢痕评价指标分析(SEI、瘢痕厚度、隆起角度、色素沉着)进一步确认F/R凝胶组瘢痕最小(图9d–f)。超声与组织切片均显示F/R凝胶组组织厚度接近正常皮肤,表皮厚度无明显增厚。Masson染色中,对照组等显现出粗大、紊乱、旋涡状的胶原沉积特征,而F/R凝胶组胶原沉积较少且细胞密度较低,接近正常组织。在重塑期,胶原排列越集中有序,皮肤强度越高,愈合质量越好。进一步分析发现,F/R凝胶组胶原纤维排列方向集中,类正常组织,其他组则分散无序(图9g)。综上,F/R凝胶在兔耳感染性创伤模型中可显著加速创面闭合并有效抑制纤维化瘢痕形成,展现出良好的临床转化潜力。
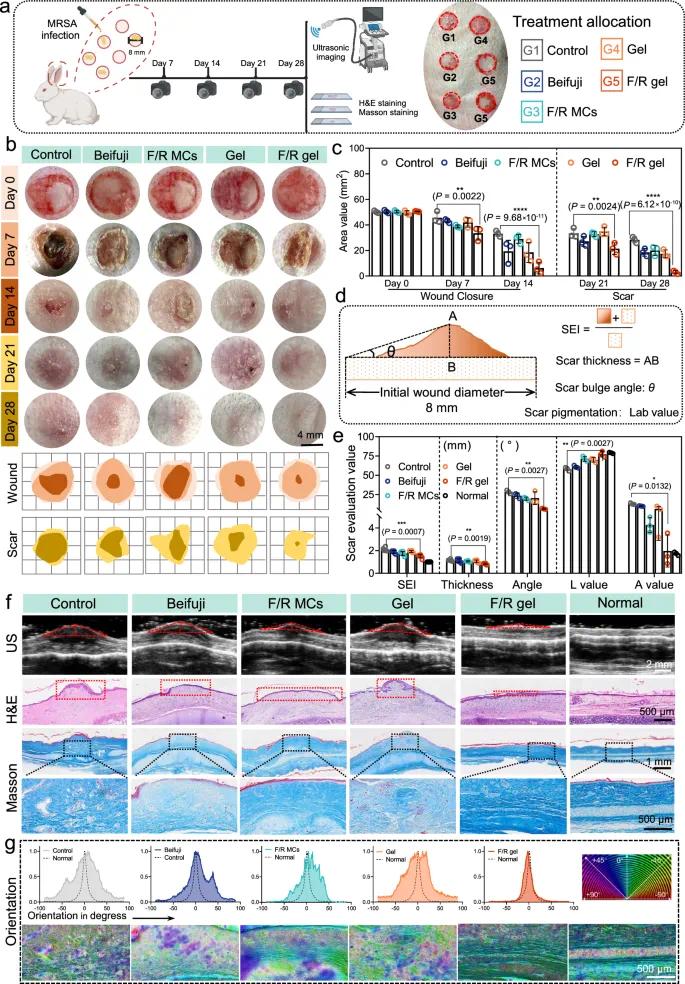
图9 F/R凝胶对兔耳增生伤口的无瘢痕愈合效果。(a)MRSA感染兔耳伤口建模及动物实验示意图;(b)第0~28天伤口愈合的光学照片、模拟图及(c)统计数据;(d)兔耳瘢痕效果评价指标示意图;(e)SEI、疤痕厚度、隆起角度和颜色测量的统计数据;(f)兔耳伤口组织的超声成像、H&E染色和马森氏染色图像;(g)基于马森染色分析的胶原蛋白取向分布
目前,临床上对慢性伤口(特别是耐药菌感染所致)的有效治疗手段有限,同时实现无瘢痕愈合更具挑战。传统治疗往往难以兼顾愈合速度与瘢痕抑制,亟需一种可动态调控创面修复过程的策略。
本研究开发了一种具有注射、自愈和黏附特性的分级释放相应水凝胶平台(F/R gel),通过动态调控伤口微环境,实现创面从炎症期到增殖期的顺利过渡。在早期阶段,εPL和εPL-CeOv通过抗菌和抗生物被膜作用迅速清除病原体,同时CeOv纳米酶清除过量ROS、抑制M1型极化,从而调节局部免疫环境,缩短炎症期。在后期阶段,F/R微胶囊缓慢释放bFGF与c-Jun siRNA,促进细胞增殖与血管新生,并通过调控成纤维细胞亚群比例(减少网状型,增加脂肪样型)有效抑制纤维化瘢痕形成。在小鼠和兔耳感染创面模型中,该水凝胶显著加速伤口闭合并抑制瘢痕增生,表现出优越的再生与抗瘢痕修复效果。
综上,F/R凝胶通过对伤口愈合阶段的程序化调控,实现了抗感染、抗氧化、促愈合及抑制瘢痕的一体化治疗策略,为难愈合慢性伤口的无瘢痕修复提供了新思路,具有良好的临床转化潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

