
动脉粥样硬化是冠心病、外周血管疾病和中风的主要原因,严重威胁人类健康。其病理机制复杂,涉及脂质代谢紊乱、炎症、氧化应激和内皮功能障碍。当前治疗策略主要针对单一病理机制(如抗炎或抗氧化),但效果有限,难以全面解决动脉粥样硬化的多因素致病特性。
作为一种内源性信号分子,NO可促进血管舒张、降低血压、增强血流量、白细胞粘附和血小板聚集。这些作用有助于维持内皮完整性并降低动脉粥样硬化的风险。此外,NO具有低分子量和亲脂性,使其易于穿透细胞膜。因此,基于NO的气体疗法是一种有前途的策略,可以快速逆转内皮细胞功能障碍,有效地减缓动脉粥样硬化血管的老化。此外,内皮细胞衰老和巨噬细胞极化在动脉粥样硬化中起着重要作用,但现有干预策略较少。

针对上述问题,上海大学陈雨教授团队研究开发了一种新型的CZALO纳米脂质体,旨在同时解决动脉粥样硬化的多种病理机制。骨桥蛋白(OPN)修饰的纳米脂质体(CZALO),其包含L-精氨酸(L-Arg)和氧化铈-氧化锆纳米颗粒(CZ NPs)。在炎症驱动的靶向和OPN介导的内吞作用后,从CZALO纳米脂质体中释放的CZ NPs通过模拟多种天然酶(包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和谷胱甘肽过氧化物酶(GPx))显著清除ROS,从而抑制胆固醇摄取,促进巨噬细胞表型转变并抑制炎性细胞因子的分泌,实现抗氧化和抗炎效果。巨噬细胞中过表达的一氧化氮合酶(NOS)选择性地催化L-精氨酸原位转化为一氧化氮(NO),从而实现NO在炎症部位的精确释放。NO扩散到内皮细胞中后,通过调节衰老相关分泌表型(SASP)因子的分泌、改善溶酶体功能、打破细胞周期停滞和减少衰老内皮细胞中的DNA损伤,从而发挥良好的抗衰老效果。CZALO纳米脂质体介导的“一石二鸟”抗氧化和抗衰老治疗策略在体内外均显示出良好的抗动脉粥样硬化效果,有效减轻动脉粥样硬化负担,且毒性最小。该文章于2025年02月20日以《Macrophage-targeting Antisenescence nanomedicine enables in-Situ NO induction for Gaseous and antioxidative atherosclerosis intervention》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2025.02.025)。
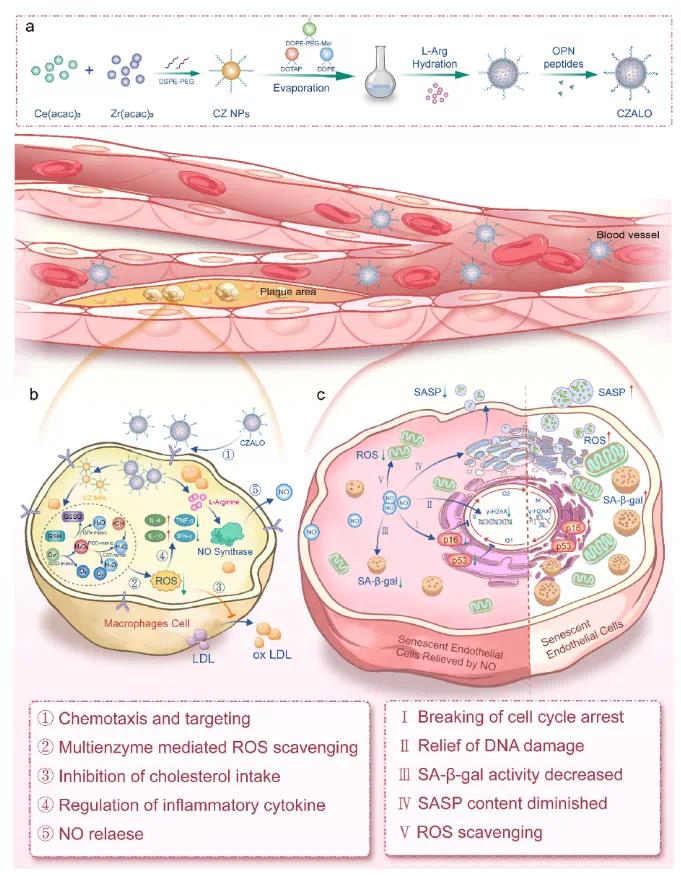
图1 CZALO纳米脂质体用于动脉粥样硬化治疗的策略示意图。(a)CZALO纳米脂质体的合成路线;(b)在OPN介导的主动靶向和巨噬细胞内化后,CZALO纳米脂质体释放的CZ NPs表现出SOD/CAT/POD/GPx样活性,有效抑制ROS,抑制胆固醇摄取并重编程巨噬细胞表型;(c)L-Arg在巨噬细胞内被过表达的NOS催化生成NO气体,NO气体扩散至内皮细胞,通过打破细胞周期阻滞、减轻DNA损伤、降低脂褐素和SASP含量、清除ROS等发挥抗衰老作用
(1)CZALO纳米脂质体的合成与表征
使用非水解溶胶-凝胶法合成Zr 4+掺杂的二氧化铈纳米颗粒,即CZ NP(图2a)。通过透射电子显微镜(TEM)图像显示,所制备的CZ NPs具有均匀的形态和离散的分布(图2b)。元素分布图和X射线光电子能谱(XPS)分析表明,合成的CZ NPs同时含有铈和锆成分(图2c)。XPS谱图证实了Ce3⁺和Ce4⁺在元素中的共存,赋予了其类酶活性和ROS清除能力(图2d)。X射线衍射(XRD)分析确认了CZ NPs的晶相,验证了其成功合成(图2e)。如图2f所示,CZ NPs表现出良好的SOD样活性,并以浓度依赖性方式显著降低O2-•含量。CZ NPs催化H2O2的分解,同时将无色的TMB氧化为蓝色的氧化TMB(ox TMB)。结果表明,CZ NPs在浓度和时间依赖性方面表现出明显的类POD模拟活性(图2g)。除了POD,过氧化氢酶(CAT)能够催化H2O2转化为H2O和O2(图2 h)。谷胱甘肽过氧化物酶(GPx)对于维持细胞氧化还原平衡和保护细胞免受氧化损伤至关重要。在谷胱甘肽(GSH)存在下,GPx催化H2O2还原为H2O。同时,谷胱甘肽还原酶(GR)利用NADPH作为电子供体,将氧化型谷胱甘肽(GSSG)还原为还原型GSH,从而恢复其抗氧化能力并维持细胞内GSH/GSSG氧化还原平衡(图2 i)。综上所述,上述发现为所构建的CZ NP的多功能酶模拟特性提供了强有力的证据,包括SOD、POD、CAT和GPx活性,这为随后的抗氧化功能奠定了基础(图2 j)。如图2k、l所示,CZ NPs可以有效地清除ABTS·+、DPPH·和PTIO·,并且其清除能力与CZ NPs的浓度呈正相关。结果表明,随着CZ NPs浓度的增加,·OH清除能力显著提高(图2 m)。此外,ESR分析显示CZ NP有效地抑制·OH(图2n)。为了提高脂质体进入动脉斑块的递送效率,进一步通过迈克尔加成反应将OPN共价修饰到脂质体表面(图2 o)。TEM图像显示CZALO为类球形,尺寸和分布相对均匀。颗粒之间没有明显的粘附,表明CZALO纳米脂质体的成功合成(图2 p)。为了评价CZALO的药物控制释放能力,评估了L-Arg在pH 7.5和6.5下的药物释放动力学。如图2 q所示,L-Arg在前12小时内快速释放,随后是缓慢释放阶段,这意味着CZALO可以在具有不同pH水平的生理环境中实现L-Arg的持续和受控释放。
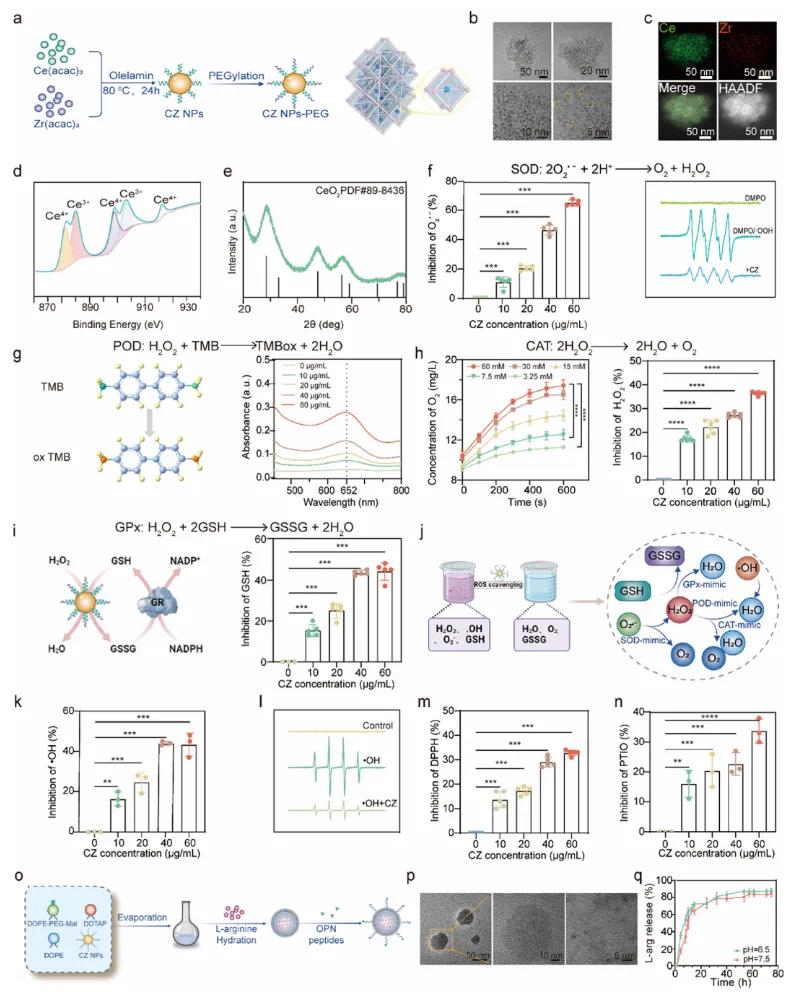
图2 CZALO的合成与表征。(a)CZ NP合成工艺示意图;(b)CZ NP的透射电子显微镜(TEM)图像;(c)CZ NP的元素分布图;(d)CZ纳米颗粒中铈(Ce)的X射线光电子能谱(XPS);(e)CZ NPs的X射线衍射(XRD)图谱;(f)不同浓度CZ NP的超氧化物歧化酶(SOD)样活性(左)和电子自旋共振(ESR)测定评估超氧阴离子(O₂⁻)(右);(g)CZ NP的过氧化物酶(POD)样活性示意图(左)和分析(右);(h)用于评估过氧化氢酶(CAT)样活性的氧气(O₂)产生(左)和过氧化氢(H₂O₂)清除(右);(i)CZ NP的谷胱甘肽过氧化物酶(GPx)样活性示意图(左)和分析(右);(j)CZ NP的酶模拟活性示意图,涵盖SOD、POD、CAT和GPx;(k-n)(1)用ESR法测定CZ NPs的羟基自由基(·OH,k);(2)1,1-二苯基-2-三硝基苯肼(DPPH)测定(m);(3)2-苯基-4,4,6,6-四甲基哌啶-1-氧自由基(PTIO)测定(n);(o)CZALO制备方案示意图;(p)CZALO的TEM图像;(q)在pH 6.5和pH 7.5下L-Arg的体外释放曲线
(2)CZALO使的巨噬细胞中的ROS清除和炎症减弱
与LPS + CZAL组相比,LPS + CZALO组显示出上级ROS清除作用,这归因于由OPN介导的主动靶向(图3a)。使用钙黄绿素AM/碘化丙啶(PI)染色评估CZALO对巨噬细胞的保护作用。与其他处理相比,在CZALO组中观察到PI标记的死亡巨噬细胞的明显减少(图3b)。类似地,与用CZAL和CZL处理相比,用CZALO处理的巨噬细胞在Raw 264.7中表现出针对H2 O2诱导的细胞凋亡的稳健的抗细胞凋亡活性(图3c)。以上结果共同证实了CZALO能够有效地抑制细胞内ROS,保护巨噬细胞免受氧化应激诱导的损伤。如图3d和e所示,在CZALO处理组中红色荧光强度显著降低,表明巨噬细胞中脂质滞留的有效减少和巨噬细胞中脂质滞留的显著抑制。随后测量Raw264.7内的胆固醇水平,显示CZALO处理组的细胞内胆固醇水平显著降低(图3f)。如图3g和图3 h所示,与模型组相比,CZALO处理的巨噬细胞显示出显著降低的CD 86水平和升高的CD 206水平。此外,采用酶联免疫吸附测定法(ELISA)评价了CZALO减少炎症反应的潜力。如图3 i和j所示,LPS处理后,促炎细胞因子包括TNF-α和干扰素-γ(IFN-γ)明显升高。相反,在与CZALO孵育的巨噬细胞中,这些促炎性细胞因子的分泌水平显著降低。此外,与其他组相比,CZALO组的抗炎细胞因子,如白细胞介素-4(IL-4)和IL-10增加(图3 k和l)。这些发现表明,CZALO促进了从促炎M1表型向抗炎M2表型的转变,从而上调抗炎细胞因子并下调促炎细胞因子(图3 m)。
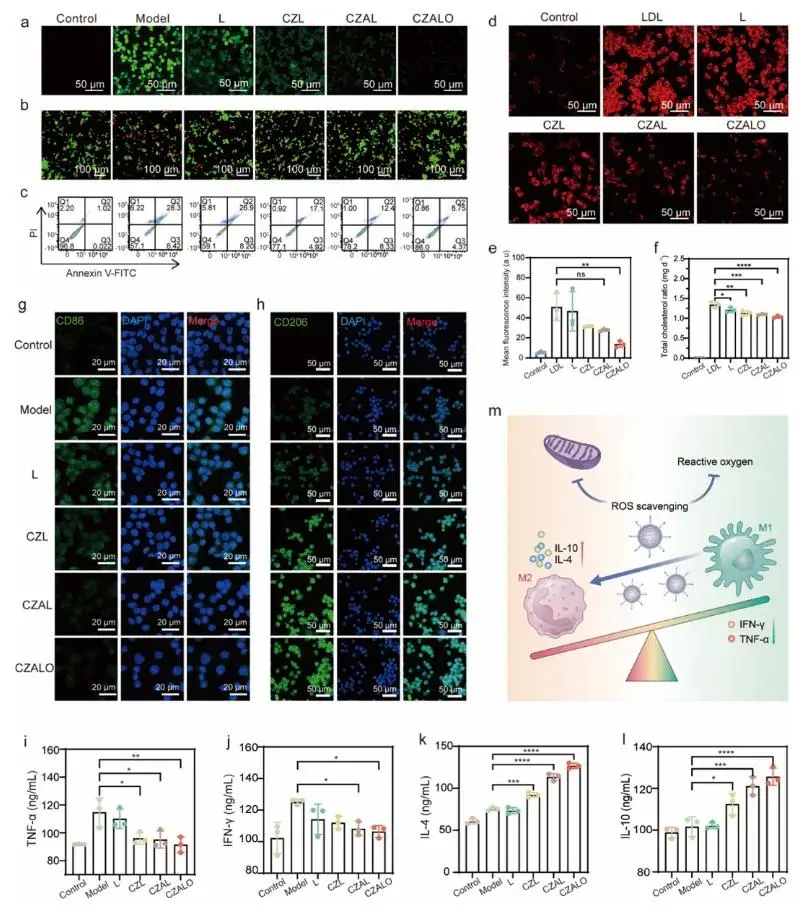
图3 CZALO激活的ROS清除和炎症减轻。(a)LPS预处理的Raw264.7细胞经不同浓度LPS处理后细胞内ROS水平变化;(b)各种处理下Raw264.7的代表性活/死染色荧光图像;(c)H₂O₂预处理的Raw264.7在不同处理后的细胞凋亡评估(Annexin V-FITC/PI双染料试剂盒染色,流式细胞术分析);(d)典型的共聚焦激光扫描显微镜(CLSM)图像和(e)Raw264.7中尼罗红染色的定量分析;(f)不同处理后Raw264.7中的细胞内胆固醇含量;(g,h)不同处理后LPS预处理的Raw264.7中(g)CD86和(h)CD206的免疫荧光;(i-l)炎症因子水平,包括(i)TNF-α、(j)IFN-γ、(k)IL-4和(l)IL-10;(m)CZALO介导的ROS消除和巨噬细胞表型调节示意图
为了进一步探索CZALO抗氧化/抗炎作用的潜在生物学机制,进行了一项高通量转录组测序分析,以比较LPS刺激的巨噬细胞(模型组)和CZALO处理的巨噬细胞(实验组)之间的差异表达基因(DEG)(图4a)。如火山图所示,CZALO处理后,2519个基因显著上调,2932个基因显著下调(图4 b)。进行基因本体(GO)分析以阐明这些基因在生物学过程、细胞组分和分子功能中的变化(图4c)。KEGG的气泡图分析显示,丰富的信号通路与炎症反应的调节相关,包括TNF信号通路、Toll样受体信号通路、NF-κB信号通路和NOD样受体信号通路,其可能在CZALO的抗氧化和抗炎作用中发挥关键作用(图4d)。基因集富集分析(GSEA)分析还表明,与模型组相比,CZALO处理组中的DEG在几种途径中显著富集,包括TNF信号传导途径、Toll样受体信号传导途径、NF-κ B信号传导途径和NOD样受体信号传导途径(图4 e)。与模型组相比,用CZALO处理的Raw 264.7中DEG如白细胞介素-1 β(IL-1β)、CD 86、白血病抑制因子(Lif)、TNF、IL-6、白细胞介素-12 β(IL-12β)和核因子κ B亚基1(Nfkb 1)显著下调(图4g)。
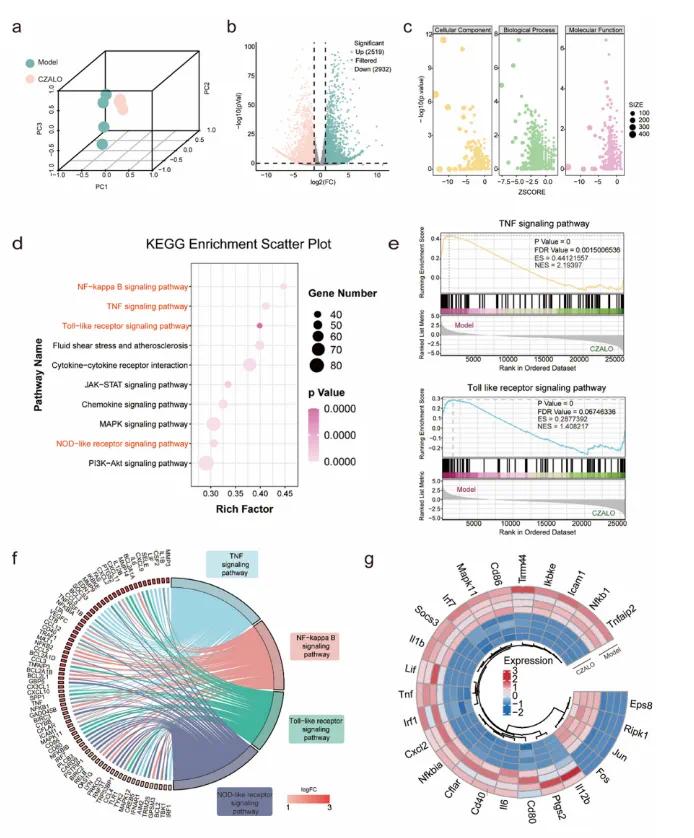
图4 不同处理后Raw264.7细胞的高通量转录组测序。(a)模型组与CZALO组差异表达基因(DEG)的主成分分析(PCA);(b)火山图展示与模型组相比,CZALO处理的Raw264.7中上调(绿色)和下调(粉红色)的基因(通过RNA-Seq分析);(c)不同处理后Raw264.7中DEG的基因本体(GO)标注分析结果;(d)与模型组相比,CZALO处理的Raw264.7细胞中DEGs的KEGG途径分析;(e)基因集富集分析(GSEA)图展示模型组和CZALO治疗组之间TNF信号通路(上)和Toll样受体信号通路(下)中基因的富集;(f)圆形图展示DEG和关键信号通路之间的相互作用;(g)圆形热图表示与TNF信号通路和Toll样受体信号通路相关的DEG的表达水平
(3)CZALO介导的内皮细胞衰老缓解
在促炎性巨噬细胞中过表达的NO合酶可以选择性地催化L-Arg产生NO,NO逐渐扩散到内皮细胞中,在内皮细胞中通过调节SASP因子的分泌、改善溶酶体功能、破坏细胞周期停滞和减少衰老内皮细胞中的DNA损伤来发挥抗衰老功能(图5a)。采用与HUVECs和Raw 264.7共培养的transwell系统来模拟动脉粥样硬化微环境。用荧光染料DAF-FMDA检测HUVECs内NO水平。如预期的,与L和CZL组相比,CZAL和CZALO组在HUVEC中表现出更高的荧光强度,证实用CZALO处理后HUVEC中的NO水平显著增加(图5 b)。当分别用L、CZL、CZAL和CZALO处理HUVEC时,炎性细胞因子的表达被显著抑制(图5c-f)。同时,进行了Western印迹实验,以评估IL-6和IL-8在HUVECs中的表达水平,NO处理导致IL-6和IL-8的蛋白质表达显著降低(图5l)。上述实验表明,由CZALO产生的NO显著降低SASP水平,包括炎性细胞因子和ROS。NO治疗组(CZAL组和CZALO组)降低HUVECs中SA-β-Gal的水平(图5g)。此外,生物透射电子显微镜(bio-TEM)观察显示CZALO处理可以减少HUVEC中脂褐素的积累(图5 h)。CLSM图像显示在衰老细胞中γ-H2 AX荧光强度显著增加。然而,在CZALO组中γ-H2 AX的荧光强度显著降低(图5i),证实CZALO处理可以有效地保护HUVEC免受DNA损伤。为了进一步确认CZALO的抗衰老性能,使用免疫荧光染色评估了与衰老正相关的细胞周期停滞标志物p16和p53的表达水平。免疫荧光图像显示CZALO处理后p16和p53的荧光强度显著降低,表明基于CZALO的NO处理可以显著降低p16和p53的表达(图5 j和k)。Western印迹结果与之前结果一致,表明CZALO处理后H2 O2组中γ-H2 AX、p16和p53的蛋白表达显著降低(图51)。总的来说,从CZALO释放的NO显著降低γ-H2 AX、p16和p53的表达水平,从而促进DNA修复并减轻细胞周期停滞。
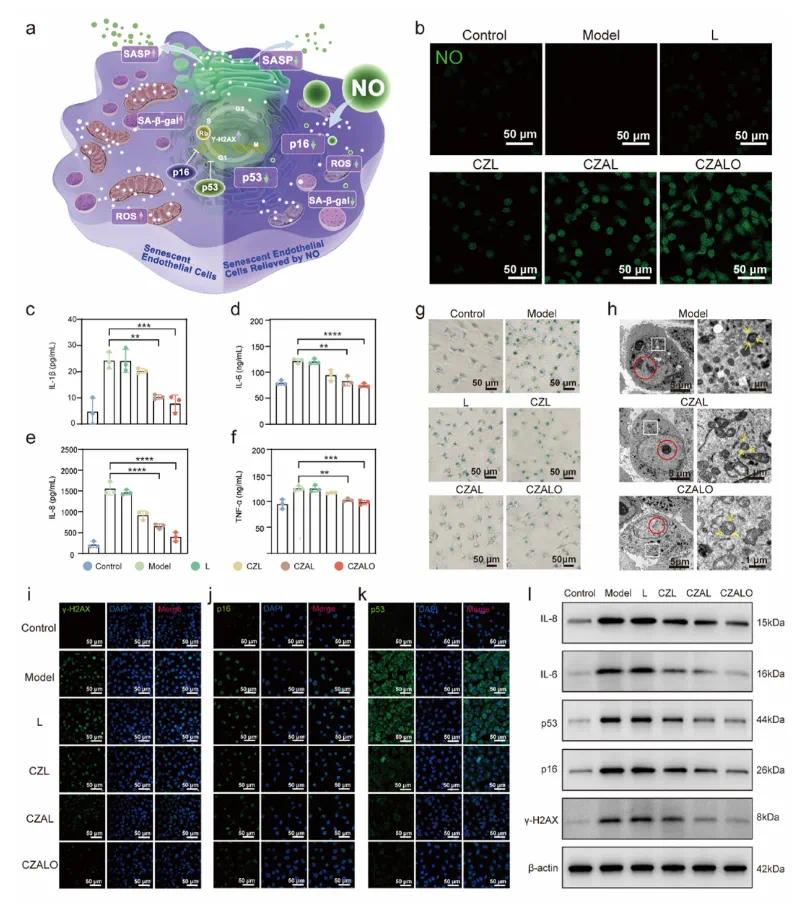
图5 内皮细胞内CZALO介导的衰老减缓。(a)示意图显示CZALO选择性释放NO以缓解内皮细胞衰老;(b)不同制剂处理后人脐静脉内皮细胞(HUVECs)细胞内NO含量的变化;(c-f)不同处理后(c)IL-1β、(d)IL-6、(e)IL-8和(f)TNF-α在H₂O₂诱导的衰老HUVEC中的分泌水平;(g)衰老和NO气体处理的HUVEC中SA-β-gal染色的代表性图像;(h)不同处理后HUVECs的生物透射电镜图像;(i)DNA损伤标记物γ-H2AX的代表性免疫荧光图像;(j,k)细胞周期停滞标志物的代表性免疫荧光图像,包括(j)p16和(k)p53;(l)Western blotting检测不同处理组HUVEC中IL-8、IL-6、p53、p16和γ-H2AX的表达水平
高通量转录组学分析,其揭示了H2 O2刺激的HUVEC(模型组)和CZALO处理的HUVEC(实验组)之间的显著DEG(图6a)。如图6 b所示,火山图证明,在CZALO处理后,202个基因显著上调,而391个基因显著下调。为了更深入地了解CZALO介导的DEG的生物学功能,进行了GO分析以探索生物学过程、细胞组分和分子功能的变化(图6c)。此外,KEGG途径气泡图显示在CZALO处理期间,诸如NF-κ B信号传导、AGE-β信号传导、MAPK信号传导和TGF-β信号传导的途径显著富集(图6d)。GSEA分析进一步证实,与对照组相比,与这些信号传导途径相关的DEG在CZALO处理组中显著富集(图6 e)。圆形图进一步证实了这些信号传导途径与衰老相关基因的密切关联,表明CZALO诱导的NO潜在地具有良性抗衰老作用(图6 f)。进一步分析了这三种途径中DEG的表达水平,发现在CZALO处理的HUVEC中,DEG如白细胞介素-1 α(IL-1α)、转化生长因子β2(TGFβ2)、叉头盒O 1(FOXO 1)和超氧化物歧化酶2(SOD 2)的锡永水平显著下调,这与先前的发现一致(图6 g)。总之,CZALO产生的NO可有效调节SASP因子的分泌,增强溶酶体功能,缓解细胞周期停滞,并减少衰老内皮细胞的DNA损伤,从而发挥强效抗衰老作用。
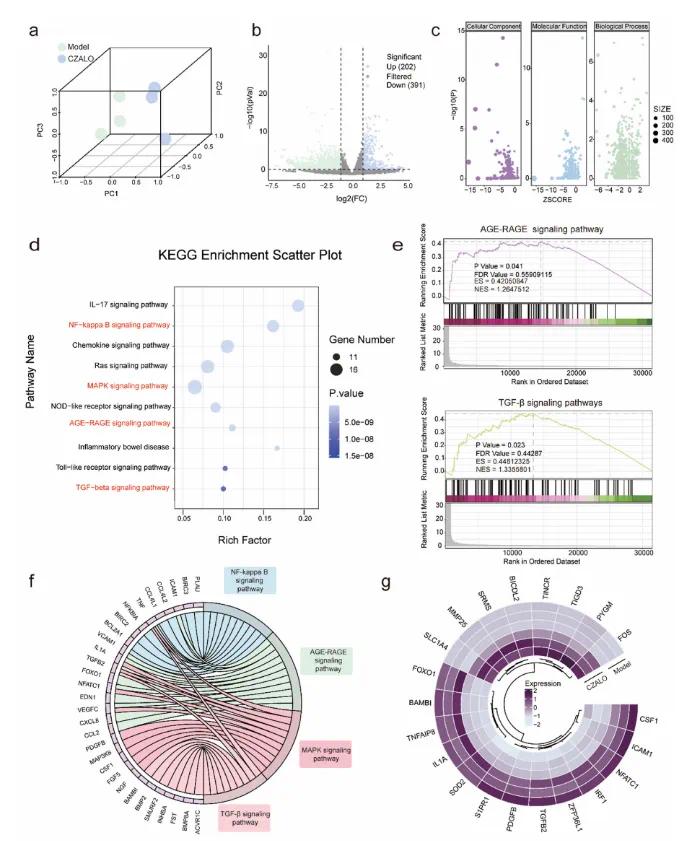
图6 不同处理的HUVEC的高通量转录组测序。(a)主成分分析(PCA)显示模型组和CZALO组之间的差异表达基因(DEGs);(b)火山图描绘了用CZALO处理的HUVEC与模型组相比的上调(蓝色)和下调(绿色)基因(使用RNA-Seq进行分析);(c)不同处理下HUVEC中DEGs的基因本体(GO)注释分析;(d)与模型组相比,CZALO处理的HUVEC中DEGs的KEGG通路分析;(e)基因集富集分析(GSEA)图显示模型组和CZALO治疗组之间AGE-RAGE通路(上图)和TGF-β信号通路(下图)中的基因富集;(f)圆形图显示DEG和关键信号通路之间的相互作用;(g)圆形热图显示与AGE-RAGE、NF-κB和TGF-β信号通路相关的DEG表达水平
(4)CZALO对ApoE−/−小鼠动脉粥样硬化的治疗作用及机制
离体荧光图像显示,CZALO组的胸主动脉和主动脉根部的荧光强度明显强于CZAL组,表明CZALO由于OPN使能的主动靶向而有效地在斑块内蓄积(图7a和b)。为了进一步研究CZALO的体内抗动脉粥样硬化功效,给ApoE−/−小鼠喂食了8周的高脂饮食,以诱导动脉粥样硬化斑块,如图7 c所示。然后从动脉粥样硬化小鼠中取出主动脉,并纵向切开以暴露动脉内膜。根据观察斑块的ORO染色(图7 d和e),与生理盐水组(32.59%)、L组(26.44%)、CZL组(23.17%)和CZAL组(16.55%)相比,CZALO组显示出最低的平均斑块面积百分比(13.72%)。同样,为了进一步研究抗动脉粥样硬化的功效和机制,采集了主动脉弓的冷冻切片和石蜡切片。冷冻切片用ORO染色,结果显示ORO染色面积从14.5%减少到5.8%(图7 f和g),表明CZALO显著减少了斑块面积。这些发现证实了CZALO在纵向和横向都能显著减少斑块面积。H&E染色表明,与盐水组相比,接受CZALO治疗的动脉粥样硬化小鼠表现出坏死核心从42.31%减少至30.25%(图7 h和i)。此外,平滑肌细胞的迁移、增殖和胶原的生成可能加剧斑块的形成和血管狭窄,Masson染色(图7 j和k)证明CZALO有效减少血管平滑肌细胞浸润和减少斑块中胶原积聚,这有利于稳定动脉粥样硬化斑块。
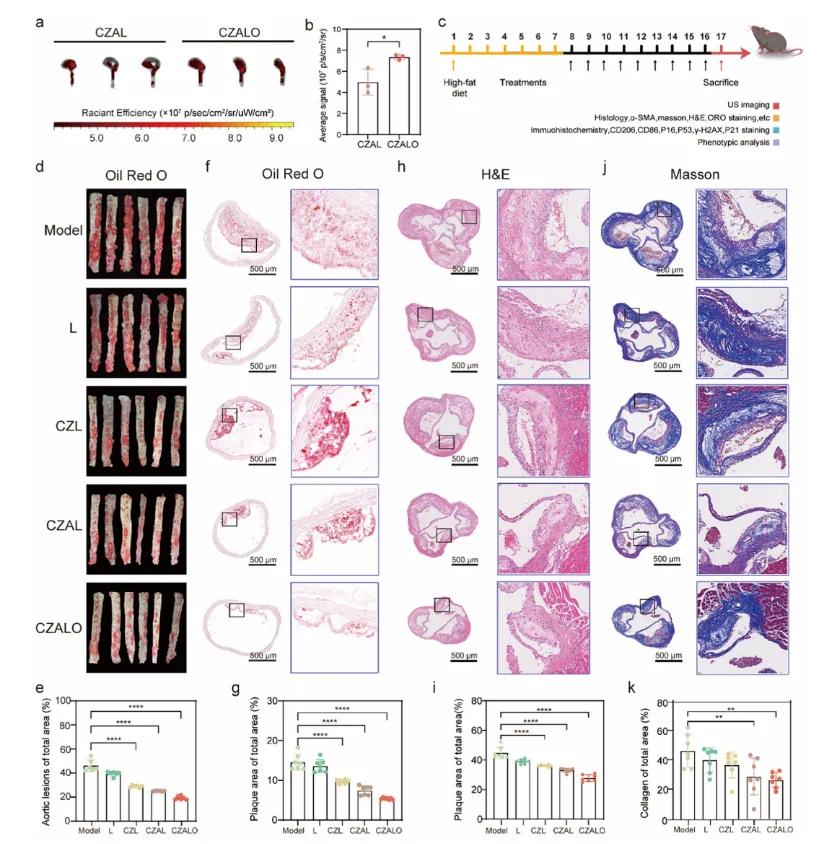
图7 CZALO在ApoE⁻/⁻小鼠中的抗动脉粥样硬化疗效。(a,b)动脉粥样硬化小鼠的心脏和主动脉的离体荧光图像(a)及相应的定量分析(b);(c)治疗方案示意图;(d,e)不同处理后动脉粥样硬化小鼠主动脉的油红O(ORO)染色代表性图像(d)及定量分析(e);(f,g)主动脉弓切片的ORO染色代表性图像(f)及主动脉窦的相应定量分析(g);(h-k)主动脉根部切片的代表性免疫组织化学图像及定量分析,包括(h,i)苏木精-伊红(H&E)染色和(j,k)Masson三色染色
受上述结果的鼓舞,研究者对CZALO在体内对抗动脉粥样硬化斑块的机制进行了深入的探索。首先研究了CZALO诱导巨噬细胞极化和重组免疫微环境以发挥抗炎作用的潜力。如图8a所示,使用F4/80、CD 86和CD 206分别标记巨噬细胞、M1巨噬细胞和M2巨噬细胞进行多重免疫荧光染色。生理盐水组的动脉炎小鼠在其主要动脉中表现出高百分比的CD 86+巨噬细胞(M1型)和低百分比的CD 206+巨噬细胞(M2型)。CZALO治疗明显减少了CD 86+巨噬细胞,并增加了CD 206+巨噬细胞,证实CZALO促进M1(炎症)巨噬细胞向M2(抗炎)巨噬细胞极化。此外,CZALO通过降低包括TNF-α和IFN-γ在内的炎性因子的血清水平而显示出有效的抗动脉粥样硬化功能,如图8b-e所示。上述结果表明,CZALO通过促进巨噬细胞从炎性M1型向抗炎性M2型的极化并降低炎性因子的血清水平来对抗体内动脉粥样硬化斑块。根据γ-H2 AX免疫荧光染色,在生理盐水组中观察到显著的亮黄色荧光信号,而CZALO组显示斑块内荧光信号显著降低(图8 f和j)。接下来,使用细胞衰老的生物标志物(包括p16、p21和p53)进行免疫荧光染色,以评价CZALO的抗衰老效果。根据实验结果,在盐水组中观察到p16的显著红色荧光信号,而在CZALO处理组中斑块内的荧光信号显著降低(图8 g和k)。类似地,在p21和p53免疫荧光染色图像中,生理盐水组显示出强的荧光信号,而CZALO组中的荧光信号逐渐减弱(图8h-1、i和m)。上述结果表明,CZALO通过下调衰老标志物γ-H2 AX、p21、p16和p53在动脉粥样硬化的治疗中发挥抗衰老作用。综上所述,体内实验证明CZALO具有协同抗炎和抗衰老作用,从而有效治疗动脉粥样硬化。
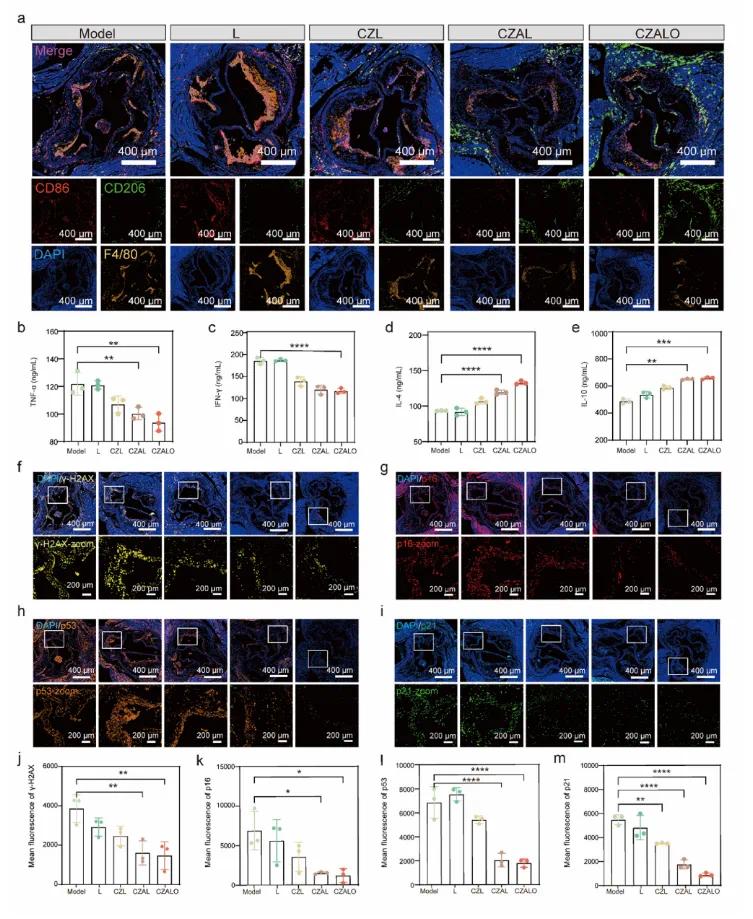
图8 CZALO在ApoE⁻/⁻小鼠中的抗动脉粥样硬化机制。(a)ApoE⁻/⁻小鼠经不同处理后的主动脉根部切片的代表性免疫荧光图像(用CD86、CD206和F4/80抗体染色);(b-e)血清中炎症因子水平,包括(b)TNF-α、(c)IFN-γ、(d)IL-4和(e)IL-10;(f-m)主动脉根切片的代表性免疫荧光图像及定量分析,包括抗(f,j)γ-H2AX、(g,k)p16、(h,l)p53和(i,m)p21抗体染色
本研究设计和工程化了一种创新的CZALO纳米脂质体,用于在有效的抗动脉粥样硬化治疗中特异性地调节血管微环境稳态。首先,CZALO选择性地靶向动脉粥样硬化部位并通过OPN介导的内吞作用进入巨噬细胞,随后释放包封的CZ纳米颗粒(NP)和L-Arg。CZ NP模拟多种天然抗氧化酶,如SOD、POD、CAT和GPx,以有效地抑制ROS,从而显著抑制胆固醇摄取并促进巨噬细胞表型转化,这提供了抗氧化和抗炎作用作为第一益处。同时,L-Arg在巨噬细胞内被过氧化的NOS催化产生NO气体,NO气体选择性地在原位释放,然后扩散到内皮细胞中。该过程调节SASP因子分泌,增强溶酶体功能,破坏细胞周期停滞,并减少衰老内皮细胞中的DNA损伤,从而实现抗衰老作用作为第二个益处。抗氧化/抗炎和抗衰老的组合作用协同调节动脉粥样硬化微环境,降低动脉粥样硬化负担,在体外和体内均具有令人满意的生物安全性。这项工作强调了CZALO通过利用其选择性抗氧化特性和抗衰老机制同时靶向和治疗动脉粥样硬化的独特能力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

