
研究背景:
肿瘤免疫治疗通过激活机体免疫系统识别并攻击肿瘤细胞,具有更高的特异性和安全性,且能显著预防肿瘤转移和复发。然而,肿瘤相关抗原的有效释放是免疫治疗的关键,而传统肿瘤疫苗因制备复杂且免疫效果不足,限制了其应用。
光疗等特定肿瘤治疗方法可诱导肿瘤细胞发生免疫原性死亡,将其转变为“原位”癌症疫苗。金属离子在生物活动中发挥重要作用,其中细胞焦亡、铁死亡和铜死亡可释放肿瘤相关抗原,激活抗肿瘤免疫。然而,金属离子直接递送效率低且存在脱靶毒性。基于金属离子的纳米制剂可通过肿瘤微环境中的酸性响应性释放,增强抗肿瘤免疫效果。尽管如此,单一金属过氧化物的治疗效果有限,且合成双金属过氧化物的过程复杂,开发更多类型和合成路线的纳米复合材料对肿瘤治疗具有重要意义。

针对上述问题,中科院长春应化所林君通过一步共生法合成了透明质酸修饰的锌铜双金属过氧化物(ZCPO@HA)纳米颗粒,所得到的纳米颗粒展现出了诱导肿瘤细胞铁死亡和铜死亡的能力,同时还能激活环鸟苷单磷酸-腺苷单磷酸合成酶-干扰素基因刺激因子(cGAS-STING)通路,并与免疫检查点抑制剂(抗PD-1)协同增强免疫治疗效果。当ZCPO@HA纳米颗粒被肿瘤细胞特异性识别并内吞,它们能释放大量的Zn2+和Cu2+,并在弱酸性环境中产生过氧化氢(H2O2)。由铁死亡和铜死亡诱导的免疫原性细胞死亡(ICD)能够释放大量损伤相关分子模式(DAMPs),有效刺激抗肿瘤适应性免疫反应。此外,过量的Zn2+和大量的・OH会造成线粒体损伤,导致大量线粒体脱氧核糖核酸(mtDNA)的释放,显著激活cGAS-STING通路,并促进抗肿瘤天然免疫反应。简而言之,通过简便的一步共生法制备的锌铜双金属过氧化物纳米颗粒具有同时激活天然免疫和适应性免疫反应以损伤肿瘤的强大能力,实现了显著的抗肿瘤免疫治疗效果。该文章于2025年4月3日以《One-Step Symbiosis of Bimetallic Peroxides Nanoparticles to Induce Ferroptosis/Cuproptosis and Activate cGAS-STING Pathway for Enhanced Tumor Immunotherapy》为题发表于《Advanced Materials》(DOI:10.1002/adma.202500337)。
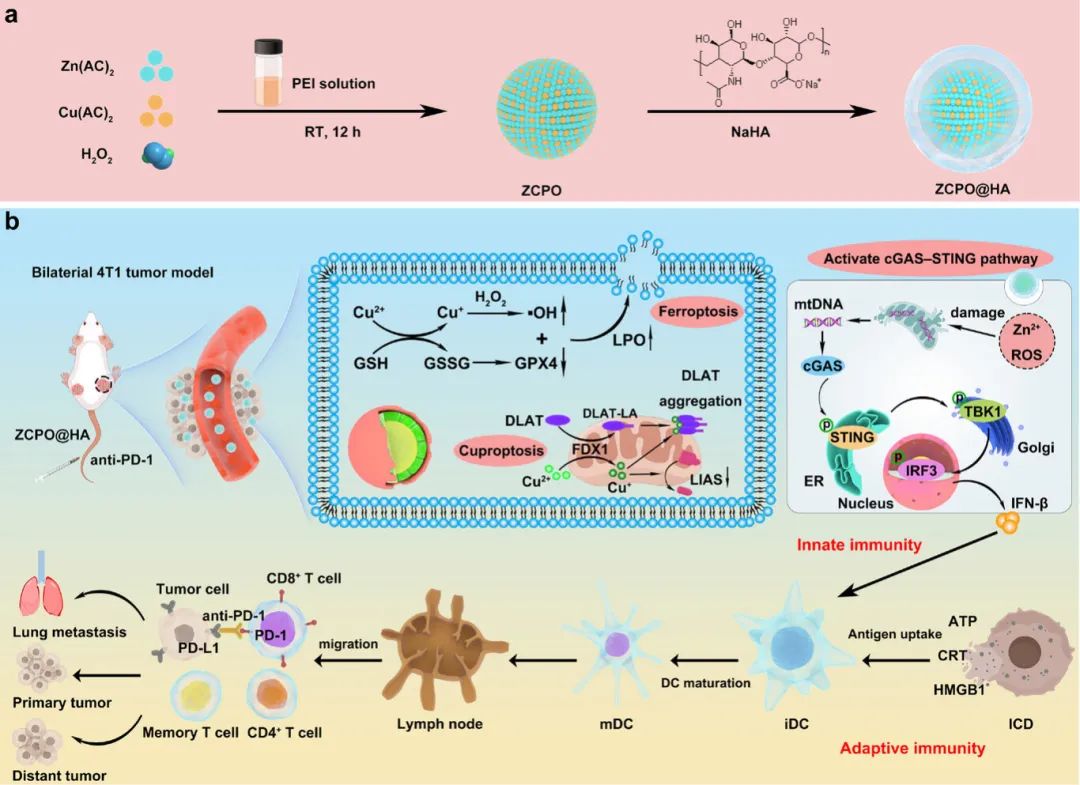
研究示意图
(1)ZCPO@HA纳米颗粒的构建与表征
由图1 a、b的透射电子显微镜(TEM)图像所示,与过氧化锌(ZnO2)纳米颗粒(约40 nm)相比,锌铜双金属过氧化物(ZCPO)纳米颗粒尺寸更大(约60 nm),且更趋向于球形。从高角度环形暗场扫描透射电子显微镜(HAADF-STEM)图像和元素映射可看出,ZCPO纳米颗粒中锌(Zn)、铜(Cu)、氧(O)、氮(N)和碳(C)分布均匀(图 1c).不同mZn/mCu比例的产物的X射线衍射(XRD)和X射线光电子能谱(XPS)图谱如图 1d、e所示。随着mZn/mCu比例降低,(200)晶面与(111)晶面的衍射峰强度比(I (200)/I (111))下降,锌与铜的原子含量比(AZn/ACu)也相应降低(图 1f)。随后,通过用透明质酸钠(NaHA)修饰获得透明质酸修饰的ZCPO(ZCPO@HA)纳米颗粒,对纳米颗粒进行透明质酸(HA)表面修饰不仅能提高其分散性和生物相容性,还赋予其靶向肿瘤细胞的能力。如图 1g所示,铜元素主要以一价和二价状态存在于ZCPO@HA纳米颗粒中,分别占比47%和53%。此外,在氧1s的XPS光谱中,两个分别归属于C═O(531.9 eV)和O-O(533.5 eV)的峰表明HA和过氧基团的存在(图 1h)。图 1i中HA修饰前后的热重分析(TGA)曲线显示,ZCPO@HA纳米颗粒表面HA含量为6.0%(w/w)。这些结果表明通过上述方法成功制备了ZCPO@HA纳米颗粒。
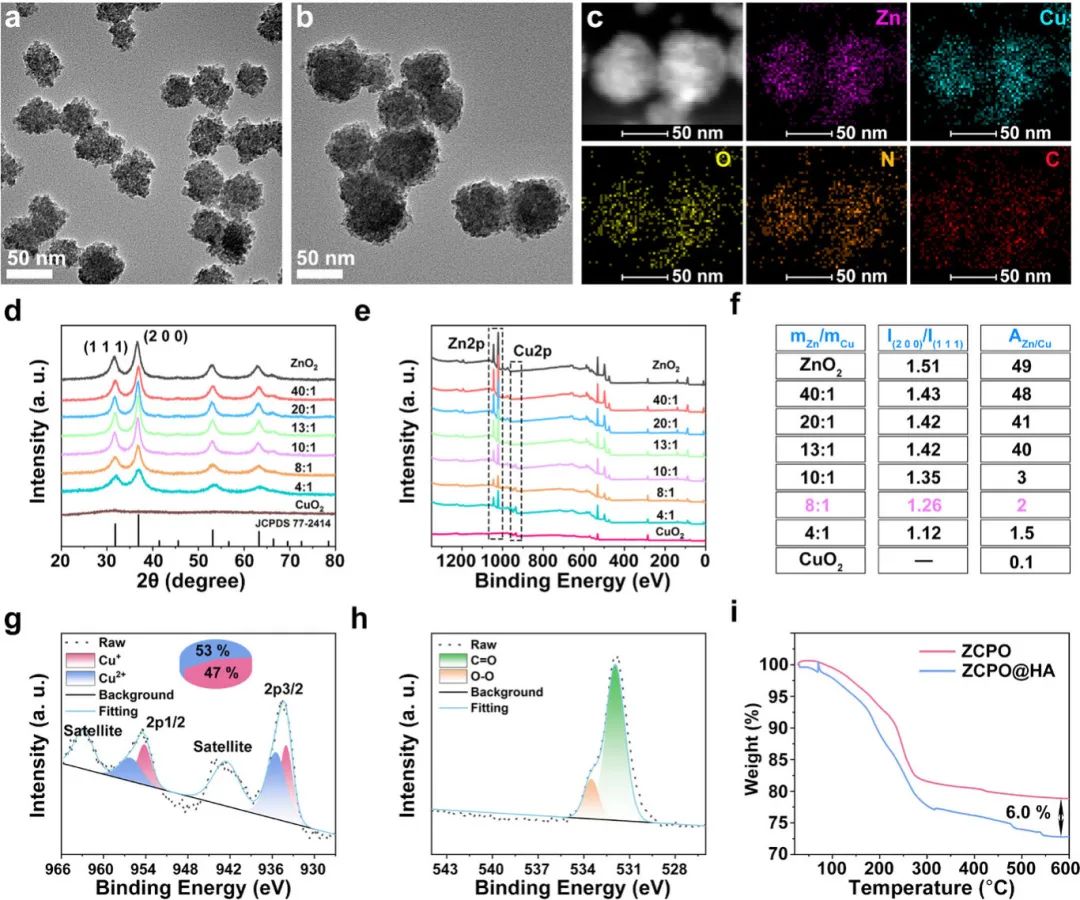
图1(a)过氧化锌(ZnO₂)纳米颗粒和(b)锌铜双金属过氧化物(ZCPO)纳米颗粒的TEM图像;(c)ZCPO纳米颗粒的HAADF-STEM图像及元素映射;(d)ZnO₂纳米颗粒、不同锌铜质量比的ZCPO纳米颗粒及CuO₂纳米颗粒的XRD图谱和(e)全XPS图谱;(f)(200)晶面与(110)晶面的衍射峰强度比及锌铜原子比的表格;(g)ZCPO@HA纳米颗粒的铜2p XPS光谱和(h)氧1s XPS光谱;(i)不同样品的TGA曲线
(2)ZCPO@HA纳米颗粒的分解能力
通过ICP-OES测定ZCPO@HA纳米颗粒在不同pH值溶液中Zn²⁺和Cu²⁺的释放行为。结果表明,Zn²⁺和Cu²⁺在弱酸性溶液(pH=5.5)中释放显著且呈时间依赖性,而在中性溶液(pH=7.4)中几乎无释放。与ZCPO纳米颗粒相比,ZCPO@HA纳米颗粒因HA包覆,释放量较少,显示出更好的稳定性(图2a、b)。此外,ZCPO@HA纳米颗粒在弱酸性溶液(pH=6.5)中可逐渐产生H₂O₂,且在pH=5.5时H₂O₂释放量显著增加(图2c)。随着ZCPO@HA纳米颗粒浓度增加,GSH含量降低,表明其可有效消耗GSH(图2e)。ZCPO@HA纳米颗粒释放的Cu²⁺可催化H₂O₂生成・OH,TMB在650 nm处的吸光度增强,OPD的吸光度随反应时间延长而增强(图2g、h)。ESR光谱检测到在弱酸性溶液(pH=5.5)中处理的ZCPO@HA纳米颗粒呈现出最明显的・OH信号(图2i)。TEM图像显示,ZCPO@HA纳米颗粒在酸性溶液中逐渐崩解,12小时后几乎完全分解,而在中性溶液中无明显变化,进一步证明其在生理环境中的稳定性(图2j)。
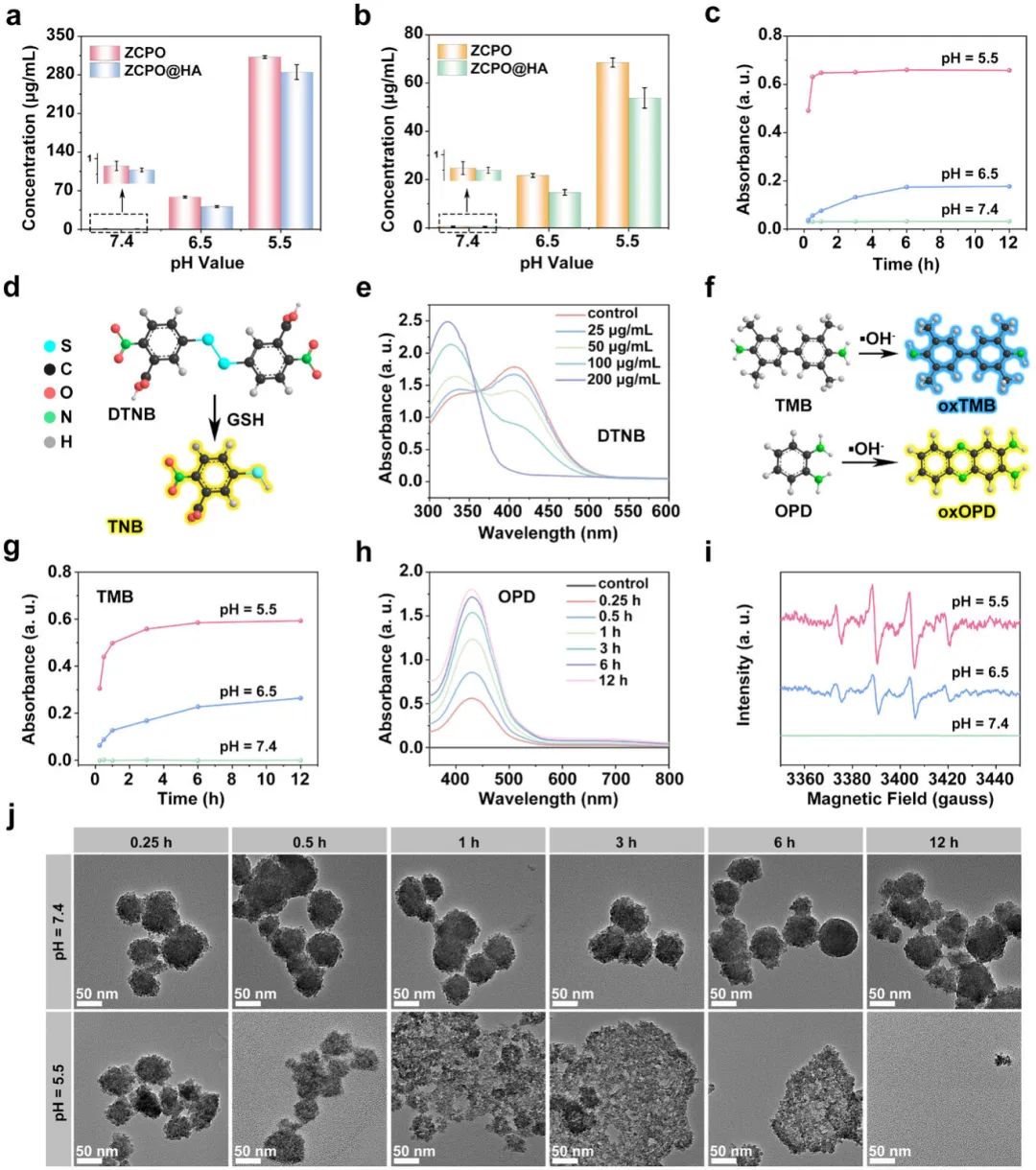
图2(a)不同样品在不同pH值溶液中锌离子(Zn²⁺)的释放情况;(b)不同样品在不同pH值溶液中铜离子(Cu²⁺)的释放情况;(c)ZCPO@HA与硫酸钛(Ti(SO₄)₂)溶液混合后在410 nm处吸光度随时间变化;(d)DTNB与谷胱甘肽(GSH)反应机制;(e)不同浓度ZCPO@HA消耗GSH的能力;(f)TMB和OPD检测羟基自由基(・OH)机制;(g)ZCPO@HA与TMB溶液混合后在650 nm处吸光度随时间变化;(h)弱酸性溶液(pH=5.5)中处理不同时间后,ZCPO@HA与OPD混合的紫外-可见吸收光谱;(i)不同条件下DMPO与ZCPO@HA混合后的ESR光谱;(j)不同处理下ZCPO@HA随时间变化的TEM图像
(3)ZCPO@HA纳米颗粒诱导铁死亡与铜死亡
利用小鼠乳腺癌(4T1)细胞评估了ZCPO@HA纳米颗粒的细胞摄取情况。如图 3a、b所示,随着ZCPO@HA纳米颗粒与4T1细胞共培养时间的增加,细胞内Zn2+和Cu2+的含量逐渐上升。然而,经HA预处理后,细胞内的金属离子含量显著降低,这表明HA修饰使ZCPO@HA纳米颗粒能够靶向肿瘤细胞,并促进细胞吞噬。同时,与ZnO2和CuO2相比,ZCPO@HA纳米颗粒对4T1细胞表现出更显著的细胞毒性(图 3c)。接下来,探究了 ZCPO@HA纳米颗粒杀伤肿瘤细胞的具体机制,如图 3d、e所示,由于大量Cu2+的释放以及H2O2自补偿效应,ZCPO@HA纳米颗粒比ZnO2和CuO2纳米颗粒具有更强的谷胱甘肽(GSH)消耗能力。相应地,根据谷胱甘肽过氧化物酶4(GPX4)的荧光染色图像以及蛋白质免疫印迹(WB)条带的灰度值结果(图 3f、g),ZCPO@HA纳米颗粒有效抑制了GPX4的表达。在所有实验组中,经ZCPO@HA纳米颗粒处理后的4T1细胞内脂质过氧化物(LPO)含量最高,表现出最明显的铁死亡效应(图 3h)。细胞内Cu2+的积累会影响线粒体中的三羧酸(TCA)循环过程,导致二氢硫辛酸S-乙酰转移酶(DLAT)聚集以及铁硫蛋白(如脂酰合酶(LIAS))减少,最终引发铜死亡(图 3i)。如图 3j所示,与不同实验组相比,在与含有相同浓度Cu2+的CuO2纳米颗粒和ZCPO@HA纳米颗粒共培养后,WB条带的灰度结果表明铁氧还蛋白-1(FDX1)的表达下调。同时,DLAT出现明显聚集,LIAS的表达也受到显著抑制。DLAT低聚物的荧光成像进一步证实了这一现象(图 3k)。因此,ZCPO@HA纳米颗粒可通过在细胞内响应性释放大量Cu2+诱导细胞发生铜死亡。
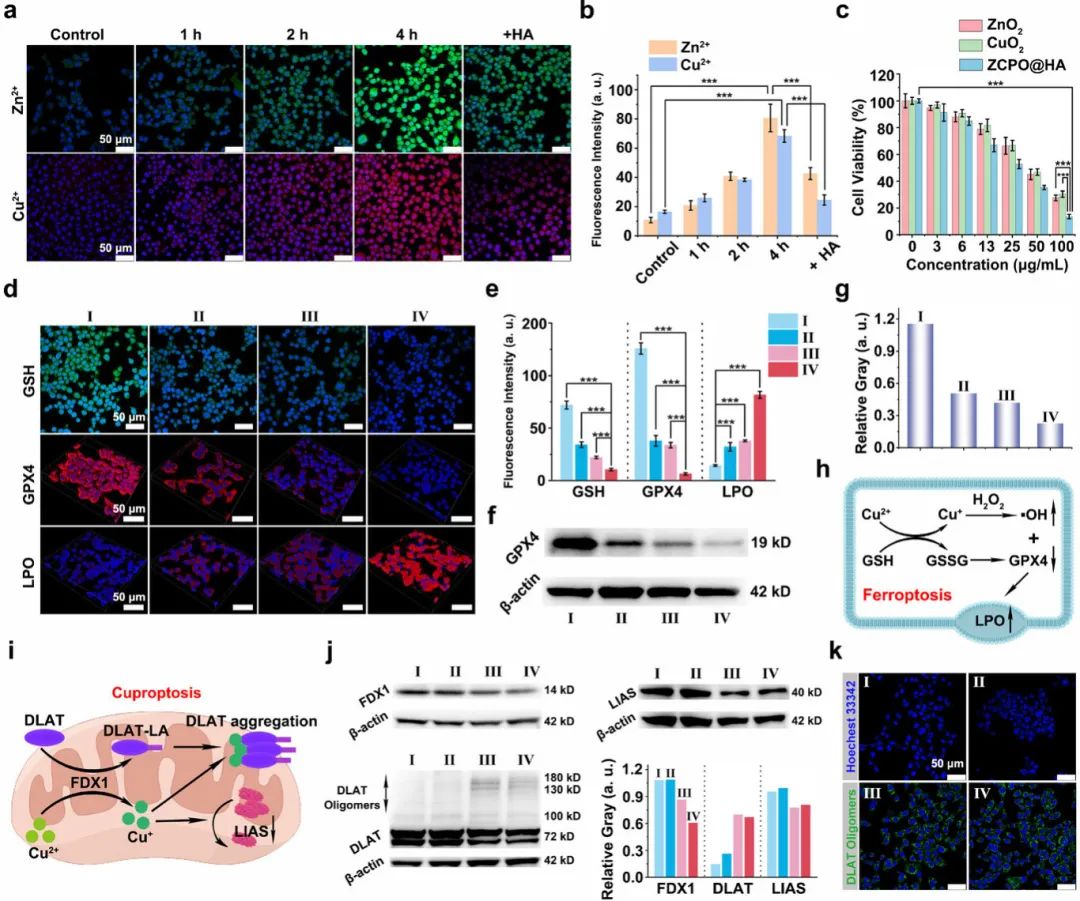
图3(a)4T1细胞与ZCPO@HA孵育不同时间(对照组、1 h、2 h、4 h及4 h加额外HA)的Zn²⁺和Cu²⁺荧光图像;(b)荧光强度定量统计;(c)不同条件下4T1细胞的细胞毒性;(d)不同条件下孵育的4T1细胞的各类荧光图像;(e)荧光强度(I:对照组;II:ZnO₂;III:CuO₂;IV:ZCPO@HA);(f)不同样品对4T1细胞中GPX4表达影响的WB分析;(g)条带相对灰度值;(h)ZCPO@HA介导的铁死亡分子机制;(i)ZCPO@HA介导的铜死亡分子机制;(j)对FDX1、DLAT和LIAS表达的WB分析及条带相对灰度值;(k)不同条件下孵育的4T1细胞中DLAT低聚物的荧光图像
(4)ZCPO@HA纳米颗粒诱导线粒体损伤激活cGAS-STING信号通路
ZCPO@HA纳米颗粒处理4T1细胞后,细胞结构逐渐破坏,线粒体损伤加剧,6小时后细胞几乎完全碎片化(图4a)。实时PCR检测显示,ZCPO@HA处理组的4T1细胞中线粒体损伤最严重,mtDNA释放量最高(图4b)。WB分析显示,ZCPO@HA处理组中pTBK1和pIRF3表达显著,表明cGAS-STING信号通路被激活(图4c、d)。此外,ZCPO@HA处理的4T1细胞中CRT暴露量最大,HMGB1几乎全部迁移至细胞外,ATP分泌水平最高(图4e、f),表明其可诱导免疫原性细胞死亡(ICD)。Transwell模型实验表明,ZCPO@HA处理组中36.4%的DC2.4细胞成熟,显著高于其他对照组(图4g、h)。ELISA检测显示,ZCPO@HA处理组中TNF-α和IL-6分泌量约为对照组的五倍(图4i、j)。这些结果表明,ZCPO@HA纳米颗粒可诱导肿瘤细胞发生铁死亡和铜死亡,激活cGAS-STING信号通路,引发天然免疫和适应性抗肿瘤免疫反应。
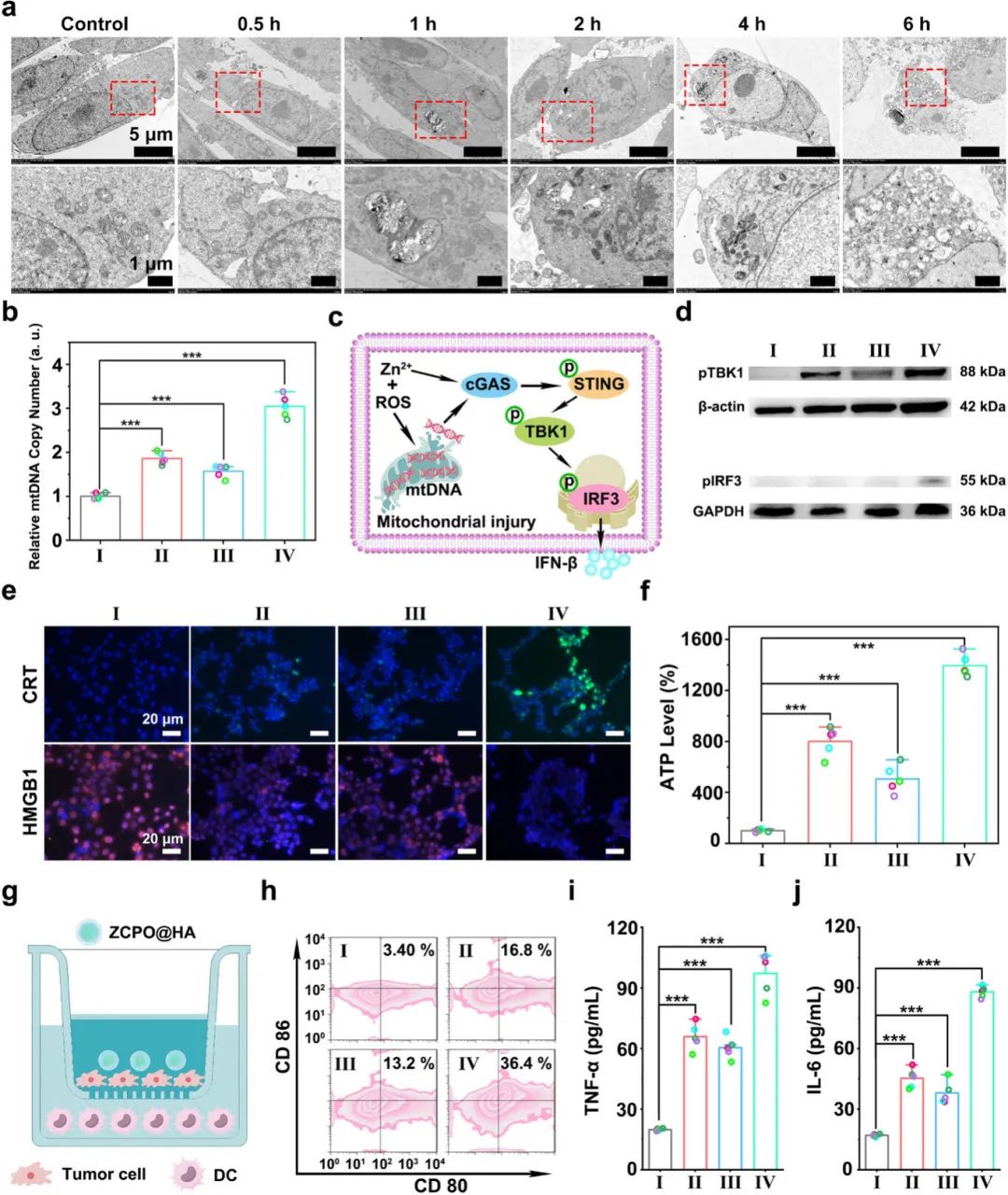
图4(a)经ZCPO@HA处理不同时间的4T1细胞的Bio-TEM图像;(b)不同处理后4T1细胞中mtDNA的定量统计(I:对照组;II:ZnO₂;III:CuO₂;IV:ZCPO@HA)(n=5);(c)ZCPO@HA介导的cGAS-STING通路激活的分子机制;(d)pTBK1和pIRF3表达的WB分析;(e)4T1细胞中CRT和HMGB1的荧光图像;(f)4T1细胞的细胞外ATP水平;(g)Transwell模型示意图;(h)通过流式细胞术分析CD80/CD86表达检测DC成熟度;(i)TNF-α和(j)IL-6的ELISA结果
(5)ZCPO@HA纳米颗粒对肿瘤组织的杀伤效果
在小鼠双侧4T1肿瘤模型中,ZCPO@HA纳米颗粒联合免疫检查点抑制剂(抗PD-1)对肿瘤生长、抗肿瘤免疫反应及肿瘤转移的抑制效果进行了验证(图5a)。结果显示,ZCPO@HA纳米颗粒治疗后原发肿瘤生长显著受抑(图5b、d、f),与抗PD-1联合使用时,抑制效果更为显著。H&E染色和TUNEL染色表明,ZCPO@HA纳米颗粒与抗PD-1联合治疗可有效破坏肿瘤组织(图5h)。免疫荧光染色显示,ZCPO@HA纳米颗粒诱导肿瘤组织发生铁死亡和铜死亡,且联合抗PD-1使用可增强免疫反应,促进CD8T细胞在肿瘤部位浸润和富集(图5c、e、g)。最终,联合治疗组中远处肿瘤生长受到最大程度抑制,部分远处肿瘤消失。
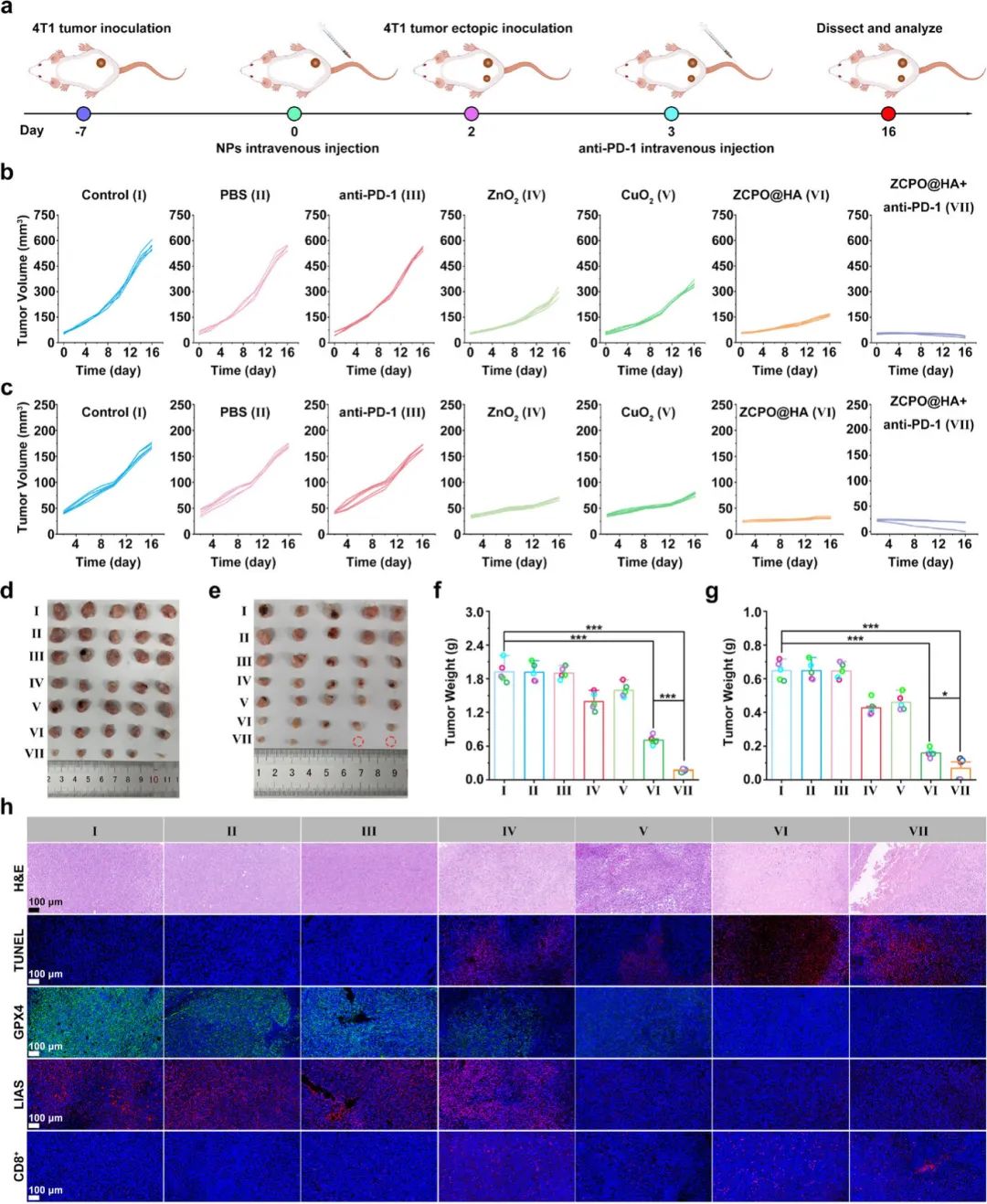
图5(a)ZCPO@HA纳米颗粒联合抗PD-1在双侧4T1肿瘤模型上进行免疫治疗的实验安排示意图;(b)不同处理后原发肿瘤的个体生长曲线;(c)不同处理后远处肿瘤的个体生长曲线;(d)不同处理后切除的原发肿瘤照片;(e)不同处理后切除的远处肿瘤照片;(f)不同处理后原发肿瘤的重量;(g)不同处理后远处肿瘤的重量;(h)不同处理后切除的原发肿瘤组织切片中H&E、TUNEL、GPX4、LIAS和CD8T细胞的免疫荧光图像
(6)ZCPO@HA纳米颗粒的抗肿瘤免疫反应
ZCPO@HA纳米颗粒处理后,脾脏和淋巴结中树突状细胞(DC)的成熟率更高(分别为28.2%和27.0%),与抗PD-1联合使用后,成熟率进一步提高至31.3%和31.9%(图6a)。ZCPO@HA纳米颗粒联合抗PD-1治疗后,血清中IFN-β、TNF-α、IL-6、IL-12和IFN-γ等细胞因子的分泌水平最高(图6b)。此外,该联合治疗组小鼠远处肿瘤部位CD4和CD8T细胞浸润以及脾脏中记忆T细胞浸润最为显著(图6c)。在肺转移模型中,ZCPO@HA纳米颗粒组和联合抗PD-1组肺部几乎无肿瘤细胞转移(图6d),且该联合治疗组小鼠存活时间最长,存活率在50天以上达到60%(图6e)。体内实验表明,ZCPO@HA纳米颗粒具有显著生物相容性,能诱导肿瘤细胞发生铁死亡和铜死亡,激活抗肿瘤适应性免疫反应,增强cGAS-STING信号通路介导的天然免疫反应,抑制肿瘤转移并显著延长生存期。
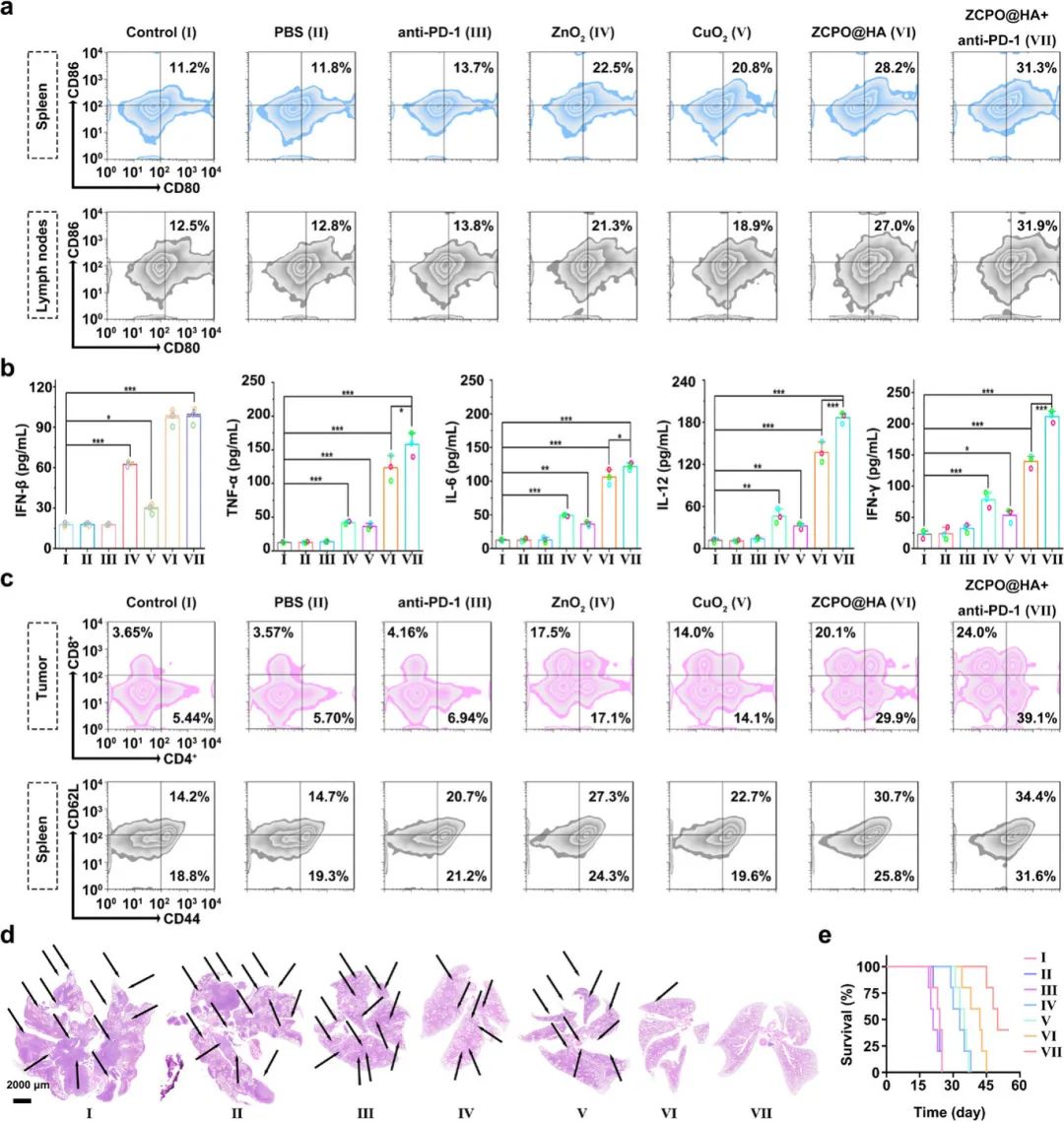
图6(a)不同处理后荷瘤小鼠脾脏和淋巴结中树突状细胞(DC)成熟度的流式细胞术分析;(b)不同处理后荷瘤小鼠血清中IFN-β、TNF-α、IL-6、IL-12和IFN-γ细胞因子的ELISA结果;(c)体内不同处理16天后,荷瘤小鼠远处肿瘤部位CD4/CD8T细胞及脾脏中记忆T细胞的流式细胞术分析;(d)不同处理后荷瘤小鼠肺组织切片的H&E染色结果;(e)不同处理后荷瘤小鼠的生存率
该团队成功合成了一种新型双金属过氧化物纳米颗粒,经透明质酸钠(NaHA)进一步修饰后,得到的ZCPO@HA纳米颗粒能够靶向肿瘤细胞,并在被肿瘤细胞内吞后释放大量的锌离子(Zn2+)、铜离子(Cu2+)和过氧化氢(H2O2),过量的锌离子(Zn2+)和生成的羟基自由基(・OH)诱导线粒体损伤,并释放大量线粒体脱氧核糖核酸(mtDNA),激活环鸟苷单磷酸-腺苷单磷酸合成酶-干扰素基因刺激因子(cGAS-STING)信号通路。 ZCPO@HA纳米颗粒不仅能引发肿瘤细胞的免疫原性细胞死亡(ICD)以诱导抗肿瘤适应性免疫反应,还能促使由cGAS-STING信号通路介导的天然免疫反应,在抗PD-1的辅助下,ZCPO@HA纳米颗粒展现出增强的长期抗肿瘤免疫治疗效果,并抑制肿瘤细胞的转移,为金属过氧化物纳米制剂在肿瘤免疫治疗领域的应用提供了新的思路和有价值的参考。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

