
膀胱癌作为泌尿系统常见的恶性肿瘤,其治疗面临着诸多挑战。尽管膀胱独特的解剖结构为腔内灌注治疗提供了便利,但传统的灌注化疗存在药物滞留时间短、肿瘤穿透性差等局限性,导致治疗效果不尽理想。
近年来,免疫治疗虽然在晚期癌症中显示出良好的应用前景,但其疗效高度依赖于肿瘤微环境(TME)的免疫表型。研究表明,STING信号通路在调节肿瘤免疫应答中发挥着双重作用:一方面,该通路的激活可以促进I型干扰素分泌,增强抗肿瘤免疫;另一方面,持续的STING激活可能促进肿瘤转移和耐药。这种复杂性使得如何精确调控STING通路成为提高膀胱癌治疗效果的关键科学问题。此外,传统纳米药物递送系统在膀胱灌注治疗中仍面临药物快速清除、肿瘤靶向性不足等挑战,亟需开发新型药物递送策略。

针对上述问题,深圳大学医学院华南医院泌尿外科吴松教授团队提出了一种创新的自驱动原位聚合纳米药物灌注系统。该系统的核心设计包括:1)利用多巴胺在膀胱内原位聚合形成聚多巴胺(PDA)纳米载体,实现药物的高效包载和可控释放;2)在纳米颗粒表面修饰脲酶,利用膀胱内尿素作为燃料产生自主驱动力,显著提高药物在膀胱黏膜的滞留和渗透;3)将STING激动剂cGAMP与Mn²⁺共载于纳米颗粒中,协同激活STING信号通路,促进树突状细胞成熟和T细胞活化。这种"原位聚合+自驱动"的复合设计具有多重优势:首先,膀胱内原位聚合避免了纳米颗粒在递送过程中的解离,确保药物稳定释放;其次,脲酶驱动的自主运动显著延长了药物在膀胱的作用时间;最后,STING通路的精准激活有效改善了肿瘤免疫微环境。该研究首次将原位聚合技术与微纳米机器人技术相结合,为膀胱癌的局部治疗提供了全新的解决方案,在提高药物递送效率的同时增强了抗肿瘤免疫应答,具有重要的临床转化价值(图1)。相关研究在2025年3月26日以“Self-Propelled In Situ Polymerized Nanoparticles Activating the STING Pathway for Enhanced Bladder Cancer Immunotherapy”为题发表于《Advanced Science》(DOI: 10.1002/advs.202502750)上。
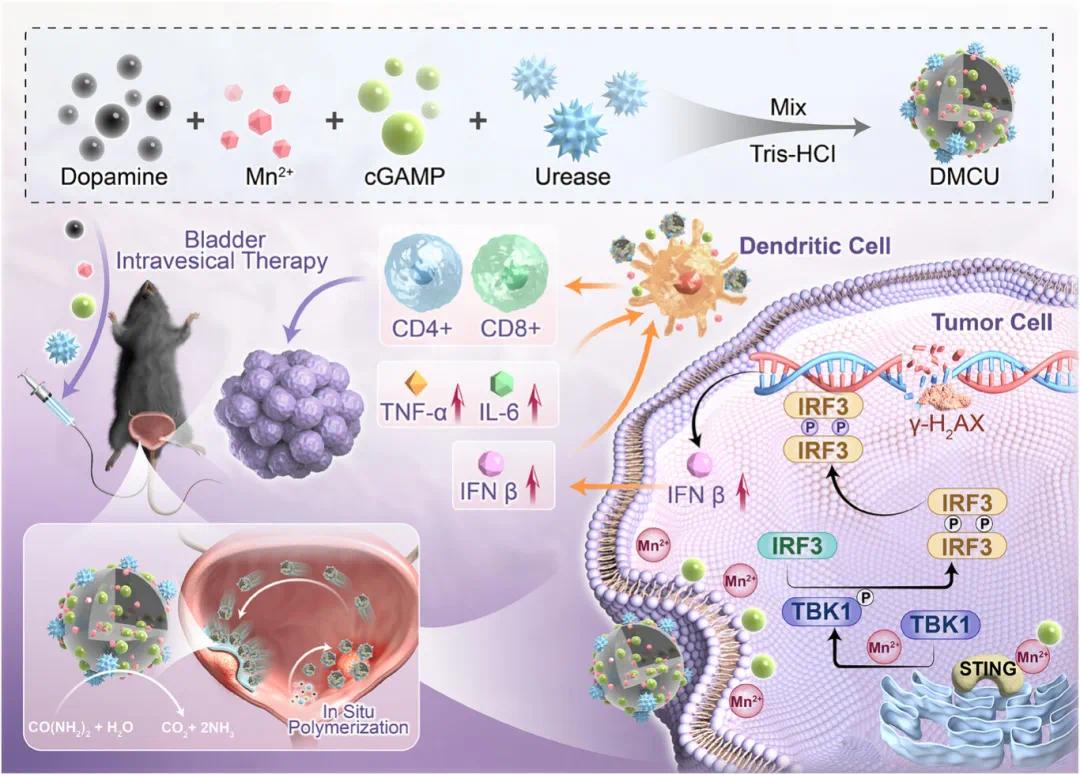
图1 原位聚合纳米药物的制备和纳米颗粒形成机制的示意图
(1)DMCU的制备与表征
体外首先合成了DMCU纳米颗粒并进行表征。采用一锅法在pH 8.5 Tris-HCl缓冲体系中聚合多巴胺、Mn²⁺和cGAMP形成DMC,随后加入脲酶搅拌制备DMCU(图2a)。DLS测定显示,DMCU平均粒径为193±27.6 nm(图2b),DA和DMC分别为276±43.5 nm(图2c)和206 nm(图2d)。各组zeta电位测定结果为:DA -12.12±0.71 mV,DM -16.09±0.25 mV,DMC -16.36±1.23 mV,DMCU -17.39±0.57 mV(图2e)。在pH 8.5 Tris-HCl体系中,DMCU平均zeta电位为15.79±2.75 mV(图2f)。稳定性实验表明,在人工尿液中48小时后DMCU粒径增至1909±132.34 nm,PBS中为1076±57.66 nm,双蒸水中保持稳定(745±17 nm)。紫外可见光谱显示DMCU在480 nm处具有特征吸收峰(图2g)。透射电镜证实所有纳米颗粒均呈不规则球形并具有粘附特性(图2g)。能谱分析验证了Mn²⁺、cGAMP和脲酶的成功负载(图2h)。聚合过程观察显示,DA组聚合较慢,而DM、DMC和DMCU组聚合速率逐渐加快。载药量测定显示DMCU对Mn²⁺的载药率为76.2%。释放实验表明,人工尿液中Mn²⁺在10小时达到释放峰值,而PBS中48小时后仍处于释放上升阶段(图2i)。

图2 a) 自推进原位聚合纳米药物的聚合过程示意图。b-d) 纳米药物 DA、DMC 和 DMCU 在聚合完成前不同时间点的粒径变化。e) 离心和纯化后 DA、DM、DMC 和 DMCU 的 Zeta 电位测量。f) 原位聚合环境(Tris-HCl,pH 8.5)中 DMCU 的 Zeta 电位随时间的变化。g) 使用紫外可见光谱法测量 DA 和 DMCU 在不同时间点的吸收峰变化。h) 通过 EDS 映射分析了 DMCU 的 TEM 图像及其元素组成。脲酶是一种含镍寡酶,其活性中心需要镍离子才能发挥催化作用。每个脲酶分子通常含有两个镍离子,对应的质量百分比约为 0.024%。由于镍的含量有限,为了更好的可视化,其位置已用黄色虚线突出显示。i)通过电感耦合等离子体光谱法(ICP)检测不同时间点DMCU在人工尿液(pH 6.5)和PBS溶液(pH 7.4)中的释放情况
(2)DMCU的自推进性能和膀胱保留
为验证脲酶对DMCU的驱动作用,在不同浓度尿素溶液(0、50、100、200 mM)中进行了运动轨迹分析。结果显示DMCU运动轨迹随尿素浓度增加显著延长(图3a),均方位移(MSD)与时间呈线性关系(图3b)。扩散系数(Deff)(图3c)和运动速度(图3d)均与尿素浓度呈正相关。膀胱肿瘤小鼠尿液检测显示尿素浓度为573.0±12.6 mM。在真实尿液中,DMCU表现出有效运动轨迹,而未修饰DMC仅显示布朗运动,两组MSD、Deff和速度存在显著差异(图3e-h)。体内实验显示,原位聚合DMCU组(ISP-DMCU)在灌注120小时后仍保持强荧光信号,而其他两组信号显著减弱或消失(图3i)。膀胱黏膜穿透实验表明,ISP-DMCU组在黏膜下仍能观察到更强的Cy5.5荧光信号。

图3 DMCU 的运动性能。a) 典型的运动轨迹(超过 25 秒)、b) MSD、c) 扩散系数 (D eff ) 和 d) DMCU 机器人在不同尿素浓度的 PBS 溶液中的速度。e) 典型的运动轨迹、f) MSD、g) D eff和 h) 膀胱肿瘤小鼠尿液中未修饰和尿素酶修饰的 DMCU 的速度。i) 在膀胱癌小鼠模型中,膀胱内注射外源聚合 (ESP) Cy5.5 标记的 DMC、原位聚合 (ISP) DMC 和原位聚合 DMCU 药物。在 120 小时内监测每个纳米颗粒在膀胱中的保留时间
(3)DMCU的体外抗肿瘤活性和细胞摄取
体外抗肿瘤实验结果显示,DMC对MB49细胞的细胞毒性显著高于其他组别(DA、DM、MC)(图4a-d)。细胞凋亡分析表明DMC组的细胞凋亡率达73.1%,明显高于其他组(图4e,f)。Calcein-AM/PI染色和CLSM观察证实DMC具有强细胞毒性(图4g)。集落形成实验显示DMC显著抑制MB49细胞增殖(图4h,j)。细胞摄取实验表明,DMC@Cy5.5与MB49细胞共孵育4小时后主要定位于细胞质(图4k)。流式细胞术检测显示细胞内红色荧光强度随孵育时间增加,7小时达到峰值(图4i)。
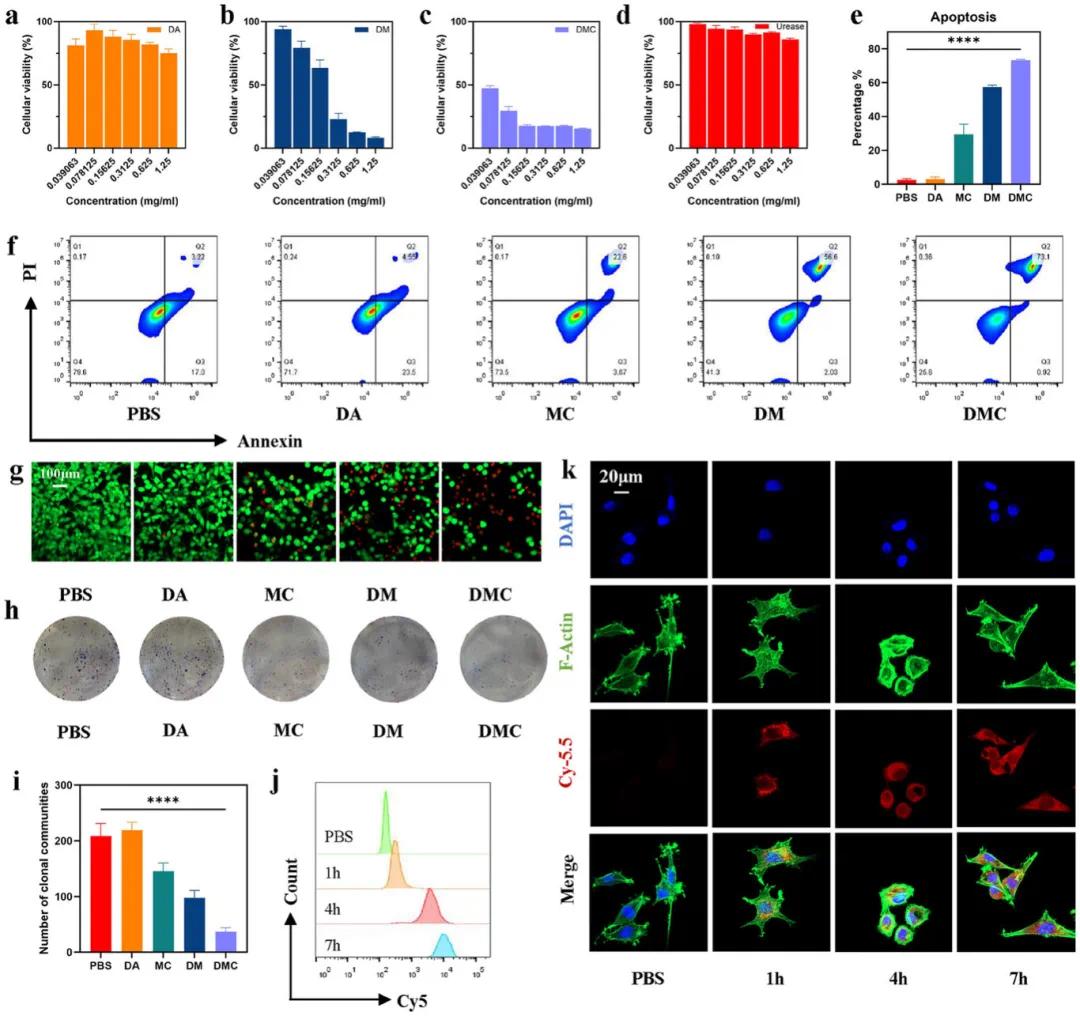
图4 DMCU 对肿瘤细胞的摄取和细胞毒性的体外评估。a–d) 使用 N-四甲基对苯二胺方法评估不同组原位聚合纳米粒子 (DA、DM 和 DMC) 和不同浓度的游离尿素酶对 MB49 细胞活力的影响。e,f) MB49 细胞凋亡的 FCM 分析图和半定量评估。g) 用 Calcein-AM (绿色,活细胞) 和 PI (红色,死细胞) 染色的 MB49 细胞的 CLSM 图像。h,i) 用结晶紫染色的 MB49 细胞集落和半定量分析。j) FCM 图谱显示 MB49 细胞在不同时间点对 DMC 的细胞内摄取。k) DMC@Cy5.5与 MB49 细胞共培养 1、4 和 7 小时的 CLSM 图像
(4)DMC诱导的DNA损伤和cGAS/STING通路的激活
研究表明Mn²⁺通过促进DNA损伤释放dsDNA片段,经cGAS识别后促进cGAMP合成,进而激活STING通路(图5a)。免疫荧光检测显示DMC组γ-H2AX表达显著增加,证实其诱导DNA损伤并激活STING通路(图5f,l)。P-STING免疫标记显示DMC组磷酸化STING表达显著升高。Western blot分析表明DMC处理组磷酸化STING、IRF3和TBK1表达明显上调,而组蛋白H2AX无显著差异(图5b-e)。在免疫激活方面,与骨髓来源树突细胞(BMDCs)共培养后,DMC组成熟BMDCs比例最高(37.6%)(图5j,k)。ELISA检测显示DMC组上清液中IFN-β、IL-6和TNF-α水平显著高于其他组(图5g-i)。结果表明DMC通过诱导DNA损伤激活cGAS-STING通路,促进DC成熟并增强抗肿瘤免疫应答。
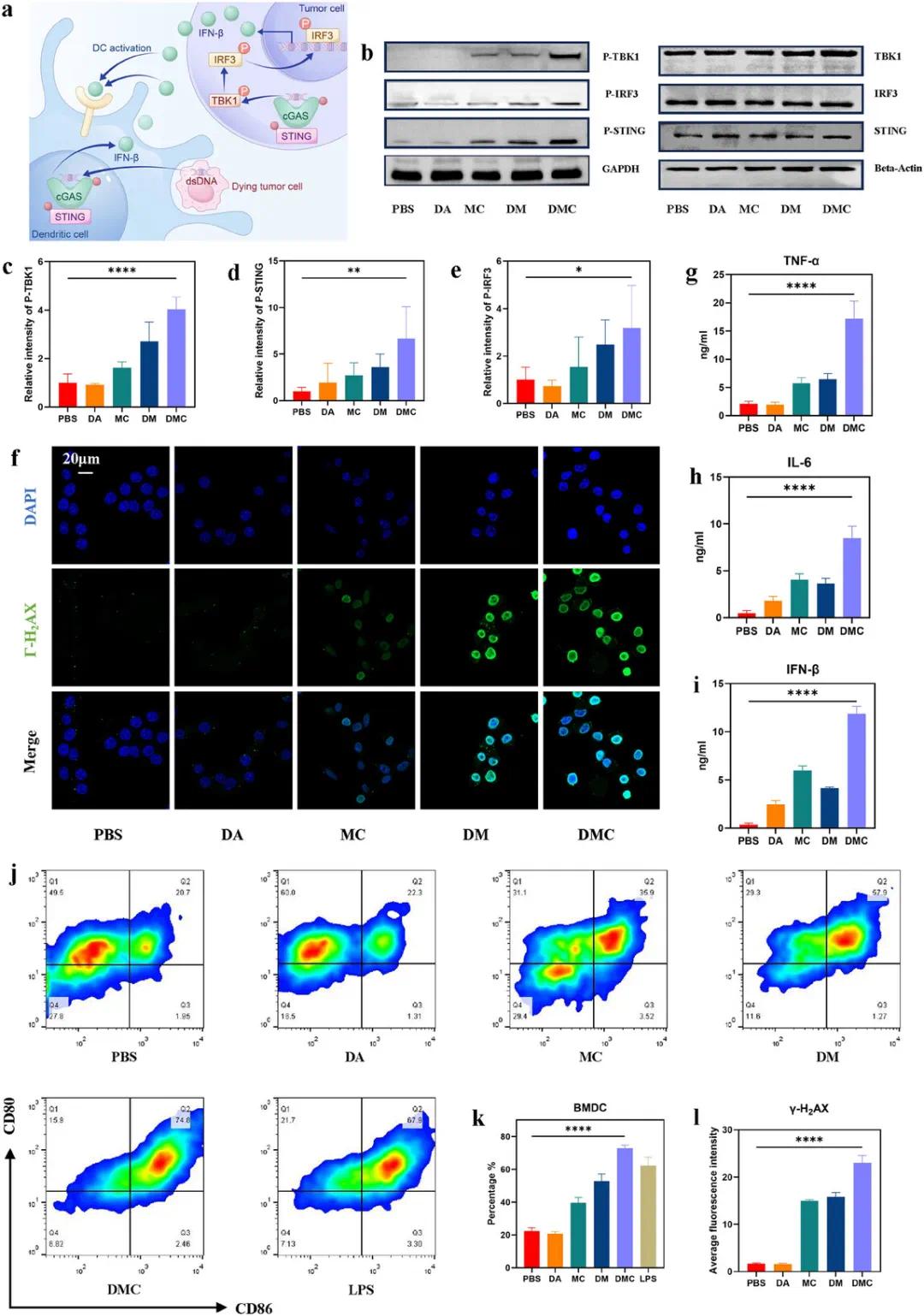
图5 DMC 在体外研究 DNA 损伤机制和 STING 通路激活。a) 肿瘤细胞中的 STING 通路及其对树突状细胞 (DC) 成熟的促进作用示意图。b) STING 通路相关蛋白的 Western blot 分析,以 β-Actin 和 GAPDH 作为内参。c–e) 基于灰度分析的 STING 通路相关蛋白 Phos-TBK1、Phos-STING 和 Phos-IRF3 表达水平的半定量统计分析。f) CLSM 图像显示用不同药物处理的 MB49 细胞中的 γ-H 2 AX(蓝色,DAPI;绿色,γ-H 2 AX)。g–i) DC 上清液中 TNF-α、IL-6 和 IFN-β 的细胞因子水平(n = 3 个 DC 培养皿)。j,k) 与用 PBS、DA、MC、DM 和 DMC 处理的 MB49 细胞共培养时 DC 激活的 FCM 结果。 l)对不同纳米药物处理的MB49细胞中γ-H 2 AX表达进行半定量统计分析
(5)DMCU的生物安全性和体内功效
体内安全性评估显示,DMCU处理组小鼠体重及血清肝功能(AST、ALT)、肾功能(BUN、CREA)指标均处于正常范围主要器官H&E染色未见明显病理改变。在MB49-Luc原位膀胱癌模型中,DMCU组经两次治疗后肿瘤荧光信号显著减弱(图6c)。治疗30天后,DMCU组膀胱体积和重量显著低于其他组(图6d,e),生存率达100%(图6f)。治疗终点(21天)膀胱H&E染色显示DMCU组肿瘤体积最小、侵袭性最低。肿瘤组织TUNEL检测显示DMCU组凋亡细胞信号显著增强(图6j),Ki-67免疫组化证实该组肿瘤细胞增殖活性最低(图6j)。结果表明DMCU具有良好生物安全性,能有效抑制膀胱肿瘤生长并提高生存率。
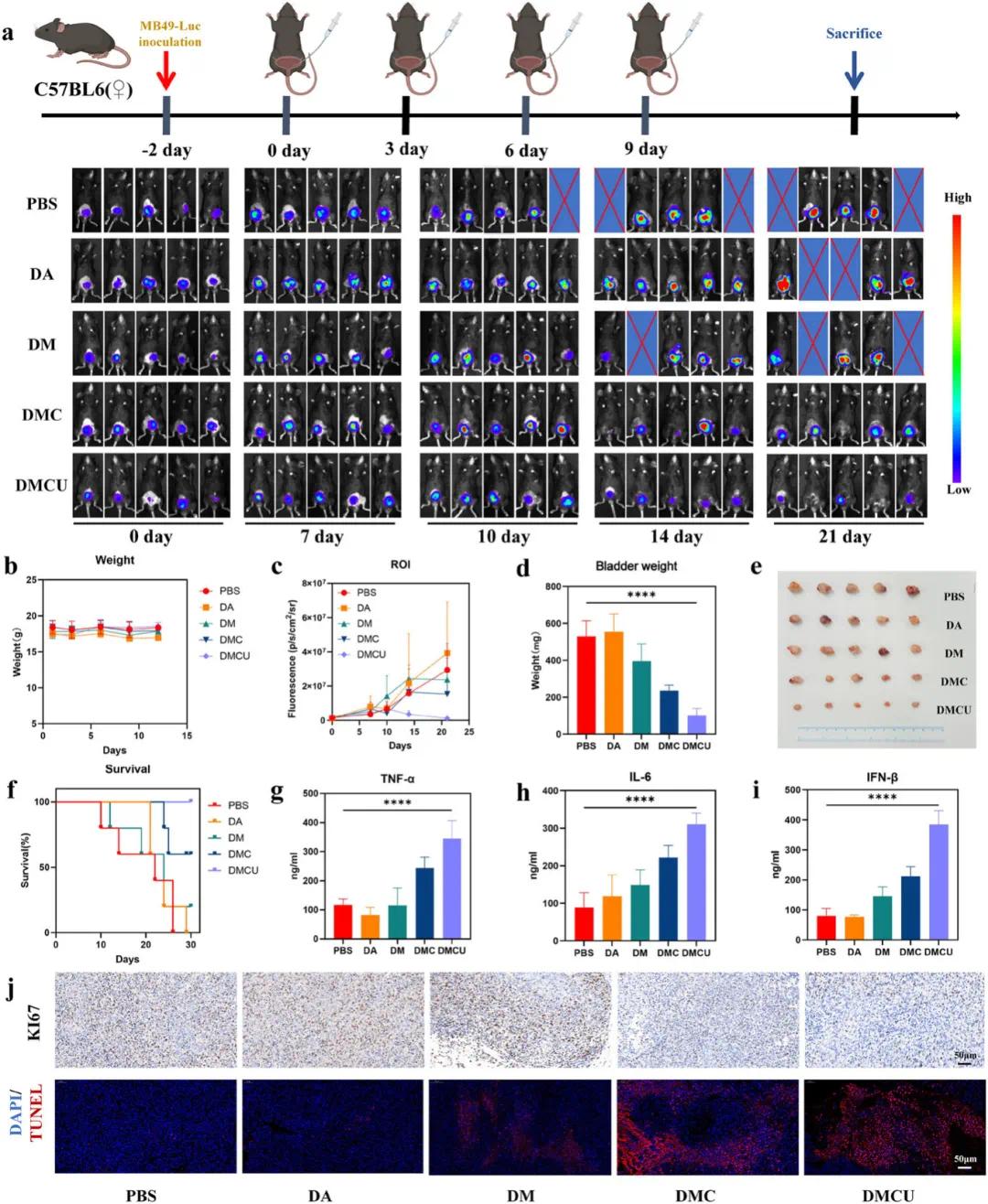
图6 DMCU对体内肿瘤生长的抑制作用。a)PBS、DA、DM、DMC、DMCU膀胱灌注治疗后,治疗方案示意图及膀胱癌荧光值变化。b)治疗期间各治疗组小鼠体重变化曲线。c)治疗周期内各治疗组小鼠膀胱肿瘤荧光变化统计图。d)观察周期末各治疗组小鼠膀胱重量统计图。e)观察周期末膀胱肿瘤代表性照片和f)各治疗组小鼠生存曲线。g-i)PBS、DA、DM、DMC、DMCU治疗小鼠血清细胞因子TNF-α、IL-6、IFN-β变化。j)不同药物治疗小鼠肿瘤组织TUNEL(上)和Ki-67(下)染色结果
(6)DMCU的体内免疫激活作用
体内免疫激活实验显示,DMCU组血清中TNF-α、IL-6和IFN-β水平显著高于对照组(图6g-i)。流式细胞术分析证实DMCU组膀胱肿瘤组织中DC成熟率最高(52.2%)(图7a)。在脾脏和膀胱组织中,DMCU组CD4⁺ T细胞比例分别为18.8%和16.7%(图7b),CD8⁺ T细胞比例分别为22.3%和8.76%(图7c),均显著高于其他组。记忆T细胞(TEM)激活分析显示DMCU组脾脏TEM激活率达26.3%。免疫荧光染色显示DMCU组膀胱组织中CD4⁺和CD8⁺ T细胞浸润显著增加(图7d)。结果表明DMCU能有效激活STING通路,促进DC成熟、T细胞活化和免疫记忆反应。

图7 DMCU通过STING通路增强体内抗肿瘤免疫反应。a) 不同治疗方案小鼠膀胱肿瘤DC活化的FCM及统计学分析。b) 不同药物治疗小鼠膀胱肿瘤及脾脏CD4 +和c) CD8 + T细胞活化的FCM及统计学分析。e) 免疫荧光染色不同药物治疗小鼠肿瘤组织CD4(上)和CD8(下)染色
该研究开发了一种自推进式原位聚合纳米药物系统,可有效激活STING通路。Mn2+和cGAMP的结合显著增强了STING的激活并增强了免疫反应,从而调节肿瘤微环境(TME),改善肿瘤治疗效果。通过膀胱灌注递送纳米药物系统模拟当前的临床治疗方案,原位聚合与尿素酶驱动推进的结合显著改善了纳米颗粒的滞留和药物递送,从而显著提高了抗肿瘤疗效。该方法为临床肿瘤治疗提供了一种有前景的创新策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

