
液-液相分离(LLPS)是一种现象,合成聚合物和天然聚合物通过热力学作用从均匀溶液中浓缩大分子,形成共醋液滴,这一过程由长程和短程相互作用共同驱动。在宏观块状系统中,LLPS 通常以形成悬浮的微米级液滴为特征,这些液滴在共醋作用后最终形成两个宏观相。相比之下,真核细胞中蛋白质和核酸的相分离导致生物分子凝聚体的形成,这些凝聚体在拥挤的细胞质环境中稳定存在,形成无膜细胞器(MLOs)。
与由脂质双层膜分隔的经典细胞器(如线粒体和高尔基体)不同,MLOs 在无物理屏障的液体空间内分隔生物聚合物。过去十年间,MLOs 在调节众多生物功能(从信号转导到基因转录 / 翻译,再到应激反应)中的关键作用已被证实。MLOs 功能障碍(由相分离过度或不足引起)可能影响基本过程,进而导致包括癌症、神经退行性疾病和传染病在内的多种疾病。因此,MLOs 在调控细胞命运中的关键作用使其成为治疗干预的潜在靶结构。尽管已开发出可与 MLOs 组分蛋白结合或调节蛋白表达信号通路的小分子药物,但直接与异常 MLOs 结合并调节其生物活性的方法仍有待探索。

针对上述问题,南开大学余志林教授团队开发了一种酶响应性原位液 - 液相分离系统,用于靶向无膜细胞器以增强癌症化疗效果。研究中利用了肽的刺激响应性以及液滴与应激颗粒(SGs)凝聚的潜在优势。通过在肽中引入硫酸酯酶响应性硫酸化酪氨酸,实现了活细胞中原位相分离的建立。硫酸酯酶是一种在多种癌细胞中异常过表达的溶酶体定位酶,主要在溶酶体中发挥催化活性。研究结果表明,这种原位形成的液滴能够靶向 SGs,通过与 SGs 的凝聚直接抑制其功能,从而解决癌症化疗中的药物耐受性问题。该研究于2025年5月7日以《In Situ Liquid-Liquid Phase Separation of Peptides Into Droplets Targeting Membraneless Organelles for Enhanced Cancer Chemotherapy》为题发表于《Advanced Materials》上(DOI:10.1002/adma.202420399)。

研究示意图
(1)肽YSO4F的酶响应性LLPS研究
肽 YSO4F 及其天然对应物 YF 合成与纯化后(图 1A),经超高效液相色谱 - 质谱(UPLC-MS)评估 YSO4F 的酶响应性。UPLC 动力学研究显示,加入硫酸酯酶后 YSO4F 逐渐转化为 YF(图 1B、C)。经 YF 相分离的浓度依赖性研究确定酶诱导 LLPS 的条件,光学显微镜显示 YF 在 1.4 mm 浓度下形成液滴(图 1D)。YSO4F 的酶诱导 LLPS 通过先在酸性溶液中孵育肽与硫酸酯酶,再调溶液 pH 至 7.4 进行。相同条件下,单独 YSO4F 呈均质溶液(图 1E),经硫酸酯酶处理后形成明显液滴(图 1F),表明硫酸酯酶诱导 YSO4F 发生 LLPS。YSO4F 与硫酸酯酶孵育并调 pH 至 7.4 后,CLSM 图像显示形成绿色球形液滴(图 1G)。CLSM 图像还显示不同液滴间的融合,两个小液滴在 90 秒内共醋成一个大液滴(图 1H)。以上结果直接证明 YSO4F 在硫酸酯酶诱导酪氨酸残基硫酸根水解后发生酶响应性 LLPS,为在过表达硫酸酯酶的活细胞中原位建立相分离奠定基础。
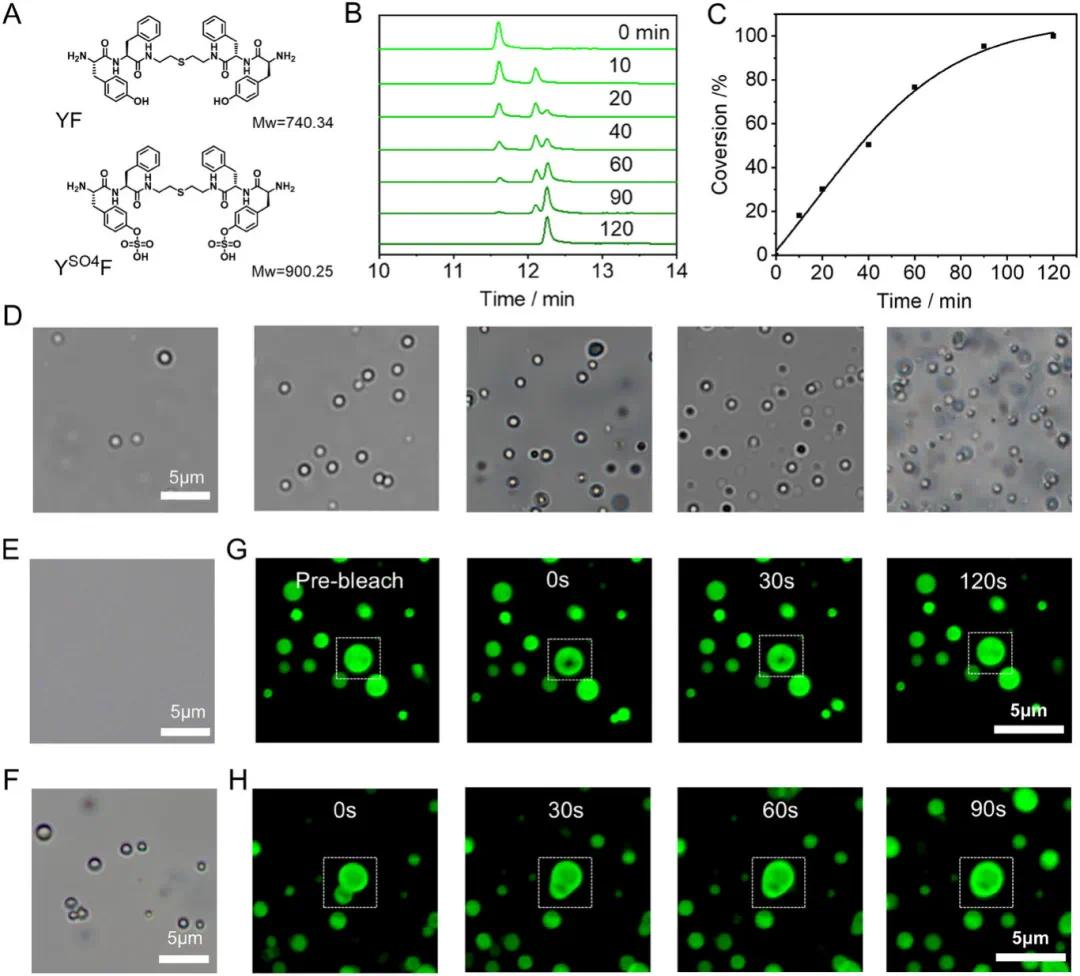
图1 A) 硫酸化肽 YSO4F 及其天然对应物 YF 的化学结构。B) 硫酸化肽 YSO4F(100 µm)在不同时间用硫酸酯酶(20 U/mL)处理的超高效液相色谱(UPLC)图谱。C) 在酶浓度为 20 U/mL 的条件下,YSO4F(100 µm)中硫酸根水解转化率随时间的变化。D) 不同浓度下肽 YF 的光学显微镜(OM)图像,从左到右:1.3、1.4、1.5、1.6 和 1.8 mm。E,F) 溶液中肽 YSO4F(1.4 mm)在与硫酸酯酶孵育前(E)和 24 小时后(F)的光学显微镜(OM)图像。G) 经硫酸酯酶处理的 YSO4F(1.4 mm)形成的液滴的共聚焦激光扫描显微镜(CLSM)图像,用于说明荧光恢复后光漂白(FRAP)过程。H) 经硫酸酯酶处理的 YSO4F(1.4 mm)形成的液滴融合的共聚焦激光扫描显微镜(CLSM)图像
(2)肽YSO4F在癌细胞中的摄取与原位LLPS研究
选用过表达硫酸酯酶的鼠乳腺癌细胞系 4T1 作为模型细胞。在相分离研究前,通过流式细胞分析和荧光信号强度定量,发现 4T1 细胞对 YSO4F 的摄取优于 YF(图 2A、B),推测与其不同的摄取途径有关。由于硫酸酯酶在驱动原位 LLPS 过程中的关键作用及其在溶酶体中的催化微环境,研究了 YSO4F 的内化途径。共聚焦激光扫描显微镜(CLSM)图像显示 YF 和 YSO4F 被 4T1 细胞成功摄取(图 2C)。YSO4F 处理的 4T1 细胞中,肽 FITC 与溶酶体示踪剂信号的皮尔逊相关系数(PCC)值最初约为 0.73,12 小时后降至 0.23(图 2D),表明肽与溶酶体的共定位及其溶酶体逃逸,阐明了 YSO4F 的溶酶体介导摄取途径。YSO4F 经硫酸酯酶诱导水解为带正电的 YF 后,可能通过质子海绵效应促进溶酶体逃逸。此外,CLSM 图像显示 4T1 细胞内形成球形液滴,经 FRAP 研究发现,肽溶酶体逃逸后,4T1 细胞内的绿色液滴在光漂白后荧光恢复强劲(图 2E),表明 YSO4F 在 4T1 细胞内发生原位相分离形成液滴。
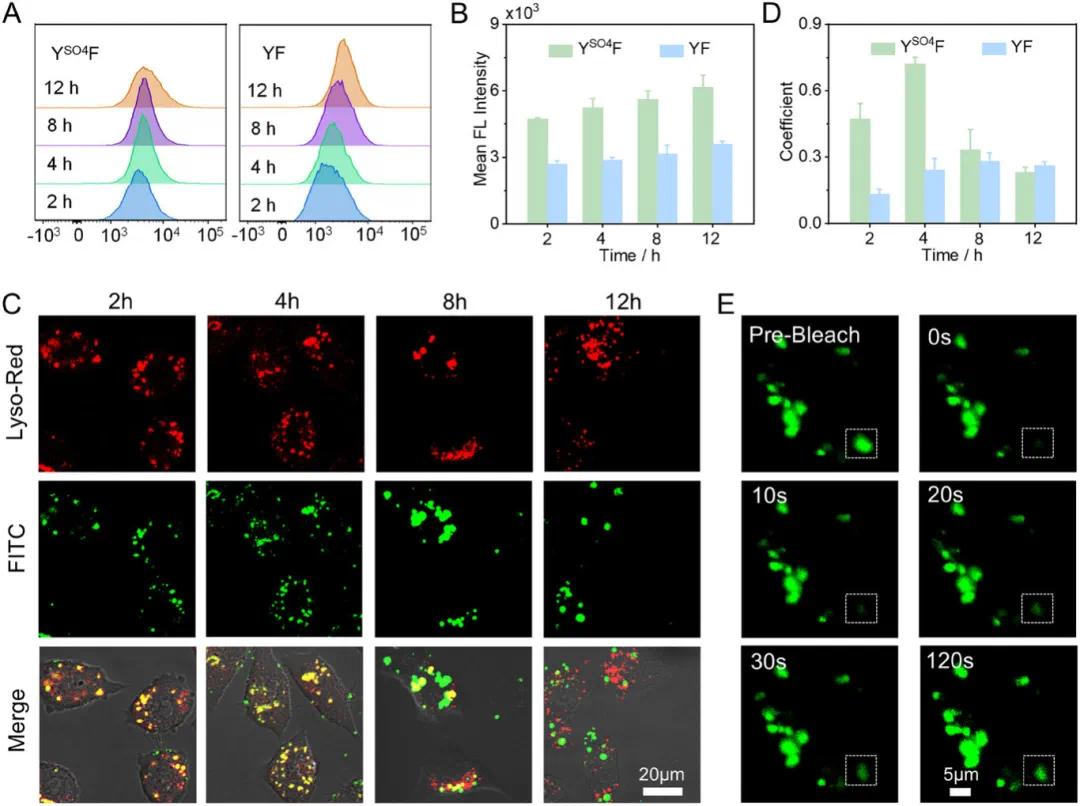
图2 A) 通过流式细胞分析法分析 4T1 细胞在不同时间点摄取 1.4 mM 的肽 YSO4F 和 YF。B) 流式细胞实验中,4T1 细胞与 YSO4F 或 YF 共孵育后的定量荧光强度。C) 4T1 细胞在 1.4 mM YSO4F 存在下孵育 2、4、8 和 12 小时的共聚焦激光扫描显微镜(CLSM)图像,用 Lyso-Red 荧光示踪剂染色。D) 用 YSO4F 或 YF 处理的 4T1 细胞在不同时间点,Lyso-Red 荧光示踪剂与 FITC 信号之间的皮尔逊相关系数(PCC)值。E) 用 YSO4F 处理 12 小时的 4T1 细胞的共聚焦激光扫描显微镜(CLSM)图像,以确认原位形成液滴的荧光恢复后光漂白(FRAP)特性
(3)基于酶诱导原位 LLPS 系统的亚细胞结构靶向功能研究
将 YSO4F 与 TPP-YSO4F 按 9:1 摩尔比混合,制备了混合物 m-YSO4F-Lm(图 3A),其中 m 表示混合物,Lm 表示靶向线粒体的配体。,证实了其酶诱导的 LLPS。同样,通过混合 YF 和 TPP-YF 制备了含配体的液滴 d-YF-Lm。通过监测肽 FITC 与线粒体示踪剂信号的共定位,评估了形成的液滴的线粒体靶向特性(图 3B)。CLSM 图像显示,m-YSO4F-Lm 处理 12、16 和 20 小时后,FITC 与线粒体示踪剂信号的 PCC 值逐渐增加(图 3C),表明液滴在细胞质中围绕线粒体积累。通过 MTT 实验评估了 m-YSO4F-Lm 对癌细胞的毒性及其诱导细胞死亡的机制。结果表明,YSO4F、m-YSO4F-Lm 和 d-YF-Lm 均能略微降低 4T1 细胞的活性(图 3D),其中 m-YSO4F-Lm 由于其增强的细胞摄取和线粒体靶向特性,对 4T1 细胞表现出较高的毒性。由于靶向配体在毒性中的关键作用,通过监测线粒体的完整性来探究 m-YSO4F-Lm 杀死癌细胞的机制。CLSM 图像显示,经 m-YSO4F-Lm 处理 24 小时的 4T1 细胞中出现强烈的绿色荧光信号,表明线粒体去极化,从而导致细胞凋亡(图 3E)。通过流式细胞实验定量分析了不同处理下 4T1 细胞中红色和绿色荧光信号的强度比值,结果表明,经 m-YSO4F-Lm 处理的 4T1 细胞中 J - 聚集体显著减少(图 3F),证明了线粒体去极化和功能障碍是细胞凋亡的原因。总体而言,研究表明原位形成的共醋液滴具有线粒体靶向特性,可诱导细胞凋亡。
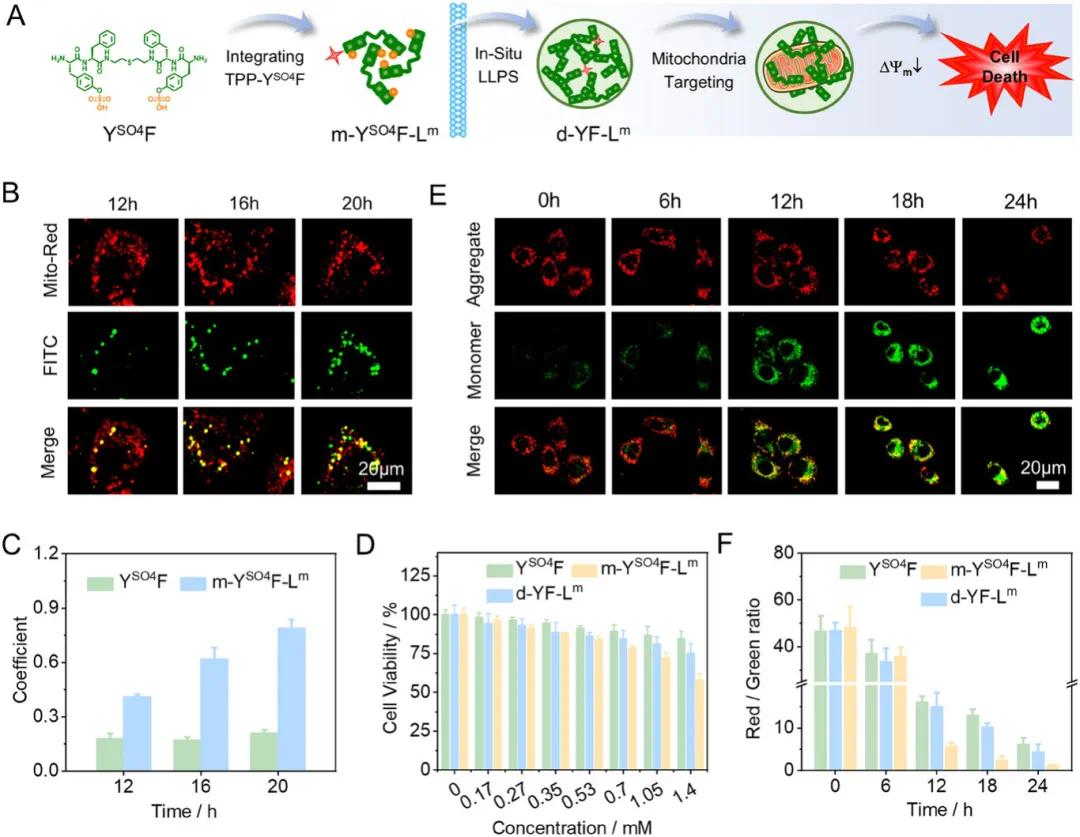
图3 A) 通过 YSO4F 与配体 TPP-YSO4F 混合制备液滴前体混合物 m-YSO4F-Lm 及其在 4T1 细胞中原位相分离成液滴 d-YF-Lm 以靶向线粒体并诱导细胞死亡的示意图。B) 用 Mito-Red 染色线粒体后,经 m-YSO4F-Lm(1.4 mm)处理 12、16 和 20 小时的 4T1 细胞的共聚焦激光扫描显微镜(CLSM)图像。C) 用 YSO4F 或 m-YSO4F-Lm 处理的 4T1 细胞在不同时间点,Mito-Red 荧光示踪剂与 FITC 信号之间的皮尔逊相关系数(PCC)值。D) 4T1 细胞经 YSO4F、d-YF-Lm 和 m-YSO4F-Lm 在不同浓度下处理 24 小时后的细胞活性。E) 用 JC-1 标记的 4T1 细胞经 m-YSO4F-Lm(1.4 mM)处理 0、6、12、18 和 24 小时后的共聚焦激光扫描显微镜(CLSM)图像。F) 用不同处理孵育的 JC-1 标记的 4T1 细胞中,与 J-聚集体(红色)和 J-单体(绿色)信号相关的荧光强度比值的流式细胞分析结果
(4)无膜应激颗粒靶向功能研究
完成膜细胞器靶向研究后,进一步探索了原位 LLPS 系统对无膜应激颗粒(SG)的靶向功能。合成与 G3BP2 具有可靠亲和力的配体 FGDF-YSO4F 和 FGDF-YF,将其与亲本肽混合,得到混合物 m-YSO4F-LSG 和液滴 d-YF-LSG(图 4A)。微量热泳动(MST)研究显示 FGDF-YF 与 G3BP2 的结合常数为 21.6 µm,表明其对 SG 具有潜在靶向活性(图 4B)。在 MST 研究中,固定 YF 浓度为 1.4 mm 维持液滴结构,将 FGDF-YF 浓度设置为与单独配体 MST 研究相同范围,结果显示配体加入液滴 d-YF-LSG 后,配体 - 蛋白结合增强 3.9 倍(图 4C),表明液滴募集配体和蛋白,促进它们结合。根据 MST 结合曲线,配体与蛋白结合在 FGDF-YF 浓度 70 - 100 µm 时达到稳定平台阶段,因此以 5% 含量将配体混入混合物或液滴中(图 4A)。MTT 实验显示,YSO4F、m-YSO4F-LSG 或 d-YF-LSG 处理 A549 细胞未显著降低细胞活性(图 4D),表明肽对癌细胞细胞毒性低。索拉非尼对 A549 细胞表现出中等细胞毒性,半致死剂量(IC50)值约为 13 µm(图 4E)。然而,m-YSO4F-LSG 或 d-YF-LSG 预处理 A549 细胞后,再与索拉非尼共孵育,导致显著细胞死亡,特别是 m-YSO4F-LSG 与索拉非尼联合处理使索拉非尼 IC50 值降至 3 µm,表明原位形成液滴具有细胞毒性增敏作用。m-YSO4-LSG 存在下孵育 A549 细胞,再用索拉非尼刺激,导致 A549 细胞内明显形成共醋液滴(图 4F),线扫描分析显示肽 FITC 和 G3BP2-IF 染色信号显著重叠。相比之下,YSO4F 孵育的 A549 细胞(也在 A549 细胞中形成共醋液滴)未显示 FITC 和 IF 染色信号重叠(图 4G),结果强有力地表明原位形成液滴与蛋白 G3BP2 重叠源于配体与蛋白 G3BP2 结合。
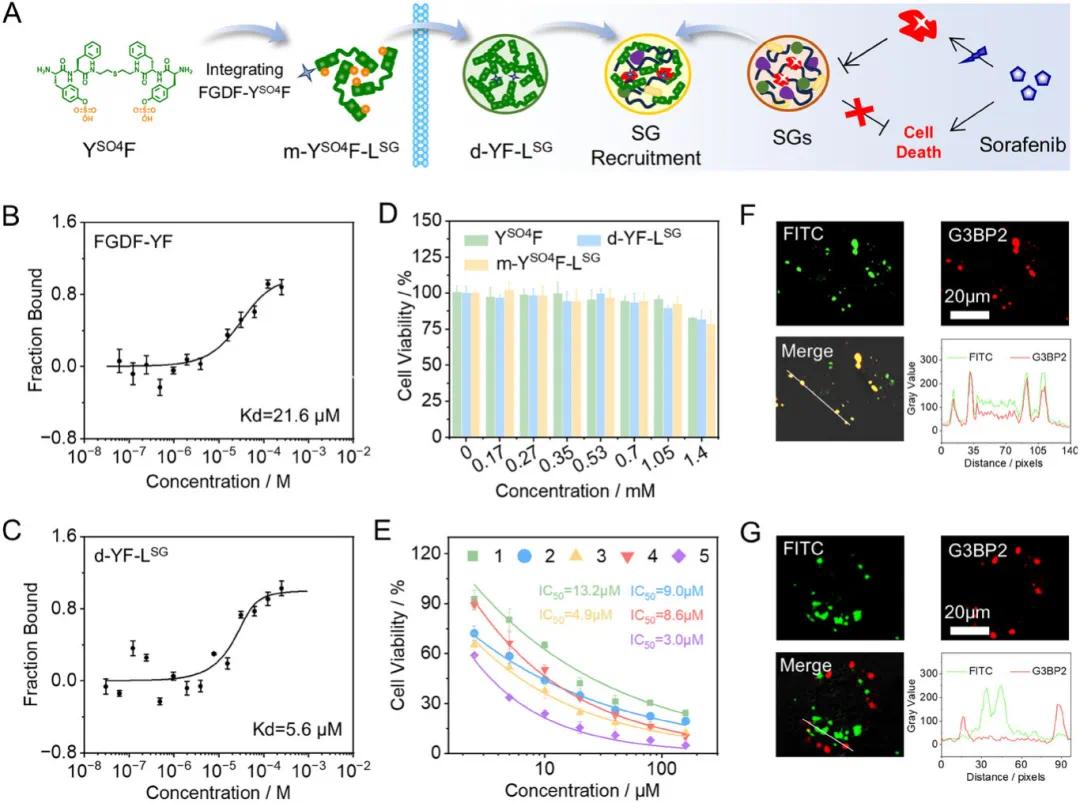
图4 A) 通过 YSO4F 与配体 FGDF-YSO4F 混合制备混合物 m-YSO4F-LSG 及其在 A549 细胞中原位 LLPS 形成液滴 d-YF-LSG 以靶向应激颗粒(SG)并诱导细胞死亡的示意图。B, C) 微量热泳动(MST)实验曲线显示配体 FGDF-YF(B)或液滴 d-YF-LSG(C)与蛋白 G3BP2 的结合亲和力随配体浓度的变化。D) A549 细胞经 YSO4F、d-YF-LSG 或 m-YSO4F-LSG 处理 24 小时后的细胞活性。E) A549 细胞单独用索拉非尼(Sor:1)处理 12 小时,或用 YSO4F(2)、FGDF-YSO4F(3)、d-YF-LSG(4)或 m-YSO4F-LSG(5)处理 12 小时后与索拉非尼共孵育 12 小时,其中显示了半致死剂量(IC50)值。F, G) 共聚焦激光扫描显微镜(CLSM)图像显示用 m-YSO4F-LSG(1.4 mm)(F)或 YSO4F(1.4 mm)(G)处理 12 小时并用索拉非尼共孵育 2 小时的 A549 细胞的免疫荧光染色 G3BP2
(5)原位形成液滴的 SG 靶向功能及机制研究
原位形成的液滴通过凝聚整个应激颗粒(SG)或招募单个蛋白 G3BP2 来增强索拉非尼的细胞毒性。共聚焦激光扫描显微镜(CLSM)图像显示,经 m-YSO4F-LSG 处理并用索拉非尼刺激的 A549 细胞中,肽 FITC 与 T 细胞内抗原 1(TIA-1)免疫荧光染色信号显著共定位(图 5A),表明液滴与整个 SG 的凝聚;而经 YSO4F 处理的 A549 细胞中,绿色 FITC 和红色免疫荧光染色信号完全分离(图 5B),直接证明了原位形成液滴的 SG 靶向特性。CLSM 图像还显示,用 NT-647 荧光染料标记的 G3BP2 与 d-YF-LSG 共孵育后,绿色 FITC 和红色 NT-647 荧光信号高度重叠(图 5C),表明液滴招募了 G3BP2。此外,在未用索拉非尼刺激的 A549 细胞中,m-YSO4F-LSG 也能使蛋白免疫荧光染色信号与肽 FITC 信号共定位(图 5D),表明即使在无 SG 形成的条件下,液滴也能招募蛋白 G3BP2,招募蛋白可能是增强索拉非尼细胞毒性的次要途径。
Western blot 实验显示,经肽和索拉非尼处理的 A549 细胞中,m-YSO4F-LSG 处理的细胞磷酸化 p38(P-p38)和裂解的 caspase-3 水平显著增加(图 5F),证实了原位形成液滴增强了索拉非尼的 caspase 依赖性凋亡途径。尽管天然液滴 d-YF-LSG 和配体 FGDF-YSO4F 与索拉非尼共孵育也能提高活化 caspase-3 水平,但与 m-YSO4F-LSG 相比,其改善有限,表明原位相分离在抑制 SG 功能方面具有优势。CLSM 图像显示,在 m-YSO4F-LSG + 索拉非尼处理的细胞中,RACK1 被液滴招募的情况显著减少(图 5G),与传统 SG 抑制剂 ISRIB 的结果一致。Western blot 分析还显示,索拉非尼处理的 A549 细胞中 MTK1 磷酸化被显著抑制,而添加 m-YSO4F-LSG 或 ISRIB 可增加 MTK1 磷酸化水平(图 5H),表明液滴 - SG 共醋液滴阻止了 RACK1 的隔离,并随后激活了 MTK1 磷酸化,从而抑制了 SG 功能(图 5I)。
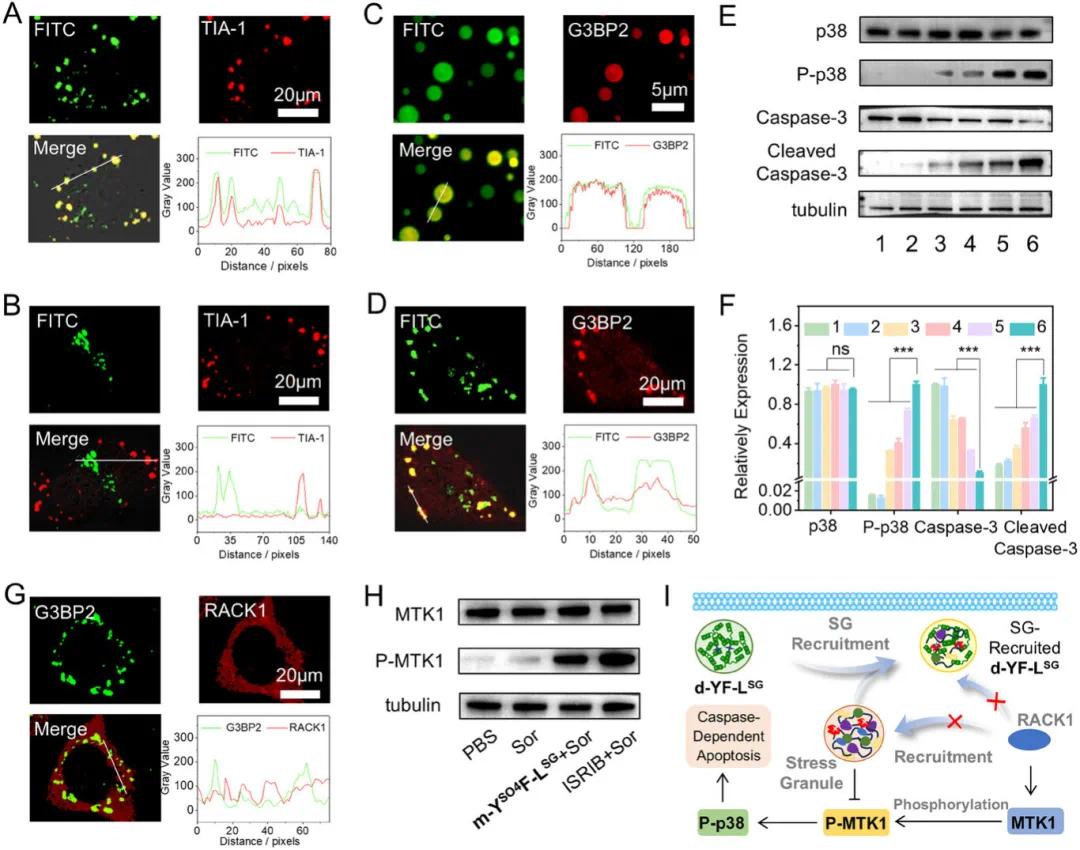
图5 A, B) 经 m-YSO4F-LSG(A)或 YSO4F(B)处理 12 小时并用索拉非尼刺激 2 小时的 A549 细胞的免疫荧光染色 TIA-1 的共聚焦激光扫描显微镜(CLSM)图像。C) 含有 NT-647 标记的蛋白 G3BP2 的液滴 d-YF-LSG 的共聚焦激光扫描显微镜(CLSM)图像。D) 仅用 m-YSO4F-LSG 处理 12 小时的 A549 细胞的免疫荧光染色 G3BP2 的共聚焦激光扫描显微镜(CLSM)图像。E, F) 经 PBS(1)、m-YSO4F-LSG(2)处理 24 小时,或经 Sor(3)处理 12 小时,以及经 d-YF-LSG(4)、FGDF-YSO4F(5)或 m-YSO4F-LSG(6)处理 12 小时后与索拉非尼共孵育 12 小时的 A549 细胞内 p38、P-p38、caspase-3 和裂解 caspase-3 水平的 Western blot 实验(E)和定量数据(F)。G) 预孵育 12 小时 m-YSO4F-LSG(1.4 mm)并用索拉非尼(13 µm)额外孵育 2 小时的 A549 细胞的免疫荧光染色 G3BP2 和 RACK1 的共聚焦激光扫描显微镜(CLSM)图像。H) 经 PBS、索拉非尼(13 µm)处理 2 小时,预孵育 m-YSO4F-LSG(1.4 mm)12 小时或 ISRIB(200 nm)2 小时并用索拉非尼(13 µm)额外孵育 2 小时的 A549 细胞内 MTK1 和 P-MTK1 水平的 Western blot 实验。I) 原位形成液滴抑制 SG 功能并激活 caspase 依赖性凋亡途径的机制示意图。统计分析采用单因素方差(ANOVA)分析。*p < 0.05,**p < 0.01,***p < 0.001
(6)原位LLPS系统的体内化疗效果及生物安全性研究
验证原位 LLPS 系统的无膜细胞器靶向功能后,开展动物实验研究原位形成液滴的体内化疗效果。用 A549 细胞皮下注射建立荷瘤 Balb/c 小鼠模型,肿瘤体积约 100 mm³ 时,小鼠随机分七组,每组接受四次给药,每隔一天一次。索拉非尼腹腔注射,肽瘤内注射,联合给药时交替日注射。治疗期间,每两天记录一次给药小鼠体重和肿瘤体积,21 天后解剖研究肿瘤组织。肿瘤生长曲线和重量显示,m-YSO4F-LSG 联合索拉非尼组肿瘤生长最慢(图 6A、B),表明原位形成液滴对索拉非尼化疗有增敏效果。解剖肿瘤组织大小也证实了联合注射抑制肿瘤生长(图 6C)。接着,通过解剖肿瘤组织切片的 CLSM 研究,探究肽的体内相分离和原位形成液滴的 SG 靶向行为。可能证实了肽的硫酸酯酶诱导体内相分离。此外,给药后 24 小时小鼠肿瘤组织切片显示,绿色肽 FITC 和红色 G3BP2 免疫荧光染色信号显著重叠,皮尔逊相关系数(PCC)约 0.77(图 6D)。而用 YSO4F 和索拉非尼注射的小鼠肿瘤组织内,肽和蛋白荧光信号几乎分离,PCC 值低(图 6),结果证明 m-YSO4F-LSG 成功靶向 SG。WB 实验评估肿瘤组织蛋白水平,确认增强化疗效果机制(图 6F),显示 m-YSO4F-LSG 和索拉非尼联合治疗组 P-p38 蛋白水平上调最明显(图 6G),伴随 caspase-3 水平下调和裂解 caspase-3 水平增加,表明原位形成液滴通过激活 caspase 依赖性凋亡途径增强治疗效果。对治疗小鼠肿瘤组织和主要器官进行苏木精 - 伊红(H&E)染色实验,确认肿瘤细胞凋亡并评估生物安全性(图 6H)。m-YSO4F-LSG + 索拉非尼治疗小鼠肿瘤组织内细胞萎缩和凋亡特征显著,支持治疗效果。
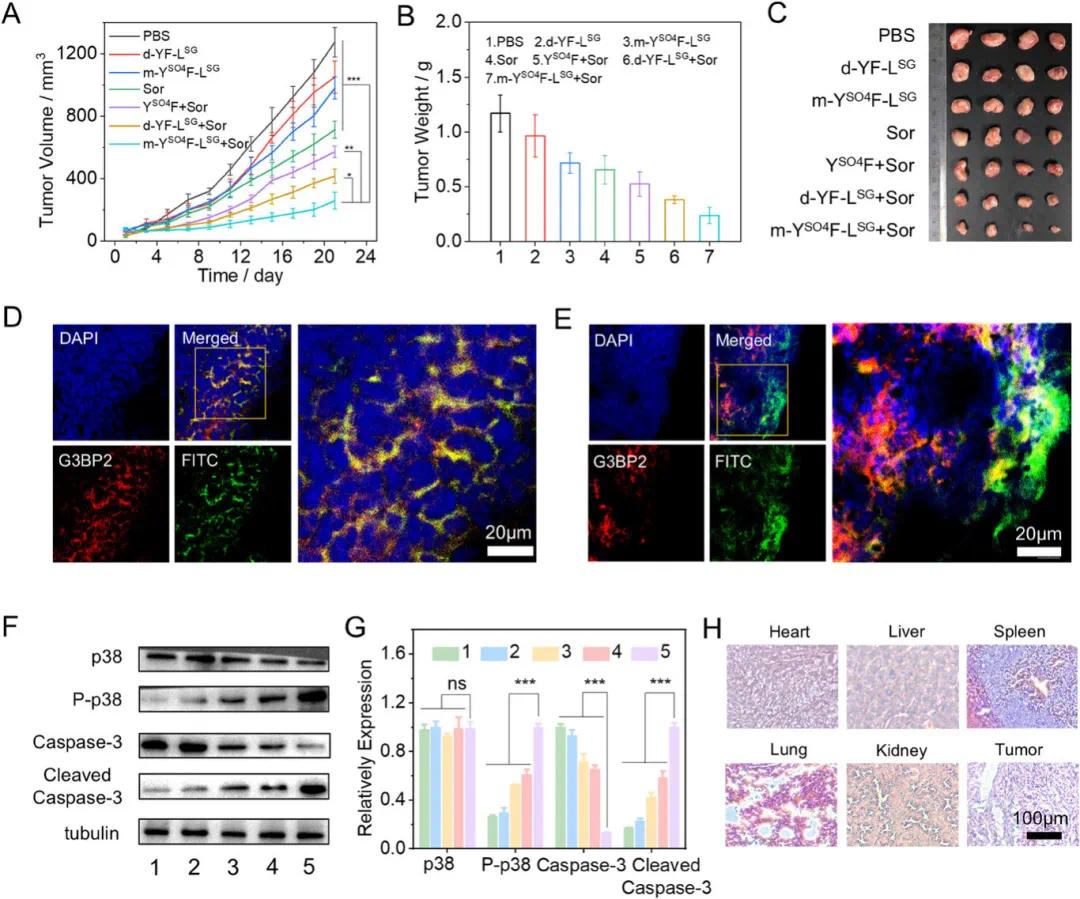
图6 A-C) 经 PBS、d-YF-LSG、m-YSO4F-LSG、索拉非尼(Sor)、YSO4F + 索拉非尼、d-YF-LSG + 索拉非尼和 m-YSO4F-LSG + 索拉非尼处理的小鼠解剖的肿瘤组织的肿瘤生长曲线(A)、肿瘤重量(B)和代表性图像(C)。D, E) 经 m-YSO4F-LSG + 索拉非尼(D)和 YSO4F + 索拉非尼(E)处理的小鼠肿瘤组织冰冻切片的共聚焦激光扫描显微镜(CLSM)图像。F, G) 经 PBS(1)、m-YSO4F-LSG(2)、索拉非尼(3)、d-YF-LSG + 索拉非尼(4)和 m-YSO4F-LSG + 索拉非尼(5)给药的小鼠肿瘤组织内 p38、P-p38、caspase-3 和裂解 caspase-3 蛋白水平的 Western blot 实验(F)或定量数据(G)。H) 经 m-YSO4F-LSG + 索拉非尼给药后小鼠的肿瘤组织和主要器官的苏木精 - 伊红(H&E)染色图像。统计分析采用单因素方差(ANOVA)分析。*p < 0.05,**p < 0.01,***p < 0.001
本研究报道了一种酶诱导的肽在活细胞中原位液 - 液相分离成靶向无膜细胞器的液滴用于癌症化疗的策略。通过在富含酪氨酸的肽中引入硫酸根,使肽具有硫酸酯酶响应性,从而在硫酸酯酶作用下发生液 - 液相分离形成液滴。 细胞实验验证了在过表达硫酸酯酶的癌细胞中硫酸酯酶诱导的相分离。通过结合适当配体,原位形成的液滴展现出线粒体靶向特性并诱导线粒体功能障碍。尤为重要的是,观察到液滴与无膜细胞器应激颗粒的凝聚,这由配体与应激颗粒的关键蛋白组分结合所促进。细胞毒性实验和 Western blot 分析表明,原位形成的液滴通过激活 caspase 依赖性凋亡途径增强了小分子药物索拉非尼的细胞毒性。此外,动物实验确认,与索拉非尼联合给药的原位液滴显著抑制了荷瘤小鼠模型中的肿瘤生长,展现出原位液滴对癌症化疗的增敏效果以及优良的生物安全性。 本研究阐明了一种在肿瘤细胞内原位形成共醋液滴的新方法,以及一种基于共醋液滴中配体 - 蛋白相互作用靶向无膜细胞器的新材料,为未来疾病靶向治疗提供了有前景的新策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

