
B细胞淋巴瘤(BCL)是一种具有高度异质性的血液恶性肿瘤,代表着成熟B细胞的侵袭性增殖。尽管BCL的传统治疗方法在临床试验中取得了初步成功,但大多数患者最终对治疗产生耐药性,临床预后较差。表观遗传失调是BCL发病机制的主要贡献者,针对表观遗传途径的治疗是治疗BCL的有希望的替代策略。

为此研究人员该研究开发了一种名为CRUPPA19的纳米声敏剂,通过将铜配合物封装到具有Z型异结构的UiO-66-NH2中,并修饰上mPEG-PO3和抗CD19抗体,使其能够特异性靶向B细胞淋巴瘤(BCL)细胞。在超声照射下,CRUPPA19可以产生活性氧(ROS)诱导细胞凋亡,并通过自噬释放铜和大黄素,分别导致铜死亡和PDL1转录抑制,从而协同诱导免疫原性细胞死亡,激活CD8+T细胞,引发抗淋巴瘤免疫反应。该疗法不仅清除了原发性和转移性淋巴瘤,还能清除骨髓中的淋巴瘤细胞,为基于MOF的纳米表观遗传治疗平台提供了新思路,展现了超声触发级联放大作用在增强抗血液肿瘤免疫力方面的潜力。该文章于2025年2月7日以《UiO-66 MOFs-Based “Epi-Nano-Sonosensitizer” for Ultrasound-Driven Cascade Immunotherapy against B-Cell Lymphoma》为题发表于《ACS Nano》(DOI:10.1021/acsnano.4c15761)。

研究示意图
(1)CuR@UiO66 的构建与表征
合成了CuRhein复合物(图1A)。Cu(II)形成正方形平面几何结构,与两个Rhein分子的1-羟基-9-酮基团配位。1692和1266 cm–1处的峰分别对应-C═O和-C–OH基团的振动伸缩,其强度变化和位置偏移表明Cu(II)与Rhein之间存在相互作用。与Rhein相比,CuRhein的吸收强度更强,延伸至近750 nm。如图1B所示,Rhein在可见光区域的最大吸收带位于428 nm,而CuRhein的吸收带出现在480 nm。这种红色位移归因于羟基蒽醌二阴离子的生成和Cu(II)中心的诱导效应。铜莱茵的荧光强度更高,表明与Cu(II)配位后生成了更大的共轭物(图1C)。
将CuRhein封装入UiO-66-NH₂中,生成高声动力活性的纳米平台。CuR@UiO66采用两步法合成(图1D)。透射电子显微镜(TEM)显示CuR@UiO66纳米晶体具有良好的八面体形态(图1E)。动态光散射(DLS)测量显示,UiO-66-NH₂和CuR@UiO66的颗粒尺寸分别为230.7±5.4和240.9±6.1 nm(图1F)。CuR@UiO66的粉末X射线衍射(PXRD)图案与UiO-66-NH₂相似,表明CuRhein的封装未影响UiO-66-NH₂的结构完整性(图1G)。CuR@UiO66的元素映射证实了Zr、Cu、O、N和C的存在以及CuRhein的成功负载(图1H)。UiO-66-NH₂和CuR@UiO66的FTIR光谱如图S5所示。CuR@UiO66显示出C═O和C–O的额外吸收峰,分别对应于1629和1285 cm–1的振动伸缩,这与CuRhein的引入一致。CuRhein的最大负载效率为98%,在CuRhein/CuR@UiO66质量比为0.1:1时,负载容量(LC)为9.8%(图S6)。为了匹配临床剂量,选定的CuRhein负载纳米载体的最终浓度为15μg/mL(25μM),纳米颗粒溶液的总浓度为100μg/mL。
为了评估CuRhein与MOF之间的相互作用,通过X射线光电子能谱(XPS)对UiO-66-NH₂、CuRhein和CuR@UiO66的化学状态进行了表征。CuR@UiO66的Zr 3d XPS光谱显示两个明显的峰,分别位于186.1和183.7 eV,对应于3d₃/₂和3d₅/₂杂化轨道(图1I)。与UiO-66-NH₂相比,CuR@UiO66的Zr 3d₃/₂和3d₅/₂峰向左移动了0.5 eV,其N 1s峰向左移动了0.2 eV(图1J)。与纯CuRhein相比,CuR@UiO66的Cu 2p₁/₂和2p₃/₂峰分别向右移动了0.3 eV至954.5和935.0 eV(图1K)。结果表明,与CuRhein相比,CuR@UiO66的Cu 2p状态电子更多,而与UiO-66-NH₂相比,CuR@UiO66的Zr 3d状态电子更少,这可能是由于从UiO-66-NH₂到CuRhein的电子转移引起的。

图1. CuR@UiO66的合成和表征。(A)CuRhein合成示意图;(B)CuRhein和Rhein的紫外-可见吸收光谱;(C)CuRhein和Rhein的荧光光谱;(D)CuR@UiO66的合成;(E)CuR@UiO66的透射电子显微镜(TEM)图像;(F)UiO-66-NH₂和CuR@UiO66的流体动力学粒径;(G)UiO-66-NH₂和CuR@UiO66的X射线衍射(XRD)图谱;(H)CuR@UiO66的扫描透射电子显微镜(STEM)图像及其相应的元素映射;UiO-66-NH₂和CuR@UiO66的高分辨率X射线光电子能谱(XPS)显示(I)Zr 3d峰,(J)N 1s峰和(K)Cu 2p峰
(2)铜纳米粒子@UiO66的声动力机制
铜R@UiO66的声动力性能通过使用2,2,6,6-四甲基哌啶(TEMP)作为捕获剂,通过电子自旋共振(ESR)光谱测量¹O₂的产生来测试。在未照射的CuRhein、UiO-66-NH₂和CuR@UiO66中未检测到¹O₂的特征1:1:1三重峰,而在CuRhein和UiO-66-NH₂中观察到微弱的峰,这表明在超声照射(1 W/cm²,1 MHz,50%占空比,5分钟)后,¹O₂的产生较弱。另一方面,照射的CuR@UiO66出现了明显的1:1:1三重峰,表明将CuRhein封装到UiO-66-NH₂中增强了超声触发的¹O₂产生(图2A,B)。这些结果进一步使用单线态氧传感器绿色(SOSG)(图2C)和1,3-二苯基异苯并呋喃(DPBF)探针分别得到证实(图2D)。使用亚甲基蓝(MB)探针检测到超声激活的CuR@UiO66产生的羟基自由基(•OH)(图2E和S11)。超声激活的CuR@UiO66产生的•OH比其他组更高。
为了进一步探索CuR@UiO66相较于CuRhein或UiO-66-NH₂具有更高声动力性能的机制,分析了它们的光学吸收性质和能带结构。UiO-66-NH₂、CuRhein和CuR@UiO66的紫外-可见光(UV-vis)漫反射光谱(DRS)表明,CuR@UiO66的吸收发生了显著的红移,这可以归因于UiO-66-NH₂和CuRhein的协同作用(图2F)。通过基于它们的吸收光谱的Tauc图确定了UiO-66-NH₂、CuRhein和CuR@UiO66的带隙(图2G)。Mott-Schottky(M-S)测量表明,UiO-66-NH₂、CuRhein和CuR@UiO66的平带位置分别为-0.60、-0.91和-0.63 V vs Ag/AgCl(图2H-J)。为了进一步了解CuR@UiO66的电子结构,使用了密度泛函理论(DFT)来确定表面电荷密度(图2K)。铜R@UiO66的差分电荷密度计算表明,UiO-66-NH₂表面C原子(蓝色)周围的电子密度降低,而CuRhein中Cu原子(黄色)周围的电子密度增加,表明电子从UiO-66-NH₂转移到CuRhein。提出了CuRhein的Z型机制,如图2L所示。在超声刺激下,CuRhein和UiO-66-NH₂都被激发并产生电子-空穴对。由于最低未占据分子轨道(LUMO)电位(-0.81 V vs正常氢电极(NHE))比O₂/•O₂⁻氧化还原电位(-0.33 V vs NHE)更负,CuRhein优先产生¹O₂。另一方面,由于最高占据分子轨道(HOMO)电位(+2.42 V vs NHE)比H₂O/•OH氧化还原电位(+2.38 V vs NHE)更正,UiO-66-NH₂更有利于产生•OH。此外,CuRhein不能产生•OH产物,因为CuRhein HUMO电位高于H₂O/•OH氧化还原电位。总体而言,在超声照射过程中,电子从UiO-66-NH₂转移到CuRhein是通过高效率的电子途径实现的,而空穴被限制在UiO-66-NH₂的HOMO中,导致电子-空穴对的效率空间分离。

图2. CuR@UiO66通过超声刺激产生ROS的机制。(A)非辐照的CuRhein、UiO-66-NH₂和CuR@UiO66产生的TEMP/¹O₂的ESR光谱;(B)超声辐照的CuRhein、UiO-66-NH₂和CuR@UiO66产生的TEMP/¹O₂的ESR光谱;(C)SOSG的归一化荧光强度,表明在超声辐照下(1 W/cm²,1 MHz,50%占空比)磷酸盐缓冲盐溶液(PBS)、CuRhein、UiO-66-NH₂和CuR@UiO66产生¹O₂;(D)DPBF的归一化紫外-可见吸收,表明在超声辐照下(1 W/cm²,1 MHz,50%占空比)PBS、CuRhein、UiO-66-NH₂和CuR@UiO66产生¹O₂(有/无超声辐照);(E)MB的归一化紫外-可见吸收,表明在超声辐照下(1 W/cm²,1 MHz,50%占空比)PBS、CuRhein、UiO-66-NH₂和CuR@UiO66产生·OH,数据为平均值±标准偏差(SD);(F)CuRhein、UiO-66-NH₂和CuR@UiO66的紫外-可见漫反射光谱;(G)CuRhein、UiO-66-NH₂和CuR@UiO66的带隙;(H-J)CuRhein、UiO-66-NH₂和CuR@UiO66的Mott-Schottky(M-S)图;(K)CuR@UiO66的电荷密度;(L)CuR@UiO66在超声辐照下产生ROS的Z型机制示意图
(3)CuR@UiO66选择性靶向B淋巴细胞
为了提高CuR@UiO66对B淋巴瘤细胞的靶向能力,将抗CD19抗体与CuR@UiO66偶联,并引入mPEG-PO3以增强生物相容性,得到纳米复合材料CRUPPA19(图3A)。用DPBF和MB探针检测活性氧证实,这些改性不会影响其声动力活性。使用共聚焦显微镜评估Cy3标记的CRUPPA19在A20细胞和原代单核细胞中的摄取情况(图3B)。结果表明,CRUPPA19可以被CD19过表达的B淋巴细胞选择性摄取。细胞内的Rhein在发射520 nm(激发488 nm)时检测到绿色荧光。用CRUPPA19处理的A20细胞在无超声刺激时无绿色荧光信号,而超声照射后荧光增强(图3C),表明超声触发了Rhein的释放。电感耦合等离子体质谱原子发射光谱法(ICP-AES)定量细胞内锆含量进一步证实了这一点(图S18)。共聚焦显微镜共定位分析显示,超声激活后CRUPPA19可进入自噬体(图3D)。通过体外荧光成像和ICP-MS测量不同组织中的锆含量,评估CRUPPA19在A20肿瘤携带小鼠中的生物分布(图3E)。CRUPPA19纳米颗粒用Cy7标记以进行体内成像。结果显示,CRUPPA19在肝脏和脾脏中积累较少,而在肿瘤组织和骨髓中的锆含量和Cy7荧光强度在给药后30分钟达到峰值(图3F–H),表明其可以靶向淋巴瘤组织和骨髓微环境。流式细胞术分析显示,从骨髓中分离出的CD19+淋巴瘤细胞中存在强烈的Cy7信号(图3I、J),进一步证实了CRUPPA19的归巢能力。总之,CRUPPA19的高稳定性、生物相容性和淋巴瘤靶向能力使其成为治疗BCL的理想纳米药物。

图3. CRUPPA19可选择性靶向B淋巴细胞。(A)通过将抗CD19抗体和mPEG-PO₃结合到CuR@UiO66中,说明CRUPPA19合成的示意图;(B)显示A20细胞和正常单核细胞(L929)在孵育30分钟后,Cy3标记的CRUPPA19(红色荧光)摄取的代表性荧光图像,细胞核用4′,6-二氨基-2-苯基吲哚(DAPI)(蓝色)染色,比例尺=20 µm;(C)分别培养额外30分钟和2小时的CRUPPA19或CRUPPA19+US处理的A20细胞的荧光图像,比例尺=20 µm;(D)CRUPPA19或CRUPPA19+US处理的A20细胞自噬体转位分析1小时,比例尺=20 µm;(E)建立小鼠BCL模型和评估体内CRUPPA19分布的示意图;(F)肿瘤携带小鼠的代表性原位荧光图像,显示Cy7标记的CRUPPA19或CRUPP的生物分布;(G)在静脉注射CRUPPA19或CRUPP后24小时,肿瘤、股骨(TB)和主要器官的代表性荧光图像;(H)肿瘤、骨髓(BM)和其他主要器官中Zr含量的变化,表明NPs的生物分布;(I,J)从携带A20小鼠骨髓中提取的淋巴瘤细胞(CD19⁺)中,Cy7标记的CRUPPA19摄取的流式细胞术分析
(4)超声触发的CRUPPA19级联放大以诱导淋巴瘤细胞死亡
使用2,7-二氯荧光素二乙酸盐(DCFH-DA)荧光探针检测了CRUPPA19处理的A20细胞内活性氧(ROS)产生情况。结果显示,经CRUPPA19处理并超声照射后的细胞荧光强烈,表明ROS产生量高(图4A)。通过Annexin V-FITC和7-氨基放线菌素D(7-AAD)双重染色检测细胞凋亡情况,发现CRUPPA19+US处理的细胞凋亡率为54%(早期和晚期凋亡的总和),显著高于其他组(图4B)。使用pCMV-mCherry-GFP-LC3B质粒报告系统量化自噬通量,结果显示CRUPPA19在超声照射下以剂量依赖性方式诱导自噬,而未经照射的CRUPPA19组则缺乏自噬诱导(图4C)。CRUPPA19+US治疗后,自噬特异性底物p62显著下调(图4D),表明自噬被有效诱导。分析CRUPPA19处理的细胞中相关生物标志物的表达水平,发现CRUPPA19介导的声动力治疗(SDT)以剂量依赖性方式导致脂酰化的DLAT寡聚化,铁氧还蛋白1(FDX1)和脂酰合酶(LIAS)的表达下调(图4D)。分析CRUPPA19处理的A20细胞中程序性死亡配体1(PDL1)的表达情况,发现CRUPPA19+US显著降低了PDL1表面蛋白水平(图4E)。进一步的m6A点印迹(图4F)、液相色谱-质谱联用(LC/MS)(图4G)和基因特异性m6A qPCR(图4H)显示,CRUPPA19+US增加了全局m6A RNA甲基化,降低了PDL1转录本(图4I)和PDL1蛋白表达稳定性。总体而言,CRUPPA19在超声照射下触发细胞内级联反应,导致多模态程序性细胞死亡(图4J)。
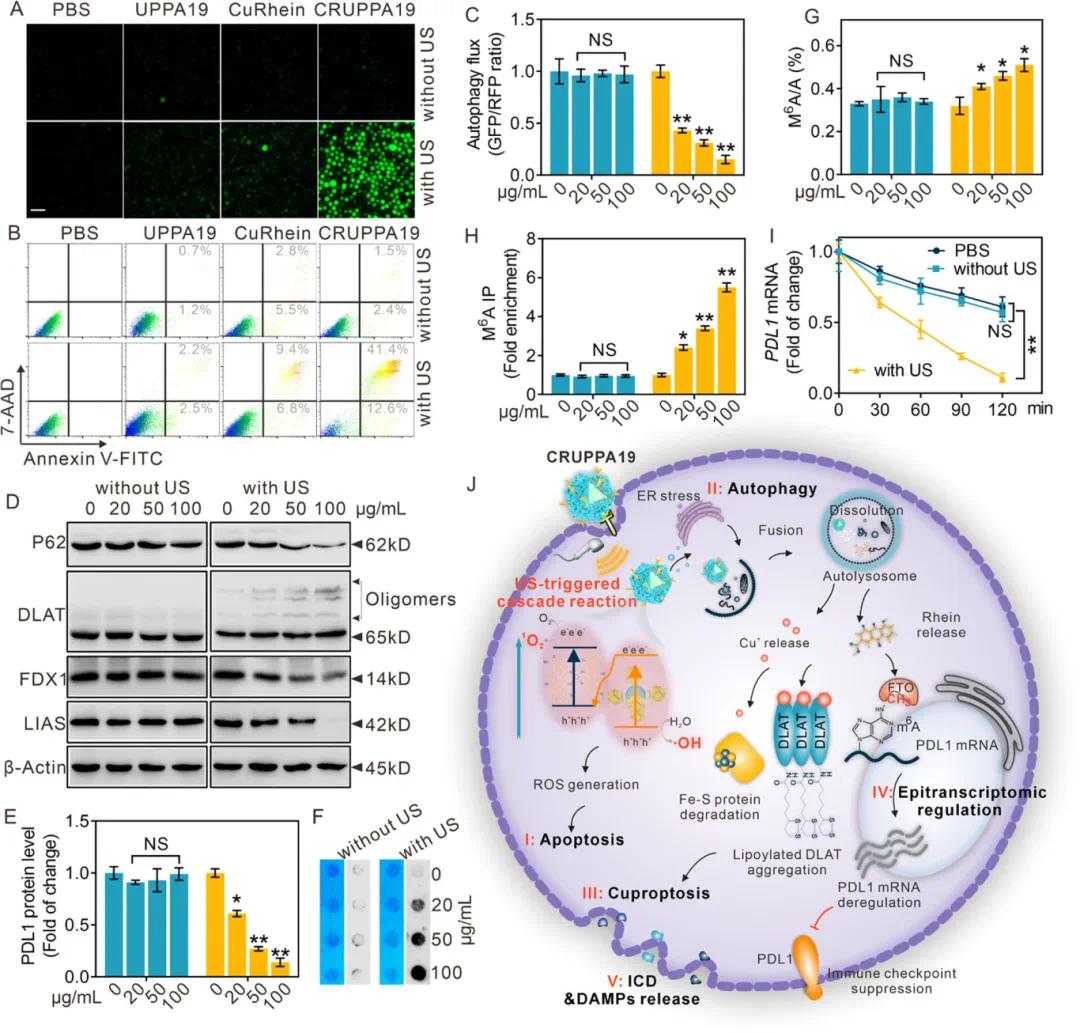
图4. US触发的CRUPPA19级联放大以诱导淋巴瘤细胞死亡。(A)用细胞内¹O₂探针DCFH-DA染色的不同处理A20细胞的代表性荧光图像,标尺=50 µm;(B)流式细胞术图显示经指定处理后annexin V-FITC/7-AAD阳性A20细胞的百分比;(C)绿色荧光蛋白(GFP)/红色荧光蛋白(RFP)比率,表明在适当处理的A20细胞中,经GFP-LC3-RFP报告基因转染后的自噬通量,GFP/RFP比率增加表示自噬通量减少;(D)Western印迹显示A20细胞在1 W/cm²的US照射下,经不同剂量的CRUPPA19处理5分钟后,铜死亡或自噬相关蛋白的表达;(E)经指定剂量CRUPPA19处理的A20细胞的表面PD-L1表达;(F)点印迹和(G)液相色谱串联质谱(LC-MS/MS)测定经指定剂量CRUPPA19处理的A20细胞中的m⁶A mRNA水平;(H)特异性m⁶A定量聚合酶链反应(qPCR)显示经CRUPPA19指定剂量处理的A20细胞中PD-L1 m⁶A-mRNA水平;(I)PD-L1 mRNA稳定性实验:A20细胞用CRUPPA19(100 µg/mL)预处理24小时,然后与放线菌素D(Act-D)孵育指定时间,收集细胞并进行qPCR检测;(J)说明CRUPPA19在体外声动力效应的示意图
使用A20 B淋巴细胞瘤细胞在小鼠中建立双边肿瘤模型(图5A)。将A20细胞移植到每只小鼠的右侧腹部建立原发肿瘤,并在24小时后在左侧腹部建立继发肿瘤。当肿瘤生长到约250 mm³时,将小鼠随机分为11组(每组6只),分别用不同方法治疗。结果显示,PBS和PBS+US组肿瘤快速双边生长,所有小鼠在23天内死亡。UPPA19介导的声动力治疗(SDT)仅抑制原发肿瘤生长10.8%,对远处肿瘤影响弱,导致接种后27天内100%死亡率。Rhein对原发和继发肿瘤分别实现20.5%和17.6%的生长抑制。CuRhein+US治疗导致双侧肿瘤生长抑制(TGI)27.3%和24.5%,并使小鼠生存期延长至38天。抗PDL1和抗CD20抗体治疗的双侧TGI率分别为33.2%和49.7%,生存期分别为37天和43天(P<0.05)。CRUPPA19在无US刺激时对肿瘤生长无明显抑制作用,但CRUPPA19+US实现了初级肿瘤的近完全消融,并抑制了90.4%的远处肿瘤生长,所有小鼠均存活至第80天(图5B-F)。病理染色证实,CRUPPA19+US显著降低了双侧肿瘤组织中PCNA阳性细胞的比例(分别降低了94.6%和95.5%)。CRUPPA19+US显著降低了骨髓中CD19+淋巴细胞的浸润,降低了94.7%(图5G,I),表明其可以消除骨髓深处的游离淋巴瘤细胞。此外,CRUPPA19+US还逆转了肿瘤小鼠的脾肿大(图5H,J)。
评估CRUPPA19在超声照射下的免疫治疗机制,发现接受CRUPPA19和超声照射治疗的小鼠在原发肿瘤组织中HMGB1、CRT和ATP的表达水平高出5倍(图5K),证实了CRUPPA19介导的SDT触发了肿瘤中的免疫原性细胞死亡(ICD)。CRUPPA19+US显著增加了CD80+CD86+成熟DCs的比例至54.3%(图5L),并增加了肿瘤内CD8+T细胞的浸润至27.0%(图5M)。该组中IFN-γ的血清水平最高(图5P),且肿瘤组织中PDL1表达最低,m6A-mRNA水平最高(图5N、O)。这些结果表明,CRUPPA19介导的SDT通过全局m6A-mRNA甲基化下调PDL1,激活T细胞,促进DC成熟并增强CD8+T细胞的肿瘤识别能力。
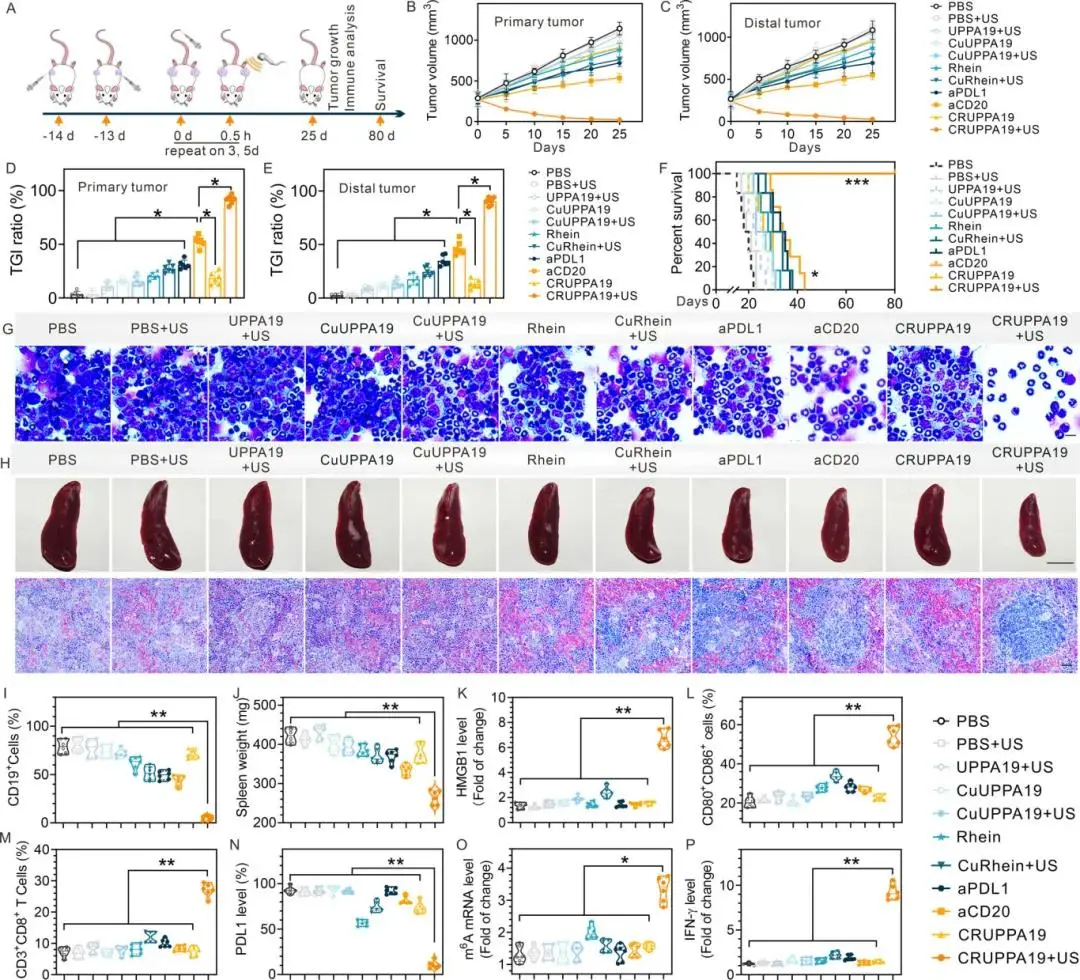
图5. CRUPPA19在淋巴瘤小鼠模型中的超声免疫治疗效应。(A)说明A20双侧肿瘤模型建立和CRUPPA19介导的超声免疫治疗的时间表。(B)所示组别原发肿瘤和(C)远处肿瘤的生长曲线。(D)所示组别原发肿瘤和(E)远处肿瘤的TGI比率。(F)显示不同处理A20携带小鼠80天总生存概率的Kaplan-Meier曲线。(G)接受者小鼠Wright-Giemsa染色骨髓(BM)涂片的代表性图像。标尺=20μm。(H)所示组别脾脏和相应的苏木精和伊红(H&E)染色组织切片的代表性图像。标尺=1 cm(脾脏图像);100μm(H&E染色)。(I)所示组别A20携带小鼠中CD19+淋巴瘤细胞的百分比。(J)所示组别脾脏重量。(K)所示组别原发肿瘤中HMGB1的相对表达水平。(L)所示组别远处肿瘤中成熟DCs的百分比(CD80+CD86+细胞在CD11c+细胞上筛选)。(M)指示组远端肿瘤中CD8+T细胞(在CD3+T细胞上筛选)的百分比。(N)指示组远端肿瘤中PDL1的表达。(O)通过LC/MS测量的远端肿瘤中m6A mRNA水平。(P)指示组血清中IFN-γ水平
由于原发性肿瘤异质性高且广泛浸润骨髓,使用常规疗法治疗 BCL 具有挑战性。尽管免疫疗法对某些患者有效,但相当一部分患者仍然没有反应并最终复发。 该研究开发了 CRUPPA19,一种基于 MOF 的新型“表观纳米声敏剂”,通过声免疫疗法消灭原发性淋巴瘤和浸润性淋巴瘤细胞。封装的 Cu 和大黄酸复合物有效地使 MOF 宿主敏感并主导带结构,从而产生高声动力学活性。此外,CRUPPA19 有效地在淋巴瘤组织中积累,并靶向浸润到骨髓的CD19 +淋巴细胞。CRUPPA19 NPs通过CD19 受体在淋巴瘤细胞中内吞,并在超声刺激下触发级联扩增,从而诱导程序性细胞死亡。CRUPPA19 介导的 SDT 通过触发 ROS 的产生来诱导细胞凋亡。随后,SDT 激活自噬导致 CRUPPA19 崩解,NPs 释放的 Cu 和大黄酸增加蛋白质脂化和整体 mRNA 甲基化,导致杯状凋亡和 PDL1 转录下调。此外,这些级联诱导 ICD 并促进肿瘤微环境中 DC 的成熟,从而增强 CD8+T 细胞的浸润和随后对肿瘤细胞的识别。最后,CRUPPA19 介导的声免疫疗法抑制了原发性肿瘤生长,抑制了转移,并从 A20 淋巴瘤小鼠的骨髓中消除了淋巴瘤细胞。 这项研究扩展了针对实体和血液系统恶性肿瘤的纳米表观遗传治疗的概念,并为治疗所有类型的 BCL 提供了另一种视角,可以转化为临床环境。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

