
血管内栓塞术是一种微创介入治疗手段,通过将栓塞剂输送至目标血管实现血流阻断,广泛应用于出血性疾病、动静脉畸形、动脉瘤及实体瘤的治疗中。现有临床栓塞剂主要包括固体栓塞剂(如弹簧圈、聚乙烯醇、明胶颗粒)和液体栓塞剂(如n-BCA、Onyx 和 PHIL)。尽管液体栓塞剂具备良好的远端血管填充能力,但其存在高温聚合、溶剂毒性、导管粘连、异位栓塞等安全隐患,限制了其临床应用。
近年来,基于生物相容性聚合物构建的水凝胶因其良好的生物相容性、可注射性和原位成胶能力,被视为具有前景的新型液体栓塞剂。已有研究尝试通过pH、金属离子或光照触发水凝胶在血管内原位凝胶化,但这些外部刺激方式操作复杂或可能引起血管壁损伤,限制了临床转化。
为克服此类问题,研究者尝试开发可注射、剪切稀化型水凝胶,其通过物理注射过程实现成胶,展现出良好注射性与栓塞性能。然而,该类水凝胶仍存在被血流冲走的风险,稳定性不足。因此,亟需设计一种可在血液内环境中自发触发、具备阶段性转化能力的水凝胶,以实现精准、安全、持久的血管内栓塞效果,满足更高安全性与可控性的临床需求。

针对上述问题,中大五院彭欣副研究员和单鸿教授、湘雅医院廖伟华教授团队合作开发了一种血液触发相变水凝胶,由季铵化壳聚糖(QCS)、单宁酸(TA)和碘海醇(I)组成,简称QTI水凝胶。该体系在接触血液后无需额外刺激即可从柔软、可注射状态快速转化为稳定硬化的栓塞体(QTI-血液水凝胶),具备显著的操作简便性与快速封堵能力。QCS与TA之间通过静电作用与氢键形成剪切稀化的可注射QT水凝胶,进一步引入临床用造影剂碘海醇,实现X线不透性。当该水凝胶接触血液时,血液中生理浓度的Na⁺与TA发生配位作用,增强凝胶网络交联密度,从而诱导其发生快速相变,形成力学稳定的硬质凝胶。通过调控QCS和TA的浓度,可精确调节QTI水凝胶的注射性能、成胶时间和最终力学强度,实现针对不同血管病变的个性化调控。在动物实验中,QTI水凝胶在兔和猪的多个动脉模型(肾动脉、破裂股动脉、股深动脉)中展现出优异的栓塞效果,与传统栓塞剂n-BCA相比更具安全性与成型优势。综合来看,该水凝胶具有操作简便、生物相容性良好、成胶可控和栓塞效果显著等优势,展现出作为下一代血管内液体栓塞材料的广阔临床应用前景。该文章于2025年2月14日以《Blood-Triggering Phase Transformational Hydrogel for Endovascular Embolization》为题发表于《Advanced Functional Materials》上(DOI:10.1002/adfm.202420440)。
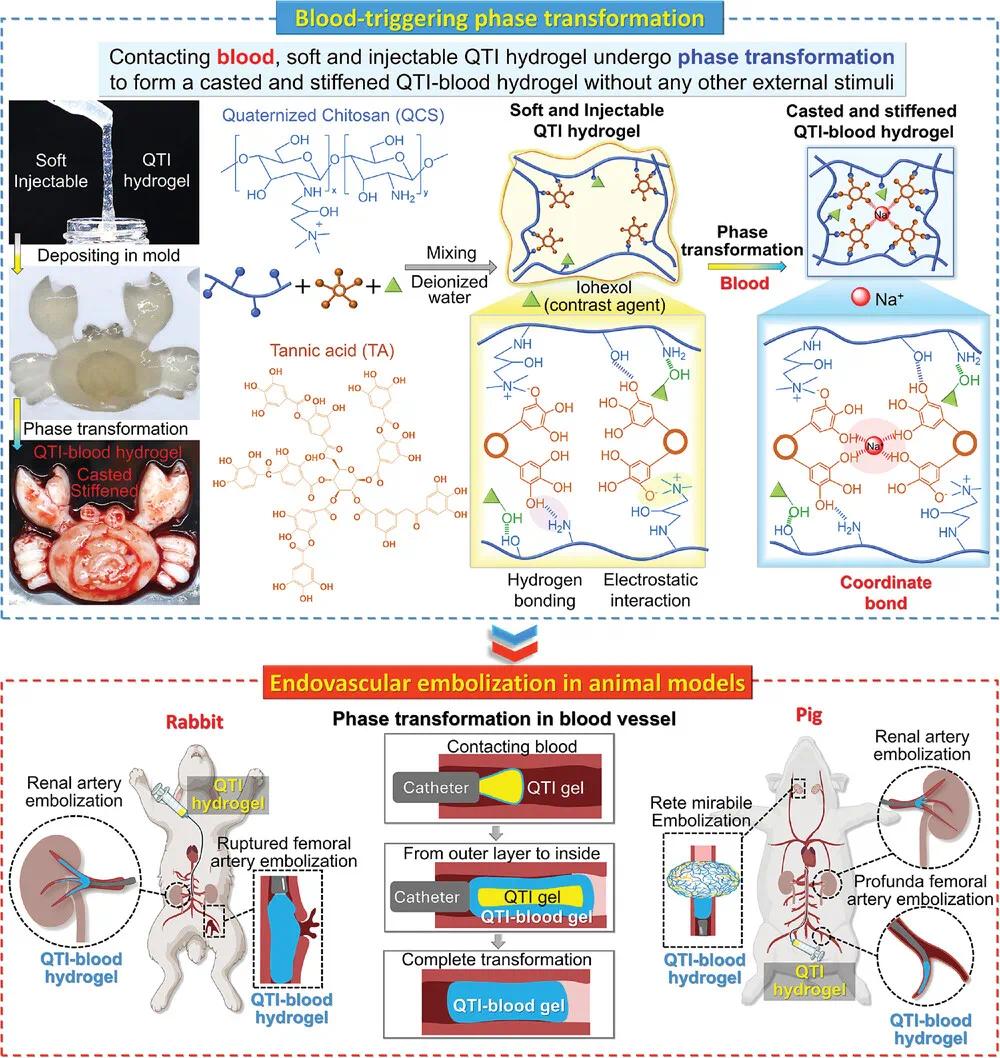
研究示意图
(1)水凝胶的相变和性质
本研究制备的水凝胶因内部相互作用较弱,可顺利通过16 G注射器针头注射。流变测试结果显示,QTI水凝胶在37°C下的储能模量(G′)与损耗模量(G″)在约480%应变处交叉(图1a),表现出显著的剪切稀化行为;在高低应变循环中,其模量可在高应变下转变为液态并在低应变下快速恢复为固态(图1b),体现出良好的动态可逆性能。此外,QTI水凝胶在不同微导管(1.7 F、2.7 F、4 F)中的注射性能测试表明,QTI-3水凝胶的注射力均显著低于50 N的临床上限,显示其具备优异的可注射性和微导管输送能力(图1c)。
QTI水凝胶在接触抗凝血液后可迅速发生相变,形成具有固定形状的铸造硬化QTI-血液水凝胶。其机制源于血液中Na⁺与TA配位,增强凝胶网络的交联密度(图1d)。为探究QTI水凝胶的相变机制,采用NaCl溶液模拟体外诱导环境,并通过FTIR与拉曼光谱分析其交联结构(图1e)。FTIR结果显示,QTI水凝胶中QCS的季铵基(1489 cm⁻¹)和胺基(1658 cm⁻¹)峰消失,说明其与TA羟基形成了静电作用和氢键。同时,QCS、TA和碘海醇的羟基峰整体红移至3463 cm⁻¹,未出现新峰,进一步证实三者通过氢键形成网络结构。拉曼光谱显示,QTI-Na水凝胶在785和1365 cm⁻¹出现新峰,表明Na⁺与TA酚羟基形成配位键,增强了凝胶交联密度。如图1f所示,QTI水凝胶在注入NaCl溶液后外层迅速硬化,随后相变向内推进,并在37°C下约180秒内完成。该逐层相变过程有助于维持内层流动性,便于水凝胶进入小血管,同时外层硬化可防止远端迁移,降低肺栓塞风险。调控QCS与TA浓度可调整相变时间(图1g),实现不同血管层级的选择性栓塞。通过模具成型实验进一步验证了QTI水凝胶良好的成型性与适应性(图1h)。
在37°C下,QTI-Na水凝胶的G′迅速上升,1小时内由42.4 Pa增至683.5 Pa,6小时达1238.8 Pa,随后保持稳定,3天后因降解略有下降(图1i, j)。应变扫描显示其无G′/G″交叉点,具有不可注射、可铸造特性(图1k)。通过调节QCS和TA浓度可调控其流变与力学性能(图1l, m)。此外,30 wt.%碘海醇赋予其优异的X射线不透性,接近临床碘油效果(图1n)。综上所述,由2 wt.% QCS、3 wt.% TA和30 wt.%碘海醇组成的QTI-3水凝胶表现出适中的注射力和完全的相变时间。因此,本研究在后续实验中使用了QTI-3水凝胶。
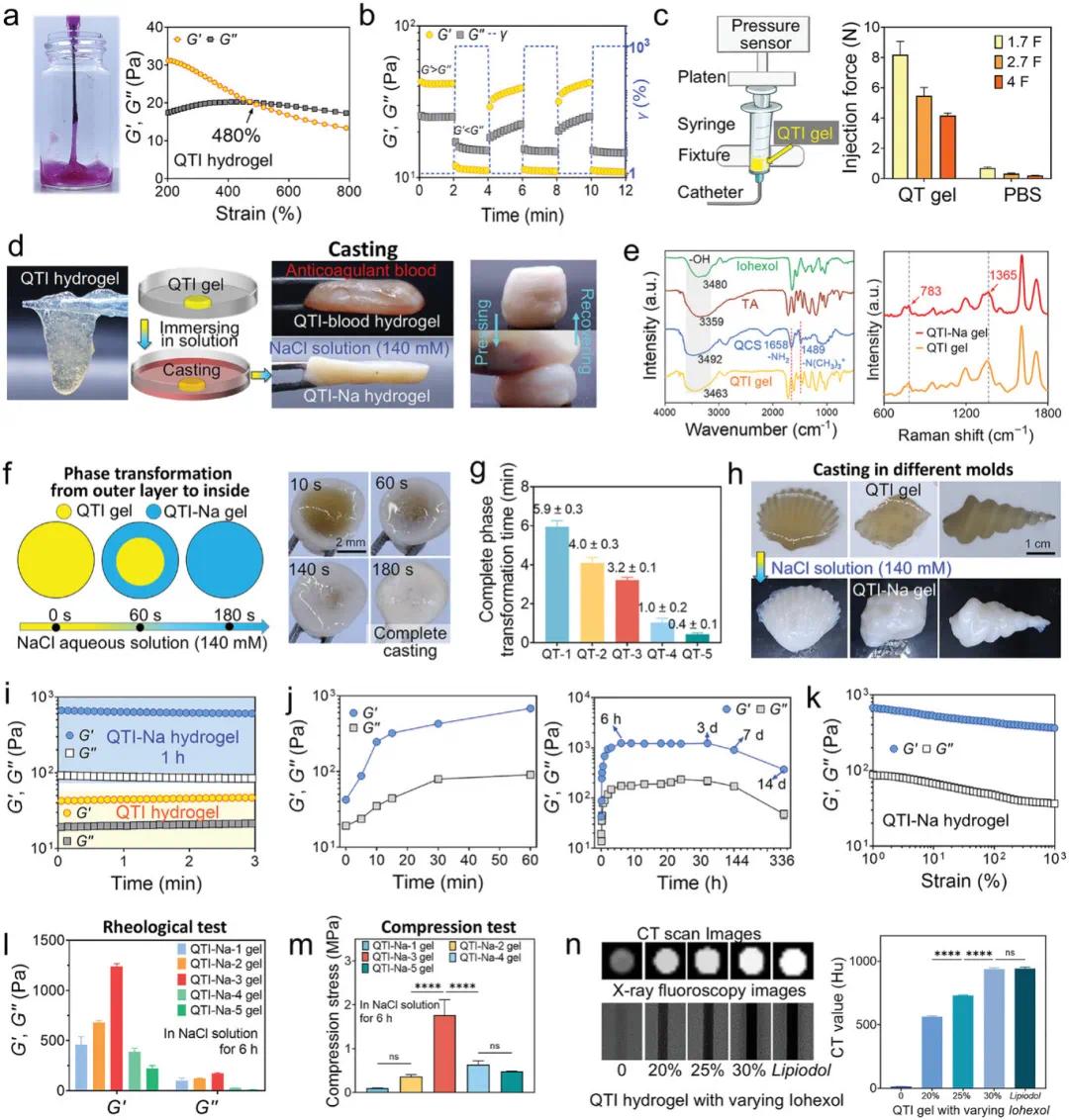
图1. 37°C 下柔软可注射 QTI 水凝胶及其衍生的 QTI-血液和 QTI-Na 水凝胶的制备和特性。a) QTI 水凝胶注射照片(左)和 QTI 水凝胶的应变扫描测量(频率 = 1 Hz)(右)。b) QTI 水凝胶的重复动态应变阶跃测试(γ = 1% 或 1000%,频率 = 1 Hz)。c) 测试 QTI 水凝胶注射力(左)和通过不同微导管测试 QTI 水凝胶和 PBS 注射力(右)的实验示意图。d) 柔软 QTI 水凝胶、硬化 QTI-血液和硬化 QT-Na 水凝胶的照片,以及 QTI-Na 水凝胶的压缩恢复特性。 e) QCS、TA 和干燥 QTI 凝胶的傅里叶变换红外 (FTIR) 光谱(左)以及干燥 QTI 和 QTI-Na 凝胶的拉曼光谱(右)。f) QTI 水凝胶在 NaCl 水溶液(140 mmol L −1)中的相变过程。g) 含有不同 QCS 和 TA 浓度的 QTI 水凝胶在 NaCl 水溶液中的完全相变时间。h) 将 QTI 水凝胶注入模具中,铸造出各种形状的 QTI-Na 水凝胶。i) QTI 和 QTI-Na 水凝胶的G′和G″ 。j) QTI-Na 水凝胶在 NaCl 水溶液中G′和G″的变化。k) QTI-Na 水凝胶的应变扫描测量(频率 = 1 Hz)。l,m) 含有不同浓度 QCS 和 TA 的 QTI-Na 水凝胶的流变性质 l) 和压缩性质 m) n) 不同浓度碘海醇和临床造影剂碘油的QTI水凝胶的计算机断层扫描(CT)和X射线透视图像(左)及CT值
(2)QTI 水凝胶的生物相容性和生物降解性
将QTI水凝胶的生物相容性与n-BCA(一种商业化的液体栓塞剂)进行比较,QTI水凝胶在生物相容性方面优于n-BCA。与红细胞共孵育24小时后,QTI组溶血率仅为4.1%,而n-BCA高达28.1%(图2a)。HUVEC共孵育实验显示,QTI组细胞活力为95.2%,n-BCA组仅为51.85%(图2b)。这表明,QTI水凝胶具有更优的血液相容性、细胞相容性。
将QTI水凝胶与n-BCA注射至大鼠背部皮下组织后,血常规与血清生化无明显差异,未见全身炎症反应(图2c–e)。第7天组织切片显示两组均有中性粒细胞浸润及肉芽组织形成,14与28天后炎症逐渐缓解(图2f–h)。Masson染色显示QTI组的纤维组织增生较n-BCA组更薄,炎症反应更轻(图2i)。结果表明,QTI水凝胶具有良好的生物相容性和安全性,具备临床应用潜力。
最后,研究了 QTI 水凝胶的生物降解性。QTI水凝胶在PBS中可逐渐降解(图2j)。将其与n-BCA分别注射至大鼠皮下后,称重结果显示,QTI水凝胶在第7天和第28天降解率分别为6.5 ± 1.3%和22.1 ± 2.0%;n-BCA无明显降解(图2k)。结果表明,QTI水凝胶具有良好的体内外生物降解性。
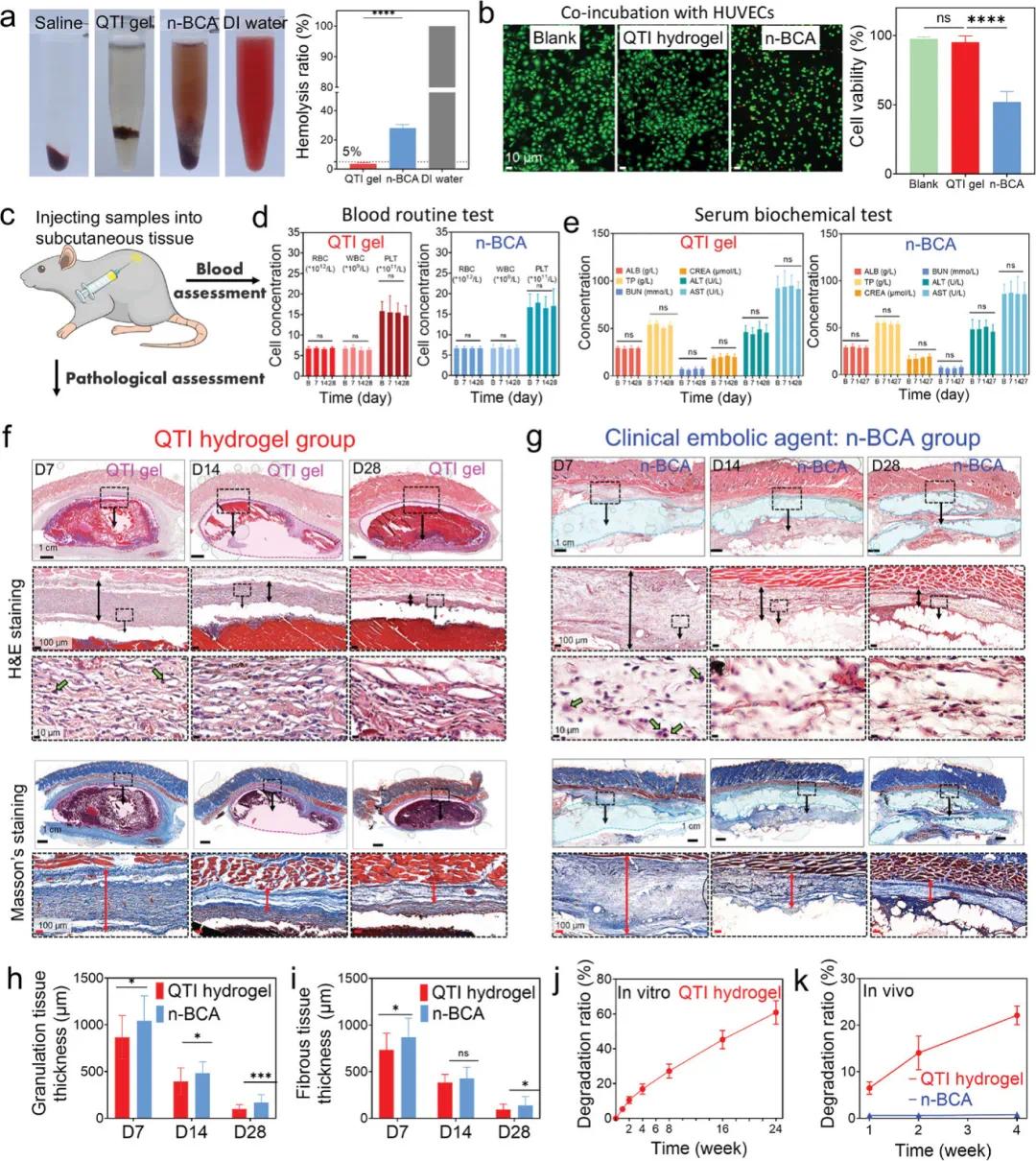
图2. QTI 水凝胶的生物相容性和生物降解性。a) 生理盐水、QTI 水凝胶、n-BCA 和去离子水的溶血图像 (左) 和溶血率 (右)。b) QTI 水凝胶和 n-BCA 与 HUVEC共孵育后的活/死染色图像 (右) 和细胞活力 (左) 。c) 将样品注射到皮下组织的示意图。(d, e) 接受 QTI 水凝胶和 n-BCA 植入的对照组和实验组大鼠的血常规检查 d) 和血清生化检查 e)。f,g) 苏木精-伊红 (H&E) 染色(上)和 Masson 染色(下)QTI 水凝胶 f) 和 n-BCA g) 周围组织的代表性图像,时间为 7、14 和 28 天。h,i) 大鼠皮下移植 QTI 水凝胶和 n-BCA 后 7、14 和 28 天皮肤中肉芽组织 h) 和纤维组织 i) 的厚度。 j) QTI 水凝胶体外降解。k) QTI 水凝胶和 n-BCA 体内降解
(3)QTI水凝胶和n-BCA对兔肾动脉进行栓塞的模型
在新西兰大白兔肾动脉栓塞模型中,通过1.7F微导管将QTI水凝胶(含30 wt.%碘海醇)或n-BCA(与碘油1:2)注入右肾动脉(图3a)。QTI水凝胶逐层硬化并进入小分支,完成铸型栓塞;n-BCA聚合形成胶状物实现封堵。术后造影显示,两组右肾动脉及分支均不显影,提示栓塞成功(图3b)。术后通过NECT、CECT、CTA、CDFI和CEUS评估栓塞效果(图3c)。QTI组栓塞肾体积逐渐减小,影像清晰;n-BCA组则出现伪影,影响评估。CECT和CTA显示QTI组肾动脉无增强,提示完全栓塞;n-BCA组因碘油沉积出现高密度影,难以判断再通情况。CDFI和CEUS未见血流信号,确认两组均实现有效栓塞。总体而言,QTI水凝胶栓塞效果稳定,影像友好,优于n-BCA。
双侧肾脏取材进一步评估栓塞效果(图3d)。栓塞侧肾体积缩小,对侧肾代偿性增大。QTI组H&E染色显示,第7天起肾实质染色变浅,细胞核减少,第28天出现大面积坏死,且未见水凝胶进入微循环。n-BCA组也出现坏死,但程度较轻,部分细胞核仍存。尽管QTI水凝胶缓慢降解(G′下降),但因降解速率低且血管内连续铸型,栓塞效果稳定,不易再通。
H&E染色结果显示,QTI水凝胶可连续铸型至肾动脉并扩散至最小45 µm血管(图3d,e),优于n-BCA的80 µm,表明其具有更强的血管内扩散性。该优势源于QTI水凝胶在血液中逐层硬化,便于深入小血管,而n-BCA快速聚合形成胶状物,难以远端扩散。结果表明,QTI水凝胶更适用于小动脉(≈30 µm)栓塞。
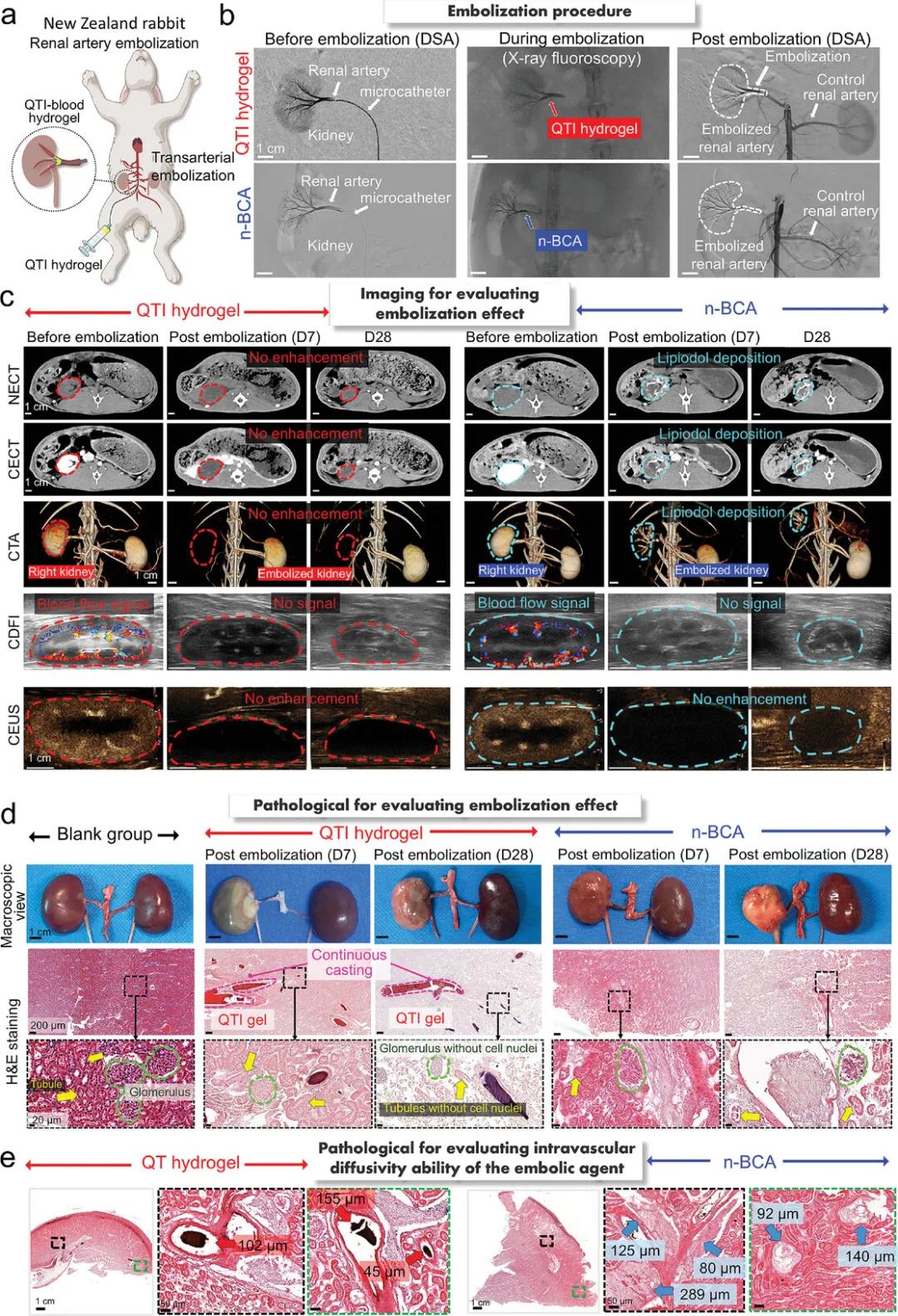
图3. 使用 QTI 水凝胶和 n-BCA 对新西兰兔模型进行肾动脉栓塞。a) 通过动脉栓塞进行肾动脉栓塞的示意图。b) 使用 QTI 水凝胶(上)和 n-BCA(下)栓塞前后右肾动脉的数字减影血管造影 (DSA),以及栓塞过程中的 X 射线荧光图像。c) 使用 QTI 水凝胶(左)和 n-BCA(右)栓塞前后兔肾脏的非增强计算机断层扫描 (NECT)、增强计算机断层扫描 (CECT)、计算机断层血管造影 (CTA)、彩色多普勒血流成像 (CDFI) 和增强超声 (CEUS) 图像。 d) 对照组、QTI 水凝胶组和 n-BCA 栓塞组兔肾宏观图像(上图)和肾实质代表性 H&E 染色图像(下图)。e) QTI 水凝胶组和 n-BCA 组肾实质代表性 H&E 染色图像
(4)QTI水凝胶和n-BCA对兔股动脉出血进行栓塞治疗
为验证QTI水凝胶在急性出血性病变中的止血效果,建立兔股动脉穿刺出血模型(图4a)。在DSA下可见造影剂外溢(黄色虚线),注入QTI水凝胶或n-BCA后,造影剂消失,出血动脉封堵,止血成功(图4b)。拔出微导管时,QTI组无水凝胶残留,n-BCA则粘附于导管尖端(图4c)。第7天和第28天通过NECT、CECT、CTA及CDFI评估股动脉栓塞后是否再通(图4d)。QTI水凝胶组在所有成像中均未见股动脉显影,提示血管闭塞;n-BCA组因碘油沉积产生伪影,难以判断再通情况(青色虚线框)。CTA显示两组后肢远端血管通畅,未见水凝胶移位。CDFI图像证实两组栓塞血流信号消失,表明栓塞持续有效。重要器官CECT未见异常密度变化,说明QTI水凝胶未诱发异位栓塞。综上,QTI水凝胶可稳定、有效地封堵破裂股动脉,避免再通和远端栓塞,具有良好安全性。
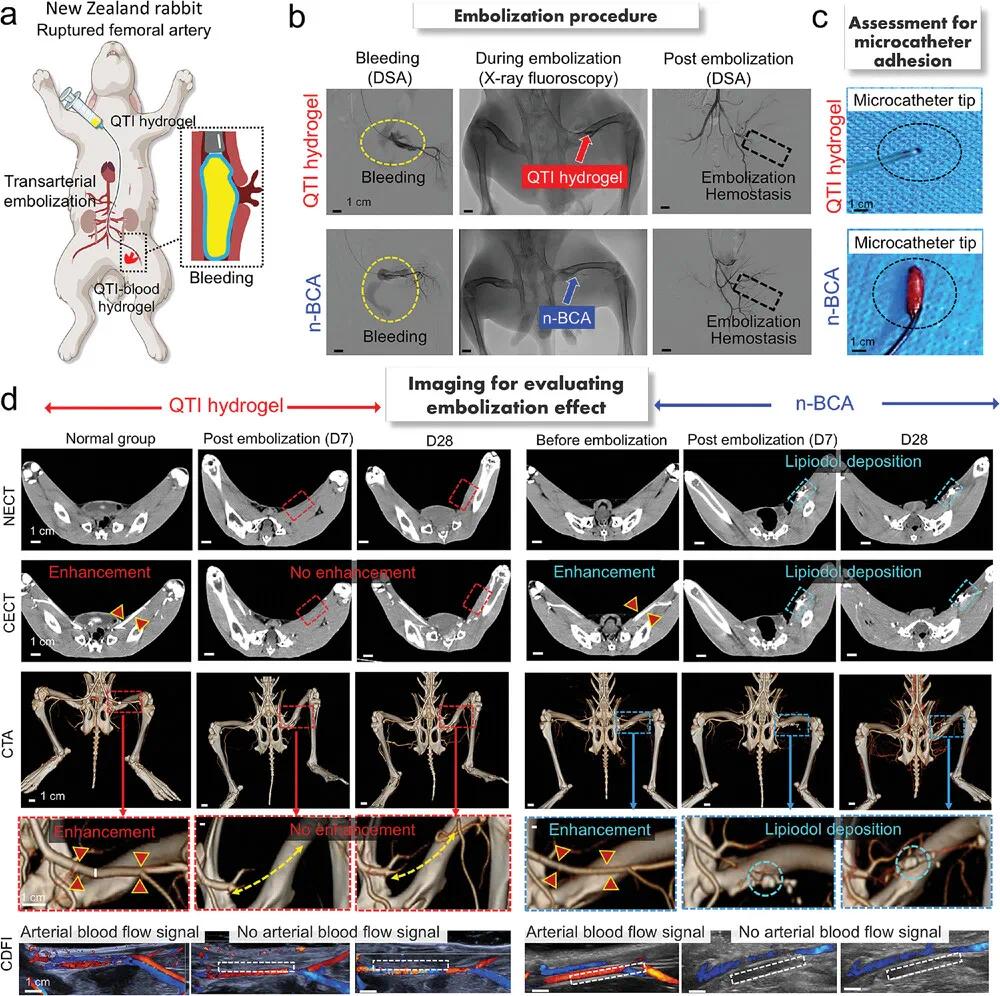
图4. 兔股动脉出血栓塞模型。a) 经动脉栓塞兔股动脉出血栓塞模型示意图。b) 破裂股动脉分别用QTI水凝胶(上)和n-BCA(下)栓塞前后DSA扫描,以及栓塞过程中的X射线荧光图像。c) 微导管拔除后QTI-血液水凝胶和n-BCA对微导管粘附性的评估。d) 正常兔和用QTI水凝胶(左)和n-BCA(右)栓塞的兔在第7天和第28天的NECT、CECT、CTA和CDFI图像
(5)QTI水凝胶在猪肾动脉栓塞模型中的应用
为进一步验证QTI水凝胶的栓塞效果及临床转化潜力,在猪的终末器官动脉(左肾动脉)进行临床前评估(图5a)。在超声引导下穿刺右股动脉并置入4F鞘,经股动脉路径将4F Cobra导管选择性插入左肾动脉造影,确认血管通畅后,通过1.7F微导管缓慢注入QTI水凝胶。术后造影显示左肾动脉及其分支(红色箭头)完全消失,提示栓塞成功(图5b)。术后第7天和第56天,采用NECT、CECT、MPR和CTA评估栓塞效果。结果显示栓塞肾脏体积逐渐缩小,未见强化,CTA提示左肾动脉完全闭塞(图5c)。H&E染色显示肾实质大面积凝固性坏死,肾小球及肾小管细胞核减少,水凝胶未进入微循环(图5d)。图5e显示,QTI水凝胶均匀铸型于肾动脉,伴随血管壁破坏变薄;图5f进一步证实其可深入至直径23和40 µm的小分支。以上结果说明,QTI水凝胶通过外层快速硬化防止扩散,整体铸型稳定,实现对肾动脉的有效、持久和安全栓塞,未见再通。
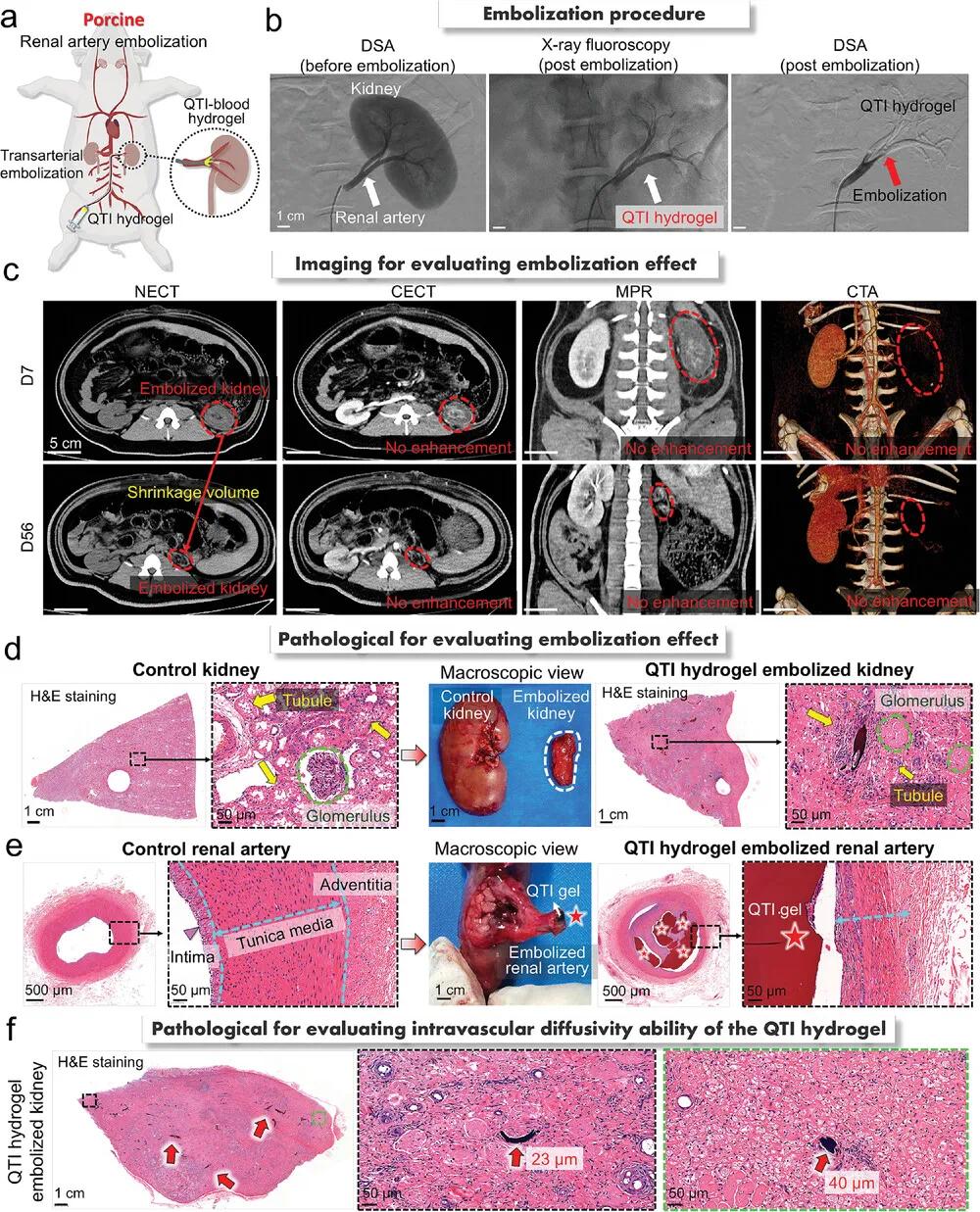
图5.使用 QTI 水凝胶对猪肾动脉进行栓塞。a) 通过动脉栓塞对猪肾动脉进行栓塞的模型示意图。b) 使用 QTI 水凝胶栓塞前后肾动脉的 DSA 图像,以及栓塞过程中的 X 射线透视图像。c) 使用 QTI 水凝胶栓塞后的猪肾的 NECT、CECT、MPR 和 CTA 图像。d) 栓塞组和对照组肾脏的猪肾宏观图像和肾实质的代表性 H&E 染色图像。e) 栓塞组和对照组肾动脉的宏观图像和代表性 H&E 染色图像。f) QTI 水凝胶栓塞组肾实质的代表性 H&E 染色图像
(6)使用QTI水凝胶对猪股深动脉和股动脉网进行栓塞
为拓展临床前验证,选用猪股深动脉(PFA)与股浅动脉(SFA)作为模型。Cobra导管造影确认血管通畅后,在X射线监测下将QTI水凝胶注入左侧PFA。术后造影显示PFA及其分支消失,提示栓塞成功(图6a,b)。CECT与MPR成像显示,第7天与第56天左侧PFA持续闭塞,对侧PFA保持通畅(图6c),表明QTI水凝胶可有效栓塞直径约4 mm的大动脉,且不发生再通,具备应用于人类中等动脉的潜力。为模拟AVM栓塞,在猪模型中选择血管丛状结构的脑网(RM)作为替代(图6d)。通过4F导管插入颈动脉造影,定位升咽动脉(APA)及RM(图6e)。在X射线透视下,将QTI水凝胶均匀注入RM,术后DSA显示RM血管网消失。CECT与CTA图像显示RM及APA(红色箭头)均未显影,提示栓塞成功(图6f)。结果表明,QTI水凝胶可稳定封堵AVM样血管网,具良好安全性和控向性。
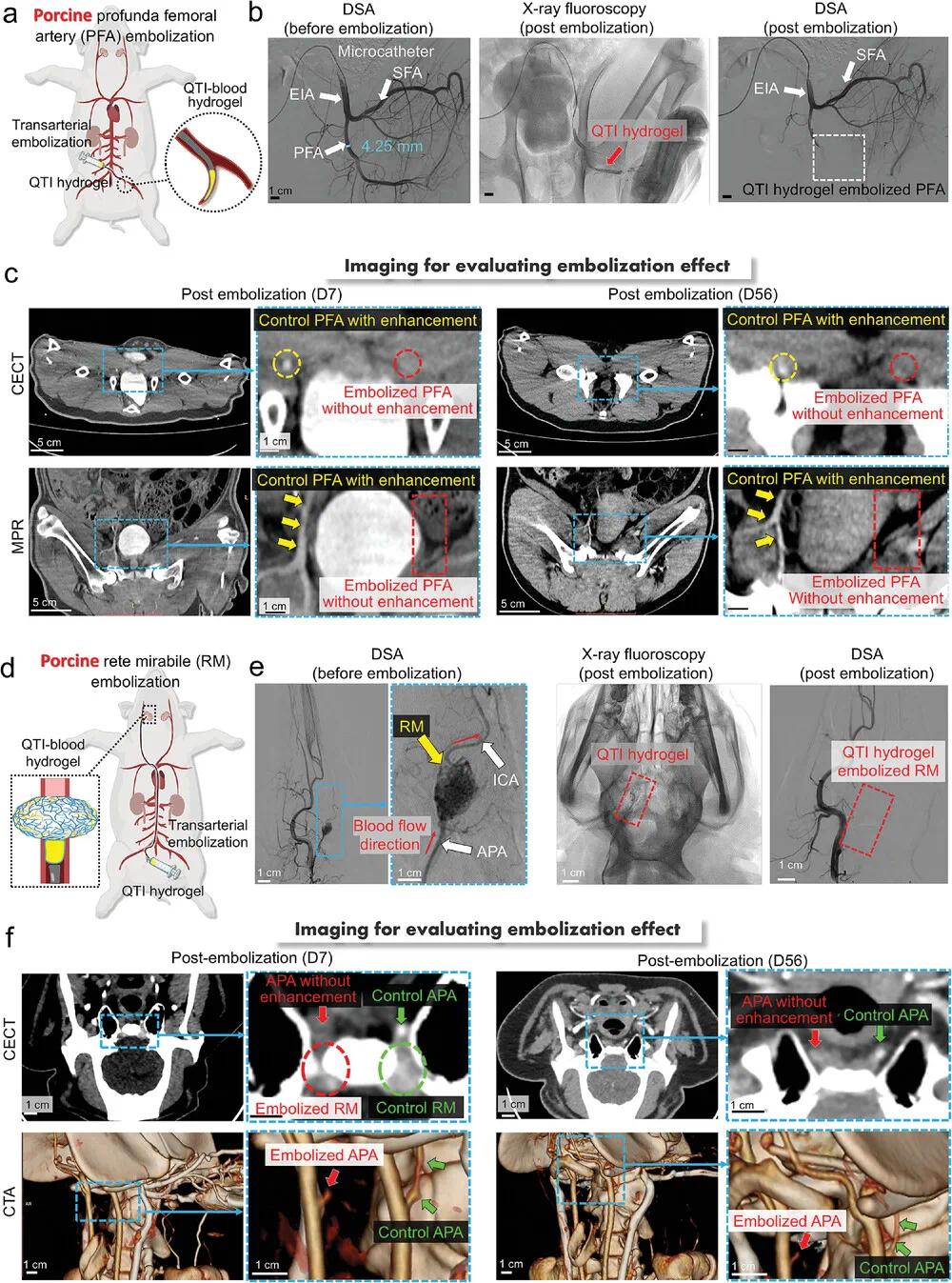
图6.使用 QTI 水凝胶对猪模型中的股深动脉 (PFA) 和股外侧皮 (RM) 进行栓塞。a) 使用 QTI 水凝胶栓塞 PFA 的示意图。b) 使用 QTI 水凝胶栓塞前后 PFA 的 DSA 图像以及栓塞过程中的 X 射线透视图像。c) 使用 QTI 水凝胶栓塞后猪 PFA 的 CECT 和 MPR 图像。d) 使用 QTI 水凝胶栓塞 RM 的示意图。e) 使用 QTI 水凝胶栓塞前后 RM 的 DSA 图像以及栓塞过程中的 X 射线透视图像。f) 使用 QTI 水凝胶栓塞后猪 RM 的 CECT 和 MPR 图像
本研究开发了一种血液触发型液体栓塞剂——QTI水凝胶,该材料由季铵化壳聚糖(QCS)、单宁酸(TA)和碘海醇构成,具备可注射性、剪切稀化性和X线不透性。 QTI水凝胶在接触血液或生理浓度Na⁺后可自发相变为硬化铸型,无需外部刺激,具良好生物相容性与操作便捷性。该相变由外向内进行,赋予其良好的远端血管扩散能力,并可通过调控QCS/TA浓度调节注射力、相变时间和力学性能,实现个性化栓塞。动物实验证实,QTI水凝胶可有效封堵兔肾动脉和破裂股动脉,止血并防止再通;相比n-BCA,表现出更佳的血管内扩散性、非粘附性和更少的影像伪影。在猪模型中,QTI水凝胶成功栓塞终末器官动脉、大动脉(≈4 mm)及血管丛状结构,均未出现再通或异位栓塞。 综上,QTI水凝胶具备优异的可控相变、良好生物性能和成像兼容性,未来有望应用于血管内栓塞、肿瘤消融及药物递送等多种介入治疗场景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

