
研究背景:
伤口治疗给全球医疗保健系统带来了沉重负担,每年影响大量人群且成本高昂。其中,糖尿病足溃疡困扰着众多患者,截肢风险也不容小觑。急性伤口愈合有其固定的顺序,而慢性伤口常停滞在早期炎症阶段,这与糖尿病引发的高糖微环境密切相关。高糖微环境会导致慢性炎症及细菌生物膜的形成。鉴于此,抗高血糖成为糖尿病伤口愈合治疗的关键部分。
随着纳米技术的发展,纳米材料在生物医学领域的应用潜力巨大。金纳米颗粒虽具有葡萄糖氧化酶活性,可用于相关治疗,但因其尺寸小,易被清除,药代动力学问题较为突出。相比之下,原位递送系统保留时间长,适合长期管理血糖。改变金纳米颗粒的形态,如将其制成金纳米线,可提升疗效。然而,金纳米线容易聚集。因此,开发能在注射前后转变形态的金纳米材料,并采用协同治疗模式,对于应对糖尿病伤口复杂生理环境下的治疗难题具有重要意义。

针对上述问题,山东第一医科大学王昌龙教授团队开发出形态可切换的Au纳米线(ANW),与血红蛋白(Hb)-白藜芦醇(RES)纳米颗粒(HR)经微针共同递送,用于糖尿病伤口的协同治疗。制备时,通过调节聚乙二醇(PEG)的量和超声处理将ANW转变为Au纳米球(AS)以提高递送效率;治疗时,AS浓度依赖性解聚为ANW,凭其葡萄糖氧化酶活性持续消耗葡萄糖。将该纳米材料用于PVA微针并与HR共递,在STZ诱导的糖尿病小鼠模型中,微针降解,HR协同改善缺氧、清除ROS、抑制巨噬细胞向M1表型分化,ANW持续降糖。本研究提出糖尿病伤口愈合中长期控糖新策略,并应用于基于微针的协同治疗系统。该文章于2025年3月11日以《Co-Delivery of Morphologically Switchable Au Nanowire and Hemoglobin-Resveratrol Nanoparticles in the Microneedle for Diabetic Wound Healing Therapy》为题发表于《Advanced Materials》(DOI:10.1002/adma.202419430)。
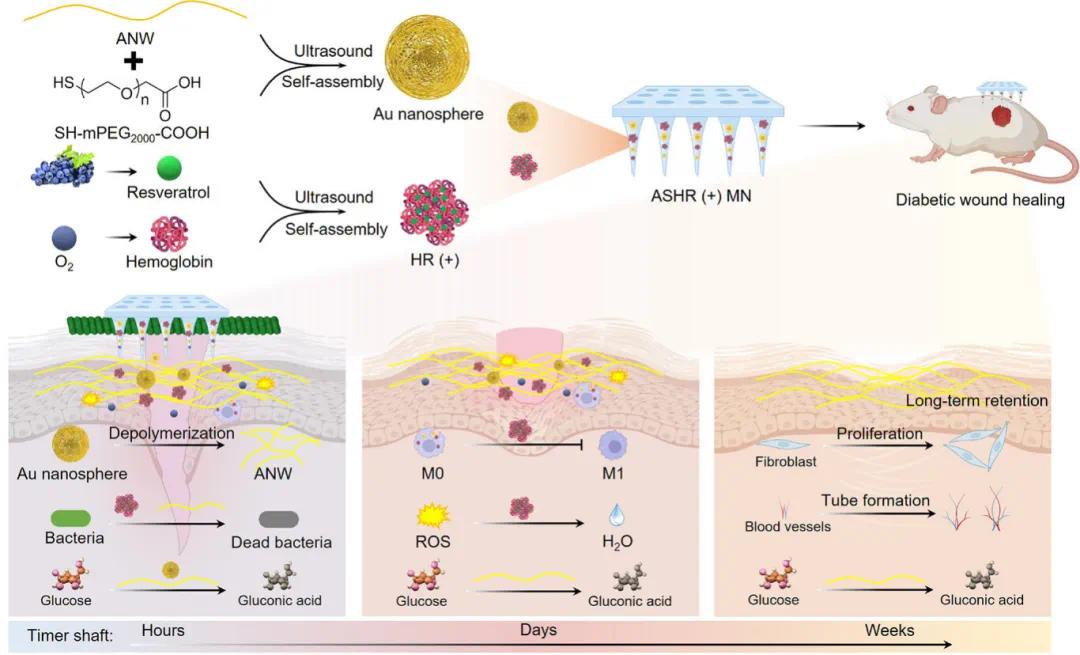
研究示意图
(1)ANW与AS的构建与表征
本研究选用直径约1.6纳米、长度达数微米的超薄金纳米线(ANW)作为降糖剂,通过简单溶液还原法合成,并在室温下用SH-PEG2000-COOH(PEG)替换其表面的油胺(OA)封端配体(图1A)。高分辨率透射电子显微镜(HRTEM)图像显示,ANW-PEG长度超4微米,直径始终低于2纳米(图1B)。HRTEM成像结合能量色散X射线(EDX)图谱及光谱分析确认了金纳米线的成功构建(图1C、D)。不同形式的ANW(ANW-OA和ANW-PEG)的葡萄糖氧化酶活性测试表明,ANW-PEG因去除了致密的油胺层而展现出高葡萄糖消耗效率,验证了其在糖尿病伤口区域消耗葡萄糖的可行性(图1E)。在超声条件下,通过调节PEG浓度,开发了形态可切换的ANW,将其转变为金纳米球(AS)。当PEG浓度从10微克/毫升降至8微克/毫升时,纳米线开始自组装成环;当PEG浓度为5微克/毫升时,出现粒径约200纳米的纳米球;当PEG浓度降至2微克/毫升时,AS粒径无明显变化,但进一步降至0.5微克/毫升时,ANW开始团聚沉淀(图1F、G)。透射电子显微镜(TEM)图像显示,组装的AS直径在150至300纳米之间(图1H),HRTEM成像结合元素图谱及EDX光谱分析进一步确认了AS的成功构建(图1I、J)。自组装成AS后,其Zeta电位从−15.7±0.5毫伏降至−13.42±0.8毫伏(图1K)。当AS浓度稀释至0.01毫克/毫升(金)时,开始解聚为分散的ANW,而浓度高于0.1毫克/毫升(金)时保持稳定,这可能归因于在低浓度下,疏水-亲水平衡被打破,水合作用增强,导致稳定性下降(图1L、M)。
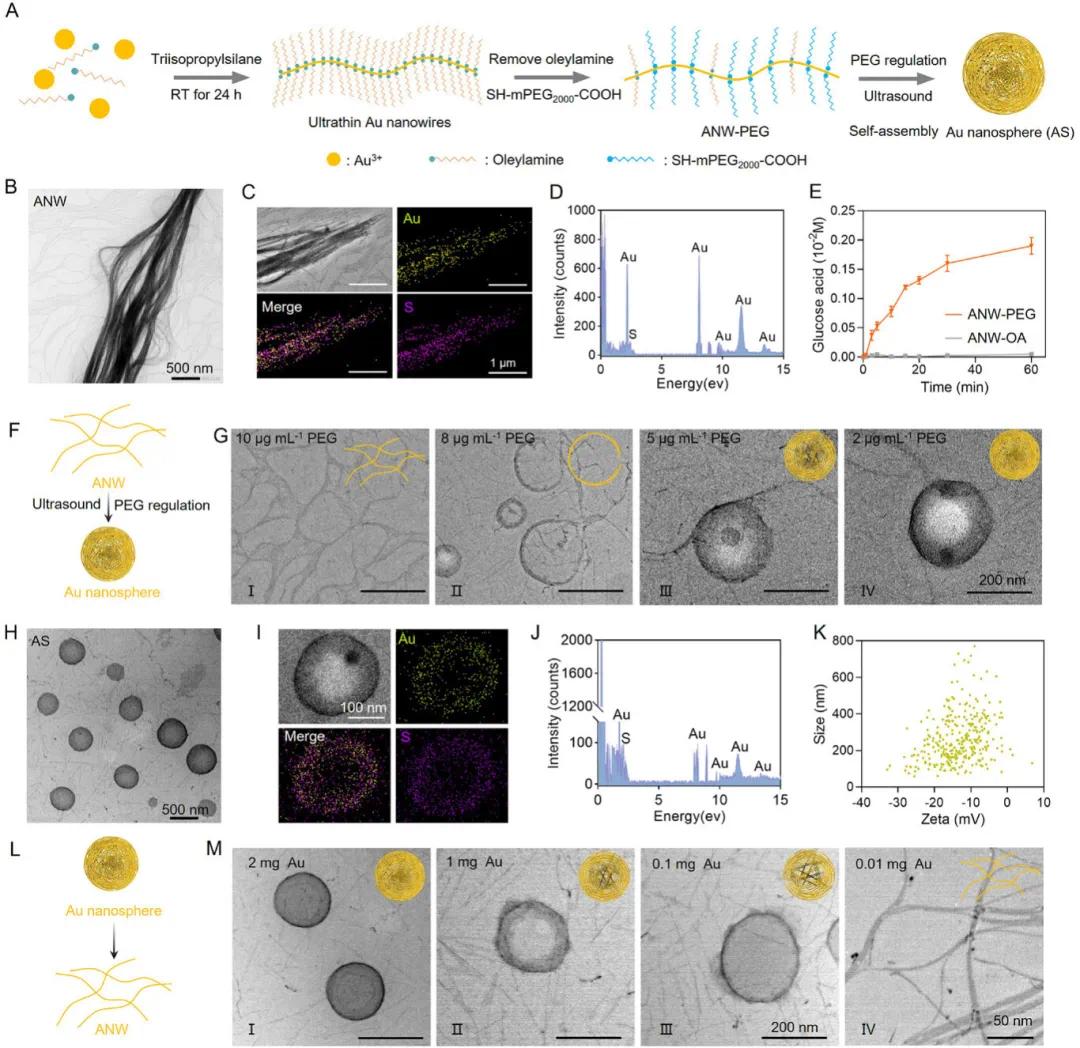
图1. 金纳米球(AS)纳米颗粒的构建与表征。A)金纳米线和金纳米球的合成示意图;B)ANW-PEG(聚乙二醇修饰的金纳米线)的透射电子显微镜(TEM)图像;C)ANW-PEG的高分辨率透射电子显微镜(HRTEM)图像和能量色散X射线(EDX)图谱;D)ANW-PEG的EDX光谱微分析;E)分别与ANW-OA(油胺修饰的金纳米线)和ANW-PEG孵育的葡萄糖溶液中葡萄糖酸浓度变化曲线;F)AS自组装过程的示意图;G)经不同浓度的SH-PEG2000-COOH(PEG)超声处理后ANW的典型TEM图像;H)ANW-PEG2000超声处理30分钟后,水中AS的TEM图像;I)AS的典型HRTEM图像和EDX图谱;J)AS的EDX光谱微分析;K)通过纳米颗粒跟踪分析(NTA)得到的AS的粒径和ζ电位分布;L)AS解聚过程的示意图;M)在不同浓度的分散于水中的AS解聚过程的典型TEM图像
(2)ASHR微针的构建和表征
将金纳米球(AS)与由携氧血红蛋白(Hb)和抗炎白藜芦醇(RES)自组装而成的HR纳米颗粒共同封装到微针中,用于协同治疗(图2A)。TEM和DLS测量显示,HR纳米颗粒的粒径约为150纳米,表面电位约为−30毫伏(图2B、C)。HR纳米颗粒在4℃的PBS中储存八天后粒径无明显变化,表现出良好的稳定性(图2D)。其UV-vis-NIR光谱显示出RES和Hb的特征吸收峰,证实RES成功负载到Hb中(图2E)。在缺氧环境中,HR纳米颗粒能逐渐释放氧气,保留了携氧和释氧能力(图2F),并保留了清除活性氧(ROS)的能力,ESR光谱显示其对・OH和O₂⁻的清除作用(图2G、H),且随着HR浓度增加,总ROS以剂量依赖的方式减少(图2I)。这些结果表明,HR纳米颗粒可缓解糖尿病伤口的缺氧并清除ROS,与AS降解葡萄糖协同作用,促进有效的伤口愈合治疗。随后,将AS与HR纳米颗粒共同负载到聚乙烯醇(PVA)微针中,微针设计为圆锥形,高度550微米,底部宽度300微米,针间距500微米(图2J、K)。荧光成像和EDX图谱分析显示,HR纳米颗粒和AS在微针中均匀分布,证明ASHR微针构建成功(图2L、M)。携氧HR纳米颗粒(HR(+))与AS的协同效应测试表明,ASHR(+)组中葡萄糖酸的生成量高于ASHR组,说明氧气增强了AS对葡萄糖的催化作用(图2N)。在葡萄糖溶液中,不同浓度的ASHR(+)未观察到DCFH-DA荧光显著增加,表明AS催化葡萄糖反应产生的H₂O₂并未提高ASHR(+)系统中的总自由基水平,这可能归因于HR(+)中的白藜芦醇对自由基的消耗(图2O)。为评估存在生物膜屏障时ASHR(+)的递送效率,建立了模拟伤口屏障的体外模型,生物膜由表达绿色荧光蛋白(GFP)的大肠杆菌在琼脂糖凝胶中形成并培养7天。将标记有Cy5的ASHR(+)微针应用于模具顶部以模拟局部药物递送,同时将游离的ASHR(+)添加到模具顶部作为对照。激光共聚焦显微镜数据显示,微针显著提高了ASHR(+)向目标区域的递送效率(图2P),而游离的ASHR(+)穿透效率有限,主要局限于屏障表面(图2Q),从而阻碍了其到达更深目标区域的能力。总体而言,这些结果表明ASHR(+)微针能够克服慢性伤口中的屏障,将药物直接递送至病变部位以发挥治疗功能。
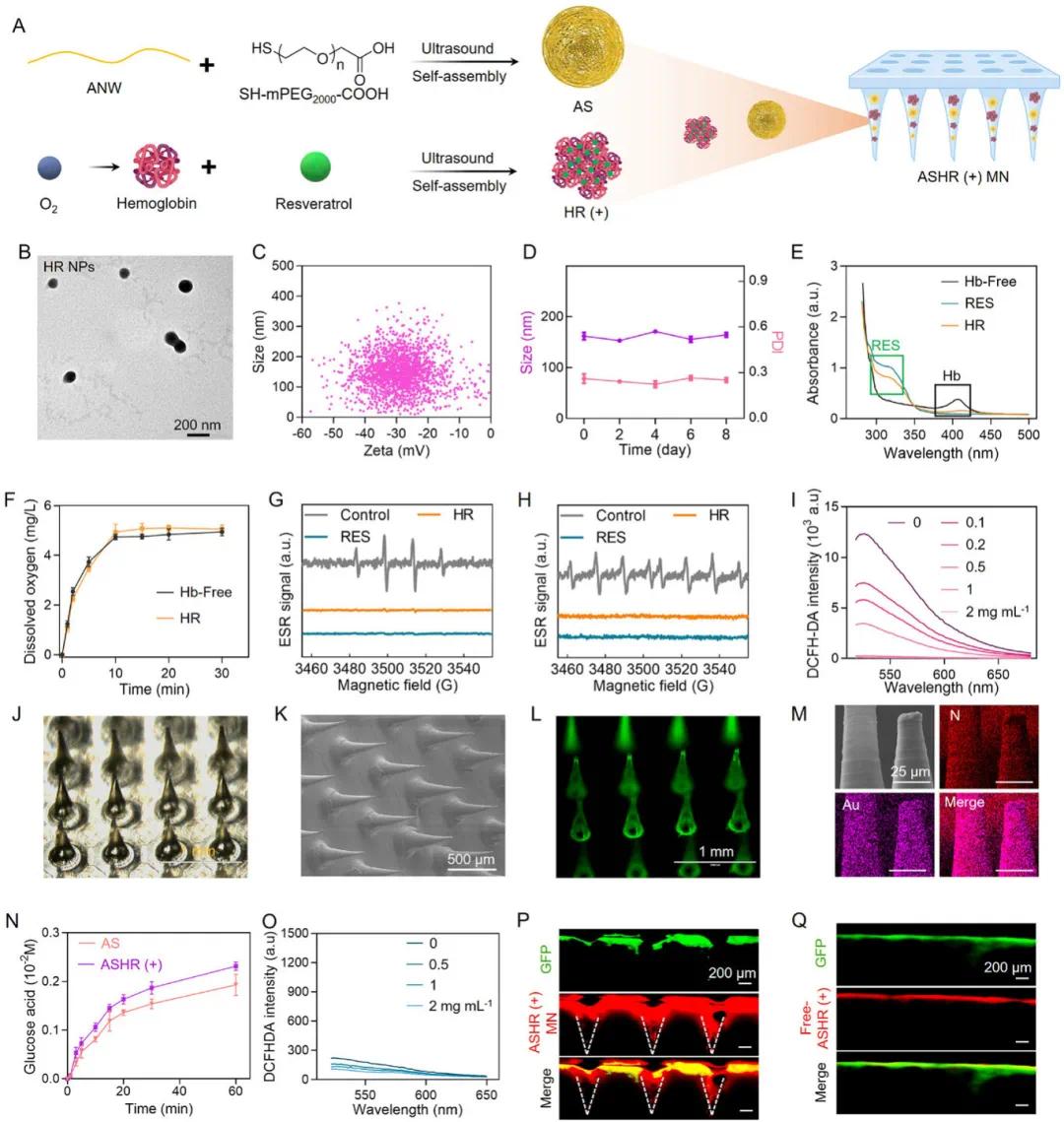
图2. ASHR(+)微针的构建与表征。A)ASHR(+)微针设计的示意图;B)HR纳米颗粒的透射电子显微镜(TEM)图像;C)HR纳米颗粒在水中的粒径和ζ电位;D)HR纳米颗粒八天的稳定性和分散系数变化曲线;E)血红蛋白(Hb)、白藜芦醇(RES)和HR纳米颗粒的紫外-可见-近红外(UV-vis-NIR)吸收光谱;G)加入Hb、RES和HR纳米颗粒后对・OH清除情况的电子自旋共振(ESR)分析;H)加入Hb、RES和HR纳米颗粒后对O2−清除情况的ESR分析;I)以DCFH-DA作为活性氧(ROS)探针,不同浓度的HR纳米颗粒对ROS的清除情况;J)ASHR微针的形态;K)ASHR微针的扫描电子显微镜(SEM)图像;L)ASHR微针的荧光图像;M)ASHR的高分辨率透射电子显微镜(HRTEM)图像和元素图谱;N)与AS微针和ASHR(+)微针孵育后葡萄糖酸浓度变化曲线;O)以DCFH-DA作为ROS探针,ASHR(+)微针对ROS的清除情况;P-Q)ASHR(+)微针(P)和游离的ASHR(+)(Q)在体外生物膜和琼脂糖凝胶中的穿透深
(3)ASHR对糖尿病伤口愈合的体外协同治疗效果分析
在体外研究中,ASHR展现出协同治疗效果。其对金黄色葡萄球菌和大肠杆菌的抑制效率均约为90%,具有广谱且高效的抗菌特性(图3A、B)。死活细胞染色实验进一步证实了ASHR的抗菌效果(图3C),这可能源于超薄金纳米线诱导的氧化应激及白藜芦醇的天然抗菌活性。细胞计数试剂盒-8(CCK-8)检测显示,即使在较高浓度下,ASHR对真核细胞(L929细胞)也几乎无影响(图3D)。在糖尿病伤口愈合过程中,ASHR可降低伤口微环境中的葡萄糖浓度,促进愈合。与PBS组和HR组相比,L929细胞在与AS或ASHR孵育后,细胞内葡萄糖的荧光信号显著降低(图3E、I)。HR有望清除AS消耗葡萄糖过程中产生的过氧化氢(H₂O₂),平衡氧化还原微环境。在营造病理性氧化微环境的条件下,HR纳米颗粒显著降低了细胞内ROS的浓度(图3F、J)。携氧的HR(+)能显著改善细胞缺氧状况,缺氧诱导因子-1α(HIF-1α)免疫荧光染色结果表明,HR(+)在糖尿病伤口愈合中具有缓解缺氧的作用(图3G、K)。在由干扰素-γ(IFN-γ)和脂多糖(LPS)诱导的炎症条件下,含有白藜芦醇的HR组和ASHR组中CD86(M1型巨噬细胞的标志物)表达显著降低(图3H、L),表明白藜芦醇有效调节了巨噬细胞的表型。在缺氧、ROS和高糖条件下,ASHR(+)组表现出最显著的促进L929细胞迁移作用(图3M、N)。此外,ASHR(+)对人脐静脉内皮细胞(HUVEC)具有保护作用。在缺氧、高糖和氧化条件下,ASHR(+)组的线粒体保护效果最佳(图3O、P),且表现出最高的血管生成能力(图3Q)。
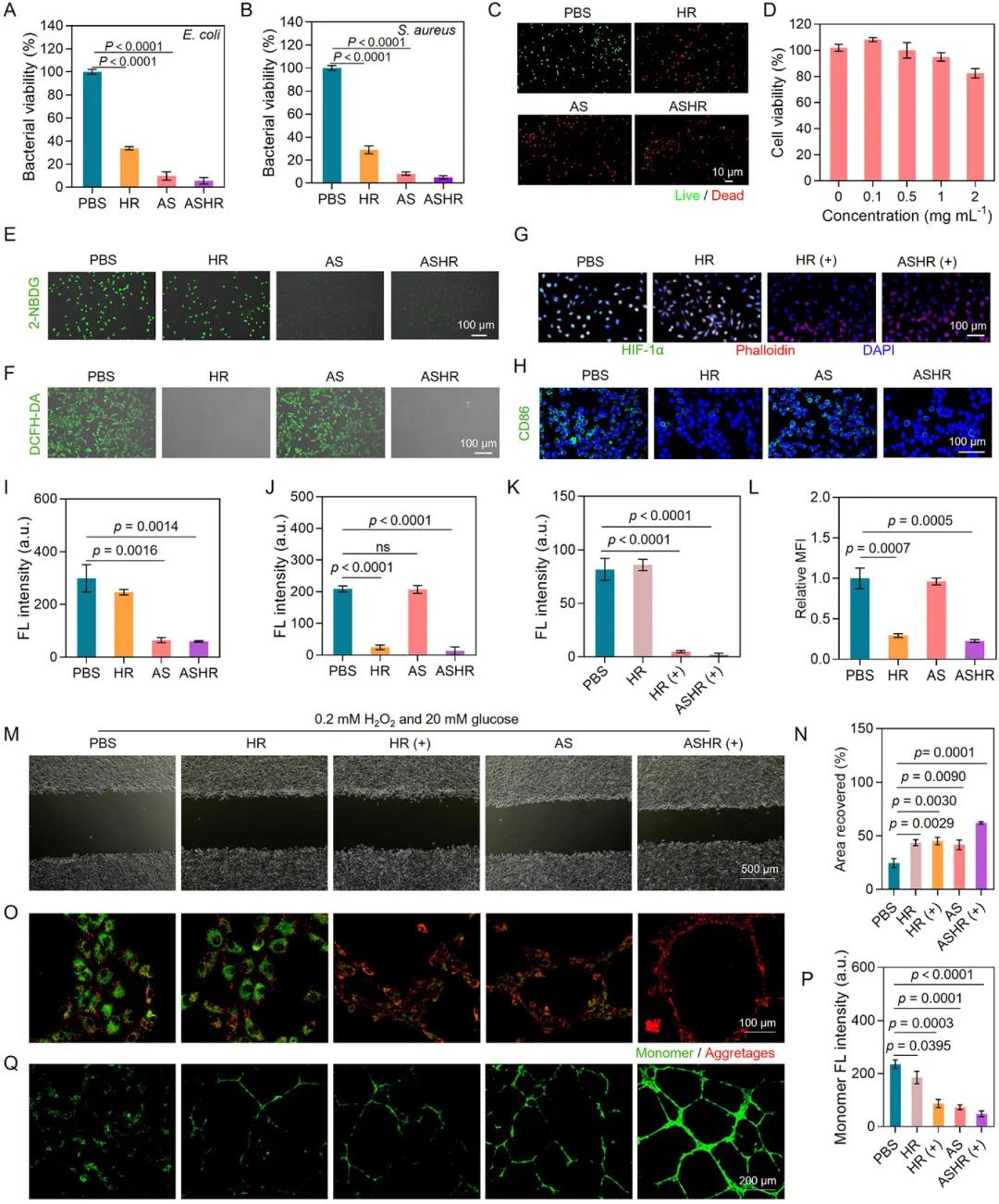
图3. ASHR的体外协同治疗效果分析。A)与磷酸盐缓冲液(PBA)、AS、HR或ASHR孵育后大肠杆菌活性的定量分析;B)与PBA、AS、HR或ASHR孵育后金黄色葡萄球菌活性的定量分析;C)与PBA、AS、HR或ASHR孵育后大肠杆菌的死活细胞染色分析;D)ASHR对L929细胞的细胞毒性评估;E)用PBS、HR、AS和ASHR处理后,与2-NBDG孵育的L929细胞内葡萄糖含量的代表性荧光图像;F)用PBS、HR、AS和ASHR处理12小时后,L929细胞中活性氧(ROS)的代表性荧光图像;G)用PBS、HR、HR(+)和ASHR(+)处理12小时后,L929细胞中缺氧诱导因子-1α(HIF-1α)表达的代表性荧光图像;H)用PBS、HR、AS或ASHR处理12小时后,RAW 264.7细胞中CD86表达的代表性荧光图像;I–L)图(D)、(E)、(F)和(G)的相应定量分析;M)在不同条件下处理12小时后,L929细胞迁移的代表性图像;N)图M中细胞迁移的定量分析;O)用PBS、HR、HR(+)、AS或ASHR处理后,与人脐静脉内皮细胞(HUVEC)用JC-1试剂盒孵育后的线粒体膜电位染色;P)图O中单体的定量分析;Q)不同组处理12小时后,HUVECs管腔形成的代表性图像
(4)糖尿病伤口小鼠模型中的体内分布分析
在糖尿病伤口小鼠模型中,测试了形态可切换的金纳米线(ANW)的效果,并与市售金纳米颗粒(Au NPs)和金纳米球(AS)进行了对比。将Au NPs、ANW和AS用SH-PEG2000-Cy5标记并载入微针中,插入血糖水平为11 mM的空腹小鼠背部区域后,ANW组和AS组的荧光信号至少持续了96小时,而市售Au NPs在6小时内就被迅速清除(图4A、B)。定量分析显示,AS在皮下的保留时间是市售相同尺寸Au NPs的4倍。在插入微针24小时后,处死另一组接受相同处理的小鼠,收集皮肤和主要器官进行荧光成像和组织切片分析。结果显示,AS在皮肤内均匀分散,三维表面图分析中出现多个明显峰值;ANW组呈现聚集结构,表面图中仅出现一个峰值;市售Au NPs已完全代谢,表面图中无峰值,且在肝脏和脾脏中检测到来自Au NPs的荧光信号(图4C-E)。这些数据证实了AS具有更优的分布特性和更长的保留时间。
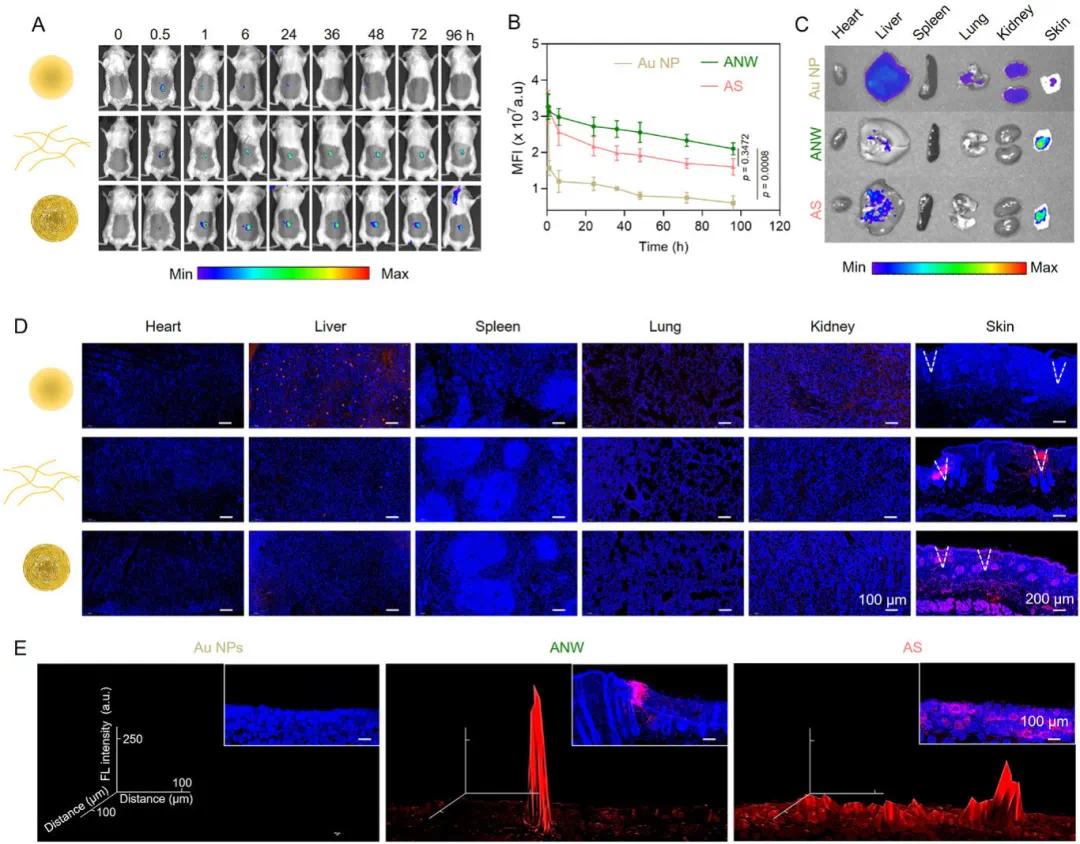
图4. AS微针的体内分布分析。A)给予金纳米颗粒-Cy5微针(Au NPs-Cy5 MN)、金纳米线-Cy5微针(ANW-Cy5 MN)或金纳米球-Cy5微针(AS-Cy5 MN)后,在指定时间点糖尿病模型小鼠的代表性体内荧光图像;B)在(A)中接受不同处理后小鼠皮肤的平均荧光强度(MFI)定量分析;C)接受Au NPs-Cy5 MN、ANW-Cy5 MN或AS-Cy5 MN处理24小时后,切除的皮肤和主要器官的荧光成像;D)接受Au NPs MN、ANW MN或AS MN处理24小时后,皮肤和主要器官的代表性荧光图像;E)使用Cy5荧光通道得到的Au NPs、ANW和AS微针的三维表面图图像
(5)ASHR(+)微针的体内治疗效果分析
在链脲佐菌素(STZ)诱导的糖尿病小鼠伤口模型中,ASHR(+)微针展现出显著的治疗效果。与PBS组相比,HR治疗显著提高了伤口愈合率,而HR(+)组的治疗效果更为显著,这主要归因于携氧血红蛋白改善缺氧的能力以及白藜芦醇的抗炎能力(图5B-D)。值得注意的是,ASHR(+)组的联合治疗效果最为优越。在第15天,ASHR(+)处理的伤口在肉芽组织厚度增加、表皮再生和伤口长度减小方面表现最为显著(图5E)。此外,ASHR(+)组中观察到丰富且排列整齐的胶原纤维,表明其治疗效果最为显著(图5F)。免疫荧光染色结果显示,HR(+)组和ASHR(+)组中缺氧诱导因子-1α(HIF-1α)表达水平显著低于其他组,表明携氧血红蛋白带来了更优越的氧气供应(图5G)。对M1型标志物CD86和M2型标志物CD206的免疫荧光染色显示,HR组、HR(+)组和ASHR(+)组中CD86表达降低,而CD206表达上调,表明M2/M1比值增加,抗炎能力增强(图5H、I)。在血管生成方面,HR(+)组和AS组中CD31的表达显著高于PBS组和HR组,而ASHR(+)组中CD31的表达水平最高,表明其促血管生成能力最为优越(图5J)。因此,ASHR(+)组通过促进表皮形成、胶原沉积和新生血管生成,加速了糖尿病伤口的愈合。
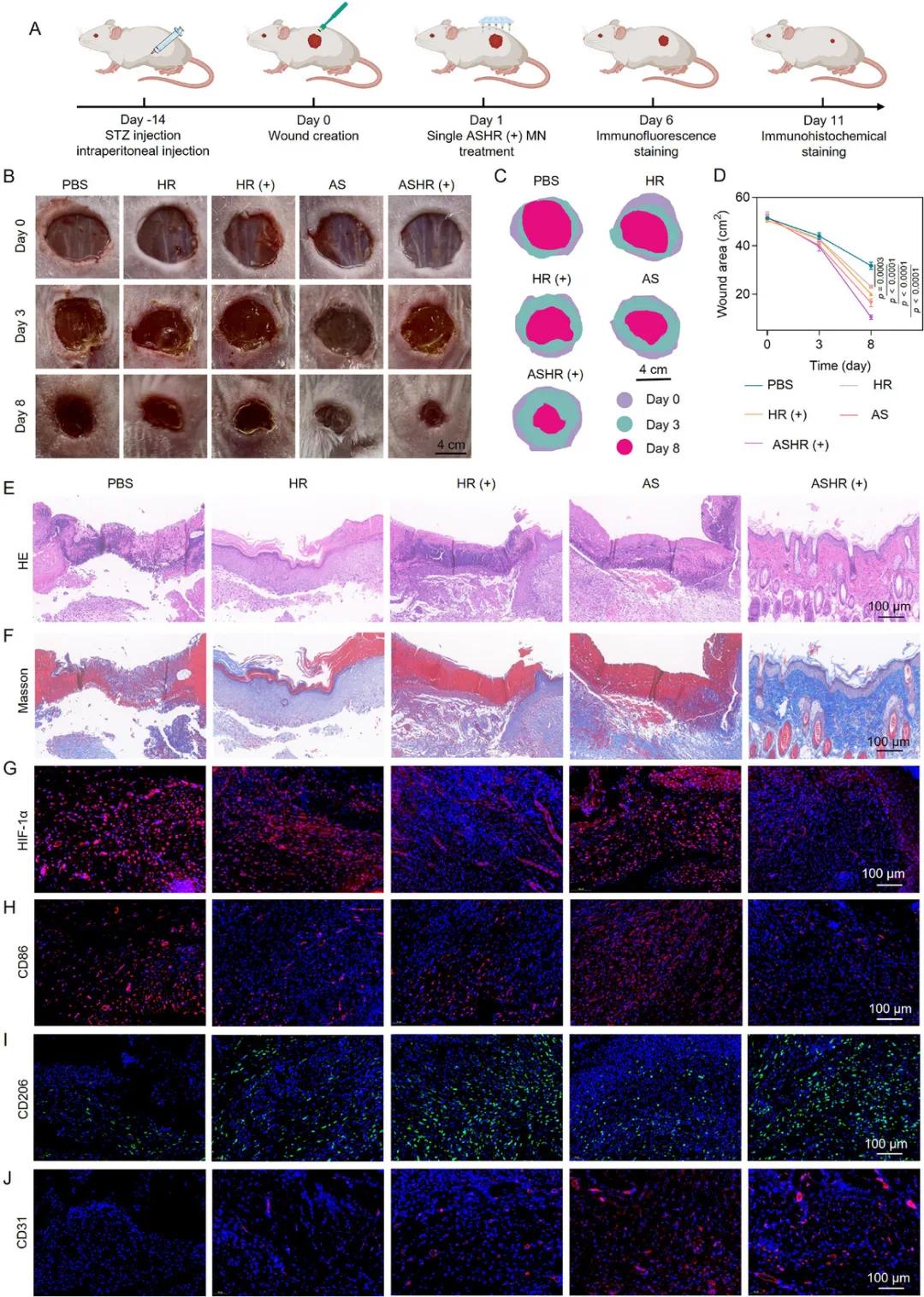
图5. ASHR(+)微针的体内治疗效果分析。A)治疗效果分析的实验设计示意图;B)不同治疗组小鼠的体内伤口愈合图像;C)不同治疗组从第0天到第8天伤口愈合过程的示意图像;D)不同治疗组伤口面积的定量分析;E)不同治疗组肉芽组织形成和再上皮化的苏木精-伊红(H&E)分析;F)不同治疗组伤口皮肤组织的代表性马松染色图像;G)不同治疗组伤口的代表性缺氧诱导因子-1α(HIF-1α)染色图像;H、I)第6天感染组织中CD86(红色)和CD206(绿色)的免疫荧光图像;J)不同治疗组伤口的代表性CD31染色图像
该团队开发了一种创新的形态可切换金纳米线,并将其与血红蛋白-白藜芦醇纳米颗粒(HR)通过可生物降解的聚乙烯醇(PVA)微针共同递送,用于糖尿病伤口的协同愈合治疗。这种精心设计的金基纳米材料能够在不同治疗阶段灵活调整形态,以实现特定的治疗目标。 在制备阶段,通过调节金纳米线(ANW)表面聚乙二醇(PEG)的含量,在超声条件下将其转变为金纳米球(AS),显著提高了其分散性和递送效率。在治疗阶段,AS以浓度依赖的方式解聚为ANW,从而促进其在伤口区域的长时间留存,并在伤口愈合过程中持续消耗葡萄糖。在链脲佐菌素(STZ)诱导的糖尿病小鼠模型中,PVA微针逐渐降解,释放出AS和HR纳米颗粒。 在治疗早期,纳米级的AS在组织间隙扩散,实现伤口区域的均匀分布。解聚后,纳米线在伤口区域长时间留存,确保持续消耗葡萄糖。与此同时,HR纳米颗粒通过缓解缺氧状况、清除活性氧(ROS)发挥抗氧化功能,减轻氧化应激,并抑制巨噬细胞向促炎的M1表型分化,调节免疫稳态。这一系列有序的过程共同促进了血管生成和再上皮化。总体而言,该方法为有效管理糖尿病伤口愈合提供了一种极具前景的治疗策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

