
血友病性关节病(HA)是血友病患者因反复关节出血引起的退行性疾病,约73%的患者有复发性出血,重型患者中关节炎发生率高达90%。其发病机制复杂,由滑膜炎和软骨退变相互作用形成恶性循环,最终导致关节破坏。此外,关节内出血导致的铁沉积也加重了病情。治疗多采用口服或注射抗氧化及抗炎药物,但往往无法解决铁过载和软骨保护问题。
近年来,注射型水凝胶作为药物载体,在治疗关节炎方面表现出缓释、镇痛、生物相容性好等优势,且可促进组织修复和改善关节功能。然而,在治疗HA方面仍存在纳米药物适配性差、铁离子残留引发二次损伤、术后摩擦致软骨损伤等挑战,急需综合策略应对炎症与出血的双重问题。

针对上述问题,四川大学顾志鹏团队为解决血友病性关节病治疗难题,利用植物多酚、铁螯合剂和α-硫辛酸一锅法构建了一种具有清除ROS和铁离子、保护软骨功能的注射型水凝胶。该水凝胶由低成本、临床可用成分构成,具备良好的生物相容性、抗炎抗氧化及耐磨性。体内外实验显示其可缓解HA病理过程、改善关节功能,具备良好应用前景。该文章于2025年04月01日以《Robust Injectable Hydrogels for Hemophilic Arthropathy via Anti-Inflammation, Iron Removal and Cartilage Protection》为题发表于《Advanced Functional Materials》上。(DOI: 10.1002/adfm.202500271)
(1)可注射水凝胶的制备与表征
研究通过一锅法组装三种商用小分子制备了多功能可注射水凝胶用于HA治疗。其中LA加热开环聚合后可与螯合模块和抗氧化模块形成多种相互作用(图1a);选用EGCG和去铁胺(DFO)。通过优化DFO和EGCG浓度获得凝胶相图,结果显示DFO浓度升高促进凝胶化,而高浓度EGCG降低凝胶概率(图1b)。采用DFO和EGCG制备的1 mg/mL可注射水凝胶SEM和能谱分析显示其具有典型多孔结构且元素分布均匀。FT-IR证实EGCG与LA通过多酚硫自由基亲核作用成功交联(图1c)。XPS分析显示PLED水凝胶的S 2p谱含二硫键(164.6 eV)、脂肪硫(163.0 eV)和硫酚键(163.5 eV)三个特征峰(图1d),表明EGCG酚基团在交联中起关键作用。分子动力学模拟显示PLED结构的范德华相互作用能最高(-85204.55 kJ/mol),稳定性最佳(图1e)。流变学测试表明水凝胶储能模量高于损耗模量,具有良好弹性(图1f)。其剪切稀化特性(图1h)和自修复性能(图1g)源于分子网络中的氢键、动态二硫键和配位键,这些特性赋予材料优异的可注射性和临床适用性。
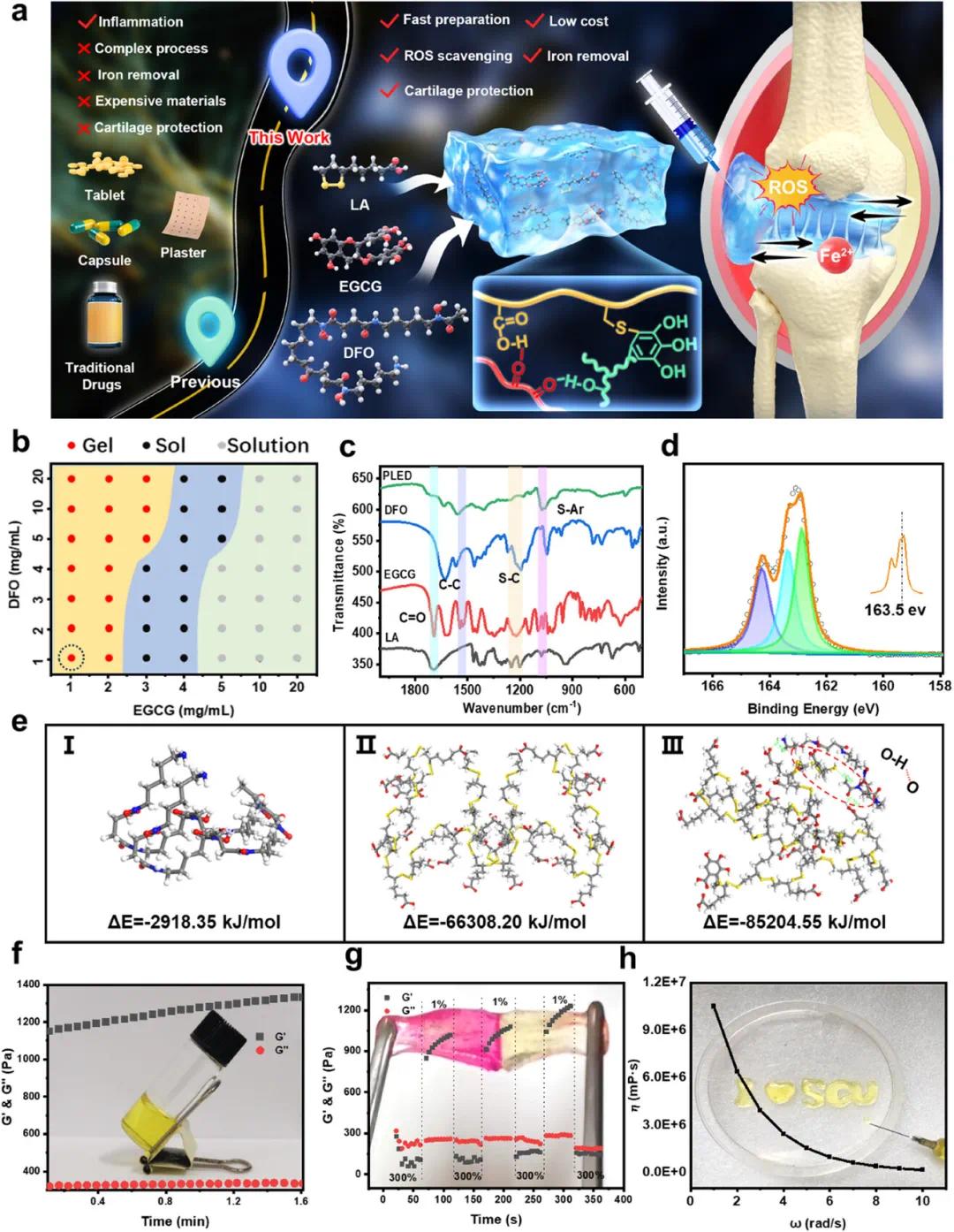
图1 可注射水凝胶的制备与表征。(a)可注射水凝胶的主要成分及制备工艺;(b)可注射水凝胶的凝胶化相图;(c)PLED水凝胶的FT-IR光谱;(d)PLED水凝胶的XPS表征;(e)PLED水凝胶各组分间物理相互作用能的分子模拟:I. DFO-DFO,II. LA/EGCG-LA/EGCG,III. LA/EGCG-DFO;(f)PLED水凝胶的流变测试结果;(g)PLED水凝胶的触变行为;(h)PLED水凝胶的剪切稀化
(2)水凝胶的多功能性
研究开发的多功能PLED水凝胶在治疗血友病性关节病(HA)方面展现出优异的综合性能(图2a)。在铁清除能力方面,通过血红蛋白氧化和菲啰啉比色法评估发现,加入亚铁离子后溶液颜色由鲜红色变为棕红色(图2b)。光谱分析显示PLED水凝胶能有效维持血红蛋白在542 nm和577 nm处的特征吸收峰(图2c),其保护效果显著优于不含EGCG的PLD水凝胶(图2d,e)。进一步的定量测试表明,PLED水凝胶对Fe²⁺的螯合能力达到83.3%(图2f,g),证实了其良好的铁清除能力。在抗氧化性能方面,DPPH和ABTS自由基清除实验显示,PLED水凝胶处理30分钟后可使紫色DPPH溶液和蓝色ABTS溶液褪色为淡黄色(图2h,i),清除率分别达到80.5%和94.5%。值得注意的是,虽然DFO本身的自由基清除能力有限,但EGCG的加入显著提升了水凝胶的整体抗氧化性能。润滑性能测试模拟了四种不同的软/软接触摩擦副(图2j)。结果显示PLED水凝胶与天然软骨间的摩擦系数为0.046lbf/lbf,与天然软骨间的摩擦系数(0.037lbf/lbf)非常接近(图2k)。这种优异的润滑性能源于其独特的液体润滑机制,在负载下能形成有效的润滑层。粘附性能评估采用牛膝关节模型,实验证明PLED水凝胶能在关节模拟液中保持10分钟以上的稳定粘附(图2l)。与易碎裂的透明质酸水凝胶相比,PLED水凝胶在反复关节运动模拟后仍能均匀分布在软骨表面(图2m),这归功于其多级相互作用机制。此外,该水凝胶还展现出良好的材料表面适应性,为其临床应用提供了更多可能性。
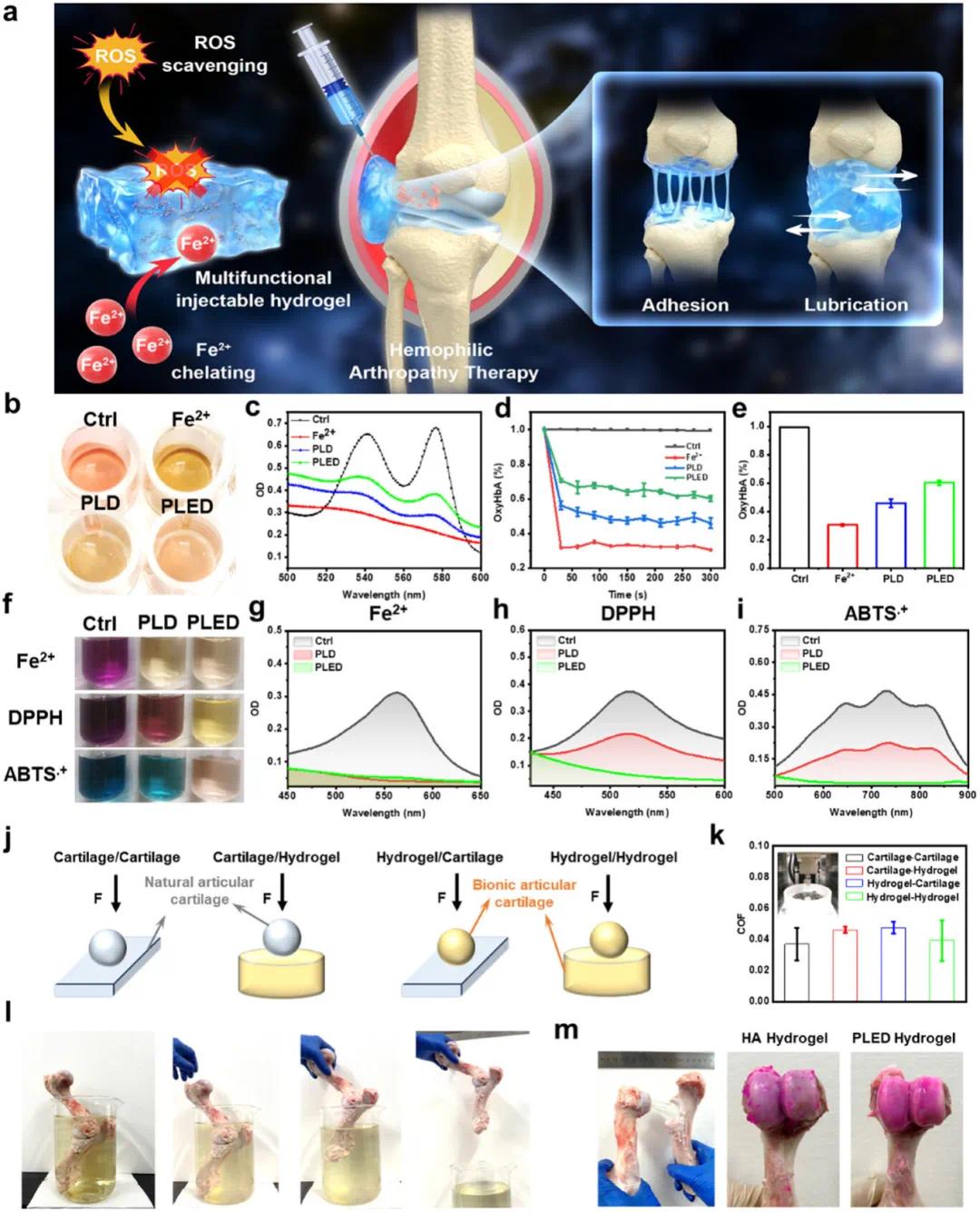
图2 水凝胶的功能特性。(a)多功能可注射水凝胶的示意图;(b–e)可注射水凝胶对血红蛋白的保护作用;(f)铁离子螯合、DPPH自由基清除、ABTS自由基清除溶液的颜色变化图;(g)铁清除能力;(h)DPPH自由基清除性能;(i)ABTS自由基清除性能;(j)简化示意图,说明四种不同的摩擦对;(k)可注射水凝胶与软骨之间的摩擦系数结果;(l)可注射水凝胶在模拟关节炎模型中的粘附效果;(m)关节运动后可注射水凝胶与关节软骨表面之间的界面现象
(3)可注射水凝胶的体外生物学评价
在评估水凝胶的生物相容性后,研究了其细胞层面的生物功能。结果显示,该凝胶能有效保护细胞免受铁离子损伤(图3a,b)。通过线粒体膜电位检测发现,铁过载会导致细胞凋亡(红/绿荧光标记,图3c),而PLED水凝胶能显著改善膜电位并减少凋亡(图3d)。流式细胞术显示PLED组凋亡率从9.14%降至5.67%(图3e,f)。普鲁士蓝染色证实PLED可减少细胞内铁沉积(图3g),荧光探针检测和流式分析(图3h,i)进一步验证了其抗铁过载损伤的保护作用。
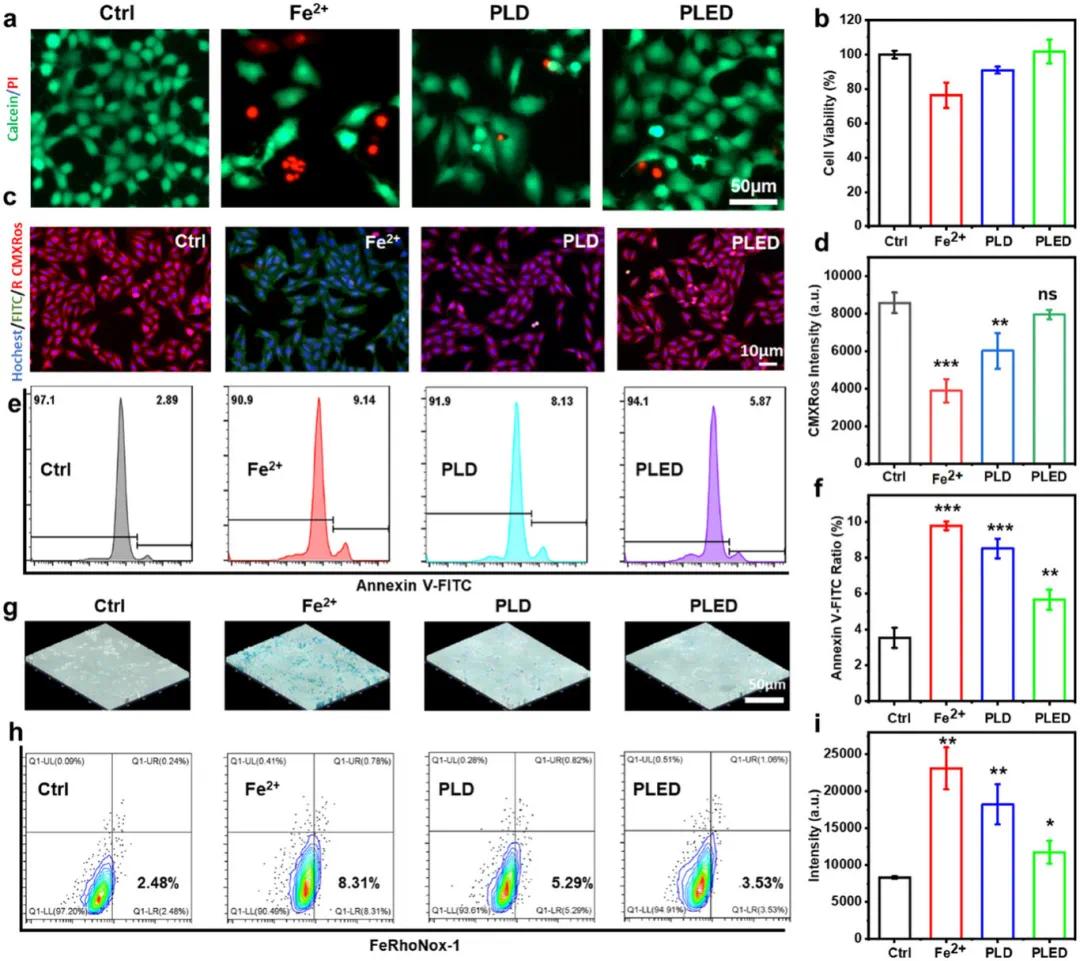
图3 PLED水凝胶体外除铁行为。(a)染色结果显示铁刺激后在水凝胶保护下的活细胞和死细胞;(b)铁超载条件下水凝胶对细胞存活率的影响;(c)铁超载后线粒体膜电位的变化;(d)CMXRos的荧光强度;(e,f)流式细胞术结果显示铁诱导的细胞凋亡;(g)细胞内铁染色结果;(h,i)细胞内铁染色的流式细胞术结果
铁过载会引发细胞内ROS过量(图4a,b)。DCFH-DA检测显示,PLED水凝胶能显著降低Fe²⁺刺激导致的ROS升高(≈10%),使其恢复至正常水平(图4c)。MDA(图4d)、SOD(图4e)、GSH Px(图4f)、CAT(图4g)和总谷胱甘肽(图4h)等指标证实,PLED较PLD能更有效缓解铁过载引起的氧化应激,使多项指标接近正常细胞水平。通过qRT-PCR评估水凝胶对炎症诱导的软骨细胞退化的保护作用。结果显示,Fe²⁺组COL II基因表达显著降低(图4i),而PLD和PLED水凝胶均能提升COL II表达,保护软骨细胞。同时,PLED组能更有效下调促炎因子(MMP13、IL-1β、IL-6、TNF-α)表达(图4j-m),其中对TNF-α的抑制作用尤为显著。铁死亡相关基因检测表明,Fe²⁺组GPX4(图4n)、COX2(图4o)和iNOS(图4p)表达升高,PLED和PLD水凝胶均可缓解这一现象。该多功能水凝胶通过EGCG和LA直接清除自由基,DFO螯合铁离子抑制氧化反应;同时EGCG和LA减少炎症因子释放,DFO通过降低铁离子浓度减轻炎症反应,在细胞水平展现出优异的铁清除、抗氧化和抗炎效果,具有治疗HA的潜力。
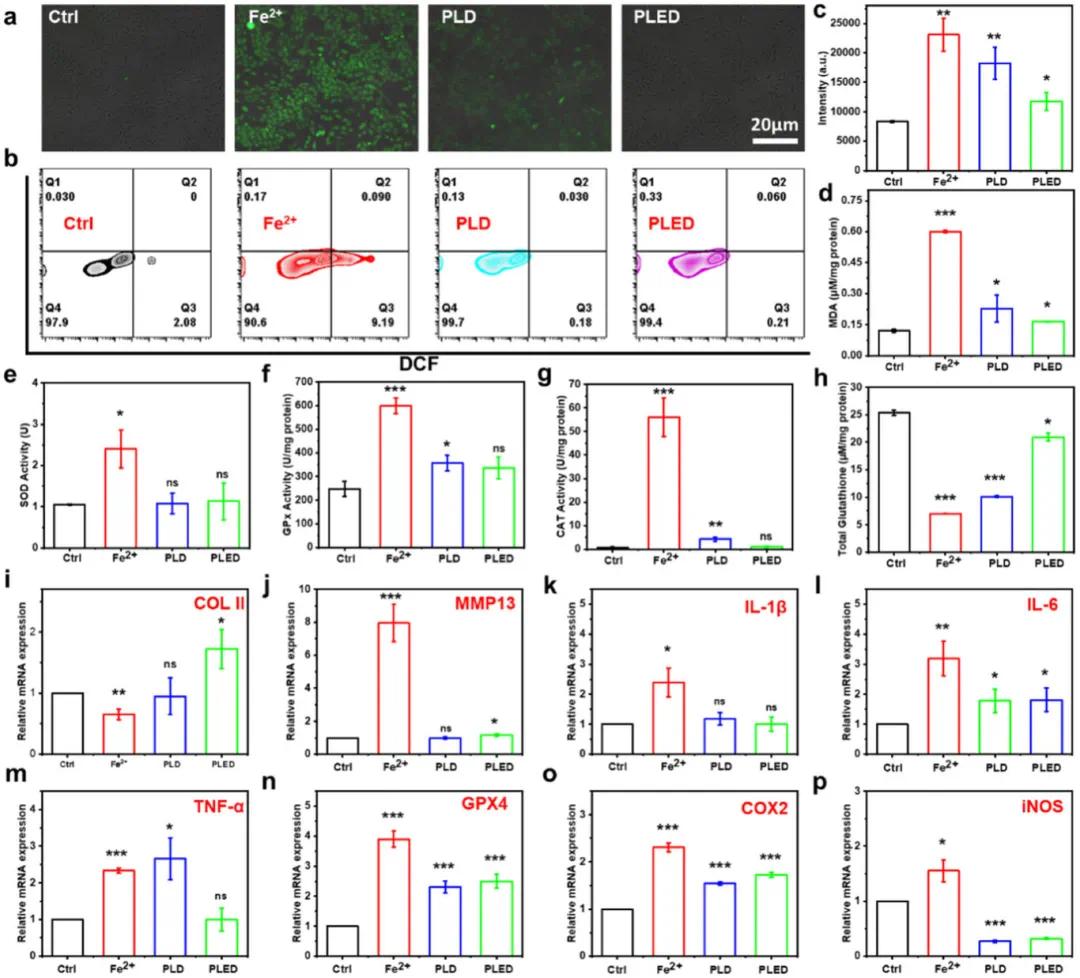
图4 水凝胶的抗炎和抗氧化特性。(a)细胞内ROS荧光染色;(b,c)定量评估细胞内ROS水平;(d)测量细胞过氧化产物;(e,f,g)细胞抗氧化酶测定;(h)测量细胞内抗氧化水平;(i,j)检测与软骨退化相关的基因;(k,l,m)测量铁刺激细胞中的炎症水平;(n,o,p)确定与细胞内铁死亡相关的基因
(4)可注射水凝胶的体内治疗
在完成体外细胞实验验证后,研究建立了血友病关节炎大鼠模型进行体内评估(图5a)。首先考察了水凝胶的生物相容性和降解行为(图5b),结果显示水凝胶可持续存在1个月且无明显不良反应,有利于长期关节炎治疗。HA模型小鼠关节内水凝胶荧光也证实了这一特性(图5c,d)。治疗一周后,未治疗组膝关节明显肿胀(图5e,g)伴局部温度升高(图5f,h),而PLD和PLED治疗组肿胀减轻、温度恢复正常。步态分析显示(图5i),未治疗组左后肢运动明显受损,PLED组恢复效果最佳。通过对站立相、摆动相等参数分析(图5j)证实,PLED治疗可使部分指标恢复正常水平。
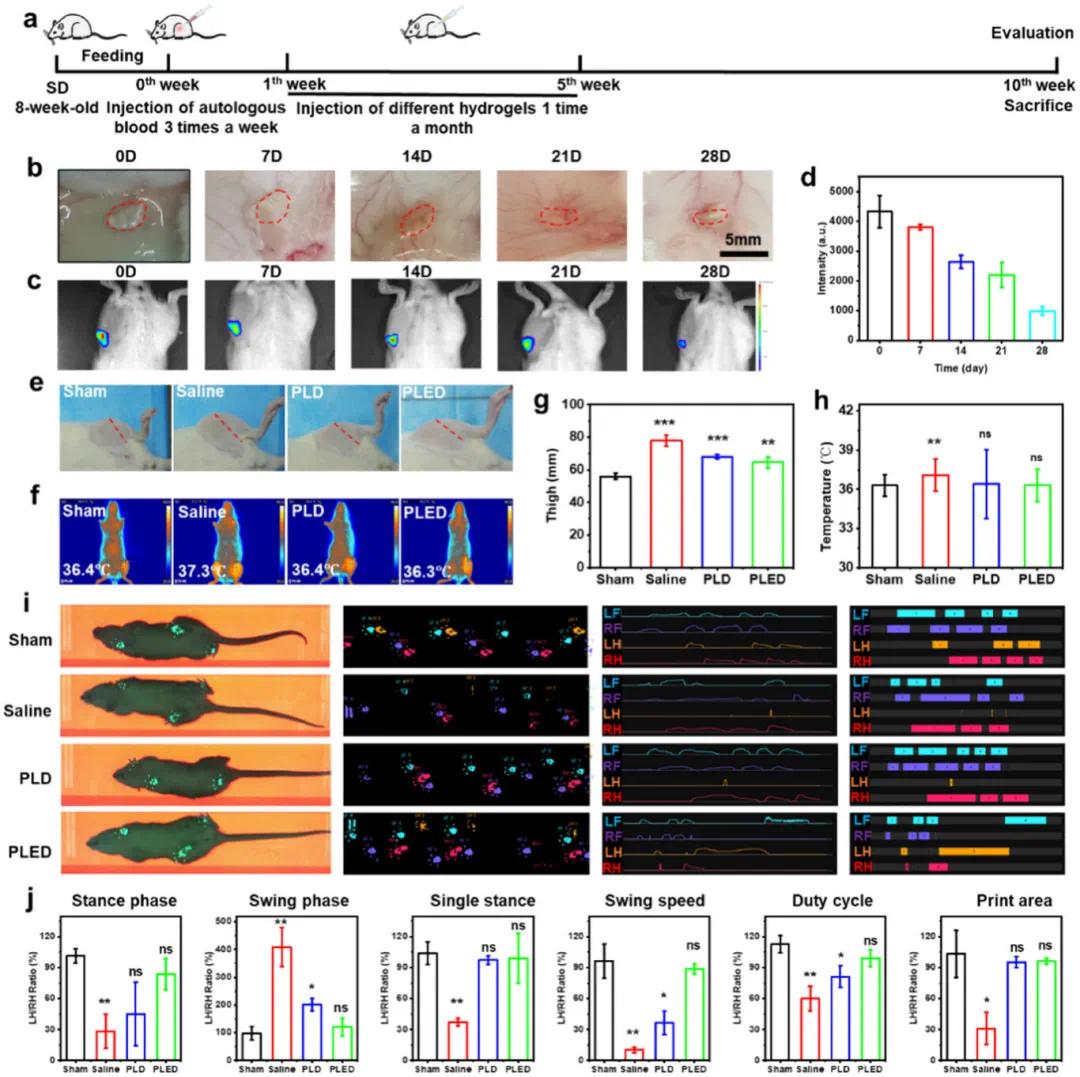
图5 PLED水凝胶治疗HA大鼠。(a)注射水凝胶治疗HA实验方案示意图;(b)注射PLED水凝胶的皮下降解;(c,d)评估注射水凝胶在关节腔内的滞留情况;(e)HA模型小鼠关节肿胀的代表性图像;(f)HA模型小鼠关节发热的红外图像;(g)HA模型小鼠关节肿胀和(h)发热的定量统计;(i)HA模型小鼠注射水凝胶治疗后的步态分析;(j)HA模型小鼠步态相关指标的定量分析
通过Micro-CT评估治疗后的关节周围骨变化,结果显示PLD和PLED凝胶显著改善了骨赘形成、软骨下硬化和骨质流失。组织学染色(图6a)表明,治疗组有效缓解了铁过载导致的滑膜增生和软骨基质降解。普鲁士蓝染色显示治疗组几乎无铁沉积。免疫荧光分析(图6a,b-i)证实,PLED较PLD能更有效促进COL II表达(图6b),减少胶原流失。同时显著调节铁死亡相关蛋白(COX2、GPX4、MMP13、iNOS)(图6c-f)和促炎因子(IL-6、IL-1β、TNF-α)(图6g-i)的表达。值得注意的是,PLED组的治疗效果显著优于PLD组,表明单一铁清除疗法效果有限。EGCG和DFO在铁螯合方面具有协同作用,而LA通过抗氧化剂再生增强整体抗氧化能力,三者联合提供了更全面持久的治疗效果。
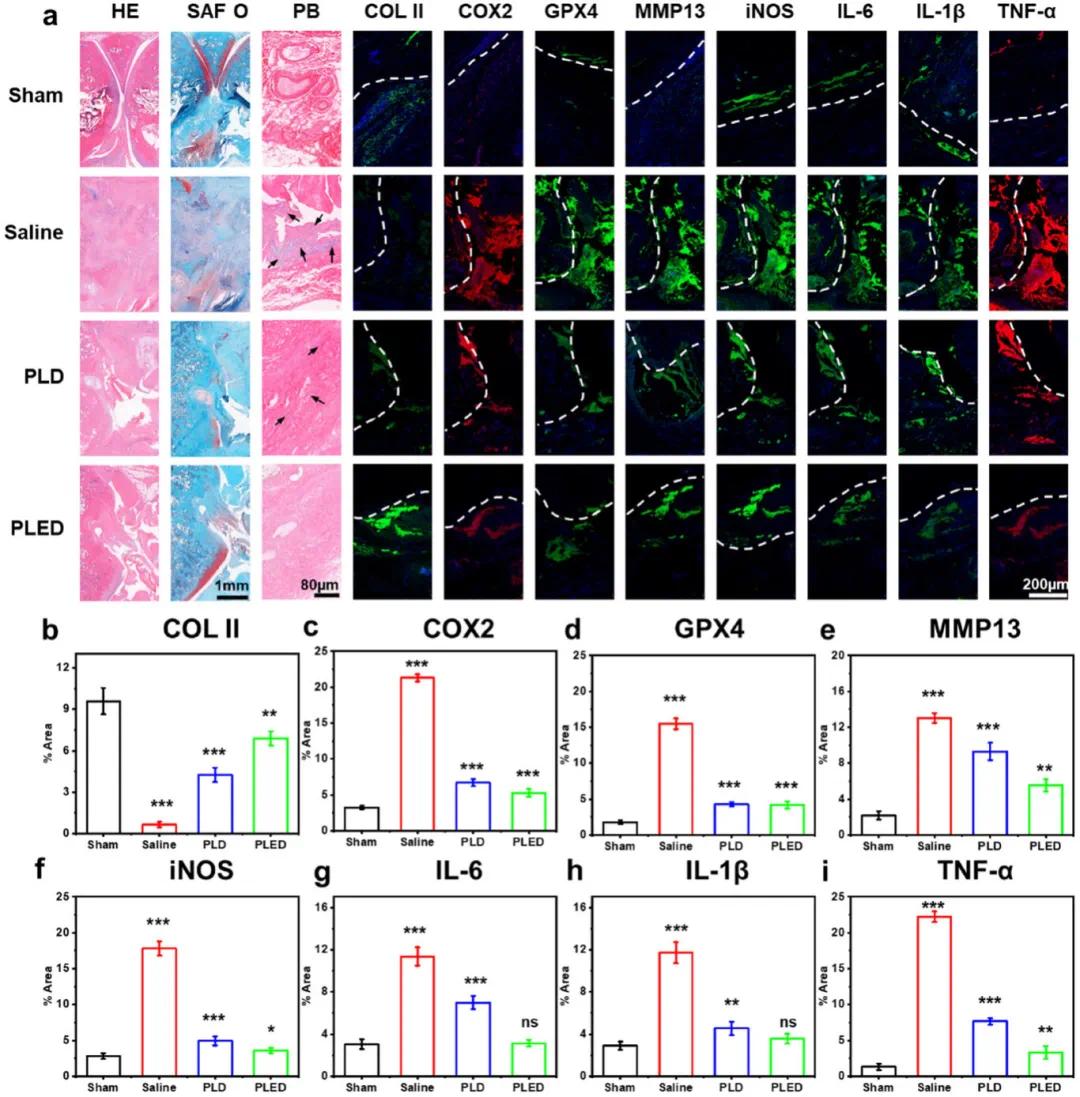
图6 注射水凝胶治疗HA后关节的组织学评价。(a)膝关节组织微观变化(HE、SAF-O、PB)及相关指标免疫荧光染色(COL II、COX2、GPX4、MMP13、iNOS、IL-6、IL-1β、TNF-α)结果(黑色箭头代表铁过载阳性表达,白色虚线代表关节界面);(b–i)使用ImageJ对相关指标进行定量分析的结果
通过RNA测序分析进一步阐明水凝胶治疗HA的机制。PCA分析显示PLED组可部分逆转铁过载引起的转录组变化(图7a)。差异基因分析发现,与生理盐水组相比,PLED组存在2274个差异表达基因(图7b),其中60.7%的上调基因和39.3%的下调基因被PLED逆转(图7c)。关键HA相关基因分析表明,PLED对Mmp12等分解代谢基因和炎症基因的调控作用尤为显著(图7d,e)。GSEA分析显示,钙信号通路和蛋白质消化吸收是富集最显著的KEGG通路(图7f,g)。GO分析表明,细胞外基质调控、阳离子通道活性等是最重要的差异mRNA功能类别。PLED可能通过调控钙信号通路、肥大性心肌病等通路发挥治疗作用,并可调节Mmp12、IL1rn等基因表达,这些基因有望成为HA早期诊断或疗效监测的生物标志物。
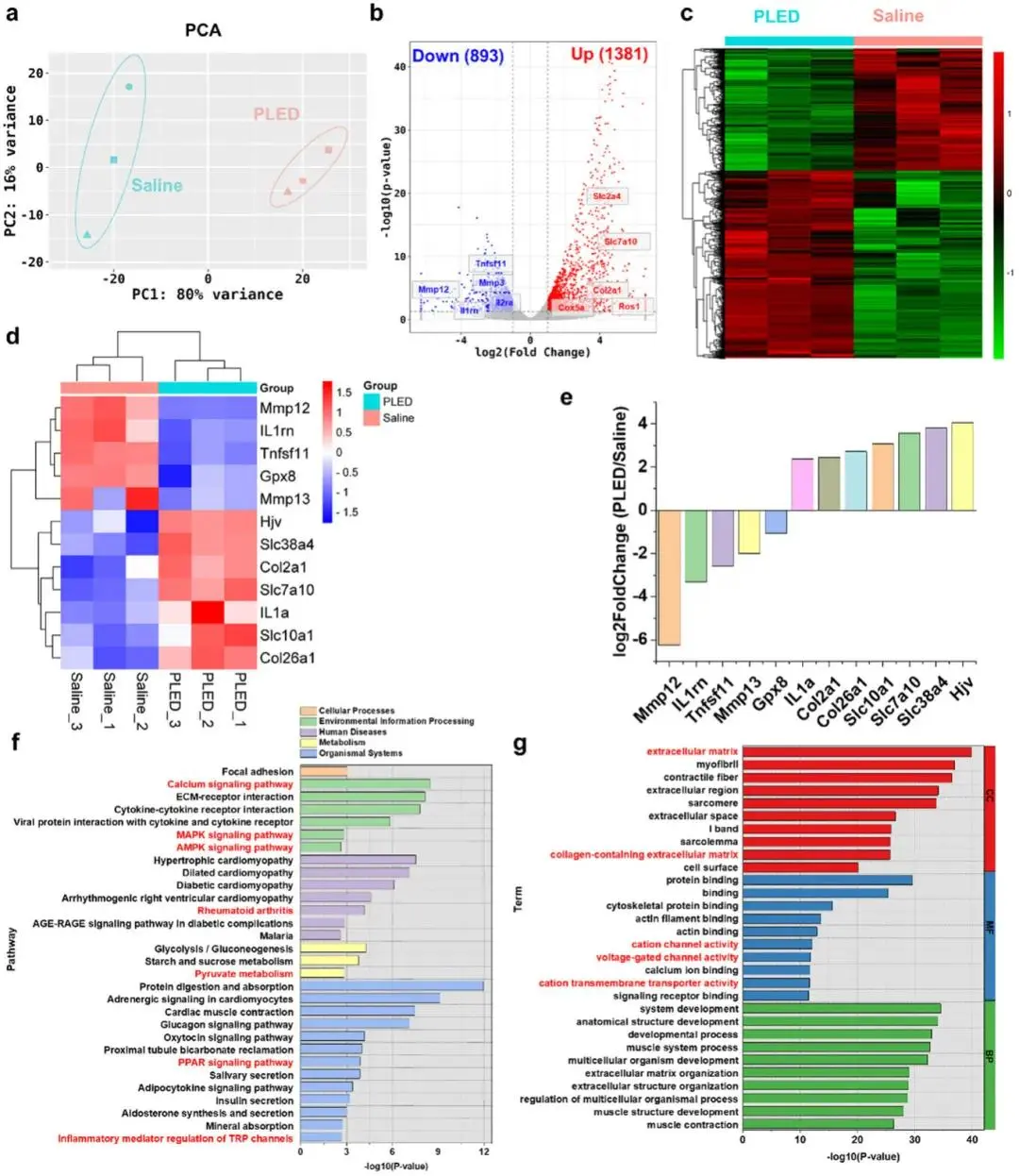
图7 PLED水凝胶治疗HA模型小鼠后RNA-seq分析。(a)RNA主成分分析(PCA);(b)生理盐水组与PLED组差异基因火山图;(c)生理盐水组与PLED组差异表达基因聚类分析;(d,e)生理盐水组与PLED组HA相关差异基因分析;(f)HA相关基因KEGG通路富集分析;(g)HA相关基因GO富集分析
研究通过整合硫辛酸、天然多酚和铁螯合剂,开发了一类高效治疗血友病性关节病(HA)的多功能可注射水凝胶。所用结构单元均为市售材料,经济高效、安全可靠,且制备方法快速简便。此外,所得水凝胶表现出优异的铁和活性氧(ROS)去除效果以及良好的生物黏附性。值得注意的是,这些水凝胶还能保护术后软骨摩擦损伤,显著缓解关节炎症,维持和增强关节功能,并促进软骨修复。这一发现为HA的临床治疗开辟了新的途径,并有望为患者提供更有效的缓解策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

