
离子稳态在维持细胞、组织和器官的正常功能中起着至关重要的作用。离子失衡可能导致严重的健康问题,如脱水、电解质紊乱、代谢性酸中毒或碱中毒,以及影响心脏、骨骼和肌肉的慢性疾病。特别是金属离子代谢失调,尤其是铜和铁,是多种恶性肿瘤的特征之一,其异常积累会促进肿瘤增殖。
癌细胞通过高表达铜转运蛋白1(CTR1)来摄取铜离子,铜离子在细胞表面金属还原酶的作用下被还原为Cu(I),从而促进癌细胞的生长和增殖。此外,铜离子对血管生成因子(如血管内皮生长因子VEGF)的活性至关重要,能够促进肿瘤的血管生成。铁离子也通过氧化应激和氧化还原平衡为肿瘤生长和存活创造有利环境。铜和铁的代谢相互关联,例如铜载体蛋白ceruloplasmin(CP)通过氧化Fe²⁺促进细胞铁的排出。因此,同时调节铜和铁水平在癌症治疗中具有显著潜力。

针对上述问题,福建师范大学曾雪梅/燕双仟教授团队开发了一种可生物降解的离子纳米调节剂 FessTMiR,用于乳腺癌治疗(图1)。其由二硫代二乙酸和亚铁离子组装的纳米载体(FessNV)与抗铜剂四硫代钼酸盐(TM)组成。FessTMiR通过增强渗透和滞留效应在肿瘤部位积累,并在肿瘤的酸性和富含谷胱甘肽的环境中分解为亚铁离子和TM,实现“铁过载效应”和“铜负荷降低方法”。铜耗竭通过铁死亡、凋亡和自噬增强治疗效果,同时抑制血管生成,降低PD-L1表达,增强免疫原性细胞死亡(ICD)。此外,铜耗竭还促进树突状细胞成熟,增加T细胞浸润和激活,减少调节性T细胞和TGF-β,将免疫学“冷”肿瘤转变为“热”肿瘤,抑制肿瘤转移。相关研究在2025年4月1日以“Biodegradable ionic nanoregulators for synchronous modulation of copper and iron ion homeostasis in breast cancer therapy”为题发表于《Chemical engineering journal》 (DOI: 10.1016/j.cej.2025.162041)上。
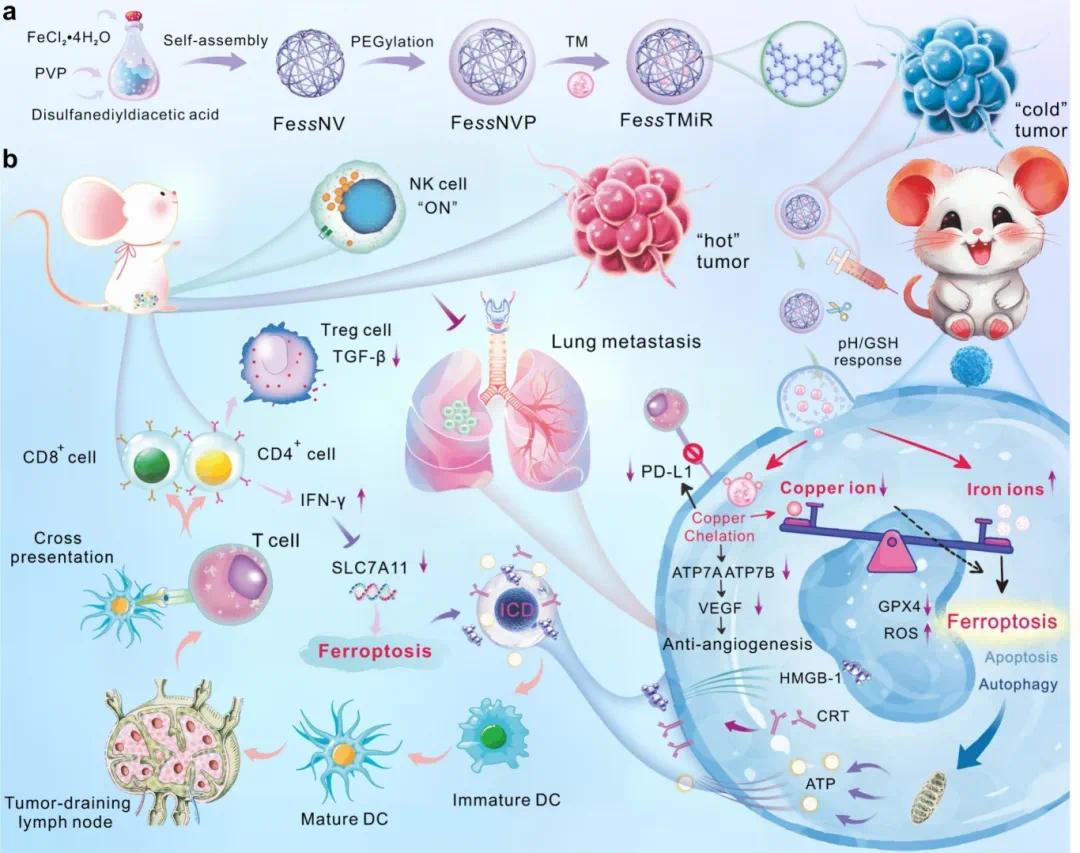
图1 研究示意图。(A)Fe ss TMiR的制备过程;(B)Fe ss TMiR 用于肿瘤治疗、激活抗肿瘤免疫反应和抑制转移的示意图
(1) Fe ss NV的制备及表征
通过水热法合成了铁基纳米载体 FessNV,并进一步修饰制备了 FessTMiR。透射电子显微镜(TEM)显示 FessNV 和 FessTMiR 结构相似(图 2A)。粒径分析显示 FessNVP 和 FessTMiR 尺寸分别为 50 nm 和 72 nm(图 2B),且 FessTMiR 的 zeta 电位更负(图 2C),表明修饰成功。XPS 分析验证了元素组成及价态,FessTMiR 中出现 Mo 元素小峰,证实 TM 成功引入(图 2D 和 2E)。FTIR 分析显示 FessTMiR 表面引入氨基,且观察到 MoS₄²⁻ 吸收带(图 2F)。紫外 - 可见吸收光谱确认了 TM 的存在(图 2G)。这些结果证实了 FessTMiR 的成功合成。在酸性条件和 GSH 存在下,FessNV 释放铁和 TM,48 小时后释放率分别达 74.4% 和 75.6%(图 2H–I)。FessNV 具有类 POD 活性,可降解 MB、氧化 OPD 和 TMB(图 2J-L),但过量 GSH 会消耗产生的羟基自由基。FessNV 还具有类 GPx 活性,可高效消耗 GSH(图 2M-O),这可能是由于其含有二硫键。总体而言,FessNV 的类 POD 和类 GPx 活性增强了 ROS 水平,削弱了 GPX4 功能,提升了铁死亡治疗效果。
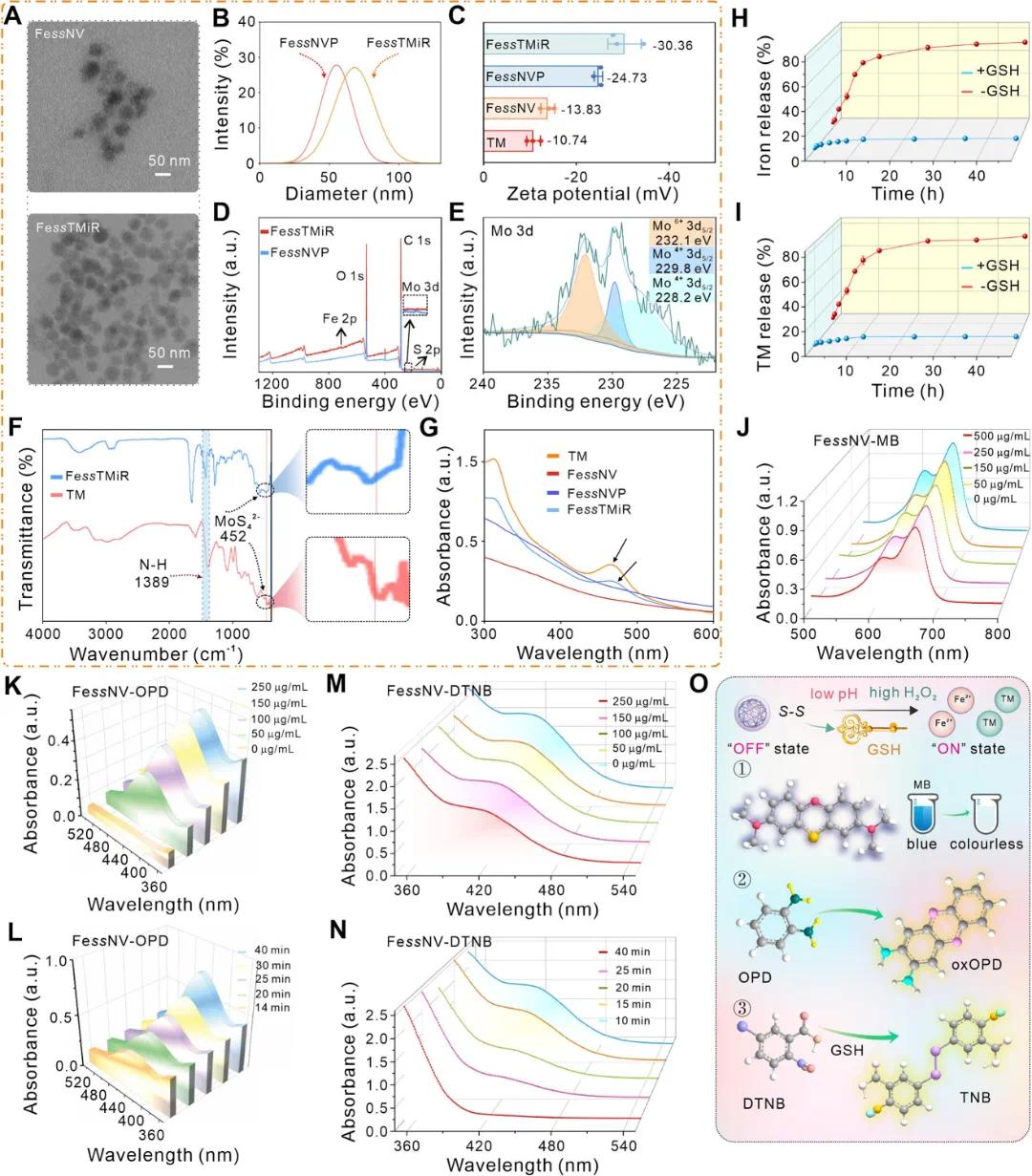
图2 表征与催化评价。(A)Fe ss NV和Fe ss TMiR的TEM图像;(B)Fe ss NVP和Fe ss TMiR的流体动力学直径;(C)TM、Fe ss NV、Fe ss NVP和Fe ss TMiR的Zeta电位;(D,E)Mo 3d的XPS光谱(全范围及高分辨);(F)TM和Fe ss TMiR的FTIR;(G)TM、Fe ss NV、Fe ss NVP和Fe ss TMiR的紫外吸收光谱;(H)不同条件下Fe ss NV的铁释放曲线(含/不含10 mM GSH);(I)不同条件下Fe ss NV的TM释放曲线(含/不含10 mM GSH);(J)pH 4.5下不同浓度Fe ss NV对MB+H₂O₂紫外吸收的影响(H₂O₂:25 mM,MB:25 μM);(K)pH 4.5下不同浓度Fe ss NV对OPD+H₂O₂紫外吸收的影响(H₂O₂:25 mM,OPD:25 μM);(L)pH 4.5下OPD+H₂O₂+Fe ss NV的紫外吸光度随时间变化;(M)pH 4.5下不同浓度Fe ss NV对DTNB+GSH紫外吸光度的影响(DTNB:1 mg/mL);(N)pH 4.5下DTNB+Fe ss NV的紫外吸光度随时间变化(DTNB:1 mg/mL,Fe ss NV:250 μg/mL);(O)POD样和GPx样活性反应示意图
(2)Fe ss TMiR细胞毒性及摄取评价
通过 CCK-8 实验评估了 TM 的细胞毒性,当 TM 浓度超过 100 μmol/L 时,4T1 乳腺癌细胞存活率显著下降至 44% 以下(图 3A),因此后续实验选择 50 μmol/L 的 TM,此时细胞存活率为 88%。进一步实验表明,50 μmol/L 的 TM 与 50 μg/mL 的 FessNVP 联合使用时,FessTMiR 组的细胞存活率随时间显著下降(图 3B)。共聚焦激光扫描显微镜(CLSM)和流式细胞仪检测显示,FITC 标记的 FessNVP 摄取量随时间增加(图 3C),且与细胞核和内质网/溶酶体存在共定位,但皮尔逊相关系数较低(图 3D-F),表明共定位较弱。这可能是因为纳米调节剂触发了内质网/溶酶体的逃逸,导致内质网/溶酶体膜破裂(图 3G)。
(3)抑制铜传输能力的评价
乳腺癌细胞因铜相关分子伴侣蛋白上调而对铜需求更高。TM 能靶向铜转运蛋白 ATP7A 并螯合铜,具有良好的细胞内治疗效果。实验表明,4T1 细胞与不同浓度的 CuCl₂ 共孵育时,细胞存活率显著增加(图 3H),但在 CuCl₂ 浓度达 10 nmol/L 时,存活率因铜过载而下降。使用 Cu²⁺ 探针 RBH 检测细胞内铜水平,结果显示 FessTMiR 组红色荧光显著减弱,表明其细胞内 Cu²⁺ 水平较低(图 3I 和 3J),且 FessNVP 组荧光强度低于 TM 组,可能是因 ROS 增加破坏铜转运载体蛋白及细胞膜。Western blot 分析显示,FessTMiR 组中铜转运蛋白 ATP7B/ATP7A 和 SLC31A1 的表达水平显著降低(图 3K-N),证实 FessTMiR 能有效抑制铜转运蛋白表达。
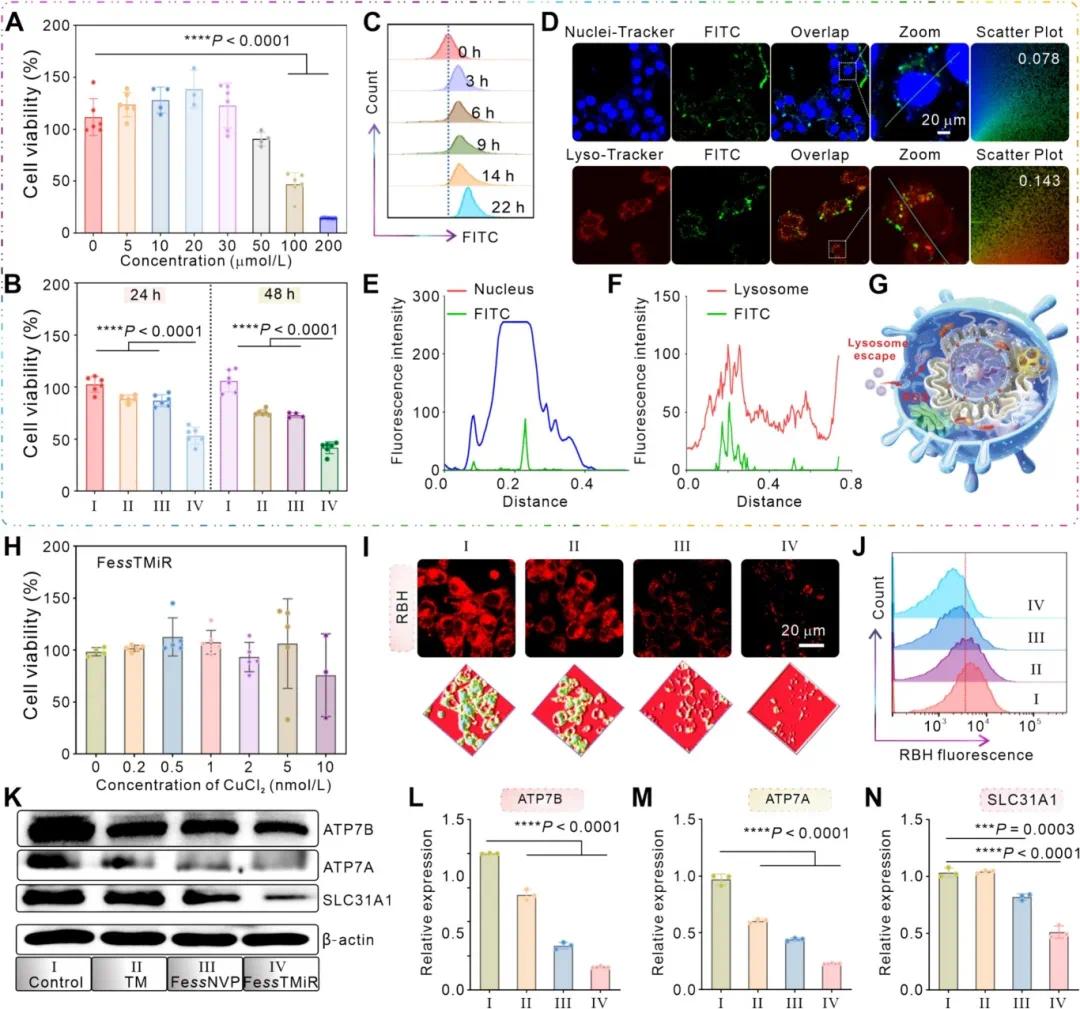
图3 抗肿瘤活性和铜转运机制评估。(A)用不同浓度TM处理4T1细胞后的细胞存活率;(B)四种不同处理24或48小时后4T1细胞的细胞存活率(Ⅰ:PBS,Ⅱ:50 μmol/L TM,Ⅲ:50 μg/mL Fe ss NVP,Ⅳ:50 μg/mL Fe ss TMiR);(C)流式细胞术分析4T1细胞对FITC标记的Fe ss NVP的细胞摄取;(D)处理4小时后4T1细胞对FITC标记的Fe ss NVP的代表性共聚焦激光扫描显微镜(CLSM)图像;(E-F)核/FITC(E)和溶酶体/FITC共定位(F)荧光强度的定量分析;(G)Fe ss NVP的溶酶体逃逸机制示意图;(H)在50 μmol/L TM存在下与不同浓度的CuCl₂孵育后4T1细胞的细胞存活率;(I-J)在4T1细胞中进行各种处理后,使用RBH探针对Cu²⁺进行代表性CLSM图像(I)和流式细胞术分析(J);(K)在4T1细胞中进行不同处理后ATP7B、ATP7A和SLC31A1蛋白表达的蛋白质印迹分析;(L-M)根据蛋白质印迹结果定量分析ATP7B(L)、ATP7A(M)和SLC31A1(N)的相对表达水平
(4)Fe ss TMiR诱导癌细胞铁死亡
FessTMiR 能有效释放细胞内 Fe²⁺(图 4A),并通过类芬顿反应增强羟基自由基(•OH)积累(图 4B),同时产生大量 ROS(图 4C-D)。此外,FessTMiR 增加脂质过氧化标志物 LPO 和 4-HNE 的生成(图 4E-G),降低 GPX4 和 xCT 表达,耗竭 GSH,诱导铁死亡。铁死亡抑制剂 Ferrostatin-1(Fer-1)和抗氧化剂维生素 E(VE)可有效逆转 FessTMiR 诱导的细胞铁死亡(图 4H),而铜死亡抑制剂对 FessTMiR 诱导的细胞死亡缓解作用有限(图 4H),表明其主要诱导铁死亡。FessTMiR 还诱导自噬和凋亡,自噬抑制剂 3-MA 和凋亡抑制剂 Z-VAD 部分恢复细胞存活率(图 4I),且 FessTMiR 处理的细胞上调自噬蛋白 LC3Ⅱ/Ⅰ 表达,下调凋亡蛋白 Bcl-2(图 4J)。流式细胞仪分析和共聚焦激光扫描显微镜(CLSM)检测显示,FessTMiR 组的自噬水平显著增加(图 4K),线粒体膜电位(MMP)显著降低(图 4L),且诱导了较高的凋亡率(图 4M-N)。
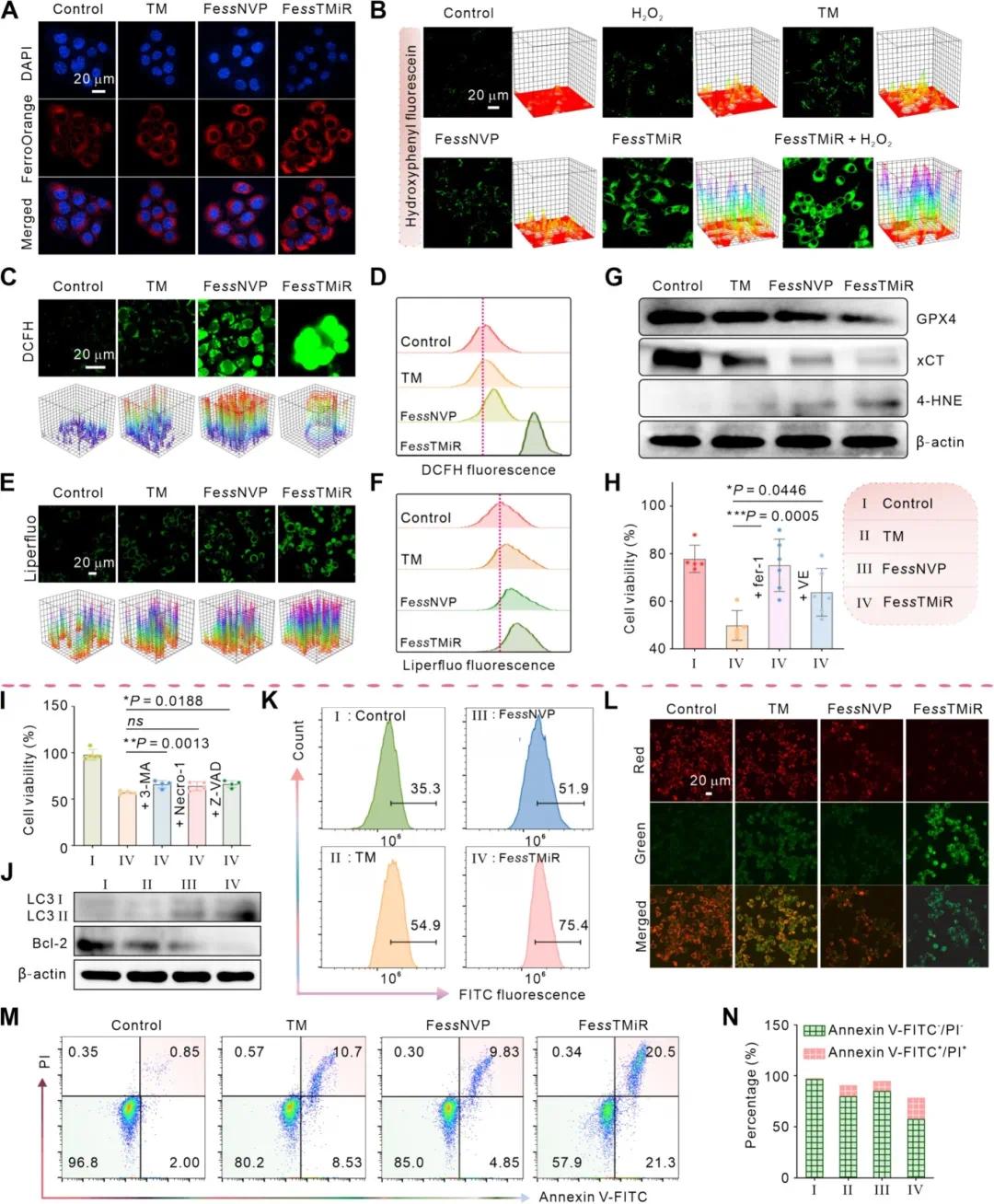
图4 Fe ss TMiR诱导癌细胞铁死亡和凋亡。(A)4T1细胞经处理后Fe²⁺水平的CLSM图像(FerroOrange探针);(B)4T1细胞内·OH水平的CLSM图像(HPF探针);(C-D)4T1细胞中ROS水平的CLSM图像(C,DCFH-DA探针)及流式细胞术分析(D);(E-F)4T1细胞中LPO水平的CLSM图像(E,Liperfluo探针)及流式细胞术分析(F);(G)xCT、GPX4和4-HNE的蛋白印迹分析;(H-I)4T1细胞的相对存活率(Fe ss TMiR+不同抑制剂);(J)LC3Ⅱ/Ⅰ和Bcl-2的Western blot分析;(K)4T1细胞自噬水平的流式细胞术分析(MDC探针);(L)4T1细胞线粒体膜电位的CLSM图像(JC-1探针);(M-N)4T1细胞凋亡的流式细胞术分析及定量分析
(5)Fe ss TMiR体外抑制肿瘤转移并激活免疫原性细胞死亡(ICD)
FessTMiR 显著降低了 4T1 细胞的迁移、侵袭和黏附效率(图 5B, F-H),并将划痕实验中的愈合率降低到 -10.2%,细胞形态受损(图 5C, D, I)。此外,FessTMiR 抑制了肿瘤球体的生长(图 5E, J),降低了 VEGF 表达(图 5M, P)。在免疫原性细胞死亡(ICD)方面,FessTMiR 增加了 CRT 暴露(图 5K),促进了 HMGB-1 外泌(图 5N),降低了细胞内 ATP 水平(图 5O),并抑制了 PD-L1 表达(图 5M, Q),从而触发了强大的抗肿瘤免疫反应(图 5R)。

图5 ICD促进的抗肿瘤转移体外分析。(A)迁移、侵袭、粘附、划痕和3D球体测定的实验装置示意图;(B)4T1细胞迁移、侵袭和粘附的染色图像(瑞氏-姬姆萨,紫色);(C-D)4T1细胞的明场图像;(E)4T1细胞球体7天生长的代表性图像;(F-H)4T1细胞迁移(F)、侵袭(G)和粘附(H)的半定量分析;(I)4T1细胞划痕试验伤口闭合的半定量分析;(J)4T1肿瘤球体的生长曲线;(K-L)4T1细胞中CRT(K)和HMGB-1(L)的免疫荧光图像;(M)VEGF和PD-L1的蛋白印迹分析;(N)4T1细胞中细胞外HMGB-1水平的量化;(O)4T1细胞中细胞内ATP水平的测量;(P-Q)4T1细胞中VEGF(P)和PD-L1(Q)水平的半定量分析;(R)肿瘤转移过程及铁死亡诱导的ICD抗肿瘤作用示意图
(6)用 Fe ss TMiR 纳米调节剂处理 4T1 细胞后的 RNA-Seq 分析
RNA-Seq 分析显示,对照组与 FessTMiR 处理组间存在显著 mRNA 表达差异(图 6A)。火山图识别出 FessTMiR 组中有 3040 个差异表达基因(DEGs),其中 1467 个下调,1573 个上调(图 6B)。KEGG 通路富集分析显示氧化磷酸化、凋亡、TGF-β 信号通路等显著改变(图 6C),铁死亡和谷胱甘肽代谢相关基因显著变化(图 6D)。GSEA 进一步证实 FessTMiR 上调铁死亡、凋亡相关基因,下调谷胱甘肽代谢基因(图 6E)。铜代谢相关基因与铁死亡相关基因的相关性显著增加(图 6F),表明 FessTMiR 通过破坏铜和铁离子平衡促进铁死亡。环形图、弦图和蛋白质 - 蛋白质相互作用网络展示了基因的生物学作用(图 6G-I),揭示 FessTMiR 通过耗竭铜离子、破坏离子稳态、诱导铁死亡和增强免疫反应发挥治疗效果。
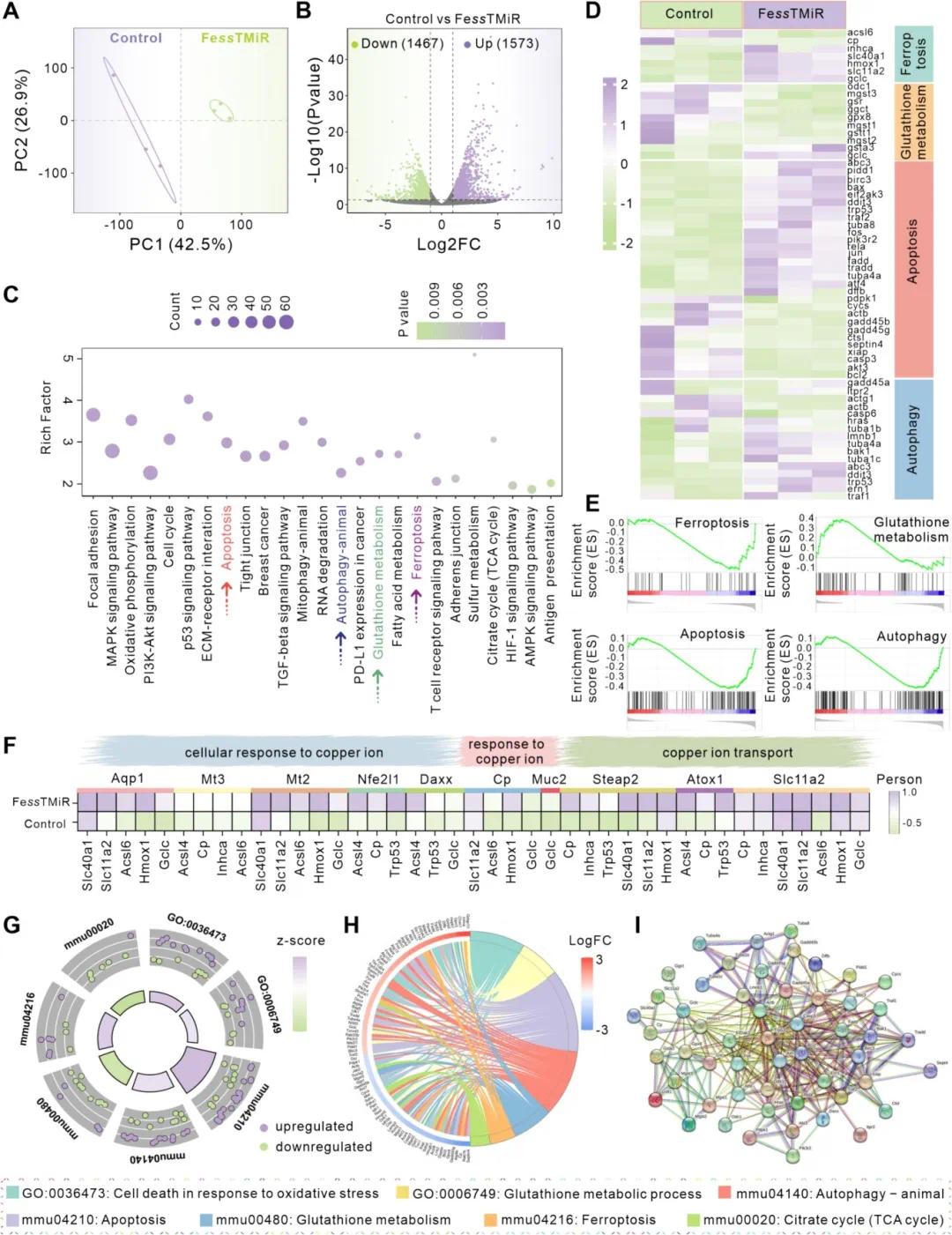
图6 Fe ss TMiR诱导增强铁死亡的机制分析。(A)对照组和Fe ss TMiR组中差异表达基因(DEG)的主成分分析(PCA);(B)火山图说明两组之间的DEG;(C)从差异基因表达分析中确定的关键KEGG通路;(D)热图显示与铁死亡、谷胱甘肽代谢、细胞凋亡和自噬相关的DEG;(E)与铁死亡、谷胱甘肽代谢、细胞凋亡和自噬相关的通路的基因集富集分析(GSEA);(F)对照组和Fe ss TMiR组中铜离子代谢信号通路与铁死亡通路之间DEG的相关性分析;(G)DEG的基因本体(GO)功能分析,其中绿色和紫色表示每个通路中下调和上调的基因;(H)KEGG弦图突出显示在多个信号通路中下调或上调的基因;(I)功能性交叉基因的蛋白质-蛋白质相互作用网络
(7)体内生物分布及抗肿瘤性能评价
在 4T1 肿瘤荷载小鼠中,FessNVP@ICG 组的肿瘤部位荧光强度显著高于游离 ICG 组(图 7),离体成像和半定量分析进一步证实其肿瘤特异性积累增强(图 7B-C)。体内治疗实验中,FessTMiR 显著抑制肿瘤生长(图 7E-G),而 FessTMiR + Lip-1 组肿瘤重新生长(图 7D)。各组平均肿瘤重量与肿瘤生长趋势一致(图 7H),且小鼠体重无显著变化(图 7I),表明 FessTMiR 无明显毒性。病理学评估显示 FessTMiR 组肿瘤切片中损伤面积最大(图 7J)。FessTMiR 组肿瘤中铜和铜载体蛋白(Cp)水平最低,铁水平最高(图 7K-L),且铁死亡相关蛋白 xCT 和 GPX4 表达显著降低(图 7M-N),VEGF、PD-L1 和 CD31 水平也降低(图 7M-N),表明 FessTMiR 通过调节铁水平、增强铁死亡、抑制肿瘤转移和增强免疫治疗发挥作用。
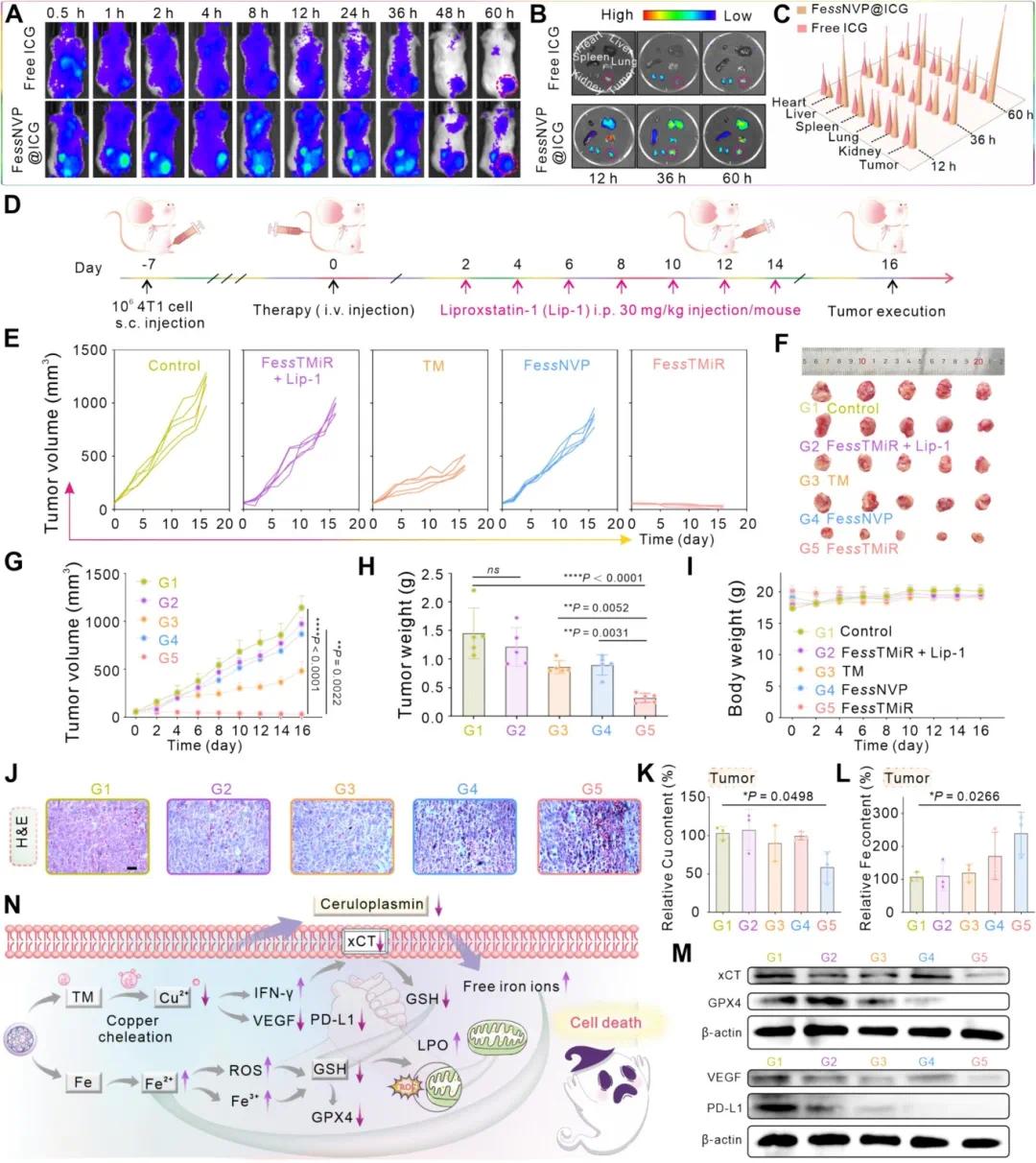
图7 Fe ss TMiR的体内生物分布和抗肿瘤功效。(A)4T1肿瘤小鼠尾静脉注射ICG标记的Fe ss NVP后不同时间点的体内荧光图像;(B-C)12、36和60小时切除的主要器官和肿瘤的离体荧光图像(B),以及相应的荧光强度量化(C);(D)皮下4T1肿瘤模型治疗的实验时间线示意图;(E)每个治疗组的肿瘤生长曲线;(F)4T1肿瘤小鼠解剖肿瘤的代表性图像;(G)不同治疗条件下4T1肿瘤小鼠的肿瘤生长曲线;(H)治疗后4T1肿瘤小鼠的肿瘤重量;(I)治疗期间小鼠的体重;(J)各种治疗后肿瘤切片的代表性H&E染色图像;(K-L)肿瘤组织中铜(K)和铁(L)含量的量化;(M)治疗后肿瘤组织中xCT、GPX4、VEGF和PD-L1表达的蛋白质印迹分析;(N)小鼠模型中Fe ss TMiR离子干预的示意图
(8)Fe ss TMiR的体内抗肿瘤免疫治疗
FessTMiR 组的成熟树突状细胞(DCs,CD80⁺CD86⁺)比例显著增加至约 30.4%(图 8A-B),表明其促进 DCs 成熟。FessTMiR 组中 MHC II⁺CD80⁺CD86⁺ 的表达显著升高(图 8C-D),增强 DCs 的抗原呈递能力。FessTMiR 处理的肿瘤中调节性 T 细胞(Tregs)水平最低(图 8E-F),而 CD4⁺ 和 CD8⁺ T 细胞水平最高(图 8G-H),表明其降低免疫抑制细胞比例,增强细胞毒性 T 细胞浸润。此外,FessTMiR 组中自然杀伤(NK)细胞显著增加(图 8I)。血清中 FessTMiR 处理组的干扰素-γ(IFN-γ)水平最高,而转化生长因子-β(TGF-β)水平最低(图 8J-K),激活 T 细胞免疫反应,减少免疫抑制细胞转化。FessTMiR 通过抑制 PD-L1 表达,促进 CD8⁺ T 细胞和 NK 细胞浸润,减缓肿瘤生长(图 7M,图 8H-I)。综上,FessTMiR 将免疫“冷”肿瘤转变为“热”肿瘤,增强抗肿瘤免疫反应,显示出显著的癌症治疗潜力。
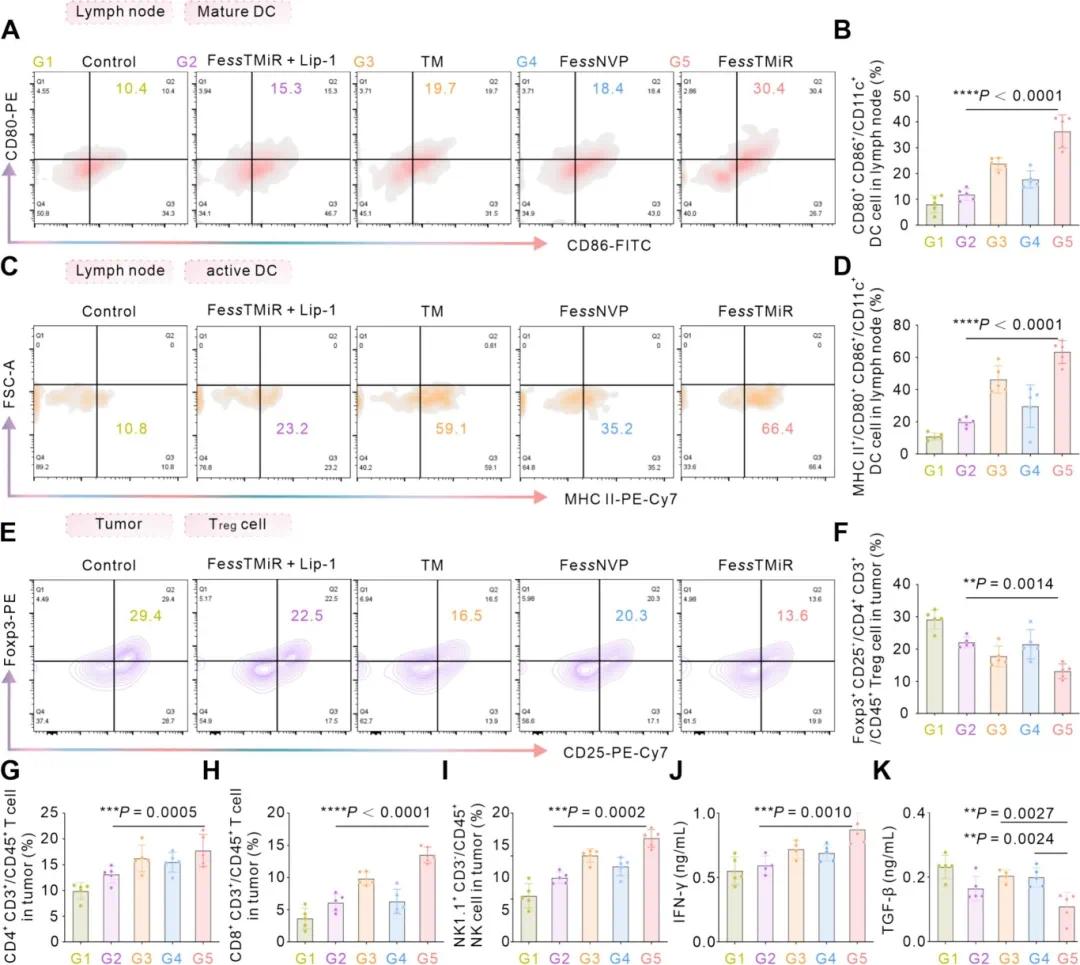
图8 Fe ss TMiR诱导的免疫反应评估。(A-B)4T1肿瘤小鼠在接受各种治疗后,代表性流式细胞术图(A)和DC成熟的量化(B);(C-D)相同条件下代表性流式细胞术图(C)和DC活化的量化(D);(E-F)代表性流式细胞术图(E)和治疗诱导的Treg细胞的量化(F);(G-I)流式细胞术分析显示肿瘤内CD4⁺ T细胞(G)、CD8⁺ T细胞(H)和NK1.1⁺细胞(I)的百分比;(J-K)治疗后血清IFN-γ(J)和TGF-β(K)水平的量化
(9)Fe ss TMiR对乳腺肿瘤的体内抗转移作用
在肺转移模型中,尾静脉注射后第 7 天,小鼠接受 Luc-4T1 肿瘤细胞注射。生物发光成像显示 FessTMiR 组肺转移显著减少(图 9B),其肿瘤生长曲线最慢(图 9C),表明抑制效果最好。FessTMiR 对小鼠体重影响极小(图 9D),且第 50 天存活率为 57.1%(图 9E)。在另一实验中,皮下注射 4T1 细胞诱导原发肿瘤后,尾静脉注射治疗药物,一周后再次注射 4T1 细胞诱导肺转移。结果显示,FessTMiR 组肿瘤体积显著更小(图 9H),小鼠体重无显著变化(图 9G)。实验结束后,FessTMiR 组肿瘤体积和重量显著更小(图 9I-J),且印度墨水染色和 H&E 切片分析显示其肺转移灶显著更少且更小(图 9M),转移率和结节数量最低(图 9K-L)。这些结果表明 FessTMiR 有效抑制了原发肿瘤生长和远处转移。
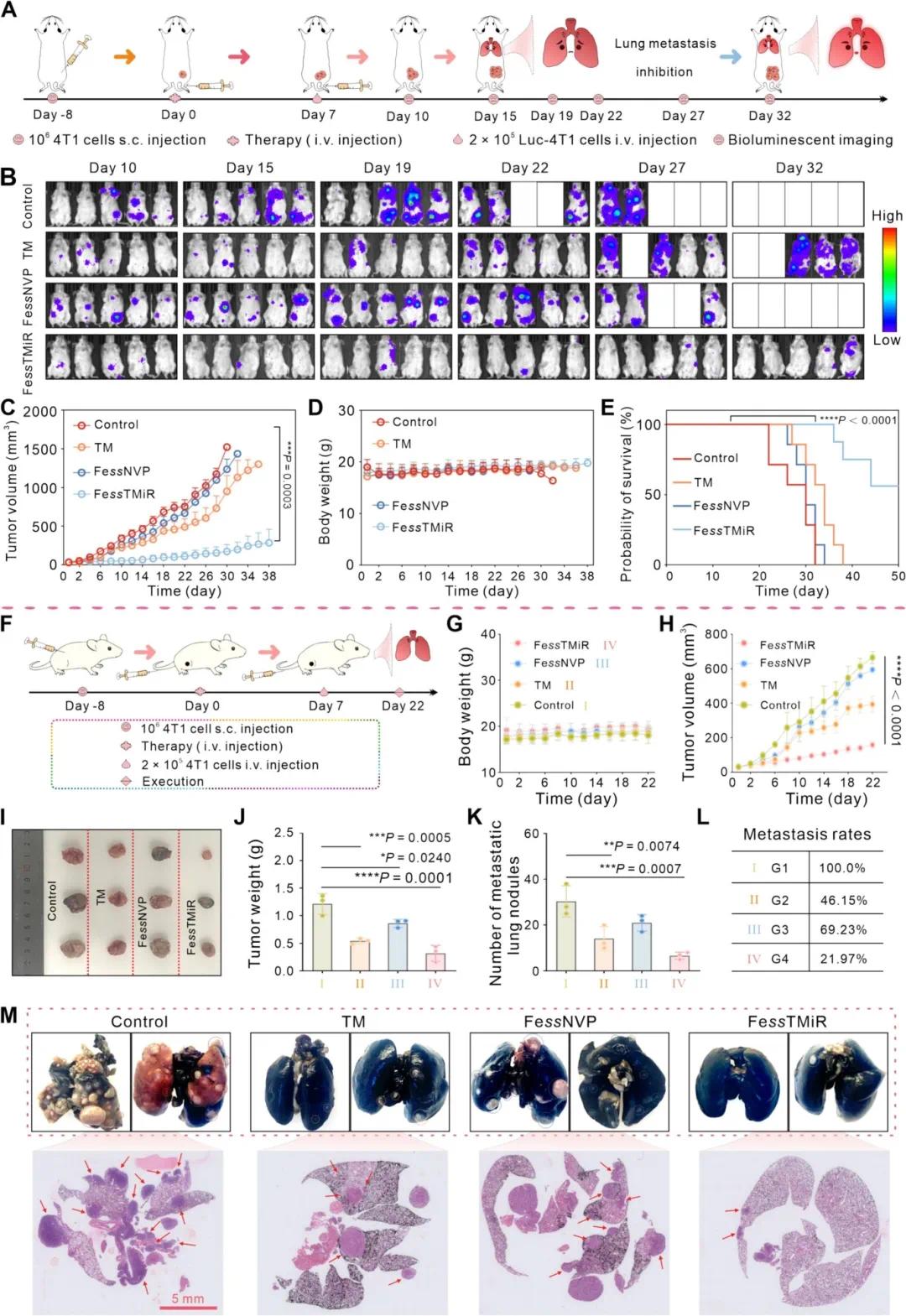
图9 抗肺转移效果评价。(A)Luc-4T1荷瘤小鼠模型体内抗转移成像试验示意图;(B)不同治疗后肺转移Balb/c小鼠生物发光图像;(C)不同治疗后Luc-4T1荷瘤小鼠肿瘤生长曲线;(D)不同治疗后Luc-4T1荷瘤小鼠体重;(E)不同治疗组肺转移Balb/c小鼠存活率;(F)4T1荷瘤小鼠模型体内抗转移试验示意图;(G)不同治疗后小鼠体重;(H)不同治疗后小鼠肿瘤生长曲线;(I)4T1荷瘤小鼠肿瘤解剖照片;(J)不同治疗后4T1荷瘤小鼠肿瘤重量;(K)4T1荷瘤小鼠肺转移结节数;(L)各组转移率统计分析;(M)不同治疗组肺的明视野和H&E染色图像
本研究制备的可生物降解的离子纳米调节剂Fe ss TMiR,能够同步调节铜和铁离子稳态,从而有效治疗乳腺癌。通过利用二硫烷二乙酸组装纳米载体 (Fe ss NV) 和抗铜剂四硫钼酸盐 (TM) 的独特特性,Fe ss TMiR 靶向肿瘤微环境以诱导铁死亡、细胞凋亡和自噬。
研究结果表明,这种双离子调节不仅可以抑制肿瘤生长和血管生成,还可以通过增加 T 细胞浸润和降低 PD-L1 表达来增强抗肿瘤免疫反应。这些结果强调了 Fe ss TMiR 作为一种新的癌症治疗策略的潜力,突出了离子稳态在调节肿瘤进展和免疫反应中的重要性。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

