
牙周炎是口腔微生物生态失衡引发的慢性炎症性疾病,会导致牙周组织破坏、牙齿脱落。牙周韧带干细胞(PDLSCs)对维持牙周稳态和组织再生很重要,但炎症环境会损害其成骨分化能力,难以恢复牙周组织。cGAS-STING通路在免疫反应中关键,能感知双链DNA激活,还参与非感染性疾病。受损线粒体释放mtDNA可激活该通路致细胞损伤,炎症下线粒体功能受损和自噬障碍是MSC成骨分化受损原因。目前,cGAS-STING通路对PDLSCs功能的调节作用尚待深入研究。

针对上述问题,重庆医科大学附属口腔医院翟启明团队阐明了cGAS-STING通路的激活阻碍了PDLSCs的成骨分化能力。从机制上讲,证明了炎症不仅导致线粒体DNA(mtDNA)通过线粒体通透性转变孔(mPTP)通道释放到细胞质中,还抑制了cGAMP的外排和降解。这两种机制共同促成了cGAS-STING通路的过度激活,进而损害了PDLSCs的成骨分化能力。因此,该团队制造了一种载有环孢素A(CsA,一种mPTP抑制剂)、ABCC1激动剂噻氟哌啶(TT)和ENPP1的线性聚乙烯醇聚(癸二酸甘油酯)(PEGA)水凝胶系统(CsA-TT-ENPP1@PEGA),该系统可以局部注射到牙周组织中。该三功能水凝胶系统在炎症条件下有效降低了PDLSCs中的cGAMP水平,并显示出作为治疗牙周骨缺损的有效治疗方法的显著前景,同时具有通过干预cGAMP稳态管理其他疾病的潜在意义。该文章于2025年2月13日以《cGAMP-targeting injectable hydrogel system promotes periodontal restoration by alleviating cGAS-STING pathway activation》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2025.02.010)。
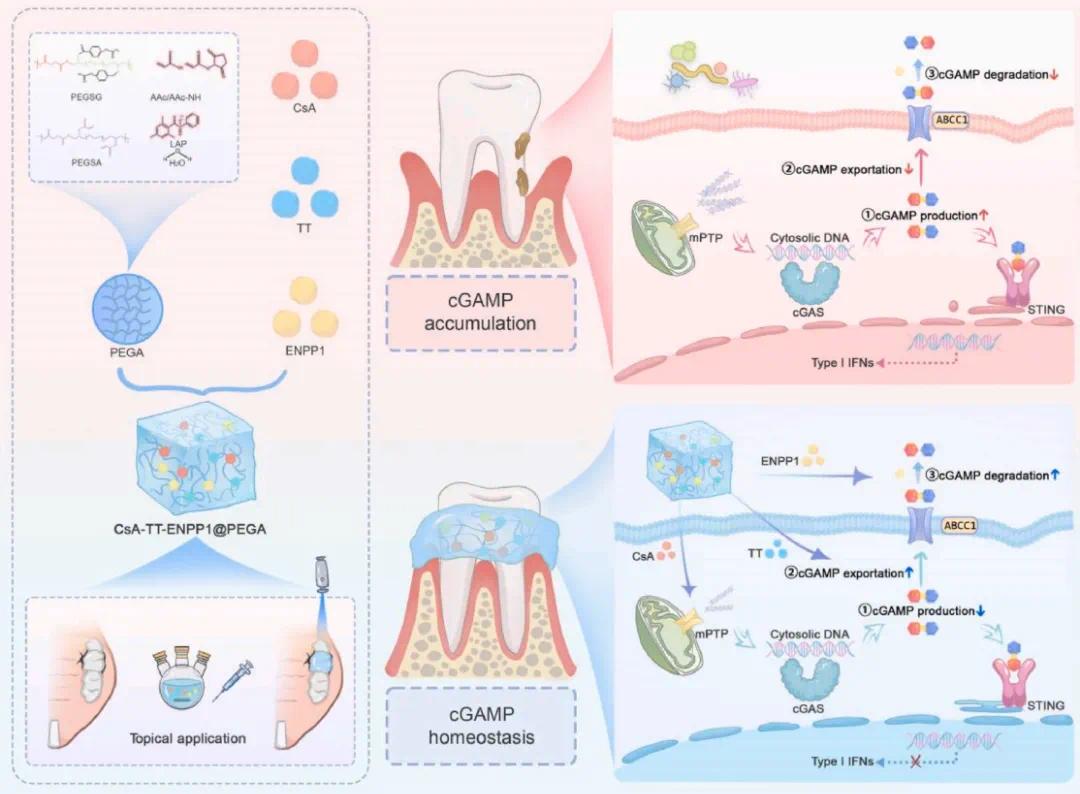
研究示意图
(1) 炎症条件下PDLSC中cGAS-STING通路被激活
首先,研究人员进行了转录组分析以阐明牙周炎的机制。火山图显示,炎症条件下许多基因被上调(见图2a)。KEGG通路富集分析(图2b)、基因本体(GO)富集分析(图2c)和基因集富集分析(GSEA)(图2d)表明,LPS暴露增加了细胞质DNA感知通路、1型干扰素信号通路以及与cGAS-STING通路相关的干扰素相关免疫反应。随后,研究人员探究了cGAS-STING通路是否在炎症诱导的PDLSCs中被激活。免疫荧光染色确认LPS刺激促进了STING的表达(图2e和f)。WB分析也显示,H-PDLSCs + LPS组中cGAS-STING通路相关蛋白的表达增加(图2g)。在结扎诱导的牙周炎小鼠中,标记为CD90的PDLSCs中STING的表达也升高(图2h和i)。综上所述,这些结果表明,cGAS-STING通路在炎症诱导的PDLSCs中被激活。
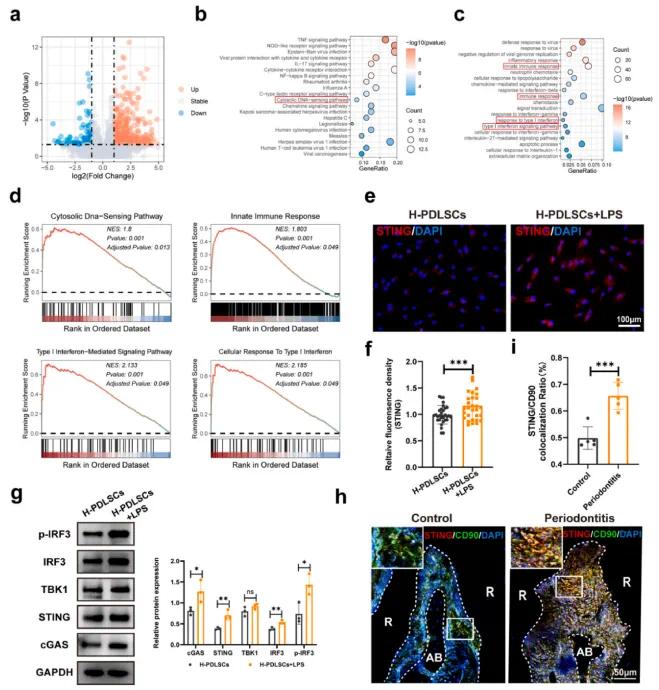
图1(a)H-PDLSC和H-PDLSC+LPS中基因表达的火山图;(b)LPS处理后的KEGG通路富集分析;(c)GO富集分析;(d)GSEA分析;(e)H-PDLSC和H-PDLSC+LPS中STING的免疫荧光染色和定量分析(f);(g)cGAS-STING通路相关蛋白的Western blot分析;(h)牙周组织中PDLSCs(CD90,绿色)和STING(红色)的免疫荧光染色;(i)对(h)中STING表达的定量分析
(2)抑制cGAS-STING通路促进PDLSCs成骨分化和牙周修复
为了验证cGAS-STING通路在PDLSCs功能失调中的作用,研究人员通过小干扰RNA(siRNA)敲低STING的表达。如预期,敲低STING显著改善了炎症条件下PDLSCs的分化能力(见图3a)。此外,他们还使用STING敲除(STING−/−)小鼠检测STING抑制对牙周修复的影响(见图3b)。免疫荧光染色显示,STING缺失显著减少了结扎诱导的牙周炎小鼠中CD90标记的PDLSCs中IRF3的表达(见图3c)。微型计算机断层扫描(micro-CT)结果表明,STING−/−小鼠中牙槽骨吸收显著减轻(见图3d),CEJ-ABC距离减小,BV/TV比值增加,骨小梁数量(Tb.N)增加(见图3e)。此外,还使用了STING的强效选择性拮抗剂H151来评估STING抑制对PDLSCs成骨分化的影响。结果发现,H151显著降低了STING及其下游通路蛋白的表达(见图3f),并显著缓解了炎症条件下PDLSCs的成骨分化缺陷(见图3g和图S4b)。为了进一步探讨STING药物抑制剂在牙周修复中的作用研究人员在牙周炎诱导一周后,向小鼠第二磨牙周围的六个部位注射C176(见图3h)。结果显示,C176显著减轻了牙周炎小鼠的牙槽骨丧失(见图3i和3j)。综上所述,体内外实验确认,cGAS-STING通路的激活与牙周炎密切相关,抑制STING具有治疗牙周炎的巨大潜力。
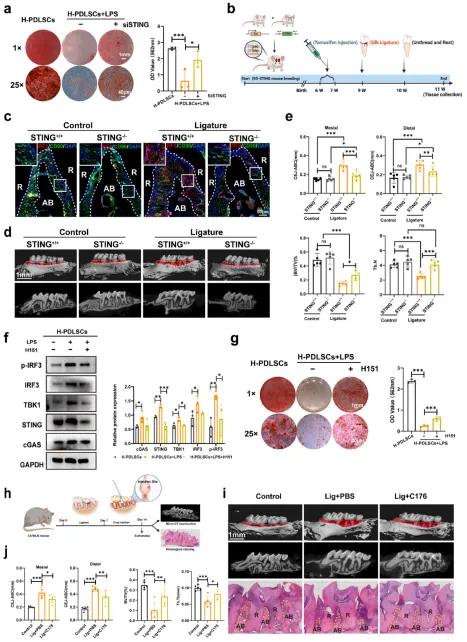
图2(a)siRNA介导的STING敲低改善了H-PDLSC+LPS细胞的成骨分化;(b)STING⁻/⁻小鼠治疗的示意图;(c)不同处理组小鼠牙周组织中PDLSCs(CD90,绿色)和IRF3(红色)的免疫荧光染色;(d)小鼠牙槽骨的代表性Macro-CT图像;(e)CEJ-ABC、BV/TV%和Th.N的定量分析;(f)H151处理后cGAS-STING通路相关蛋白的Western blot分析;(g)H151处理后阿利新红染色和矿化结节的定量分析;(h)C176处理C57小鼠结扎诱导的牙周炎的示意图;(i)不同处理组小鼠牙槽骨的代表性Macro-CT图像和H&E染色;(j)CEJ-ABC、BV/TV%和Th.Tb的定量分析
(3)从受损线粒体释放的mtDNA负责炎症后PDLSC中cGAS-STING通路的激活
为研究线粒体功能,使用Seahorse Bioscience XF分析仪检测了氧气消耗率(OCR)和细胞外酸化率(ECAR),作为代谢活性的指标。结果显示,LPS显著损害了PDLSCs的氧气消耗(见图4a),表明在炎症条件下线粒体代谢从氧化磷酸化转向糖酵解。共聚焦显微镜图像显示,H-PDLSCs + LPS组的线粒体网络受损,线粒体数量增多且形态延长(见图4b和c)。此外,线粒体反应性氧种(mtROS)是线粒体功能的重要指示物,该研究发现H-PDLSCs + LPS组的mtROS水平显著升高(见图4d)。与细胞内mtROS水平一致,H-PDLSCs + LPS组抗氧化基因的表达也显著低于H-PDLSCs组,并伴随着炎症条件下PDLSCs中膜电位(MMP)降低(见图4e)。8-羟基-2′-脱氧鸟苷(8-OHdG)作为DNA氧化损伤的标志物,在H-PDLSCs + LPS组中高表达(见图4f)。此外,H-PDLSCs + LPS组中双链DNA和线粒体的共定位减少(见图4g和h),qRT-PCR进一步提示炎症条件下更多的mtDNA被释放到细胞质中(见图4i)。为了进一步明确cGAS-STING通路的激活与PDLSCs功能失调是否与mtDNA泄漏相关,使用溴化乙锭(EtBr)去除PDLSCs的mtDNA。EtBr显著减少了mtDNA拷贝数(,并抑制了H-PDLSCs + LPS组中cGAS-STING通路的激活(见图4j)。更重要的是,EtBr处理部分缓解了炎症微环境下PDLSCs的成骨分化缺陷(见图4k)。这些结果表明,炎症刺激引起的mtDNA损伤和释放到细胞质中,进一步激活了cGAS-STING通路,导致PDLSCs功能失调。
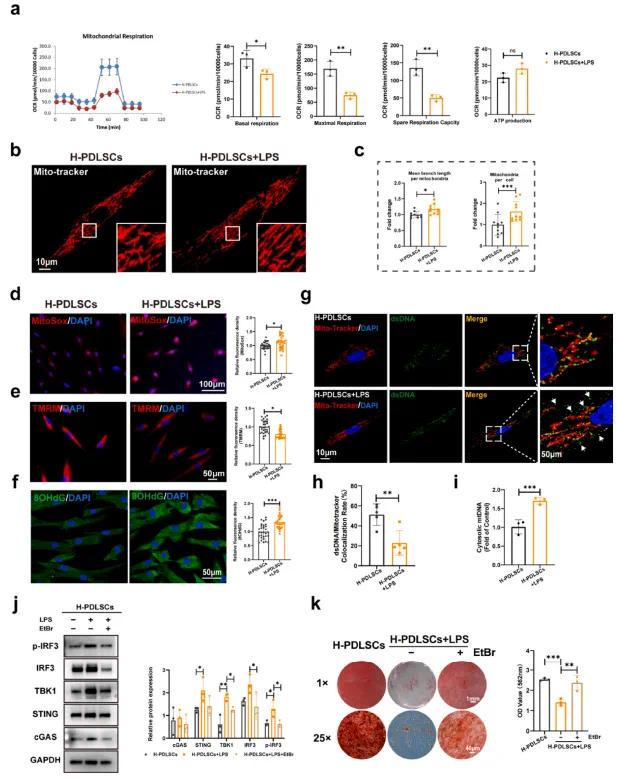
图3(a)使用Seahorse XFe24分析仪测量的线粒体呼吸能力分析(氧气消耗率;OCR);(b)用Mito Tracker染色的线粒体代表性图像;(c)线粒体形态(每个细胞的分支长度和数量)分析;(d)MitoSox染色的免疫荧光和定量分析;(e)线粒体膜电位(▵Ψm,TMRM染色)的免疫荧光和定量分析;(f)8-OHdG染色的免疫荧光和定量分析;(g)线粒体(Mito Tracker,红色)和DNA(抗双链DNA抗体,绿色)的免疫荧光染色;(h)(g)数据的共定位分析;(i)通过qRT-PCR分析细胞质DNA的来源;(j)mtDNA耗竭后cGAS-STING通路相关蛋白的Western blot分析;(k)阿利新红染色和矿化结节的定量分析
(4)发生炎症时PDLSC中mtDNA通过mPTP通道释放到胞质溶胶中
研究发现,LPS刺激未显著增加PDLSCs的凋亡或BAX表达(见图5a和b),但mPTP相关蛋白HK2和VDAC的表达显著增加(见图5b),表明炎症可能改变了mPTP状态。LPS还导致线粒体肿胀、延长,并增加内质网与线粒体的膜接触(见图5c)。同时,Ca2+过载和基质颗粒的出现(见图5c,绿色箭头)表明线粒体功能受损。Rhod-2 AM染色显示,H-PDLSCs + LPS组的Ca2+水平显著升高(见图5d),且Calcein-CoCl2染色结果表明mPTP开放增加(见图5e)。
RU360有效阻断了Ca2+的进入并抑制了mPTP的开放。此外,CsA抑制mPTP开放,减缓了cGAS-STING通路的激活(见图5f),并改善了PDLSCs在炎症条件下的成骨分化缺陷(见图5g,图S10)。在结扎诱导的牙周炎小鼠中,CsA有效减少了牙槽骨丧失(见图5h)并显著改善了CEJ-ABC距离、BV/TV和Tb.Th(见图5i)。长期使用CsA未见明显组织病理变化。综上,炎症通过线粒体Ca2+过载引发mPTP开放和mtDNA泄漏,进而激活cGAS-STING通路。
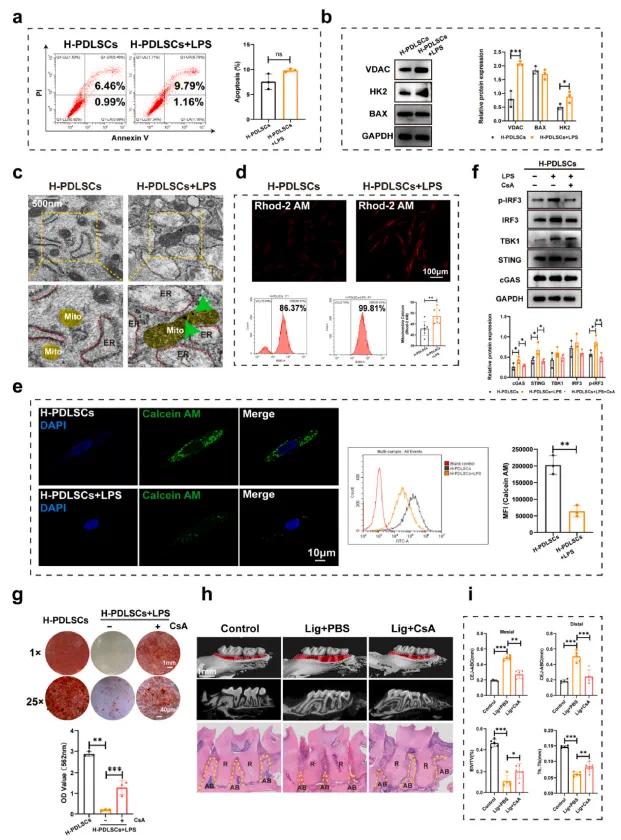
图4(a)通过PI染色和流式细胞术检测细胞凋亡;(b)BAX、VDAC和HK2表达的Western blot分析;(c)H-PDLSCs和H-PDLSCs+LPS的代表性透射电子显微镜(TEM)图像(黄色标记的结构表示线粒体,红色虚线框出的结构是内质网,绿色箭头指示基质颗粒);(d)通过Rhodi-2 AM染色和流式细胞术定量分析线粒体Ca²⁺;(e)通过Calcein AM检测mPTP开放情况,并通过流式细胞术定量分析MFI;(f)CsA处理后cGAS-STING通路相关蛋白的Western blot分析;(g)阿利新红染色和矿化结节的定量分析;(h)不同处理组小鼠牙槽骨的代表性Macro-CT图像和H&E染色;(i)CEJ-ABC、BV/TV%和Th.Tb的定量分析
(5)PDLSC中cGAMP稳态失调导致cGAS-STING通路持续激活
cGAS与细胞质中的mtDNA结合后,催化形成cGAMP,激活先天免疫反应。使用cGAMP ELISA试剂盒测量LPS刺激下不同时间点的cGAMP浓度,发现H-PDLSCs + LPS组细胞外cGAMP浓度显著低于H-PDLSCs组,而细胞内cGAMP浓度显著升高(见图6a),表明cGAMP稳态失调。可能的原因是cGAMP的转运减少或细胞外降解减少,导致细胞内cGAMP积累,激活cGAS-STING通路。
LPS处理显著降低了ABCC1和ENPP1的表达(见图6b、6c和6e),提示这些机制可能导致cGAMP积累。为增强cGAMP外排,使用ABCC1激动剂TT(1 μg/mL)并发现其显著增加了细胞外cGAMP(见图6f)。进一步实验表明,1 μg/mL TT与0.1 μg/mL ENPP1的联合使用不仅抑制了cGAS-STING通路的激活(见图6h),还恢复了PDLSCs的成骨能力(见图6i)。这些结果表明,cGAMP稳态的失调导致STING信号持续激活,从而损害PDLSCs的功能。
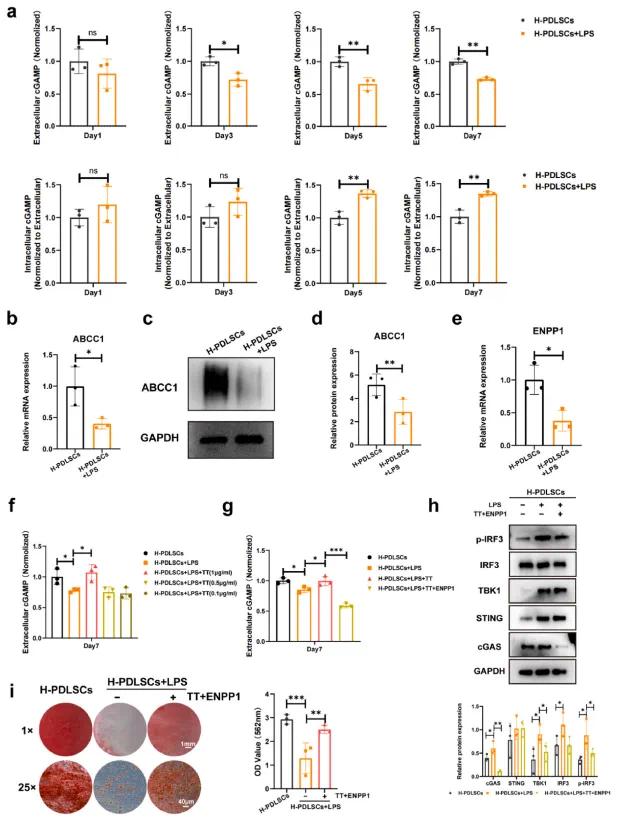
图5(a)ELISA分析H-PDLSC和H-PDLSC+LPS组在不同时间点的细胞外和细胞内cGAMP水平;(b)通过qRT-PCR定量ABCC1 mRNA的表达;(c, d)ABCC1表达的Western blot分析;(e)通过qRT-PCR定量ENPP1 mRNA的表达;(f)ABCC1激动剂TT促进cGAMP的细胞外转运;(g)TT和ENPP1联合应用后细胞外cGAMP的检测;(h)TT和ENPP1联合应用后cGAS-STING通路的Western blot分析;(i)阿利新红(AR)染色和矿化结节的定量分析
(6)通过CsA-TT-ENPP1@PEGA水凝胶恢复cGAMP稳态抑制cGAS-STING途径并促进体内牙周恢复
根据对cGAMP稳态失调的研究,研究团队合成了药物载体水凝胶系统,调节cGAMP的生成、外排和降解以治疗牙周炎。研究人员通过混合PEGA粉末和光引发剂LAP,制备了光固化水凝胶(见图7a)。不同浓度的LAP对PEGA水凝胶的力学性质和微观结构无显著影响(见图7b、7c和7d),因此选择了0.07%的LAP浓度。PEGA水凝胶具有良好的注射性和成胶性,能够精确填充不规则的牙周缺损并在蓝光照射下迅速固化(见图7f,图S14)。红外光谱(FTIR)和拉曼光谱分析确认了PEGA水凝胶的典型特性(见图7g和7h)。水凝胶在PBS中膨胀并缓慢降解(见图7i),并以快速初期释放后,慢且均匀地释放药物(见图7j)。在结扎诱导的牙周炎小鼠中,CsA-TT-ENPP1@PEGA水凝胶显著促进了成骨,CEJ-ABC距离较短,BV/TV %和Tb.Th明显提高(见图7k、7l、7m)。免疫荧光显示STING和IRF3在PDLSCs中的表达减弱(见图7n、7o)。这些结果表明,局部递送cGAS-ABCC1-ENPP1能够缓解牙周炎并促进牙槽骨再生。总的来说,研究人员发现恢复cGAMP稳态在牙周炎治疗中具有重要作用,并具有巨大的治疗潜力。
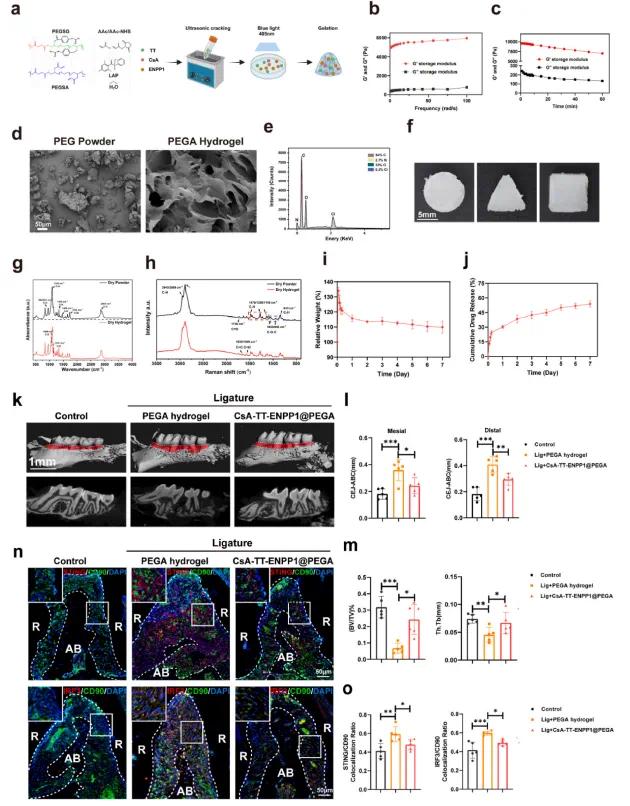
图6(a)PEGA水凝胶合成的示意图;(b)PEGA水凝胶在5%应变下储能模量和损耗模量(G′和G′′)的变化;(c)在5%应变和6 rad/s条件下PEGA水凝胶储能模量和损耗模量(G′和G′′)的时间扫描变化;(d)PEG粉末和PEGA水凝胶的扫描电子显微镜(SEM)图像;(e)PEGA的能谱分析(EDS)光谱;(f)PEGA水凝胶在不同3D模式下的注射照片(体外);(g)PEG粉末和PEGA水凝胶的傅里叶变换红外光谱(FTIR);(h)PEG粉末和PEGA水凝胶的拉曼光谱;(i)PEGA水凝胶在PBS中的膨胀和降解曲线;(j)PEGA水凝胶中DOX的累积释放曲线;(k)不同处理组小鼠牙槽骨的代表性Micro-CT图像;(l)CEJ-ABC的定量分析;(m)BV/TV%和Th.Tb的定量分析;(n)不同处理组小鼠牙周组织中PDLSCs(CD90,绿色)和STING(红色)的免疫荧光染色;(o)CD90阳性细胞和STING阳性细胞的共定位分析
该研究建立了cGAMP稳态与间充质干细胞(MSCs)功能之间的联系。此外,该研究首次发现炎症可以诱导线粒体DNA(mtDNA)释放到细胞质中,下调ABCC1的表达并降低ENPP1的水平,这些变化导致cGAMP的积累,从而引发cGAS-STING通路的持续激活,进而损害PDLSCs的分化能力。本研究不仅为牙周再生提供了新颖的方法论,还为其他与炎症相关的疾病管理提出了创新的策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

