
抗生素抗性是全球公共健康的重大挑战,导致感染性疾病治疗困难,发病率和死亡率上升。目前主要依靠多种机制抗生素联合使用提升疗效,但存在协同作用不稳定、不良反应增加等缺点,还可能加速细菌多重耐药性产生。生物材料在对抗耐药细菌感染方面有独特优势,但现有设计方法多依赖经验,缺乏系统性和预测性,难以优化材料组分间协同作用。
人工智能(AI)技术能从海量数据中提取信息、识别复杂模式并精准预测,为解决复杂问题提供了有力工具。AI驱动的生物材料设计策略通过机器学习算法分析材料组成、结构与性能间复杂关系,优化材料性能。然而,现有AI模型对生物材料与微生物相互作用机制的理解尚不充分

针对上述问题,广东省人民医院马立敏教授开发了一个AI驱动的平台(AMP-hydrogel-Designer),用于自动化设计AI-AMP水凝胶。该平台结合了生成预训练(GPT)、提示调优(PT)、对比学习、知识蒸馏(KD)和强化学习(RL)等先进技术,生成了一种新型含硫抗菌肽(AK15),其独特的氨基酸序列使其对耐药细菌具有强大且广谱的抗菌活性。AK15的设计考虑了与水凝胶中其他含硫组分的二硫键形成,从而增强了水凝胶的网络结构和稳定性。此外,为提升水凝胶在再生医学中的潜力,研究中引入了Cu-BTO(铜掺杂的压电纳米材料),通过Cu-SH配位促进额外的复杂交联。BTO能够将伤口运动的机械能转化为有益的电能,主动刺激再生并加速愈合。这种AI驱动的生物材料设计提供了一种高效、低毒的抗菌生物材料,为应对日益严峻的耐药细菌感染问题提供了创新解决方案。该研究于2025年3月30日以《AI-Guided Design of Antimicrobial Peptide Hydrogels for Precise Treatment of Drug-resistant Bacterial Infections》为题发表于材料学顶刊《Advanced Materials》上(DOI:10.1002/adma.202500043)。
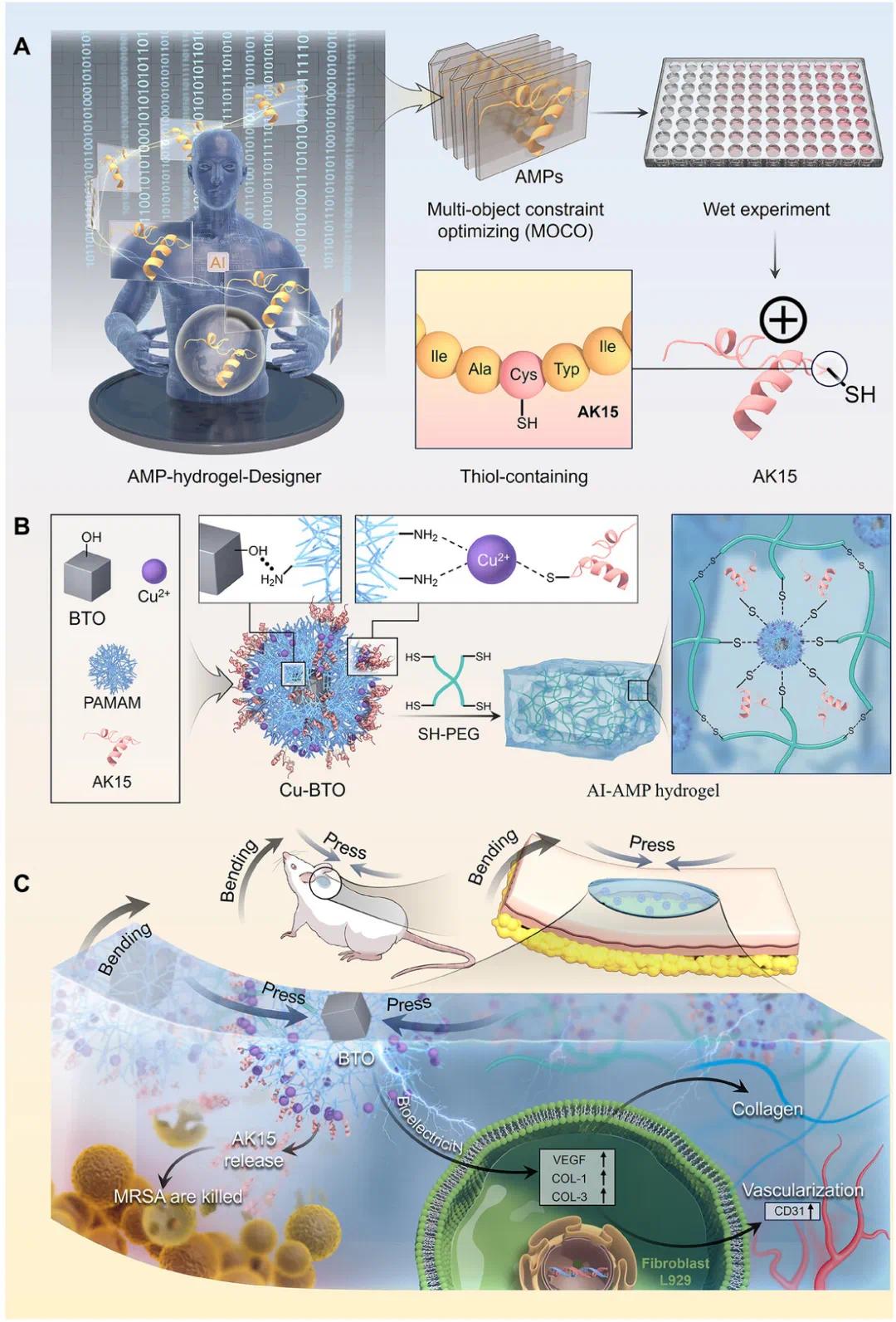
研究示意图
(1)AMP-Hydrogel-Designer 的开发及其在 AK15 生成中的应用
与静态伤口不同,颈部后侧、手腕、肘部、膝盖和脚踝等可活动部位的伤口由于持续的拉伸和弯曲,导致愈合过程更长,并增加了感染的风险。动态伤口感染模型被选中用于测试人工智能设计的生物材料的疗效。基于4臂PEG-SH(PEG-4SH)的水凝胶因其卓越的生物相容性和自愈特性,在修复活动性伤口方面表现出显著优势,但单独使用PEG-4SH作为治疗耐多药细菌感染动态伤口的生物材料是不够的。为了设计目标抗菌肽(AMP),研究者开发了AMP-水凝胶设计平台。该平台从构建一个在大量肽数据上预训练的大型语言模型(LLM)开始,随后在抗菌肽数据集上进行微调(PT),并利用强化学习(RL)进一步优化预训练模型。奖励函数由抗菌活性、针对大肠杆菌和金黄色葡萄球菌的归一化最小抑制浓度(nMIC)值以及包含半胱氨酸残基的要求组成。生成的肽经过物理化学性质分析,发现预训练的AMP-GPT模型生成的肽与真实数据非常接近,而经过微调和蒸馏的模型进一步提高了相似性。
在强化学习过程中,肽的属性得分逐渐提高,总体奖励得分从约1.6增加到3.0,抗菌活性的概率从0.5上升到约0.75,大肠杆菌和金黄色葡萄球菌的预测MIC值显著下降(图1E)。包含半胱氨酸残基的肽序列比例从约0.1增加到0.4。生成的肽经过过滤和精炼,最终选出了排名前五的序列进行实验验证。AK15表现出强大的广谱抗菌活性,对多种临床耐药菌株表现出显著的抗菌效果,因此被选为与PEG-4SH交联的理想抗菌肽。从模型构建和训练到AK15的生成、化学合成以及体外活性验证,整个过程仅耗时约16天。人工智能引导的抗菌肽设计平台有望简化生物材料开发流程,减少试错所需的资源和时间,从而实现更具成本效益的生产,并使人工智能设计的抗菌材料更广泛地应用于耐药细菌感染的患者。如图1所示,该平台的工作流程包括大型语言模型的构建、微调和强化学习优化。
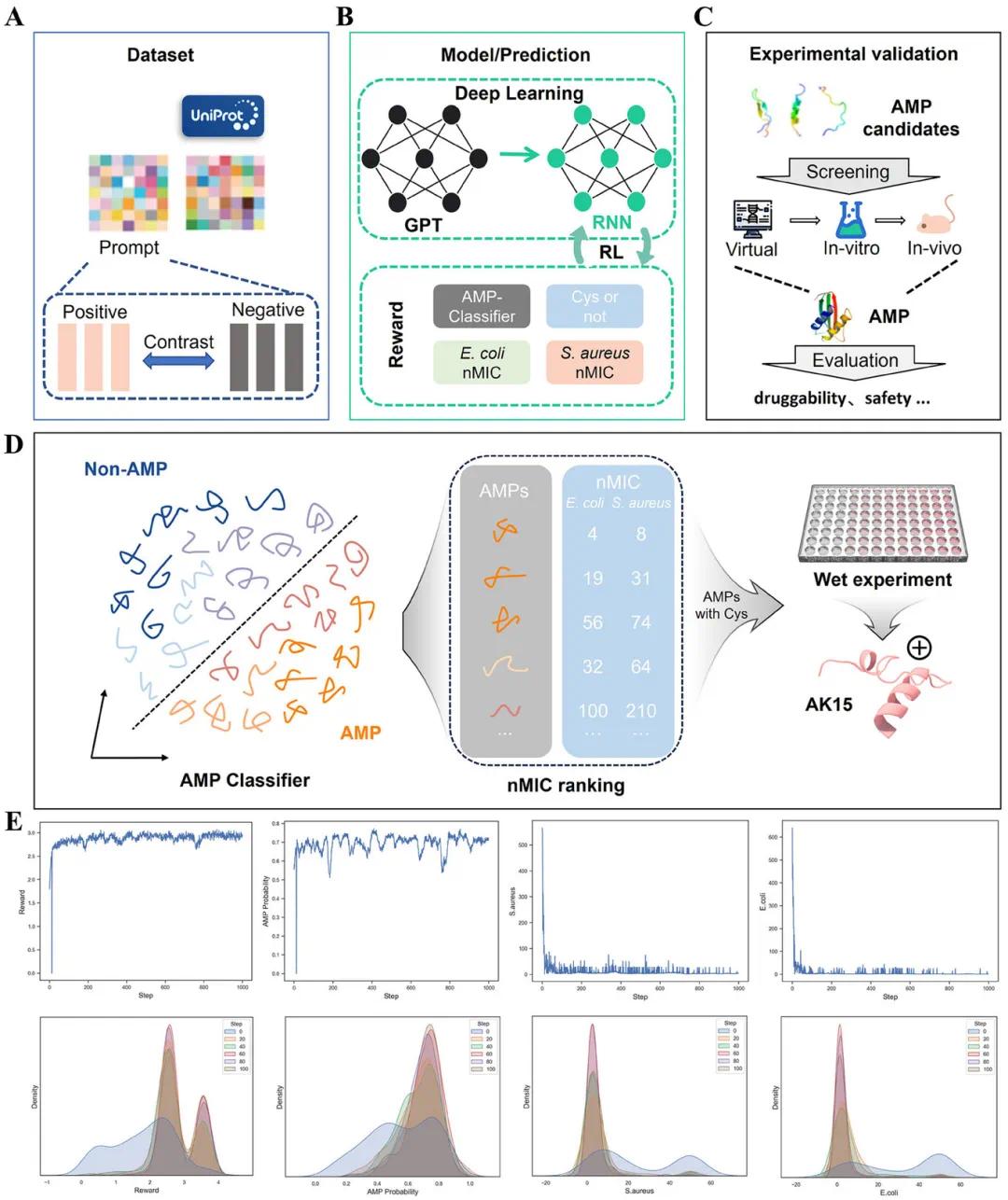
图1 使用AMP-hydrogel-Designer生成和筛选AK15。(A)AMP-hydrogel-Designer的训练数据集;(B)AMP-hydrogel-Designer的架构;(C)AMP候选物的实验验证;(D)AK15的详细生成和筛选步骤;(E)在强化学习(RL)过程中各种肽属性评分的演变
(2)AI-AMP水凝胶的制备及表征
为了促进可活动部位伤口愈合,将压电组件整合到水凝胶中以刺激细胞修复活性。选择四方相钛酸钡(BTO)纳米颗粒进行表面修饰,通过自组装在BTO表面形成氨基树状大分子涂层,随后与铜离子配位生成Cu-BTO(图2A)。SEM(图2B)和TEM(图2C)分析显示Cu-BTO粒径均匀,平均直径约195 nm,涂层厚度约20 nm。EDS和XPS分析确认N和Cu均匀分布,XPS数据显示铜结合能降低。XRD表明Cu-BTO保持四方相结构,PFM显示良好压电性能,D33约为16.14 pm/V(图2D-F)。Cu-BTO通过铜-硫醇配位与PEG-4SH和AK15交联形成可注射、自愈合的AI-AMP水凝胶。SEM(图2H)显示水凝胶多孔结构,Cu-BTO分布均匀。FTIR(图2I)确认Cu-BTO结合成功。水凝胶具动态自形成配位键,赋予自愈合性能。组织粘附测试(图2G)显示良好粘附性,吸水性测试表明膨胀率>2500%,且能自我修复(图S10-S11)。流变测试(图S12-S13)显示低剪切呈固态,高剪切转为流体,具可注射性。压电效率测试表明,在1 W/cm²超声功率下,开路电压221 mV,短路电流29.5 nA,可有效将伤口运动转化为电能。AK15含硫醇基团与PEG-4SH形成二硫键,铜离子存在时形成更稳定结构。
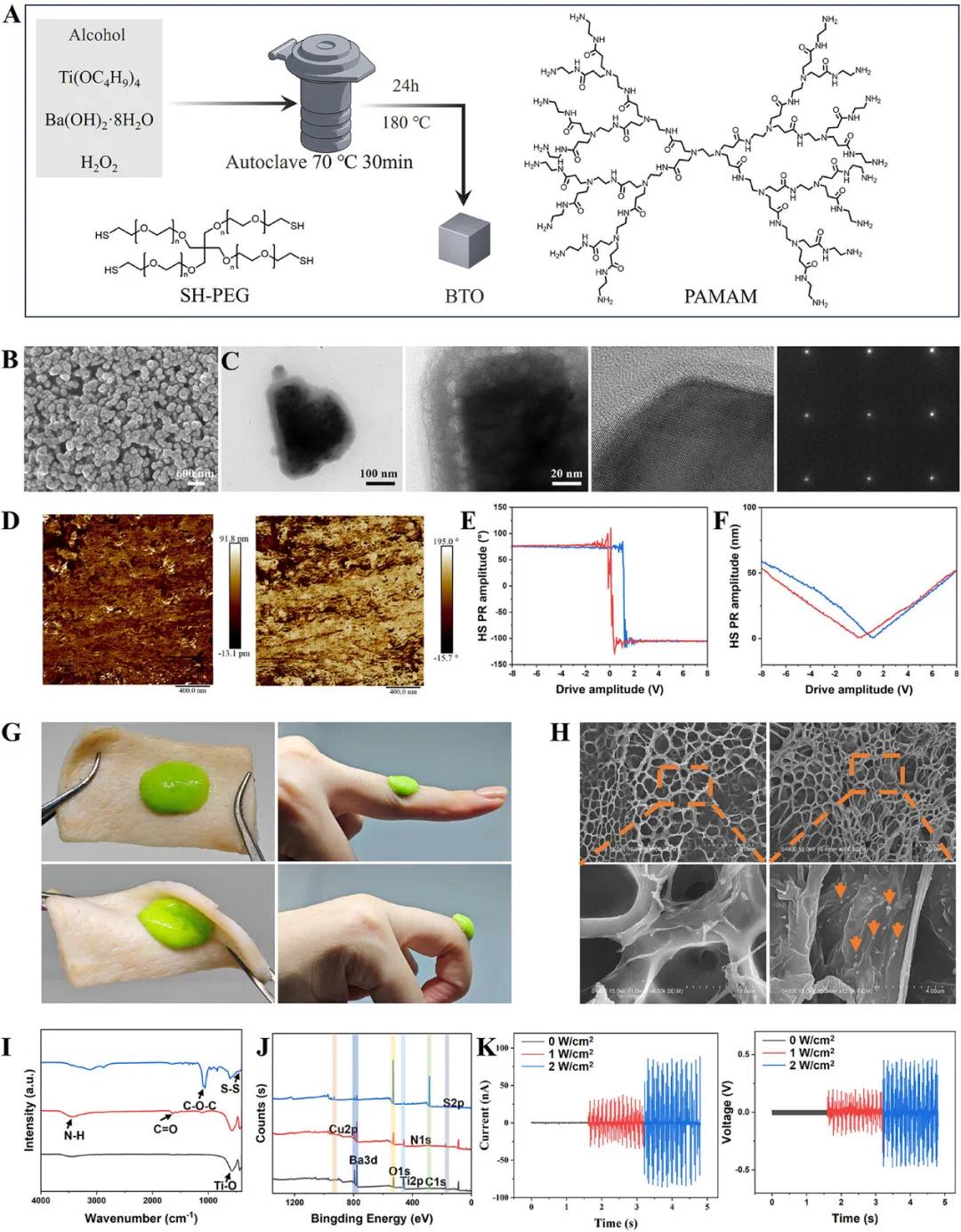
图2 AI-AMP水凝胶的制备与表征。(A)BTO纳米颗粒的表面修饰;(B)Cu-BTO纳米颗粒的SEM图像;(C)单个Cu-BTO纳米颗粒的TEM图像,以及对应的选区电子衍射图案;(D)PFM分析的振幅和相位图像;(E)滞回环;(F)蝴蝶环;(G)在猪皮和人手上进行的组织粘附测试;(H)AI-AMP水凝胶的SEM图像,橙色箭头为Cu-BTO纳米颗粒;(I)FTIR;(J)XPS;(K)在0、1和2 W cm⁻²超声功率下AI-AMP水凝胶的开路电压和短路电流
(3)AI-AMP-Hydrogel的体外抗菌活性及机理
为了测试AI-AMP水凝胶的抗菌效果,进行了菌落计数和细菌活/死染色实验,以确定与水凝胶孵育后大肠杆菌和耐甲氧西林金黄色葡萄球菌(MRSA)的活性。同时,利用TEM和SEM观察细菌形态。此外,通过结晶紫染色评估了水凝胶对MRSA生物膜的抗活性。结果显示(图3A),AI-AMP水凝胶对大肠杆菌和MRSA表现出强大的抗菌活性,与对照组相比抑制率高达99.99%,而铜和BTO水凝胶对这些菌株没有抑制作用。该研究还与广泛认可的金标准抗菌肽(蜂毒肽)进行了对比实验。结果表明,AI-AMP水凝胶的抗菌效果优于蜂毒肽水凝胶。细菌活/死染色实验(图3C)进一步证实了这些发现;与生长对照组、铜水凝胶和BTO水凝胶组相比,AI-AMP水凝胶处理组的活菌数量显著减少(图3J,K)。与传统肽载水凝胶相比,AI-AMP水凝胶通过AK15和Cu-BTO增强的活性氧(ROS)生成的协同作用,实现了更高的细菌清除率。TEM和SEM结果显示,生长对照组的细菌膜光滑且结构完整,而AI-AMP水凝胶组的细菌膜受损甚至破裂,导致细胞内容物泄漏。这表明AK15通过破坏细菌膜的完整性来发挥抗菌作用。此外,AI-AMP水凝胶破坏了MRSA生物膜,使其生存率显著低于其他三组(图3B,I)。这些结果共同表明,AI-AMP水凝胶在体外具有强大而广谱的抗菌活性。
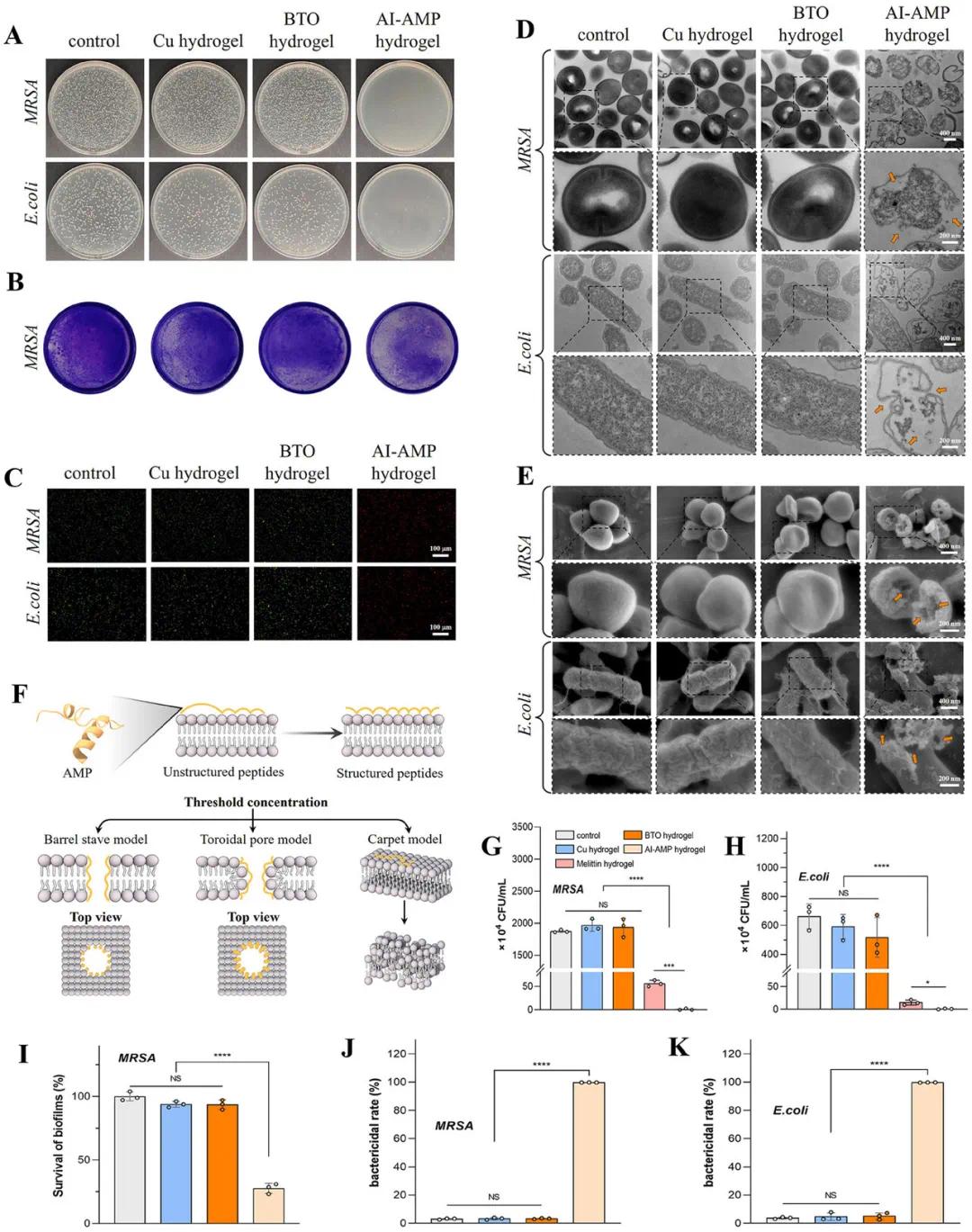
图3 AI-AMP水凝胶的体外抗菌性能。(A)不同样品处理后的MRSA和大肠杆菌(E. coli)的代表性菌落图像;(B)AI-AMP水凝胶对MRSA生物膜的抑制活性;(C)不同处理后MRSA和大肠杆菌的活/死染色图像;(D)MRSA和大肠杆菌的TEM图像;(E)MRSA和大肠杆菌的SEM图像;(F)AK15的抗菌机制;(G,H)不同处理后MRSA和大肠杆菌的菌落形成单位(CFU);(I)不同处理后存活的MRSA生物膜的定量分析;(J,K)不同处理后MRSA和大肠杆菌的存活率。(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
为了进一步阐明AI-AMP水凝胶对MRSA的抗菌机制,该研究分析了生长对照组和AI-AMP水凝胶处理组的MRSA转录组数据。火山图(图4A)显示,与对照组相比,AI-AMP水凝胶处理的MRSA表现出233个差异表达基因(DEGs),其中176个上调,57个下调。环形热图(图4B)显示,上调基因主要与细胞壁修饰、膜表面电荷调节和铜离子转运相关,而下调基因主要涉及细胞壁修复、膜应激反应、代谢活动和溶血活性。AI-AMP水凝胶不仅削弱了MRSA的细胞壁修复能力,还通过抑制膜应激反应和干扰代谢活动提高了抗菌活性。尽管MRSA试图通过改变膜电荷来保护自身,但这不足以抵抗AI-AMP水凝胶的杀菌作用。此外,AI-AMP水凝胶处理降低了溶血活性,并破坏了MRSA的铜离子稳态调节系统。
GO富集分析(图4C)显示,AI-AMP水凝胶对MRSA的影响集中在蛋白质翻译、tRNA修饰等关键生物过程。核糖体相关组分显著富集,表明细菌通过增强核糖体功能应对抗菌压力。KEGG富集分析(图4D)显示,影响集中在核糖体生物合成、代谢途径和抗菌肽抗性等过程,感染途径显著下调,表明AI-AMP水凝胶降低了MRSA的毒力和感染能力。PPI网络(图4E)显示,关键基因参与了细菌膜改变、代谢过程和毒力因子调控。基于转录组结果的抗MRSA机制示意图如图4F所示。这些结果表明,AI-AMP水凝胶通过破坏细菌膜、干扰代谢和降低毒力发挥抗菌作用。
AI-AMP水凝胶在体外对大肠杆菌和MRSA表现出优越的抗菌效果,主要归因于AK15与Cu-BTO的时间协同作用。Cu-BTO产生活性氧破坏细菌膜,为AK15的有效渗透创造机会。此外,水凝胶网络的复杂相互作用导致更紧凑的结构,有利于AK15的稳定固定和控释。
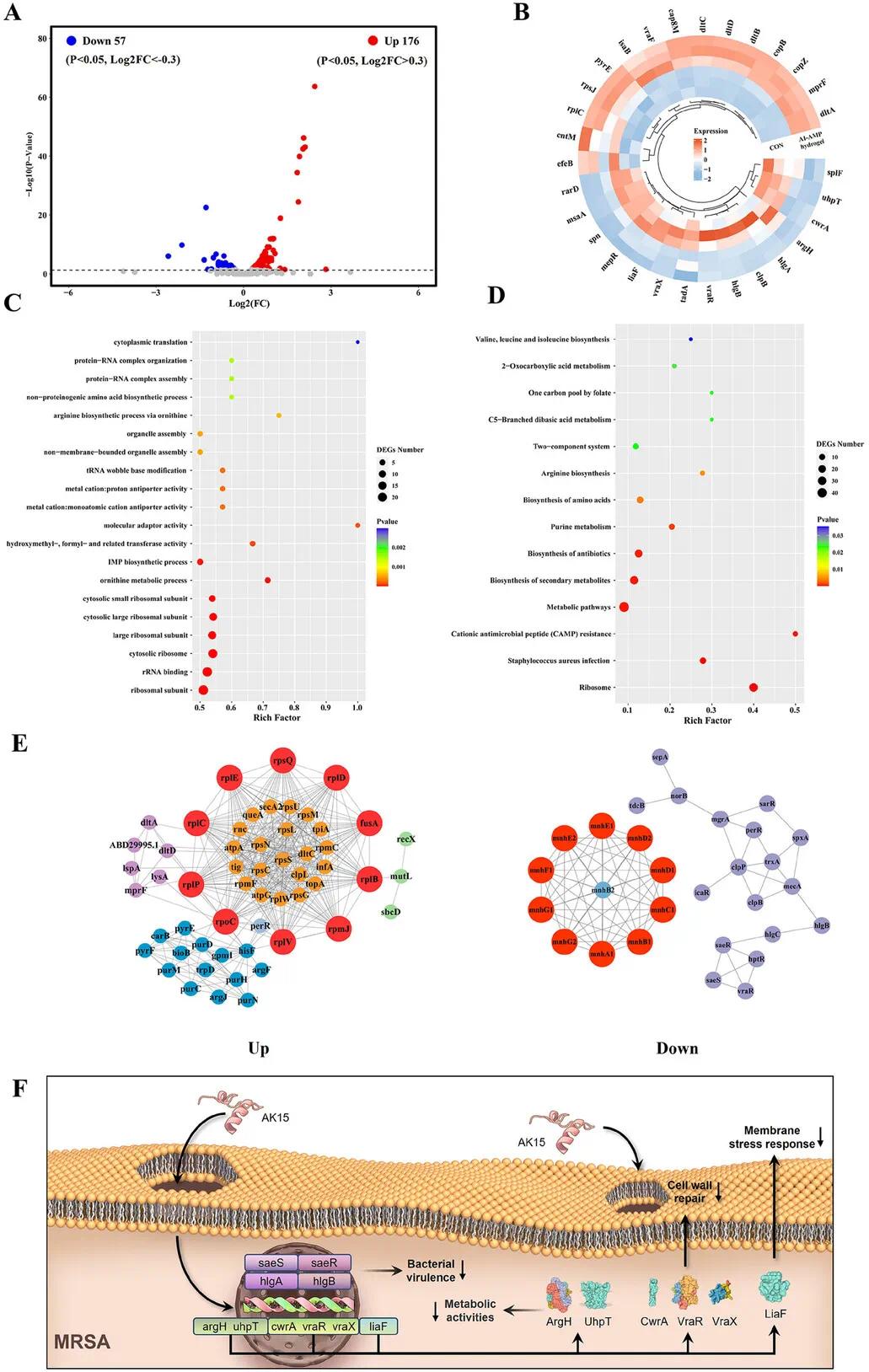
图4 转录组学分析。(A)对照组与AI-AMP水凝胶+超声组的差异表达基因(DEGs)火山图;(B)上调和下调DEGs中排名前15的基因的聚类分析;(C)所有DEGs的基因本体(GO)富集分析;(D)所有DEGs的京都基因与基因组百科全书(KEGG)富集分析;(E)上调和下调DEGs的蛋白质-蛋白质相互作用(PPI)网络;(F)AI-AMP水凝胶抗MRSA机制示意图
(4)AI-AMP-Hydrogel的生物相容性及伤口愈合性能
为了评估AI-AMP水凝胶的生物相容性,该研究使用小鼠成纤维细胞L929细胞进行实验。CCK-8实验(图5E)显示,即使AK15浓度达到128 µg/mL,L929细胞存活率仍保持在87.2%,表明AK15生物相容性良好。进一步实验(图5F)表明,AI-AMP水凝胶对细胞增殖无影响,具有优异的生物相容性。活/死染色实验(图5C)显示,无论是否超声激活,AI-AMP水凝胶对L929细胞存活均无影响。组织病理学分析显示,AI-AMP水凝胶在大鼠伤口愈合后30天内未引起慢性毒性或免疫反应,具有良好的长期生物相容性和安全性。
为了评估AI-AMP水凝胶的体外伤口愈合效果,该研究进行了Transwell和划痕实验。Transwell实验(图5A, C, G)显示,超声激活后,含BTO纳米颗粒的水凝胶组细胞迁移率显著提高。划痕实验(图5B, D, H)也表明,低强度超声显著增强了水凝胶组的细胞迁移能力。此外,qPCR结果显示,超声激活的AI-AMP水凝胶显著上调了VEGF、COL-I和COL-III的表达,促进了细胞迁移和伤口愈合。
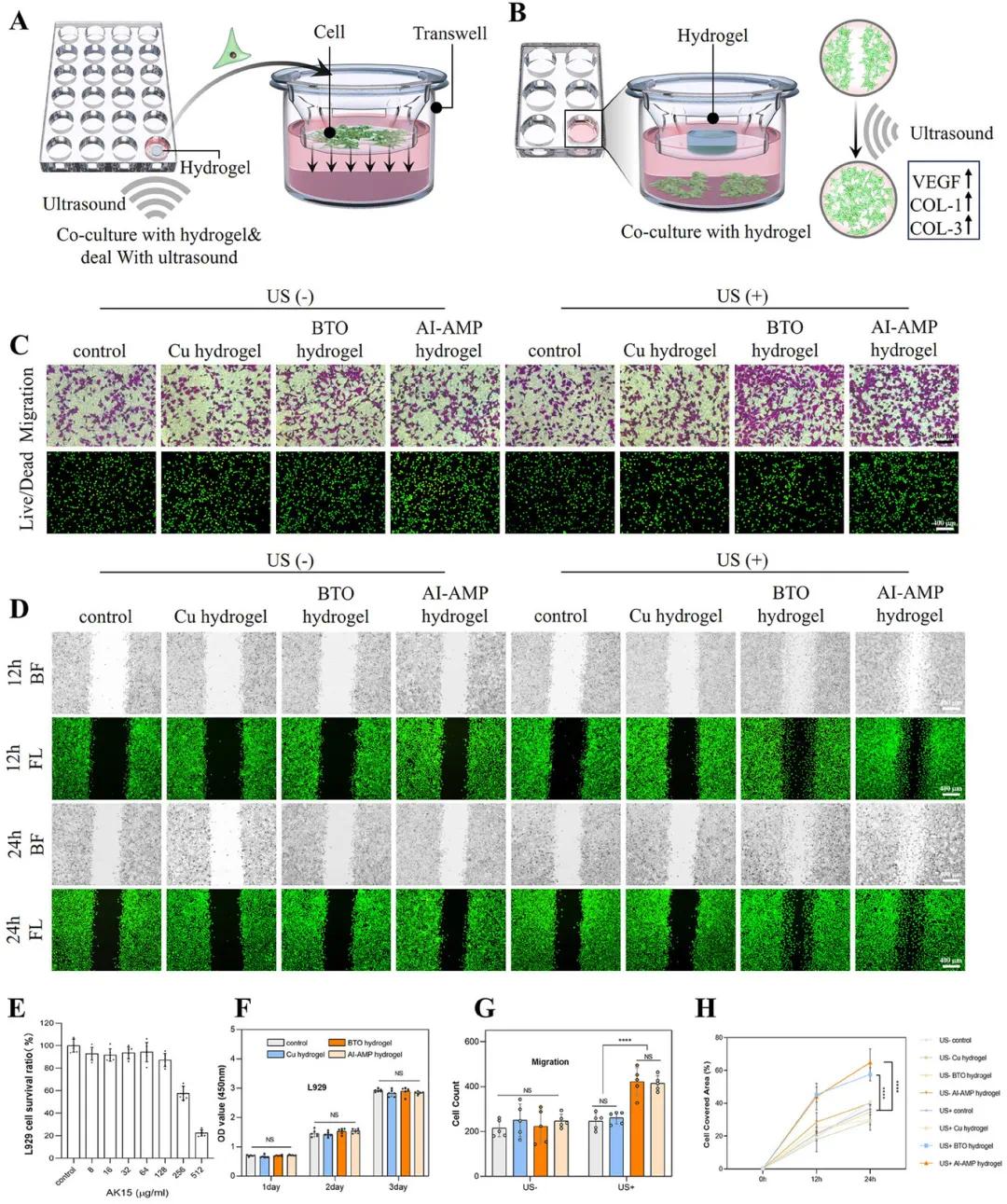
图5 AI-AMP水凝胶的生物相容性和伤口愈合特性。(A)Transwell实验示意图;(B)划痕实验示意图;(C)不同处理后L929细胞的代表性迁移实验和活/死染色图像;(D)不同处理后L929细胞划痕实验的明场(BF)和荧光(FL)图像;(E)AK15处理后L929细胞存活率的测定;(F)不同处理后1、2和3天L929细胞的细胞活性;(G)L929细胞的定量分析;(H)不同时间点细胞覆盖面积的定量分析。(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
为了评估AI-AMP水凝胶对血管生成的影响,该研究进行了管形成实验和CD31免疫荧光染色实验。结果显示,在超声激活下,BTO和AI-AMP水凝胶组的管数量显著增加(图6C,D),荧光强度也显著高于其他组(图6E)。这表明超声激活的压电材料释放的生物电能有效增强了内皮细胞的CD31表达和血管形成能力。
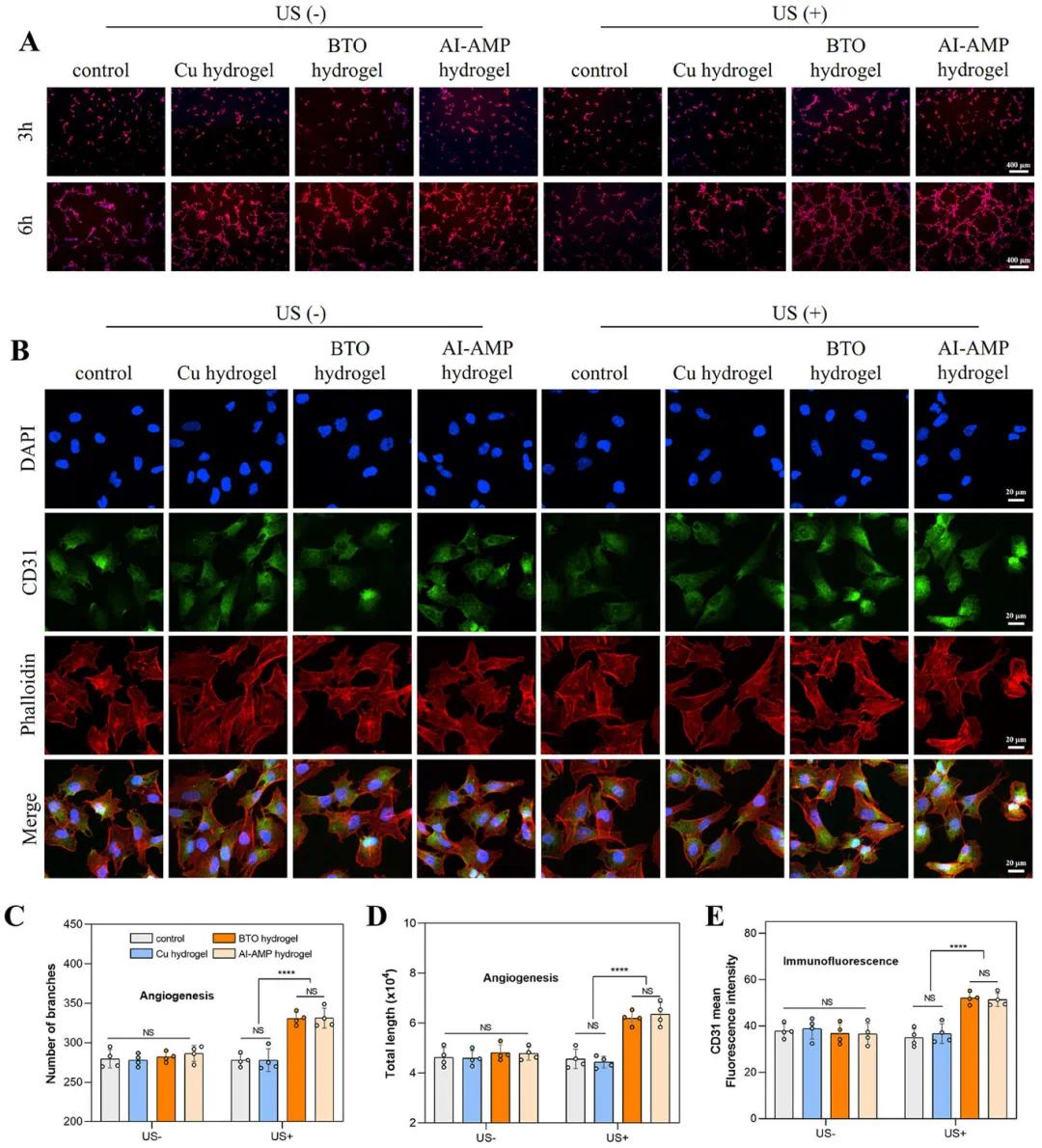
图6 AI-AMP水凝胶的体外促血管生成能力。(A)用不同样品处理人脐静脉内皮细胞(HUVEC)3小时或6小时后的血管生成图像;(B)不同处理后HUVEC的免疫荧光图像;(C,D)用不同样品处理HUVEC 6小时后的血管生成定量分析;(E)CD31平均荧光强度的定量分析。(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
(5)大鼠模型中颈背伤口修复的体内评估
为了验证AI-AMP水凝胶在体内的抗菌和伤口愈合效果,该研究使用了感染MRSA的大鼠全层颈部伤口模型。颈部运动产生的机械能替代超声激活水凝胶中的BTO,释放生物电并发挥治疗效果。结果显示,AI-AMP水凝胶组的伤口闭合率高达99.5%,显著优于其他组(BTO水凝胶组87.3%,AK15水凝胶组89.6%),表明其具有强大的抗感染和愈合能力。组织学分析(H&E染色)显示,AI-AMP水凝胶组伤口尺寸显著减小,表皮厚度增加。Masson三色染色显示,该组胶原纤维密度显著高于其他组,表明其促进了胶原沉积和组织修复。AI-AMP水凝胶通过AK15和压电材料的协同作用,快速闭合伤口,并在6天内实现完全愈合,远快于其他抗菌水凝胶。
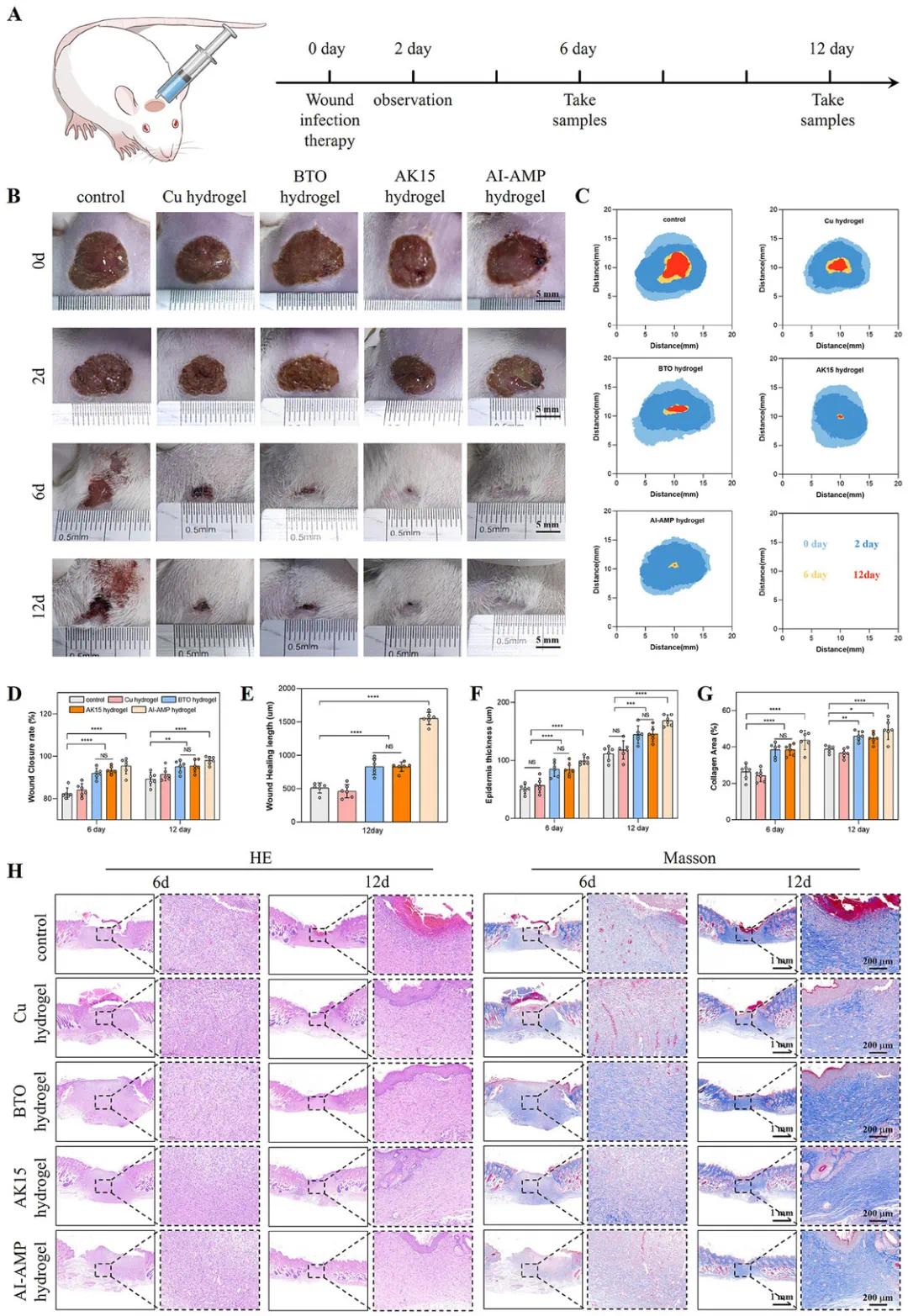
图7 AI-AMP水凝胶在感染MRSA的大鼠颈部伤口模型中的伤口愈合加速效果。(A)实验过程示意图;(B)不同时间点的伤口图像;(C)感染伤口面积变化示意图;(D)相对伤口闭合面积的定量分析;(E,F,G)伤口愈合长度、表皮厚度和胶原面积的定量分析;(H)收集样本的H&E染色和Masson染色结果(第6天和第12天)。(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
通过免疫荧光染色检测伤口部位的CD31表达以评估血管生成。结果显示,含BTO的组CD31表达较高,而添加AK15后CD31表达进一步升高,表明AI-AMP水凝胶组具有优越的促血管生成特性。定量分析显示,BTO和AI-AMP水凝胶组的COL-I和COL-III表达显著高于对照组和Cu水凝胶组,而AK15水凝胶组的表达虽高于对照组,但低于AI-AMP水凝胶组。这表明BTO将机械能转化为生物电有效促进伤口部位的胶原表达,而控制感染进一步放大了这一效果。AK15的抗菌特性不仅减少了伤口部位的细菌负荷,还与BTO产生的生物电协同作用,促进组织修复。生物电可能引导细胞迁移、增殖和分化,而AK15确保了无菌环境,共同促进伤口愈合。
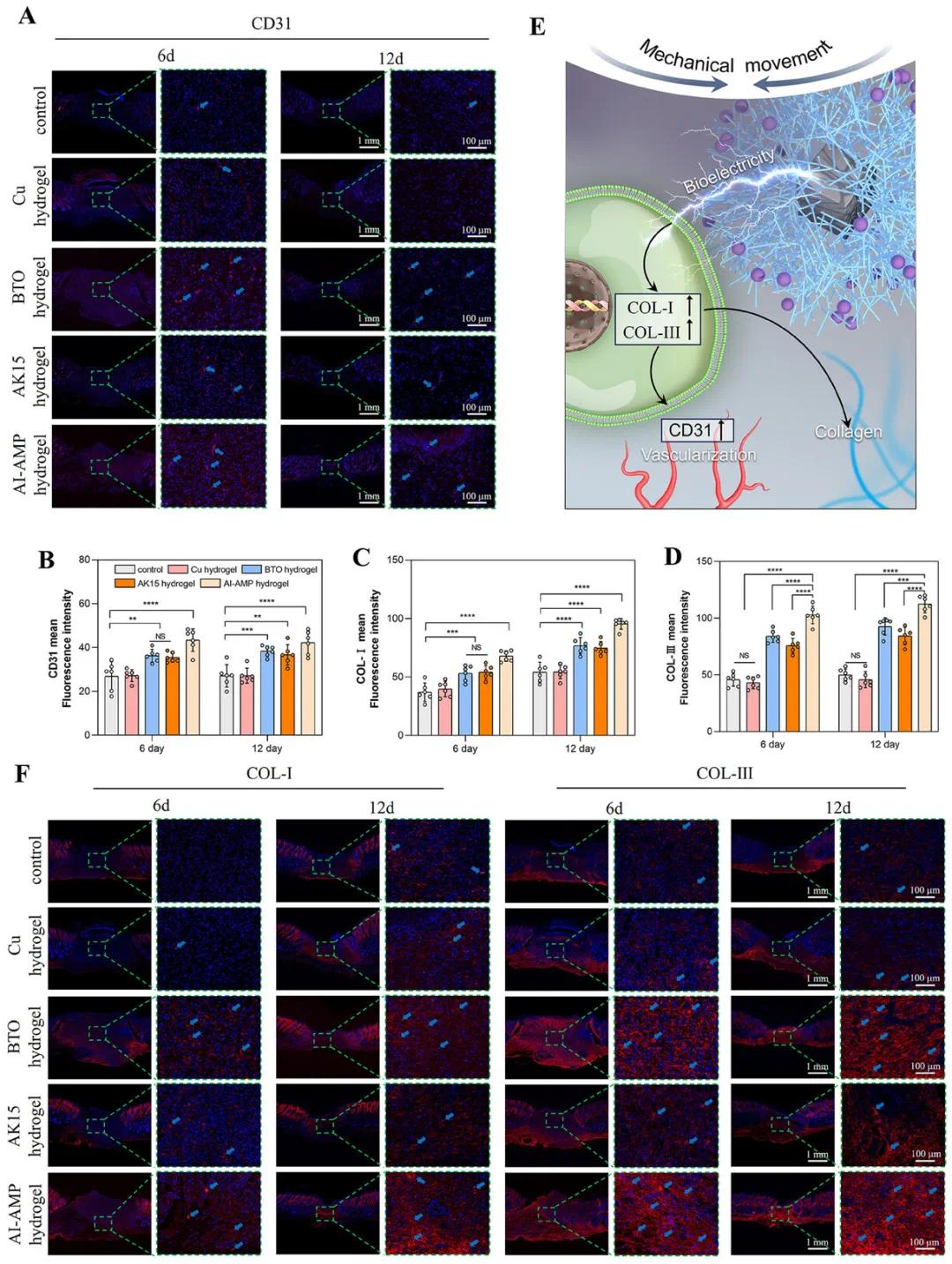
图8 伤口组织的免疫荧光染色结果。(A)收集样本的CD31染色(红色)图像(第6天和第12天);(B,C,D)CD31、COL-I和COL-III平均荧光强度的定量分析;(E)AI-AMP水凝胶促进伤口愈合的机制示意图;(F)收集样本的COL-I和COL-III染色(红色)图像(第6天和第12天)。蓝色箭头指示阳性染色区域。(*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)
该研究开发了一种基于人工智能设计的抗菌肽(AK15)和压电材料(Cu-BTO)的水凝胶(AI-AMP水凝胶),用于治疗耐药菌感染的活动性伤口。 研究结果表明,AI-AMP水凝胶具有优异的抗菌性能、生物相容性和伤口愈合能力。抗菌性能方面,AI-AMP水凝胶对大肠杆菌和MRSA展现出强大的抗菌活性,抑制率高达99.99%,优于传统抗生素和抗菌肽。其抗菌机制涉及破坏细菌膜完整性、干扰代谢活动和降低细菌毒力。生物相容性测试显示,AI-AMP水凝胶对成纤维细胞无毒性,细胞增殖率与对照组无显著差异,表明其具有良好的生物相容性。长期安全性评估表明,水凝胶在大鼠体内未引起慢性毒性或免疫反应,具有优异的长期生物相容性。在促进伤口愈合方面,AI-AMP水凝胶通过压电效应将机械运动转化为生物电,显著促进血管生成和胶原沉积。体内实验表明,AI-AMP水凝胶能快速闭合伤口,6天内实现完全愈合,远快于其他抗菌水凝胶。 综上所述,AI-AMP水凝胶通过AK15的抗菌作用和Cu-BTO的压电效应协同促进伤口愈合,是一种具有广阔应用前景的新型生物材料。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

