
骨缺损通常难以自愈,尤其是在严重创伤或疾病情况下,传统的治疗方法如自体移植和异体移植存在供体来源有限、免疫排斥等问题。近年来,纳米材料在骨组织工程中展现出巨大潜力,尤其是黑磷(BP)作为一种新型二维材料,具有优异的成骨和抗菌性能。然而,BP在生理环境中易氧化、高剂量下具有生物毒性,限制了其临床应用。因此,开发一种能够稳定BP、增强其生物相容性并促进骨再生的新型纳米复合材料成为当前研究的重点。

针对上述问题,山东大学张东姣团队开发一种基于黑磷(BP)和氨基硅酞菁(SiPc-NH2)的纳米复合水凝胶(BP-PC@GelMA),通过非共价相互作用(如π-π堆积、静电作用)增强BP的分散性和稳定性,减少其氧化降解,并提升其光热性能和生物相容性。研究进一步探讨BP-PC@GelMA在骨缺损修复中的作用机制,特别是通过调控Hippo/Wnt信号通路和线粒体动态(融合/分裂、自噬)来促进成骨分化。最终目标是构建一种兼具成骨、抗菌和光热治疗功能的多功能骨修复材料,为临床治疗骨缺损提供新的策略和理论支持。该文章于2025年1月23日以《Improved Black Phosphorus Nanocomposite Hydrogel for Bone Defect Repairing: Mechanisms for Advancing Osteogenesis》为题发表于《Advanced Healthcare Materials》(DOI:10.1002/adhm.202404934)。
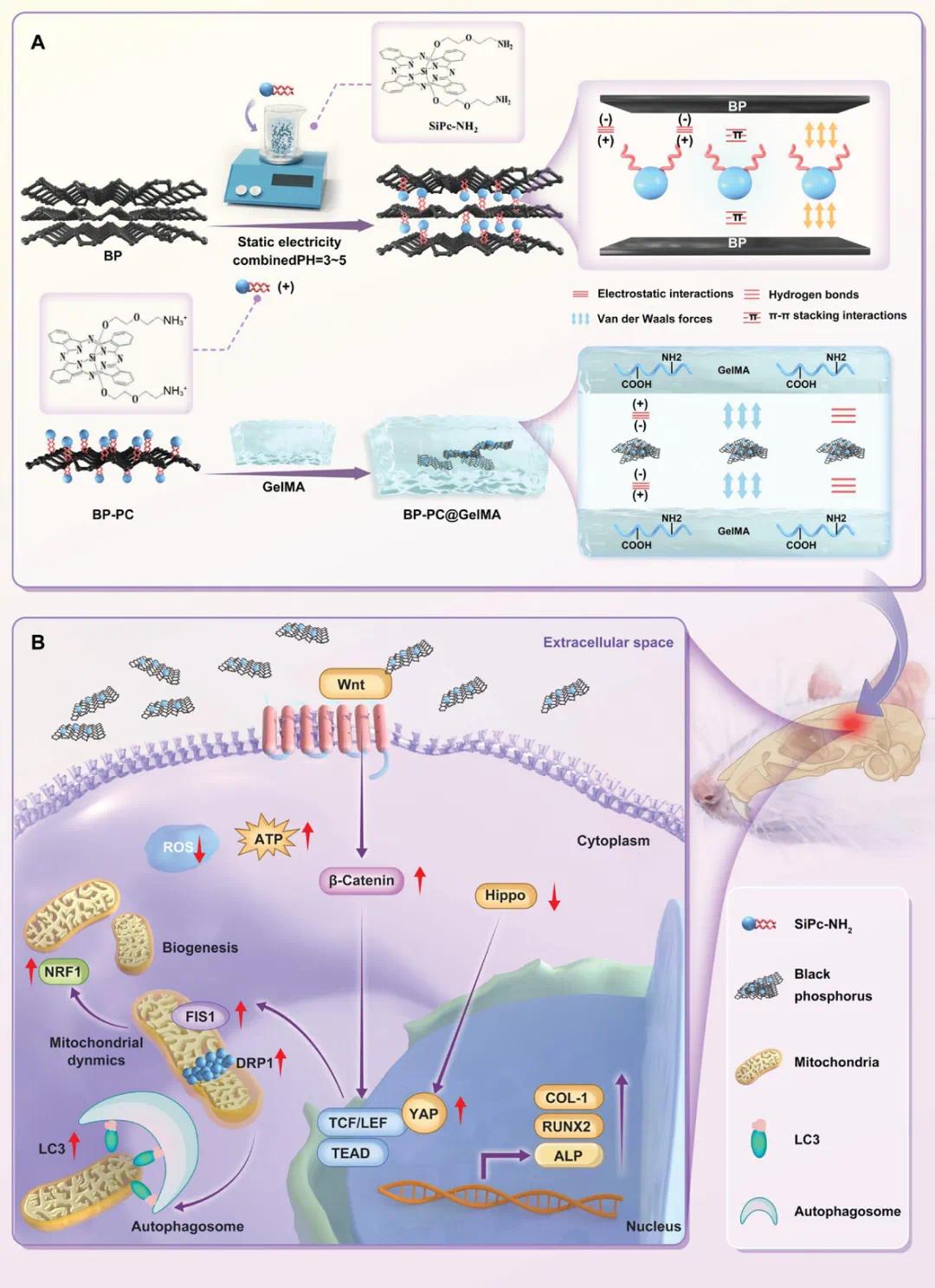
研究示意图
(1)BP和SiPc-NH2颗粒的生物相容性及合成比例研究
为了研究BP和SiPc-NH2在细胞培养应用中的最佳浓度,首先评估了BP和SiPc-NH2对大鼠成骨细胞(rOBs)活力的影响。通过CCK-8检测了1、3、5天后的细胞增殖情况,结果显示在1 μM浓度下,BP和SiPc-NH2的增殖活性随时间变化显著不同。SiPc-NH2在第3天和第5天表现出增殖增加,表明其对细胞活力具有时间依赖性增强作用。相反,BP在同一时间段内增殖活性下降,表明其对细胞活力具有时间依赖性抑制作用(图1b)。通过活死染色检测BP和SiPc-NH2颗粒,结果显示所有组中均有大量活细胞,仅少数细胞死亡,与阴性对照组(NC组)相比无显著差异(图1a,c)。
随后,采用碱性磷酸酶(ALP)染色法评估BP对rOBs成骨分化的调控作用,并探索BP和SiPc-NH2的最佳成骨浓度。结果表明,BP浓度为6μg/mL时,ALP染色强度最高,表明其成骨潜力最强。而在较低(1μg/mL)和较高(12μg/mL)浓度下,ALP染色强度减弱,表明成骨能力下降(图1d)。此外,研究发现SiPc-NH2浓度在0至75 mg/L范围内,ALP染色结果无显著差异,表明该浓度范围内无明显成骨效果。因此,确定了BP与SiPc-NH2的最佳合成比例为1:10,即少量BP与足量SiPc-NH2充分混合。
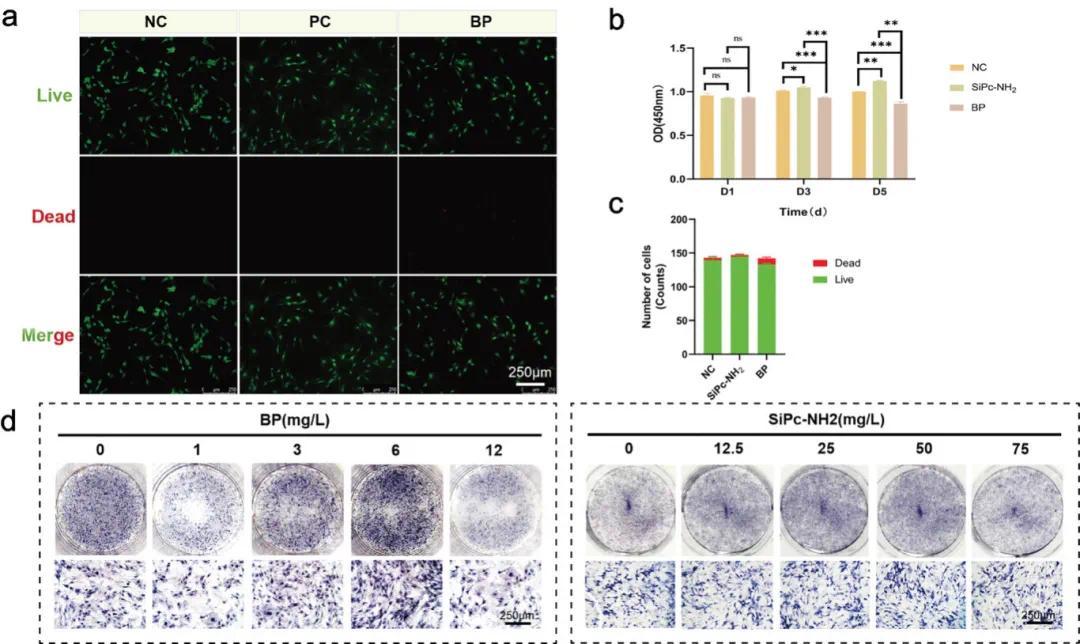
图1. BP和SiPc-NH2粒子的生物相容性和合成比例的研究。(a)来自NC、SiPc-NH2和BP组中的活/死测定的代表性图像;(b)来自NC、SiPc-NH2和BP组的CCK-8测定的OD值;(c)显示每平方毫米活细胞和死细胞数目的活/死测定;(d)不同浓度的BP和SiPc-NH2的ALP染色
(2)BP-SiPc-NH2的表征
采用液相剥离法制备BP纳米片,以NMP为剥离剂,有效防止其降解并提高产率。SEM显示BP为二维片状结构,液相剥离后形成更小纳米片(图2a)。EDS分析显示氮、磷、碳和硅在BP表面均匀分布,证明SiPc-NH₂成功负载(图2b)。FT-IR中出现SiPc-NH₂特征峰,进一步确认其负载(图2c)。XPS分析显示P2p₁/₂和P2p₃/₂峰分别在129.7 eV和130.7 eV,额外峰在133.7 eV处(图2d,e)。SiPc-NH₂的引入增加了NIR驱动的ROS生成量(图2f),改善了BP纳米片的分散性(图2g),可能由于其两侧氨基基团扩展。比较BP和BP-PC的降解前后图像和紫外光谱,发现BP-PC一个月内部分降解,而BP显著降解(图2h,i)。20 W NIR光照射时,SiPc-NH₂显著提高加热速率(图2j,k)。因此,SiPc-NH₂增强了BP的热生成和ROS产生能力,降低了降解速率,改善了分散性,有助于提高生物安全性和抗菌性能。图2i展示GelMA、BP@GelMA和BP-PC@GelMA的SEM图像,具有多孔表面结构。在PBS中降解一个月后,表面粗糙度增加甚至部分损伤,证实其优异的降解性能(图2m)。在SBF中浸泡两周后,水凝胶表面形成矿化晶体(图2n–q)。检测水凝胶加热效果,BP-PC组1分钟内温度超过40°C,具有快速升温杀灭病原菌的潜力(图2r,s)。
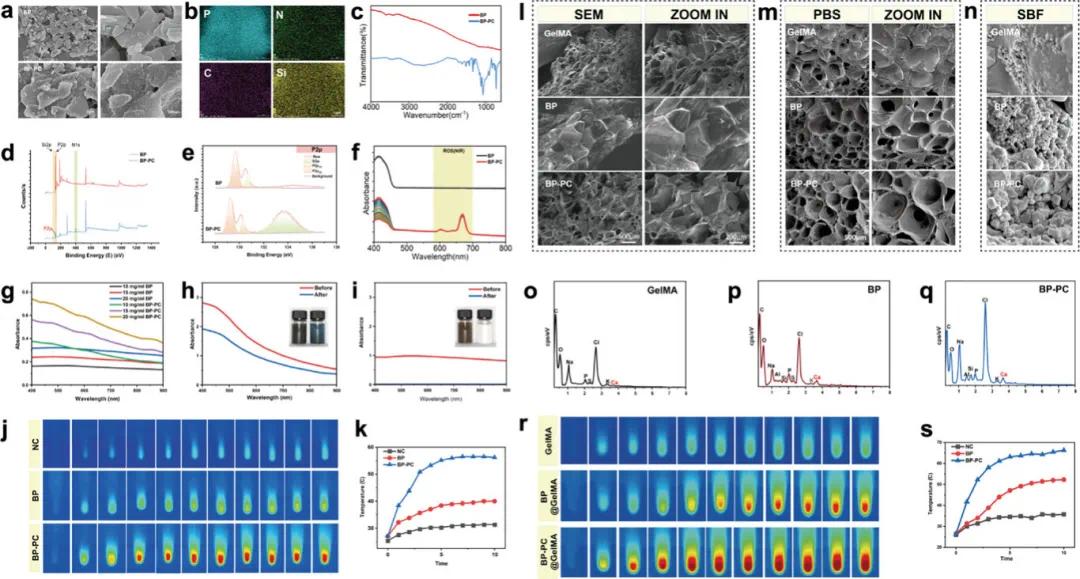
图2. BP、BP-PC、BP@GelMA和BP-PC@GelMA的表征。(a)BP和BP-PC的TEM图像;(b)BP-PC的元素图谱;(c)BP和BP-PC的FT-IR光谱;(e)BP和BP-PC的XPS测量和高分辨率P2p谱;(f)BP和BP-PC在不同浓度(10、15、20 mg L⁻¹)下的ROS生成量;(g)BP和BP-PC在不同浓度(10、15、20 mg L⁻¹)下的分散稳定性;(h)降解前后BP-PC的照片和UV光谱;(i)降解前后BP的照片和UV光谱;(j,k)在808 nm NIR光照射(功率密度为2.0 W cm⁻²)下,记录BP和BP-PC的温度变化;(l)GelMA、BP@GelMA和BP-PC@GelMA的SEM图像;(m)在不同组的PBS中降解一个月后的表面形态;(n-q)在SBF中浸泡两周后不同组的表面矿化结果;(r,s)当用808 nm NIR光(功率密度2.0 W cm⁻²)照射时,不同基团下的水凝胶的温度响应效应
(3)BP@GelMA和BP-PC@GelMA成骨性能的研究
为了进一步分析BP@GelMA和BP-PC@GelMA中的细胞活力,采用了活死染色技术。结果显示,所有实验组中均有大量活细胞,仅少数细胞死亡,与NC组相比无显著差异(图3a)。随后,研究了BP@GelMA和BP-PC@GelMA的最佳成骨浓度,以确定后续实验的浓度。分析显示,在0–25 μg/mL浓度范围内,ALP染色结果与NC组相比有显著差异,显示出良好的成骨效果,且随着浓度增加效果增强(图3b)。综合考虑生物相容性和成骨潜力,后续实验中使用25 μg/mL的BP@GelMA和BP-PC@GelMA。
此外,研究了BP@GelMA和BP-PC@GelMA对细胞迁移的影响。在培养12和24小时后,Transwell实验和划痕实验显示,两种材料均显著增强了rOBs的迁移能力(图3c,d)。值得注意的是,BP-PC@GelMA组的迁移细胞数量更多,显示出更显著的促迁移效果。此外,划痕实验表明,BP-PC@GelMA组在24小时后实现了100%的愈合率,凸显了其在促进细胞迁移和组织再生方面的功效。接下来,研究了BP@GelMA和BP-PC@GelMA复合材料的成骨潜力。ALP是早期成骨细胞分化的关键标志物。在诱导的第7天,ALP染色显示BP-PC@GelMA组的ALP含量升高,表明BP-PC@GelMA涂层促进了成骨细胞分化(图3e)。在诱导的第14天,矿化结节的形成也显示出类似的结果,支持其作为晚期成骨分化的关键指标。在先前的研究中,已确定GelMA不影响rOBs的增殖或成骨分化。因此,未单独设置GelMA组进行比较分析。关于成骨相关蛋白的表达,BP-PC@GelMA组的RUNX2、ALP和COL-1水平显著升高(图3f)。
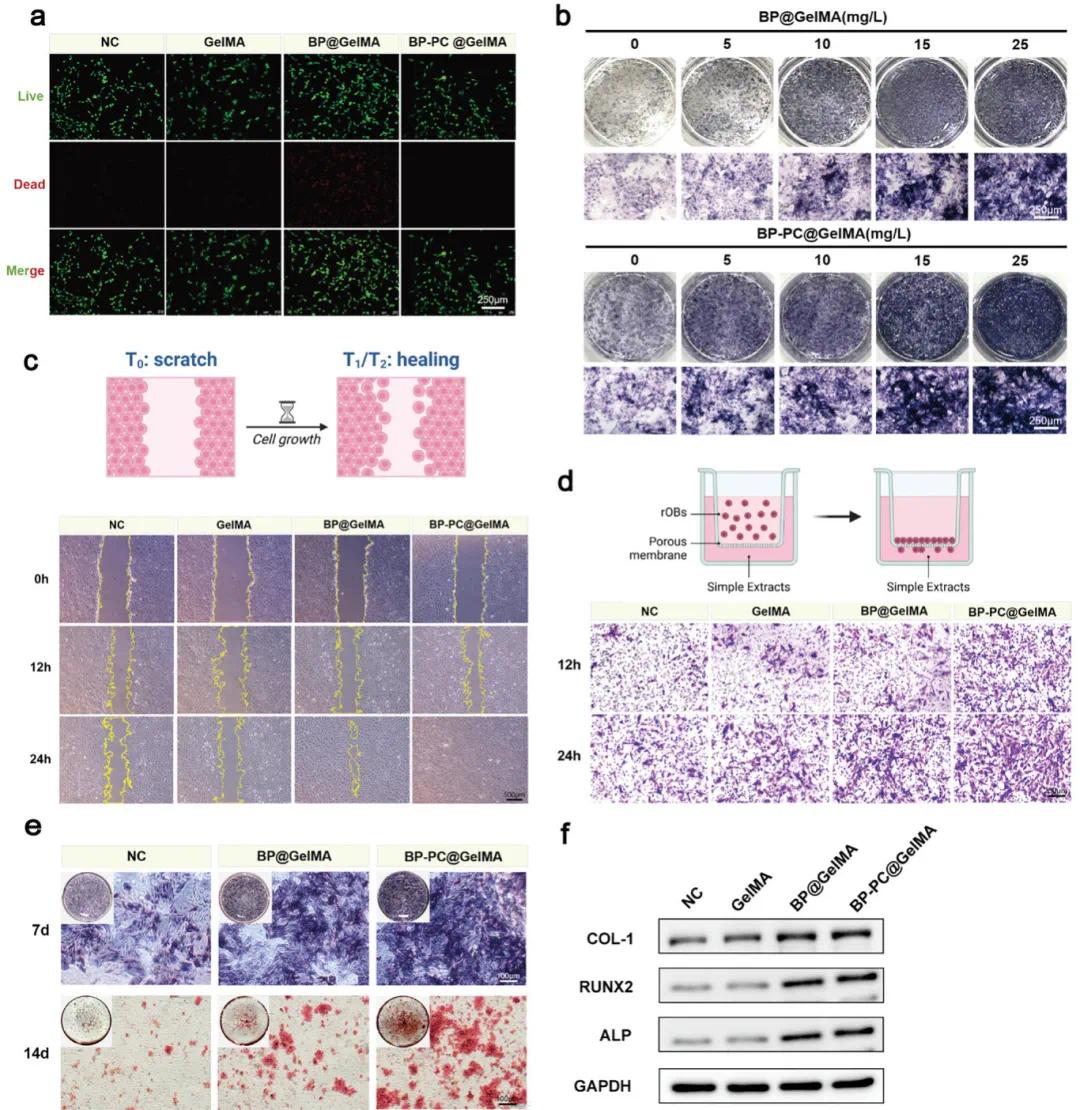
图3. BP@GelMA和BP-PC@GelMA的成骨潜力研究。(a)存活/死亡试验的代表性图像;(b)不同浓度的BP@GelMA和BP-PC@GelMA的ALP染色;(c,d)在不同组下培养12和24小时后进行的Transwell和划痕试验;(e)每组ALP和ARS染色的代表性图像;(f)成骨分化相关蛋白ALP、COL-1和RUNX2在不同组间rOB中的表达水平
(4)BP@GelMA和BP-PC@GelMA的体外光热抗菌效果研究
如图4a,b所示,在没有近红外(NIR)照射的情况下,所有实验组均显示出显著的细菌生长,琼脂平板上存在大量金黄色葡萄球菌和大肠杆菌菌落。在NIR光照射3分钟后,BP@GelMA和BP-PC@GelMA组均表现出显著的光热效应。BP@GelMA组中仍残留少量孤立的细菌菌落,而BP-PC@GelMA组的菌落几乎完全被清除。将NIR照射时间延长至5分钟后,两组的细菌菌落数量急剧减少,几乎完全消失。进一步的定量分析表明,经过3分钟NIR照射后,BP@GelMA对金黄色葡萄球菌和大肠杆菌的抗菌率分别达到98%和99.7%。5分钟后,抗菌率保持在100%。对于BP-PC@GelMA组,仅需3分钟NIR照射即可对金黄色葡萄球菌和大肠杆菌达到100%的抗菌率,5分钟后效果仍保持在100%。相应的扫描电子显微镜(SEM)图像显示,SiPc-NH2的引入增强了NIR辐射触发的抗菌效果。这些效果表现为显著的细胞皱缩、细菌聚集和模糊的细胞边界,表明细菌细胞壁结构受损。活死染色显示,BP-PC@GelMA组中活菌密度较低,需进一步研究(图4c)。总体而言,这些发现证实了光热疗法能够有效破坏微生物结构,导致其死亡和清除(图4d)。
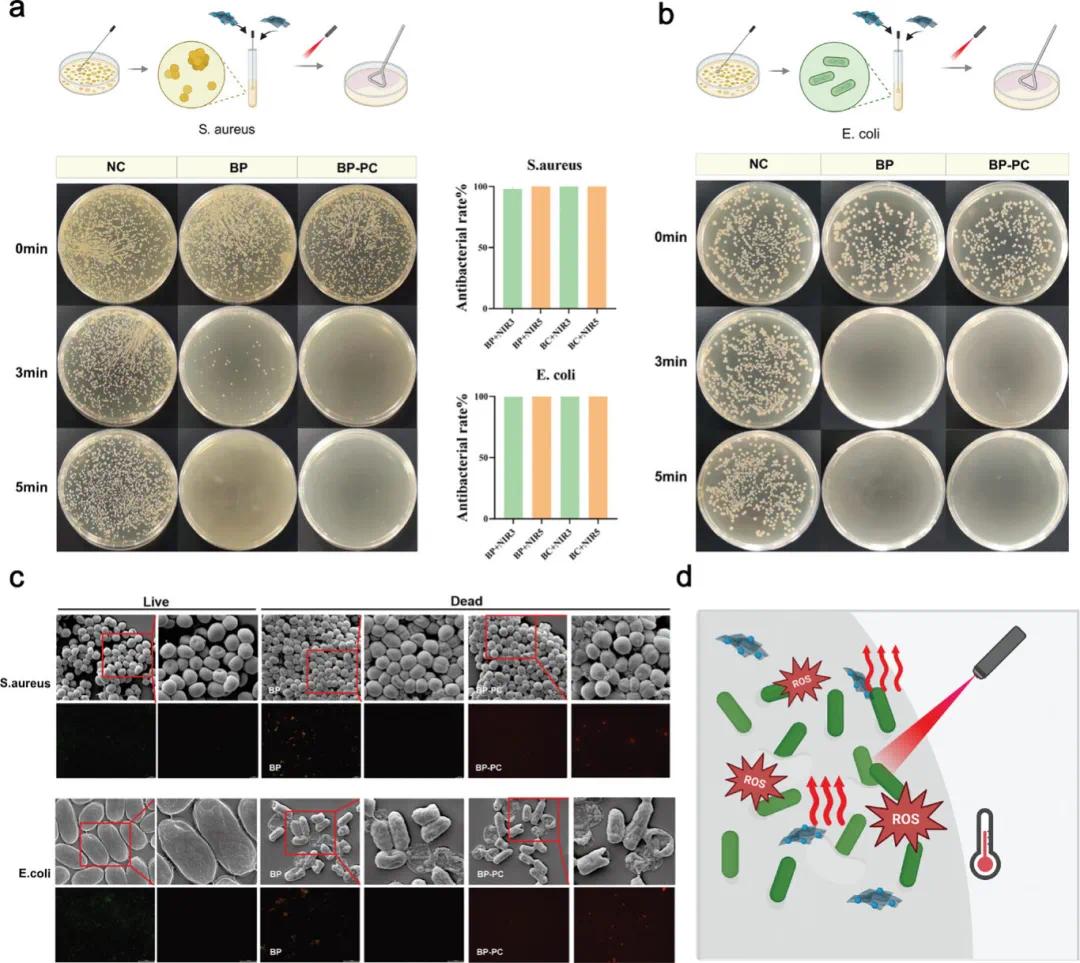
图4. BP@GelMA和BP-PC@GelMA的体外光热抗菌作用。(a)金黄色葡萄球菌(S. aureus)在808 nm近红外光(功率密度2.0 W cm⁻²)照射3分钟和5分钟后的生长情况;(b)大肠杆菌(E. coli)在808 nm近红外光(功率密度2.0 W cm⁻²)照射3分钟和5分钟后的生长情况;(c)BP和BP-PC处理之前和之后,细菌的SEM图像及细菌菌落的代表性活/死测定图像;(d)BP-PC抗菌机理示意图
(5)BP-PC@GelMA增强大鼠颅骨缺损的体内修复
为了评估体内骨再生的效果,将三种不同的水凝胶构建体GelMA、BP@GelMA和BP-PC@GelMA植入SD大鼠的颅骨缺损中,持续4周或8周(图5a)。术后所有四组SD大鼠恢复良好,未出现因实验干预导致的死亡。
为了研究BP-PC@GelMA水凝胶对骨缺损愈合的影响,通过Micro-CT分析观察了NC组、GelMA组、BP@GelMA组和BP-PC@GelMA组中新骨的形成情况。术后4周和8周,NC组和GelMA组在手术区域显示出明显的骨缺损。相比之下,BP-PC@GelMA组与其他三组相比,新骨形成显著增强(图5b)。通过定量形态学分析感兴趣区域(ROI),BP-PC@GelMA组在术后4周的骨体积与组织体积比(BV/TV)显著高于其他三组。术后8周,BP-PC@GelMA组的BV/TV达到68.08%,显著超过其他组。此外,术后4周,BP-PC@GelMA组的骨小梁分离度(Tb.Sp)为0.72μm,显著低于其他组。术后8周,BP-PC@GelMA组的Tb.Sp为0.45μm,显著低于其他组(图5c)。
通过HE染色和Masson三色染色评估新骨的质量和数量。结果显示,在术后4周时,BP@GelMA和BP-PC@GelMA组显示出显著的骨再生增强。这些组中新骨小梁的形成增加,表明成骨活性增强。在术后8周时,BP@GelMA和BP-PC@GelMA组显示出新骨体积的逐步增加,其缺损边缘和表面,成熟骨呈现深红色,与NC组和GelMA组中蓝色染色的新骨形成鲜明对比,表明BP@GelMA和BP-PC@GelMA支架在再生过程中促进了更高水平的矿化和成熟(图5d)。为了进一步研究骨再生过程中的成骨分化,进行了碱性磷酸酶(ALP)和I型胶原(COL-1)的免疫组化(IHC)染色。BP-PC@GelMA组中ALP和COL-1阳性细胞数量显著高于其他两组(图5e)。这表明BP-PC@GelMA有效增强了成骨分化并促进了骨再生。
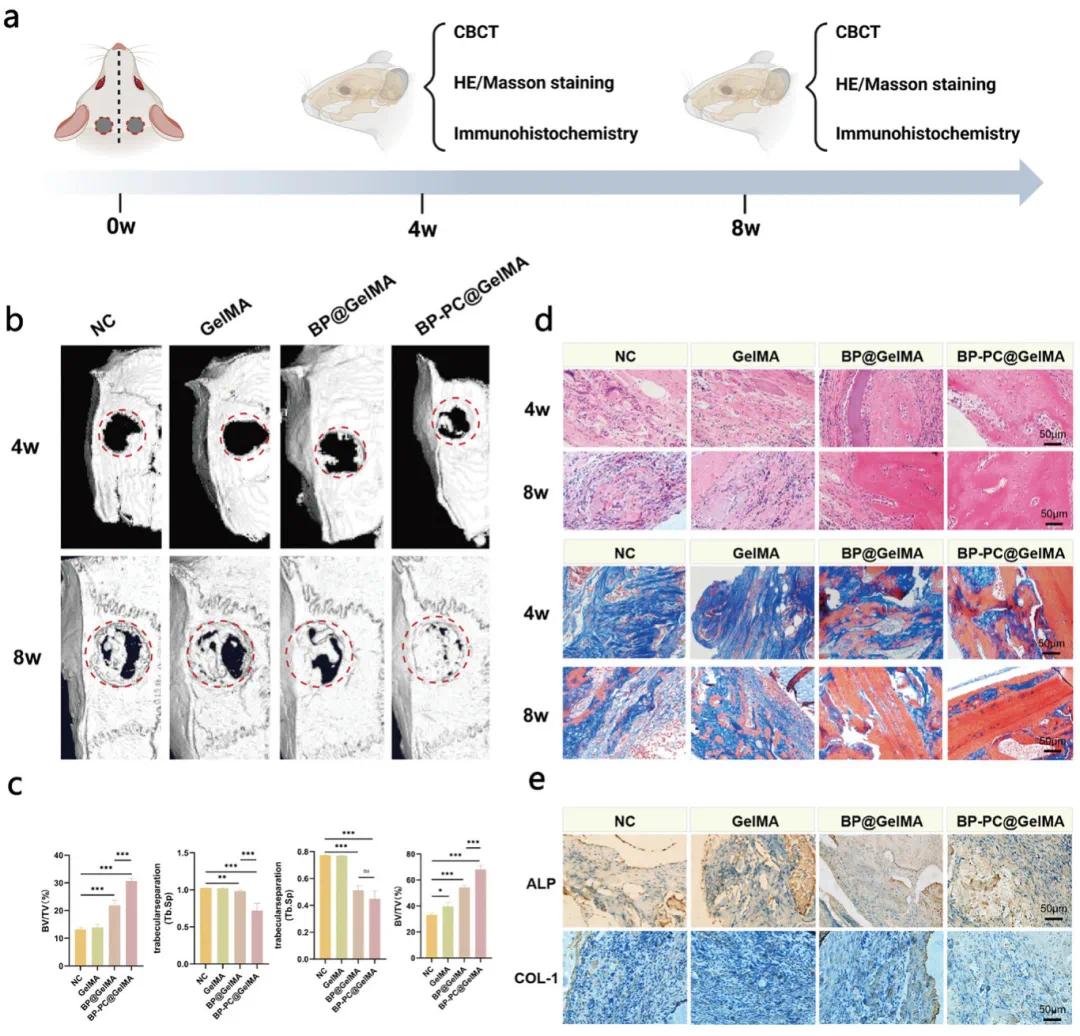
图5. BP-PC@GelMA可增强颅骨缺损的体内修复。(a)大鼠治疗方案示意图;(b)大鼠颅骨缺损的三维micro-CT扫描图像;(c)骨体积分数(BV/TV)和骨小梁间距(Tb.Sp.)的定量分析;(d)术后4周和8周时颅骨缺损的苏木精-伊红(HE)染色和Masson三色染色图像;(e)颅骨缺损后8周进行的碱性磷酸酶(ALP)和Ⅰ型胶原(COL-1)免疫组化(IHC)染色
(6)对BP-PC@GelMA处理的rOBs进行定量蛋白质组学测序分析
通过设定阈值(|log2 FC|≥0 and q-value≤0.05),筛选出差异表达蛋白(DEGs)。火山图显示,BP-PC@GelMA组中共有254个基因表达发生显著变化,其中157个上调,97个下调(图6a)。热图中展示了前20个差异最显著的基因(图6b)。关键差异基因:Sle25a11(维持线粒体融合/分裂事件及嵴的形态,通过调节线粒体谷胱甘肽水平抑制细胞凋亡)、SDHC(参与线粒体电子传递链复合体II)、Hk2(维持线粒体外膜完整性,防止促凋亡分子释放)、STX17(调控自噬体与溶酶体膜的融合)和 Mtfr11(调控线粒体形态稳态及AMPK依赖的应激诱导线粒体碎片化)。亚细胞定位分析显示,12.2%的差异蛋白定位于线粒体(图6c)。KEGG通路富集分析表明,BP-PC的成骨机制可能与溶酶体、自噬、氧化磷酸化及三羧酸循环(TCA)相关(图6d)。进一步分析发现,Hippo和Wnt信号通路显著富集(图6e)。基因本体(GO)富集分析显示,11.24%的差异蛋白与线粒体相关(图6f)。基因集富集分析(GSEA)证实,BP-PC处理的rOBs中Wnt信号通路上调,Hippo信号通路下调,氧化磷酸化相关通路活性增强,而ROS相关通路活性降低(图6g)。
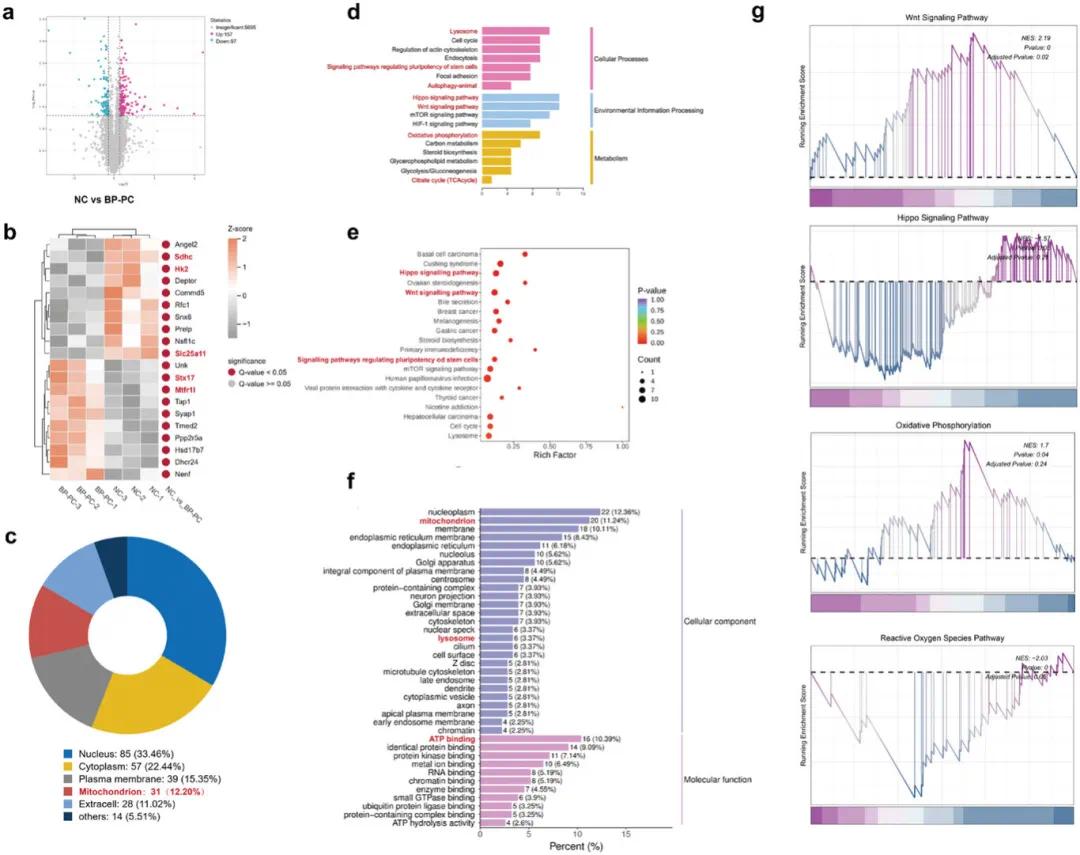
图6. 定量蛋白质组学测序分析。(a)对照组和BP-PC组之间差异蛋白质组学分析的火山图;(b)对照组和BP-PC组中差异蛋白质的热图;(c)对照组和BP-PC组中差异蛋白质的亚细胞定位结果的饼图;(d,e)对照组和BP-PC组差异蛋白KEGG富集分析的条形图和气泡图;(f)对照组和BP-PC组的差异蛋白GO富集分析条形图;(g)Hippo、Wnt、氧化磷酸化和ROS富集状态的GSEA分析
(7)BP-PC@GelMA通过Hippo和Wnt/β-连环蛋白信号通路的串扰调控线粒体稳态
基于KEGG定量蛋白质组学结果,评估不同BP和BP-PC处理下β-连环蛋白、YAP和TEAD的表达。BP-PC处理后,β-连环蛋白、YAP和TEAD表达显著增加(图7a)。为研究BP-PC@GelMA促进成骨机制,评估其对rOBs线粒体功能和形态影响。TEM观察发现,成骨诱导结合BP-PC@GelMA处理后,短棒状线粒体数量显著增加(图7d)。MitoTracker染色显示,BP-PC@GelMA处理后,rOBs线粒体呈分散网状,圆形线粒体比例增加(图7b)。定量分析表明,该组单个线粒体数量和分裂增加,网络数量减少(图7c)。进一步评估线粒体功能,结果显示BP-PC@GelMA组线粒体ATP输出最高,表明其增强了rOBs线粒体ATP生成(图7e)。此外,检测BP-PC@GelMA清除细胞内ROS能力,使用DCFH-DA评估ROS清除情况(图7f)。H₂O₂刺激模拟高ROS环境。使用JC-1和MitoSOX Deep Red评估线粒体膜电位和ROS生成。共定位结果显示,ROS诱导下,JC-1聚集体/单体比例显著降低(图7g),表明线粒体去极化和功能受损。为研究Hippo和Wnt信号通路串扰对线粒体稳态影响,使用拮抗剂LF3和IK-930。通过TMRM染色分析线粒体膜电位,发现LF3和IK-930处理后膜电位降低(图7h)。MitoTracker染色显示,处理后rOBs线粒体数量和荧光强度减少,形成稀疏网状结构,远离细胞核。Hoechst染色显示核荧光增强,提示潜在凋亡(图7i,j)。TEM观察到线粒体数量减少,多融合为拉长形态(图7k)。评估线粒体功能,结果显示ATP输出减少,降低rOBs中ATP生成(图7l)。
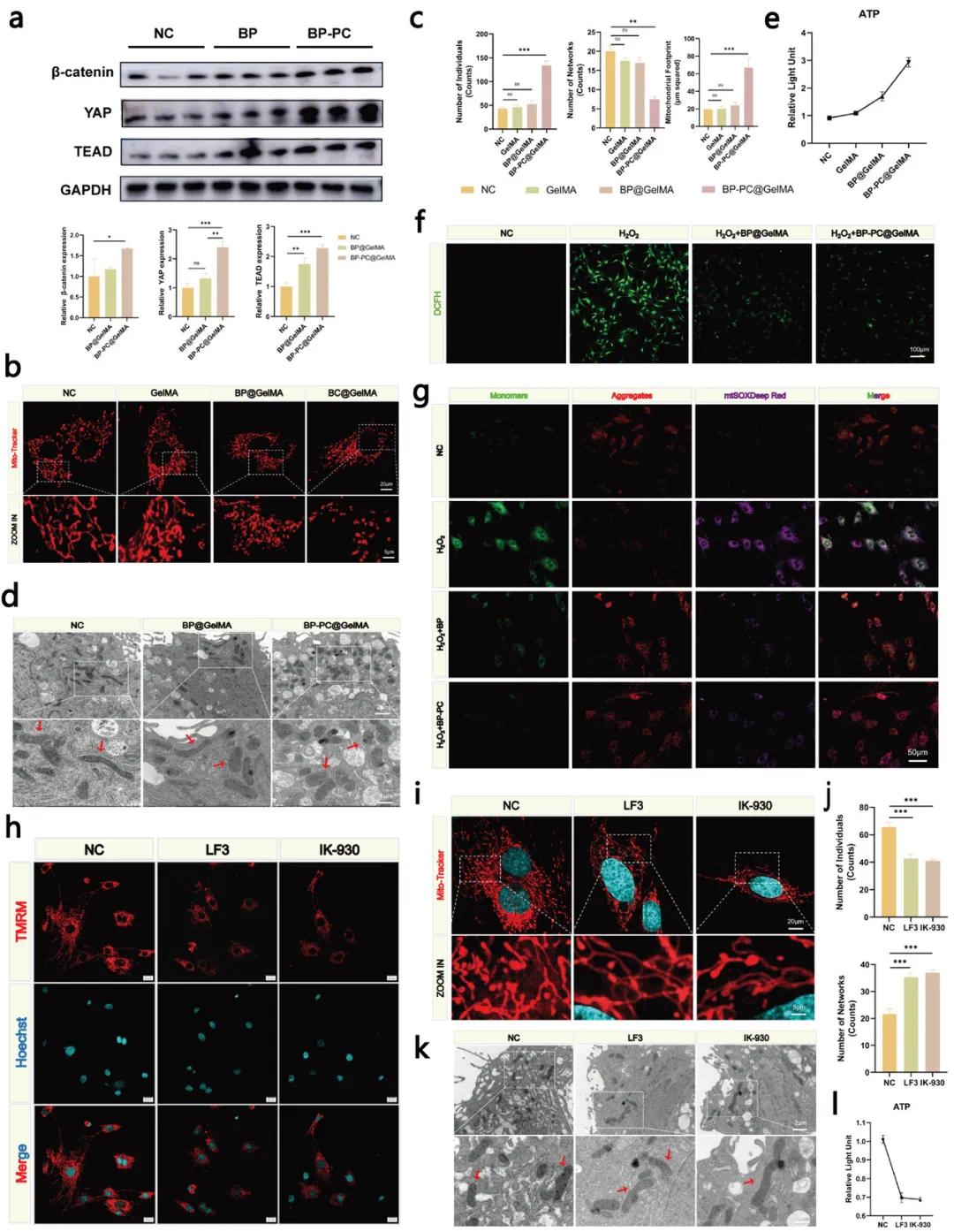
图7. BP-PC@GelMA对线粒体功能的影响。(a)β-连环蛋白、YAP、TEAD蛋白的表达及其定量分析;(b)通过激光共聚焦显微镜观察rOBs线粒体网络的形态学变化;(c)使用Kruskal-Wallis检验对个体线粒体计数、足迹和网络数量进行统计分析;(d)通过透射电镜观察rOBs线粒体形态;(e)测定不同处理下rOBs线粒体ATP的产生;(f)不同处理组的ROS染色;(g)JC-1和mtSOX深红色在不同处理组中的共定位染色;(h)不同组织的TMRM染色模式在各治疗组中的表现;(i)通过激光共聚焦显微镜观察线粒体动力学的变化;(j)使用Kruskal-Wallis检验对个体线粒体计数和网络数量进行统计学分析;(k)用LF3和IK-980处理后,通过TEM检查rOBs的线粒体形态;(l)测定不同处理下rOBs线粒体ATP的产生
(8)BP-PC@GelMA通过增强线粒体动态依赖性成骨分化促进成骨
分析了rOBs中线粒体分裂和融合标志蛋白的表达模式,重点关注分裂相关Drp1、FIS1和MFF,以及融合相关Mfn1、Mfn2和OPA1。BP-PC@GelMA处理后,分裂相关基因Drp1和FIS1表达上调,FIS1表达量较NC组增加近四倍,MFF表达不变;融合标志物中Mfn2表达增加,OPA1减少,Mfn1无明显变化(图8a)。MitoTracker活细胞成像显示rOBs中线粒体分裂活跃(图8b)。推测BP-PC@GelMA可能通过调控线粒体动态影响分裂融合过程,发挥促成骨作用。
随后,研究敲除FIS1对BP-PC@GelMA处理的rOBs线粒体动态和成骨分化的影响。设计三条靶向FIS1的siRNA序列,选敲除效率最高的siFIS1-3(图8c)。FIS1干扰使线粒体形态从松散环形变紧密网状,长度和表面积显著增加(图8d,e)。同时,BP-PC@GelMA处理后,成骨标志物RUNX2、ALP和COL-1表达水平较NC组显著下降(图8f)。ALP染色和活性检测结果一致,表明FIS1下调减弱BP-PC@GelMA对rOBs成骨分化的促进作用(图8g)。因此,BP-PC@GelMA通过调控线粒体动态促进rOBs成骨分化。
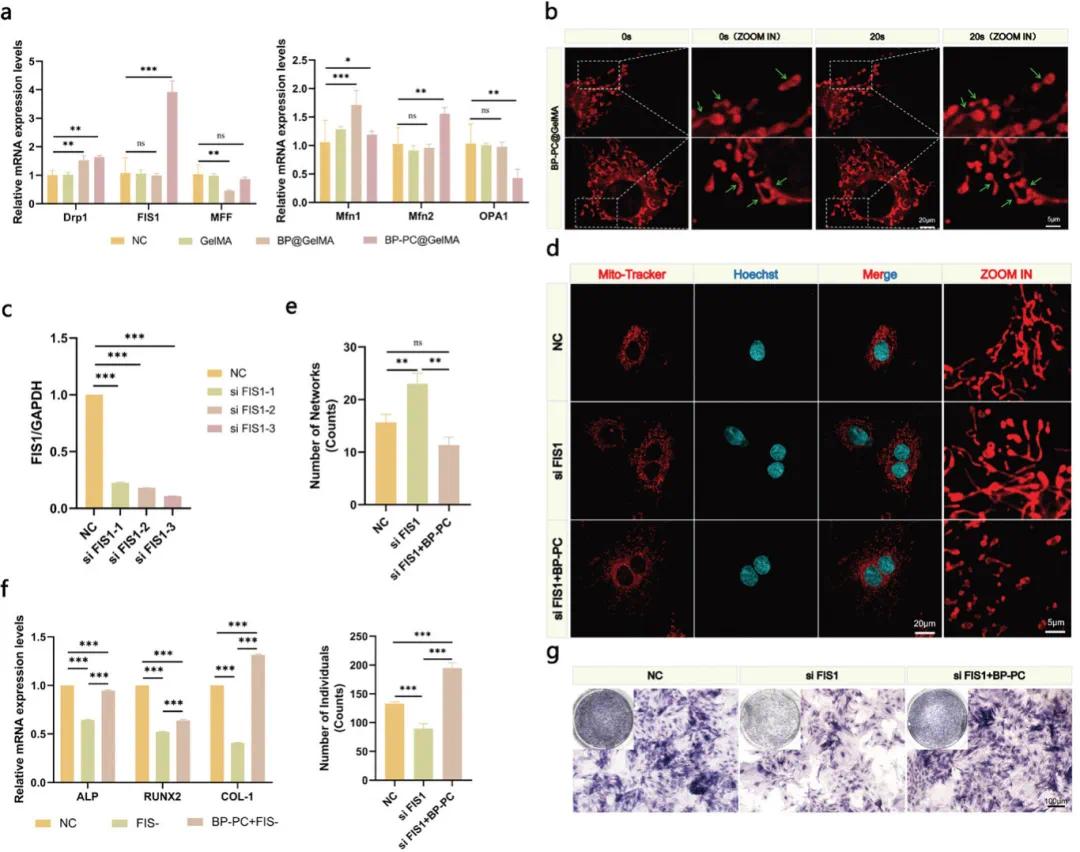
图8. BP-PC@GelMA通过线粒体动力学促进成骨细胞分化。(a)处理7天后,通过PCR分析线粒体分裂(DRP1、FIS1、MFF)和融合标记(MFN1、MFN2、OPA1)的表达;(b)使用激光共聚焦显微镜,通过MitoTracker对rOB进行活细胞成像;(c)转染后24小时,通过PCR证实最有效的FIS1敲除序列;(d)通过共聚焦显微镜评估线粒体网络形态;(e)线粒体形态学的统计分析;(f)通过PCR评价各组间ALP、Runx2和Col-1的表达水平;(g)处理组(NC、siFIS1、siFIS1 + BP-PC)的相应ALP染色结果
(9)BP-PC@GelMA作为线粒体质量控制(MQC)平台增强rOBs的分化
为了研究BP-PC@GelMA处理后rOBs中线粒体自噬水平的变化,通过Western blot分析量化了rOBs中线粒体自噬标志物LC3的表达水平。结果显示,BP-PC@GelMA处理组的LC3表达显著增加,表明该处理可能通过线粒体动态的变化增强了线粒体自噬(图9b,c)。LysoTracker Deep Red和MitoTracker Green FM的共定位为线粒体自噬的发生提供了有力证据,线粒体自噬是一种针对功能失调线粒体的重要细胞回收过程。在本研究中,这两种荧光染料被用于有效监测线粒体自噬的动态。值得注意的是,成骨细胞(OBs)中溶酶体活性显著增强,表现为LysoTracker Red荧光增加,同时GFP和LysoTracker Red阳性(黄色)区域显著增多,表明其积极参与线粒体自噬过程(图9a)。为了研究线粒体生物发生是否在线粒体数量增加中起作用,检测了rOBs中线粒体生物发生标志物的表达。结果显示,BP-PC@GelMA处理显著提高了NRF1的表达,而TFAM的表达显著降低。PGC-1α和NRF2的表达无明显变化。此外,BP@GelMA组的NRF1和PGC-1α水平显著增加。因此,推测BP纳米片可能是通过BP-PC@GelMA处理促进线粒体生物发生的关键成分(图9d)。
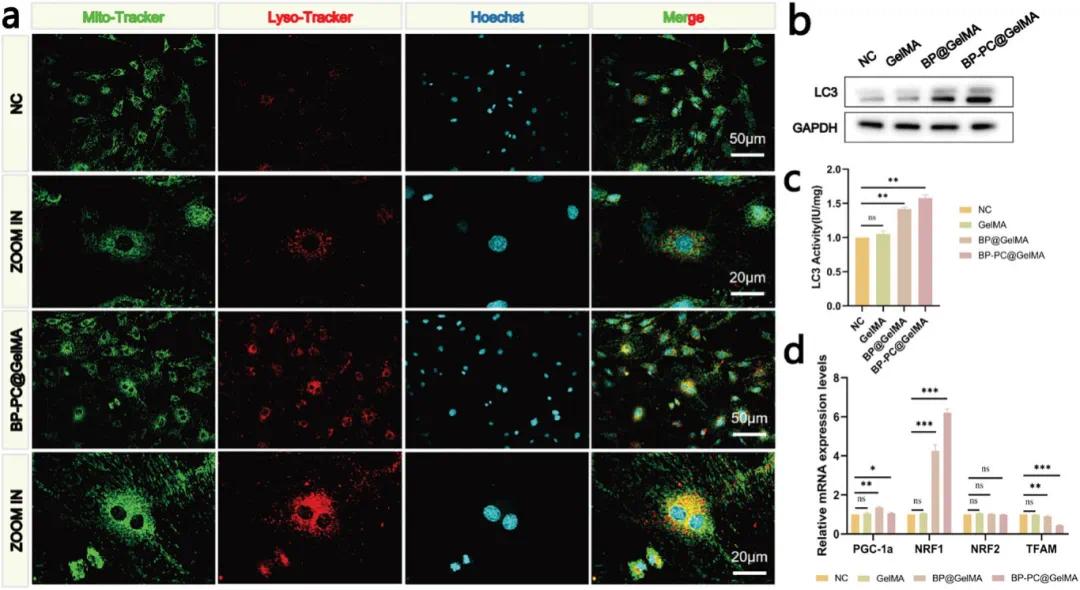
图9. BP-PC@GelMA通过MQC促进成骨细胞分化。(a)用LysoTracker™ Red和MitoTracker™绿色FM进行共定位染色;(b)自噬相关蛋白(LC3)的Western印迹分析;(c)LC3表达的定量分析;(d)线粒体生物发生相关基因(NRF1、PGC-1α、NRF2、TFAM)的PCR分析
本研究创新性地开发一种基于黑磷(BP)和氨基硅酞菁(SiPc-NH2)的纳米复合水凝胶(BP-PC@GelMA),SiPc-NH 2的加入增强了BP的分散性,有效地利用了其表面的电子性质。 该工艺减少了BP的氧化,同时提高了高浓度BP的生物相容性,有利于其长期应用。揭示了BP-PC@GelMA通过Hippo和Wnt信号通路之间的交叉作用与线粒体形态学改变之间的关系,强调了SiPc-NH 2的加入可以通过线粒体质量控制系统调节关键基因(FIS 1、NRF 1、LC 3)的表达,从而增加成骨分化并促进骨再生。此外,BP-SiPc-NH 2缓释平台可在大鼠骨缺损模型中引发有效的骨再生,为骨缺损的临床治疗提供了一种有前景的策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

