
研究背景:
多药耐药细菌感染导致的复杂伤口愈合始终难以有效解决,尤其是糖尿病患者中常见的因缺氧环境和生物膜形成而难以治愈的伤口。传统治疗方法在应对这类问题时效果有限,因为缺氧状态会削弱免疫反应并阻碍新生血管的形成,从而延缓伤口愈合过程。此外,使用光动力疗法(PDT)或声动力疗法(SDT)产生的活性氧(ROS)虽然对杀菌有效,但其扩散距离短且半衰期有限,可能对周围正常组织造成毒性风险。

针对上述问题,浙江大学黄品同教授团队开发了一种负载碳点的微泡系统(MnCDs@O2MBs),通过超声波触发实现氧气供应增强及抗菌作用。该系统不仅能有效逆转伤口区域的缺氧状况,促进细胞增殖和新血管生成,还能在超声波的作用下产生ROS,以破坏细菌生物膜结构并杀灭细菌。体内实验表明,这种新型治疗方法显著加速了小鼠全层皮肤伤口的愈合过程,并未对主要器官造成显著炎症或病理损伤,显示出良好的生物安全性。这为克服复杂伤口愈合挑战提供了一种创新且有效的策略。该文章以《Dual oxygen supply system of carbon dot-loaded microbubbles with acoustic cavitation for enhanced sonodynamic therapy in diabetic wound healing》为题于2025年1月25日发表于《Biomaterials》上(DOI: 10.1016/j.biomaterials.2025.123145)。
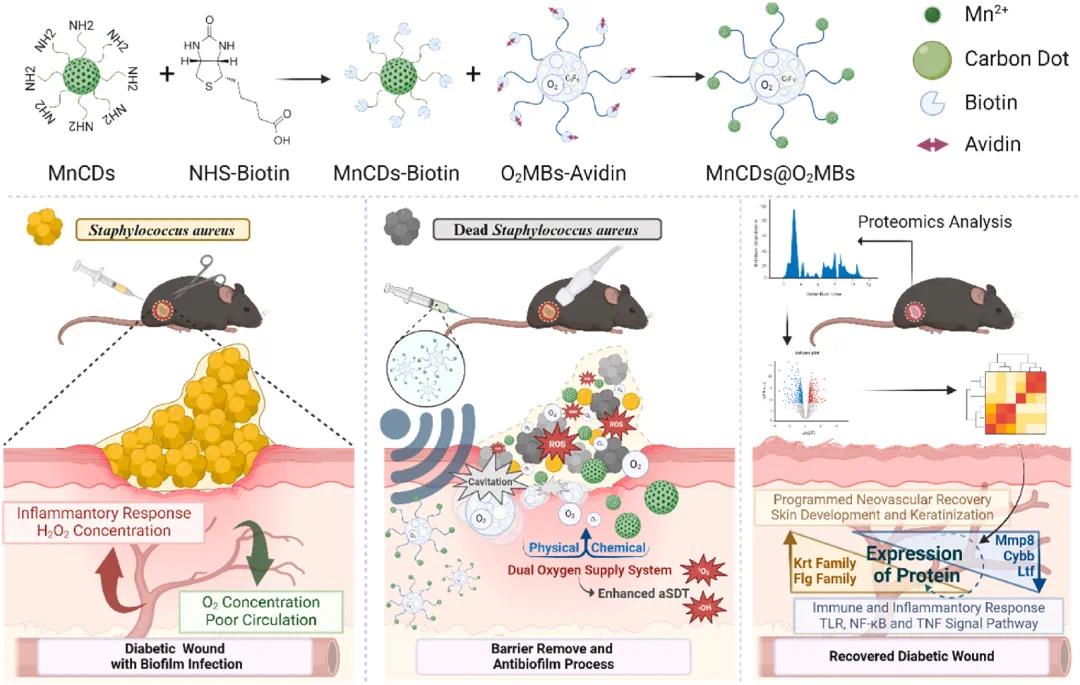
研究示意图
(1)合成与表征 MnCDs 和 MnCDs@O2MBs
透射电子显微镜(TEM)图像(Fig. 1a)显示MnCDs为单分散纳米颗粒,平均粒径约为2.19 ± 0.6 nm;高分辨率透射电子显微镜(HRTEM)图像(Fig. 1b)进一步证实了其良好的结晶性。UV-Vis吸收光谱(Fig. 1c)表明MnCDs具有独特的吸光特性,而傅里叶变换红外光谱(FT-IR)(Fig. 1d)则确认了生物素的成功结合。共聚焦激光扫描显微镜(CLSM)图像(Fig. 1e)展示了MnCDs与藻酸盐(ALG)的有效整合,标尺为2 μm。动态光散射(DLS)测量(Fig. 1f)给出了MnCDs@O2MBs的水动力直径,平均值为1581 ± 408.8 nm,证明了系统的稳定性和均一性。最后,Zeta电位测量(Fig. 1g)显示从自由O2MBs的-25.1 mV变为MnCDs@O2MBs的-21.9 mV,表明MnCDs的成功加载及系统整体稳定性增强。这些结果综合说明了MnCDs及其复合材料MnCDs@O2MBs具备理想的物理化学特性和稳定性,为其在声动力疗法(SDT)及糖尿病伤口愈合中的应用提供了坚实的基础。
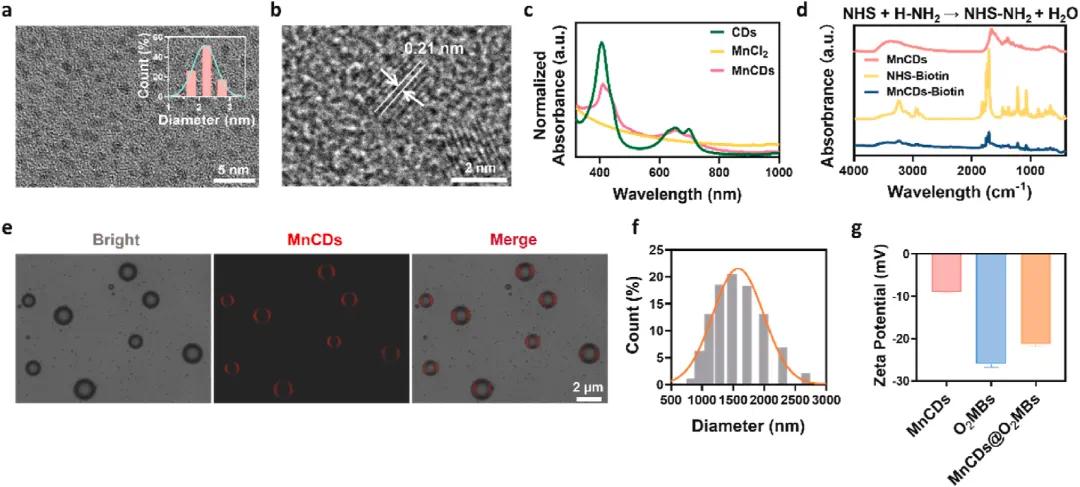
图1. MNCD和MNCD@O2MB的合成和表征。(a)MNCD的TEM图像(插图:MNCD的粒度分布),比例尺:5 nm;(b)MNCD的HRTEM图像,比例尺:2 nm;(c)水培养基中游离CD和MNCD的UV-VIS吸收光谱;(d)MNCD、NHS-BIOTIN和MNCDSBIOTIN的FT-IR光谱;(e)MNCDS@O2MBS的CLSM图像,比例尺:2 μm;(f)MNCDS@O2MBS的流体动力直径;(g)MNCD、Free O2MB和MNCD@O2MB的ζ电位
(2)双氧自供系统的体外ROS生成性能
示意图(Fig. 2a)展示了超声波触发下通过物理和化学途径实现的双氧自供系统的工作原理。氧气生成曲线(Fig. 2b)显示,在10 mM H₂O₂反应中,O₂MBs迅速释放储存的氧气,而MnCDs则通过类过氧化氢酶反应持续产生氧气,插图展示了超声波照射下产生的氧气气泡。不同浓度和时间条件下的单线态氧(¹O₂)生成情况(Fig. 2c-d)表明,随着MnCDs浓度增加和超声波照射时间延长,¹O₂生成量显著提高,证明了MnCDs作为高效声敏剂的作用。进一步评估不同处理条件下的¹O₂生成(Fig. 2e-f),结果显示即使在低氧环境下,有H₂O₂存在时也能生成¹O₂,证实了该系统在缺氧条件下增强SDT效果的能力。甲基蓝(MB)降解实验(Fig. 2g)验证了羟基自由基(·OH)的生成,表明MnCDs和MnCDs@O₂MBs在超声波照射下均能显著降解MB。荧光图像(Fig. 2h)展示了不同处理条件下金黄色葡萄球菌(S. aureus)中的ROS生成情况,标尺为50 μm,并且对应的荧光强度统计数据(Fig. 2i)显示,MnCDs@O₂MBs组的荧光水平显著高于单独使用MnCDs,证实了由双氧自供系统提供的氧气显著增强了SDT效应,显示出更优越的杀菌效果。这些结果综合表明,MnCDs@O₂MBs能够在富H₂O₂环境中快速且持续地供应氧气,并在超声波作用下高效生成ROS,从而在对抗生物膜感染和促进糖尿病伤口愈合方面展现出巨大潜力。
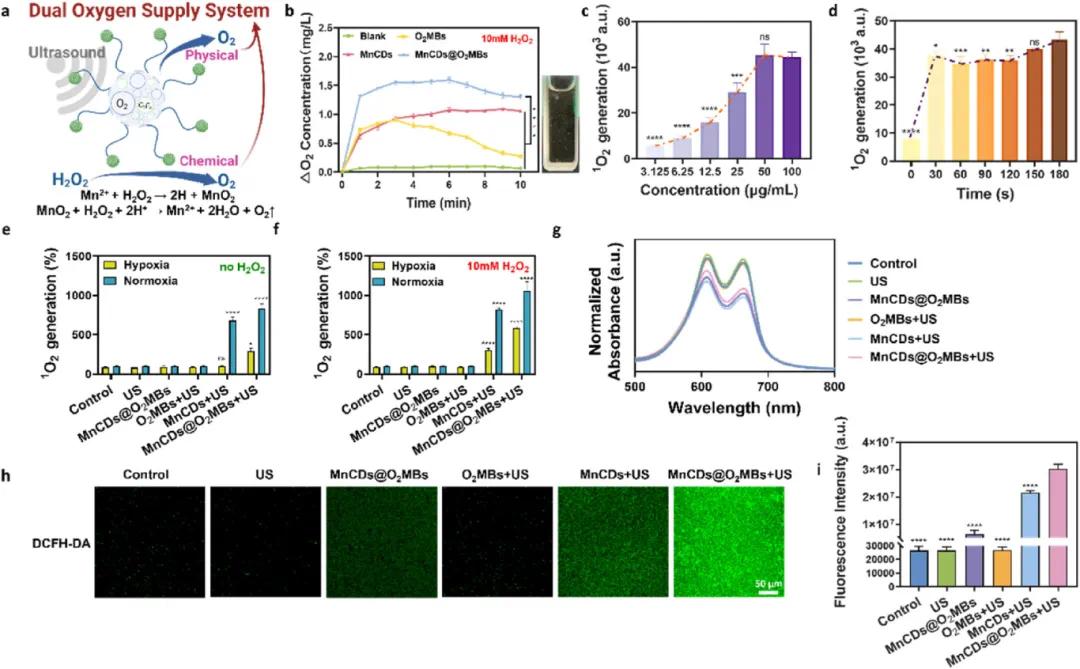
图2. 双氧供应系统的体外ROS产生性能。(a)超声通过MNCD@O2MBS通过物理和化学途径触发双氧供应系统的示意图;(b)在不同处理下与10 mmol/L H₂O₂反应10分钟的O₂生产曲线(插图:在超声照射下MNCDS@O2MBS和H₂O₂混合物中产生的O₂气泡);(c)浓度;(d)时间;(e,f)不同处理依赖的¹O₂产生,通过记录525 nm的SOSG探针强度检测;(g)不同处理下产生的MB降解;(h)不同处理下金黄色葡萄球菌的荧光图像,显示ROS产生,比例尺:50 μm;(i)ROS产生荧光强度的相应统计数据
(3)MnCDs@O₂MBs的体外抗菌活性
琼脂平板上的菌落图像(Fig. 3a)显示,在对照组和仅超声波(US)处理组中存在大量菌落生长,而MnCDs+US和MnCDs@O₂MBs+US组显著减少了菌落数量,特别是在MnCDs@O₂MBs+US组显示出最强的杀菌能力。统计数据(Fig. 3b)进一步表明,每毫升S. aureus悬浮液中的菌落形成单位(CFU)数量在MnCDs+US和MnCDs@O₂MBs+US处理后显著减少,再次证实了其高效的抗菌性能。使用XTT法评估细菌活力(Fig. 3c),结果显示这些处理显著降低了细菌活力。共聚焦激光扫描显微镜(CLSM)图像(Fig. 3d)展示了不同处理条件下S. aureus悬液的活/死细菌染色情况,标尺为200 μm,绿色荧光代表活细胞,红色荧光代表死细胞;对照组和仅US处理组显示大量的绿色荧光,而在MnCDs+US和MnCDs@O₂MBs+US组中红色荧光显著增加,表明大量细菌被杀死。相对荧光强度统计数据(Fig. 3e)进一步量化了活/死细菌的比例,结果显示MnCDs@O₂MBs+US组的红色荧光强度显著高于其他组别,证明该处理方式能够更有效地杀死细菌。
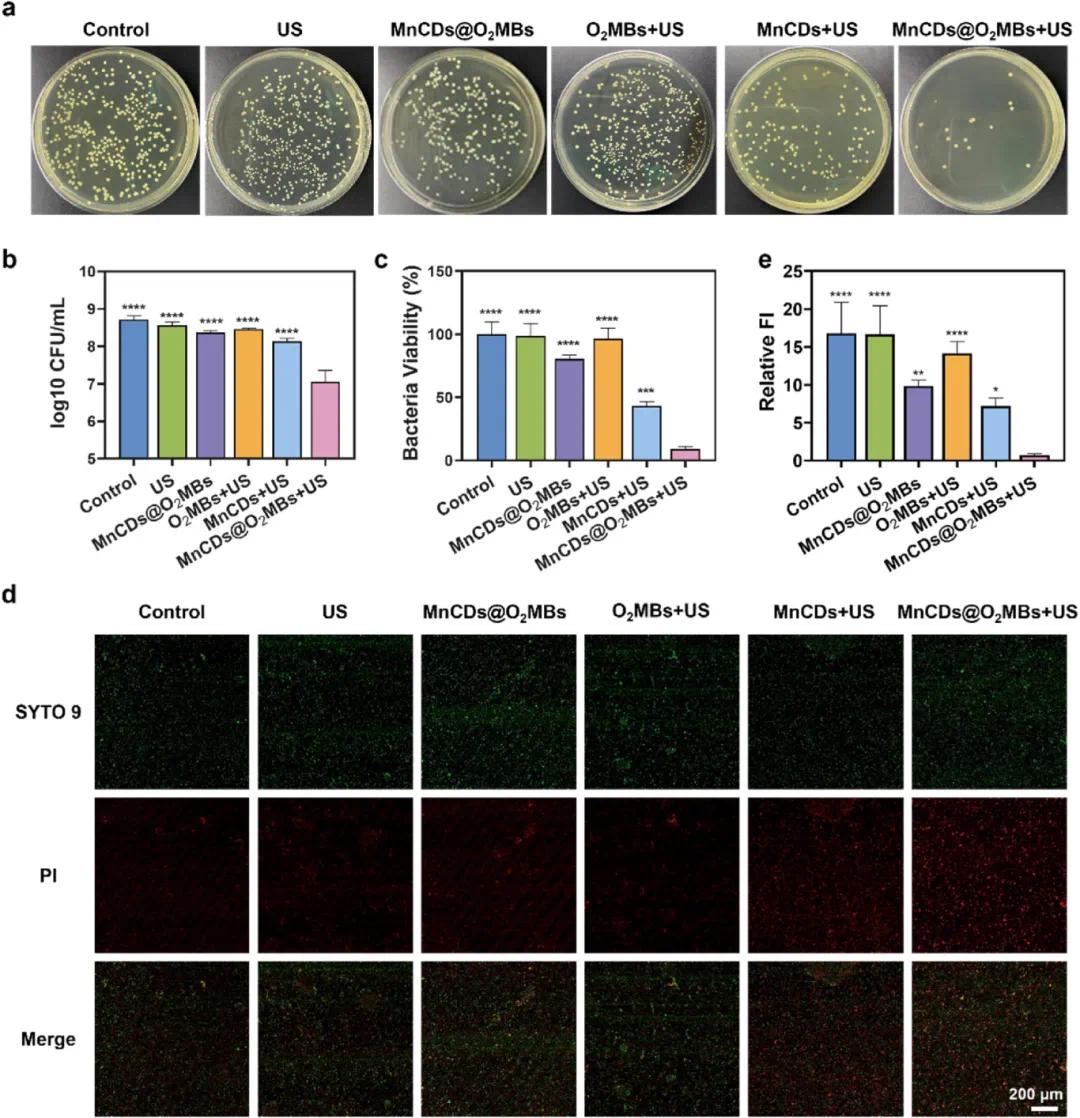
图3. MNCD@O2MBS的体外抗菌活性。(a)不同处理后琼脂板上金黄色葡萄球菌菌落的图像;(b)金黄色葡萄球菌悬浮液的每毫升CFU菌落的相应统计数据;(c)通过XTT分析评估的细菌存活率;(d)不同处理下金黄色葡萄球菌悬浮液的活/死细菌染色的代表性CLSM图像,比例尺:200 μm;(e)金黄色葡萄球菌悬浮液的活/死细菌染色法的相对荧光强度的相应统计数据
(4)MNCDS@O2MBS的空化效应和体外抗菌活性
首先,实验装置图(Fig. 4a)展示了用于测量惯性空化(IC)阈值的设置。结果显示,在不同处理条件下(Fig. 4b),MnCDs@O₂MBs在较低功率密度下即可产生显著的空化效应,并且随着超声波功率密度增加,空化现象更加明显。生物膜覆盖面积统计(Fig. 4c)表明,仅使用MnCDs@O₂MBs处理时,生物膜结构相对完整;而在结合超声波处理后,生物膜显著减少。共聚焦激光扫描显微镜(CLSM)图像(Fig. 4d)显示对照组具有完整的生物膜结构,而MnCDs+US和MnCDs@O₂MBs+US组中,生物膜被破坏,细菌表面出现皱缩和变形,标尺为100 μm。进一步通过结晶紫染色(CV)定量分析(Fig. 4e-g),发现MnCDs@O₂MBs+US组的CV吸收最低,表明其对生物膜有最强的破坏效果,并且缺氧信号显著降低,证实了有效的氧气供应。
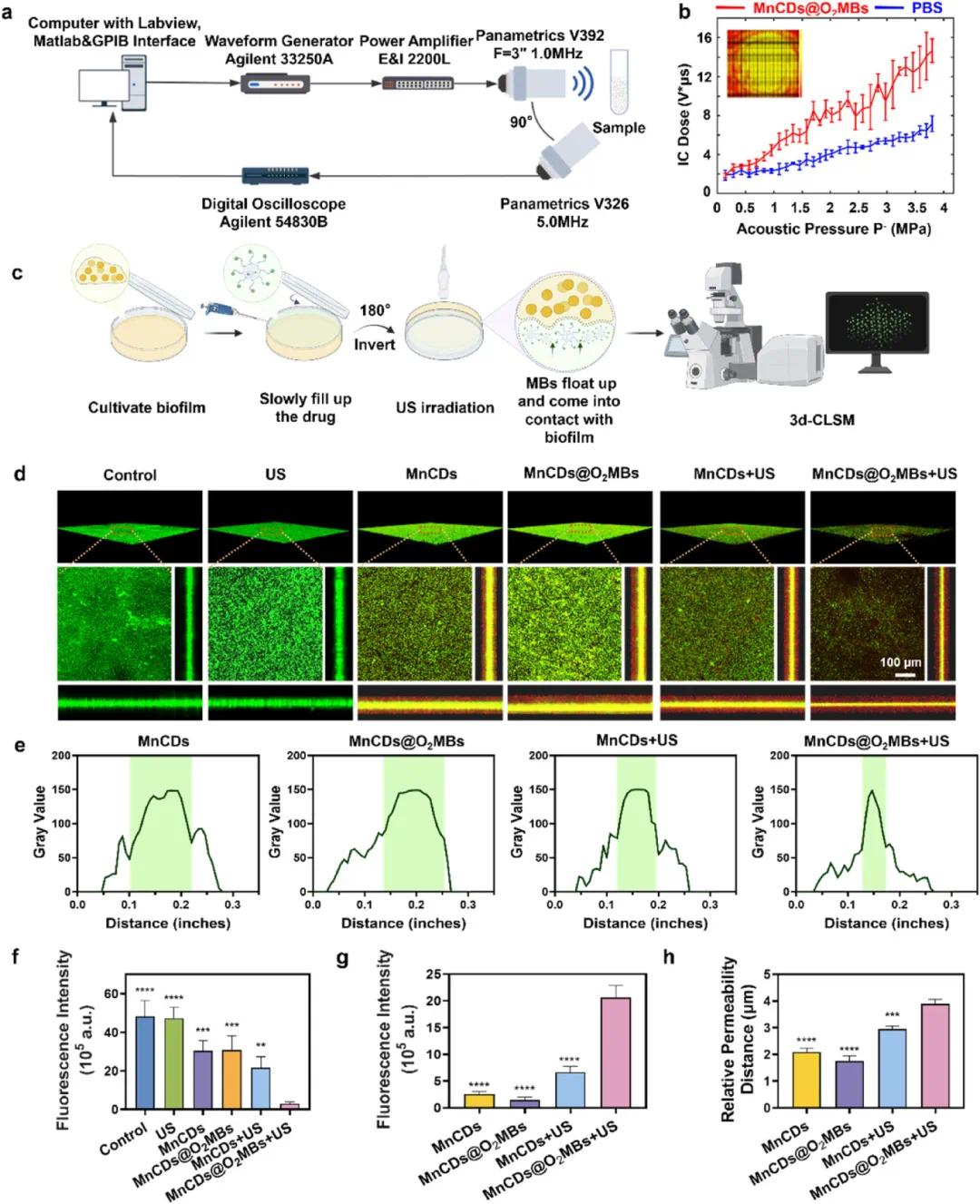
图4. MNCD@O2MBS超声检查的空化信号和渗透效应。(a)超声暴露和检测系统的示意图;(b)针对MNCD@O2MB和PBS计算的IC剂量作为声压函数的结果;(c)超声触发穿透生物膜的示意图;(d)CLSM图像显示不同药物在金黄色葡萄球菌生物膜中的分布,其中绿色荧光代表细菌生物膜,红色荧光代表不同处理,比例尺:100 μm;(e)CLSM图像横向的相对强度分析;(f)生物膜的荧光强度的相应统计数据;(g)生物膜下层药物的荧光强度的相应统计数据;(h)MNCD的渗透率与距离的相应统计数据
扫描电镜(SEM)图像(Fig. 5a)揭示了不同处理条件下S. aureus生物膜的结构变化,对照组和单独使用MnCDs或O₂MBs处理组显示出完整的生物膜结构,而MnCDs@O₂MBs+US组则显示出生物膜完全解体的现象。统计数据(Fig. 5b)进一步确认了SEM观察到的结果,表明MnCDs@O₂MBs+US组的生物膜质量显著减少。结晶紫染色(CV)吸光度测量(Fig. 5c)再次证明了MnCDs@O₂MBs+US组对生物膜的显著破坏效果。最后,使用缺氧探针进行免疫荧光染色(Fig. 5d-e),评估了不同处理条件下生物膜内的氧合状态,结果显示仅使用US或O₂MBs处理的生物膜仍呈现高缺氧信号,而MnCDs@O₂MBs+US组的缺氧信号显著降低,表明该系统能够有效逆转生物膜内的缺氧环境。
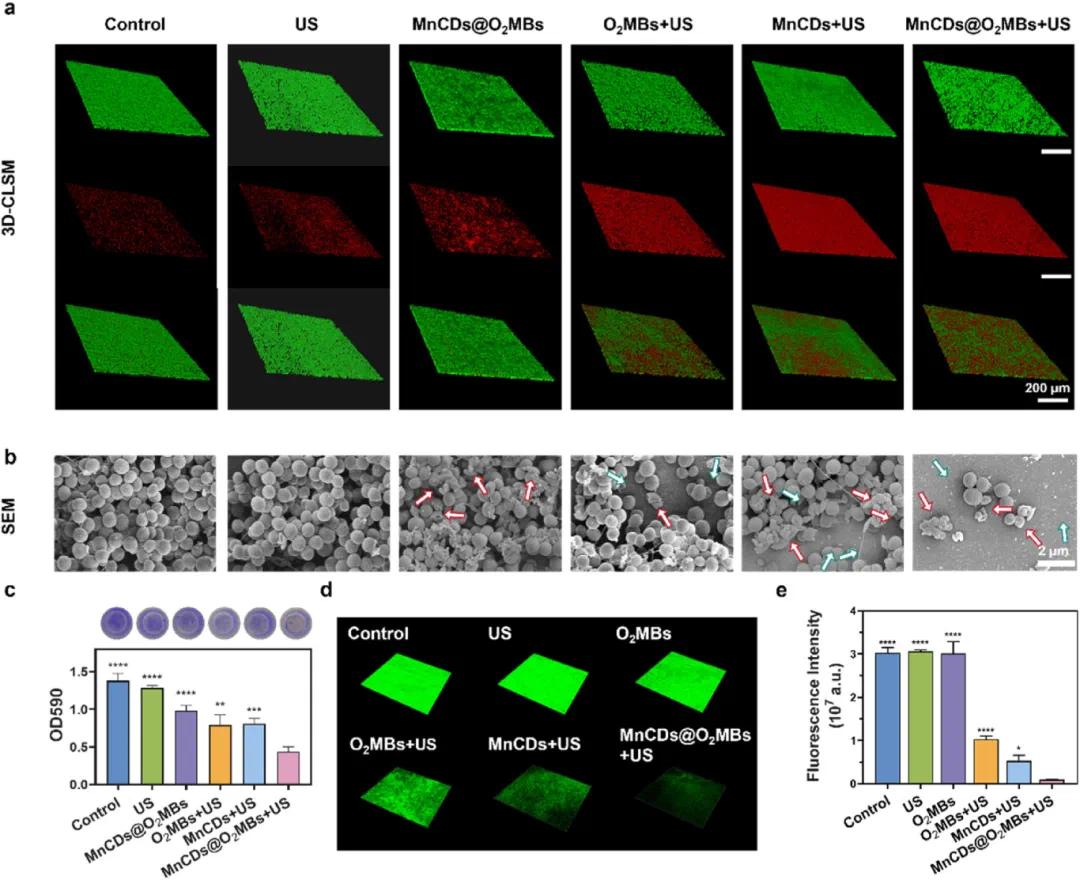
图5. MNCD@O2MBS的体外抗菌活性。(a)不同处理下金黄色葡萄球菌生物膜的活/死细菌染色的3D-CLSM图像,比例尺:200 μm;(b)不同处理下金黄色葡萄球菌的SEM图像。红色箭头表示细菌形态的典型变形,绿色箭头表示生物膜骨架的典型分散和塌陷,比例尺:2 μm;(c)不同处理后金黄色葡萄球菌生物膜的结晶紫染色图像及其相应的OD值;(d)不同处理下金黄色葡萄球菌的代表性免疫荧光图像,随后进行低氧刺激染色;(e)荧光强度的相应统计数据
(5)MnCDs@O₂MBs的伤口消毒和愈合效果
示意图(Fig. 6a)描绘了全层皮肤伤口生物膜感染模型的构建及治疗过程。代表性S. aureus感染小鼠的照片及其LB琼脂平板菌落图像(Fig. 6b)显示,在第16天时,MnCDs@O₂MBs+US组的伤口明显缩小且几乎没有可见的感染区域,而其他组别则显示出不同程度的感染和未愈合现象。模拟伤口变化图(Fig. 6c)展示了不同处理条件下伤口随时间的变化趋势,并通过统计数据显示了伤口缩小率(Fig. 6d),表明MnCDs@O₂MBs+US组在所有时间点上的伤口缩小率最高,显著加速了伤口愈合过程。抗菌效率评估(Fig. 6e)通过细菌菌落计数显示,MnCDs@O₂MBs+US组的细菌菌落数量最少,证明其最强的抗菌效果。进一步的组织学分析包括H&E和Masson染色图像(Fig. 6f),展示了第16天从不同处理组收集的皮肤组织结构。黄色箭头表示炎症细胞(如淋巴细胞、中性粒细胞和巨噬细胞),黑色箭头表示毛囊,绿色箭头表示成纤维细胞,红色箭头表示新生血管。结果显示,MnCDs@O₂MBs+US组表现出良好的上皮层形成和规则排列的胶原纤维,同时再生了毛囊和新生血管,表明其优异的伤口愈合能力。基于Masson三色染色定量分析胶原体积分数(Fig. 6g),结果显示MnCDs@O₂MBs+US组的胶原沉积量最高,进一步证实了其促进伤口愈合的效果。
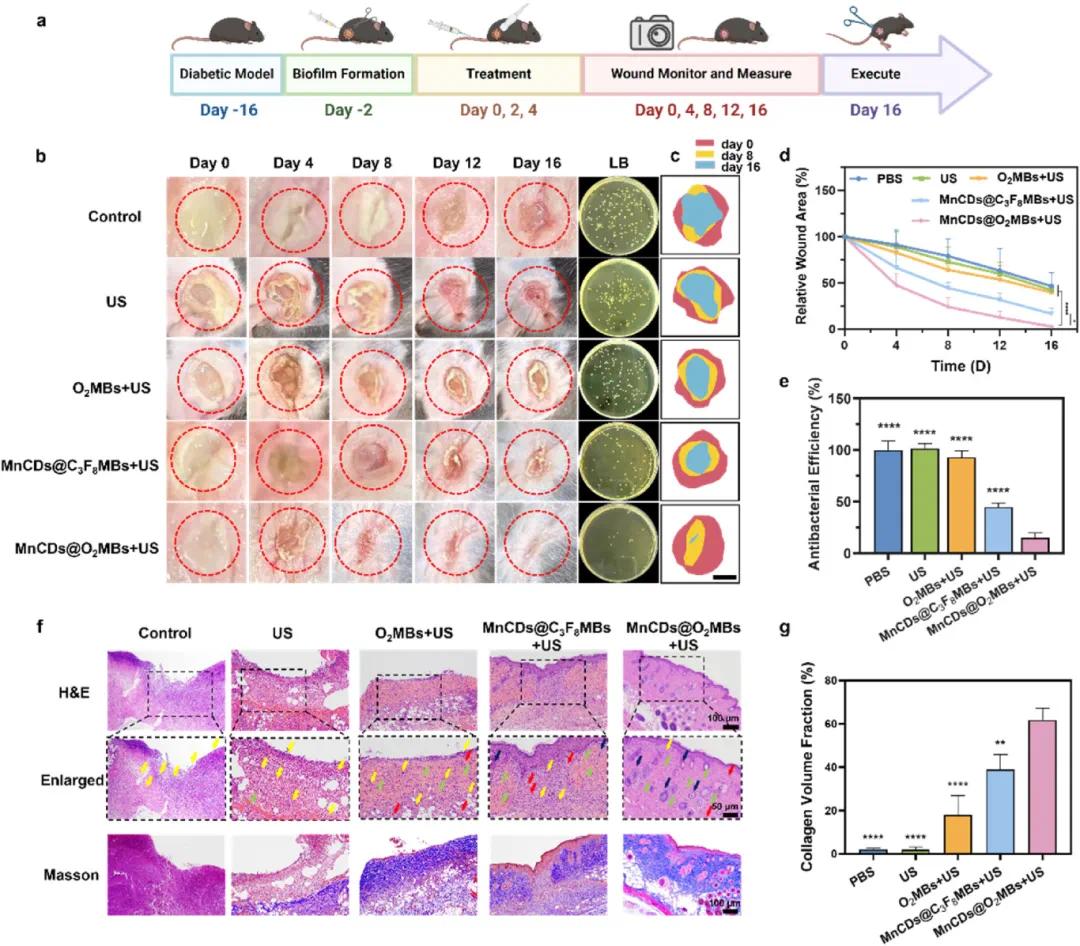
图6. MNCD@O2MB的糖尿病伤口愈合作用。(a)全厚性伤口生物膜感染模型及治疗程序的示意图;(b)各种处理后观察期间定期拍摄的金黄色葡萄球菌感染小鼠的代表性照片,以及相应的LB琼脂平板图像,显示第16天从感染小鼠病变组织中计数的细菌菌落,比例尺:5 mm;(c)不同治疗方法处理的模拟伤口在第0、8和16天的图像,以及(d)相应的统计伤口收缩率;(e)通过细菌菌落数确定的不同治疗的抗菌效率;(f)治疗后第16天,不同治疗组收集的皮肤组织的H&E和Masson染色图像。黄色箭头表示炎性细胞(包括淋巴细胞、中性粒细胞和巨噬细胞);黑色箭头表示毛囊;绿色箭头表示成纤维细胞;红色箭头表示新生血管;(g)第16天不同组的胶原蛋白体积分数的定量分析
(6)双氧自助式SDT放大后伤口修复的机制与气膜剂疗法结合
示意图(Fig. 7a)展示了蛋白质组学测量的工作流程,确保实验设计的系统性和可重复性。火山图(Fig. 7b)显示了治疗后糖尿病伤口组织中显著上调和下调的差异表达蛋白(DEPs),表明该治疗方法对蛋白质表达有显著影响(fold change > 1.20 或 < 0.83, p-value < 0.05)。正交偏最小二乘判别分析(OPLS-DA)得分图(Fig. 7c)进一步证实了对照组和MnCDs@O₂MBs+US组之间明显的蛋白质表达差异。热图(Fig. 7d)展示了与伤口愈合相关的DEPs的相对表达水平,标尺表示表达强度,有助于识别潜在的生物标志物和治疗靶点。GO注释分类(Fig. 7e)显示了DEPs在细胞成分、分子功能和生物过程中的分布情况,揭示了主要涉及的生物学通路。KEGG富集分析散点图(Fig. 7f)则展示了显著富集的代谢通路,进一步阐明了治疗对细胞内信号传导路径的影响。基于GO注释和KEGG通路的基因集富集分析(GSEA)结果(Fig. 7g-l)提供了更详细的分子机制信息,突出了特定生物过程和通路的富集情况。最后,蛋白质-蛋白质相互作用(PPI)网络(Fig. 7m)使用STRING数据库和Cytoscape插件Cytohubba构建,并确定了前10个枢纽基因(Hub-genes),包括Tlr2、Cybb和Mmp8等,这些基因参与了TLR、TNF和NF-κB信号通路,调控炎症反应和皮肤发育。这表明该治疗方案通过调节这些关键信号通路,促进了伤口从炎症期向增殖期的转变,从而加速了皮肤再生和角质形成细胞分化。
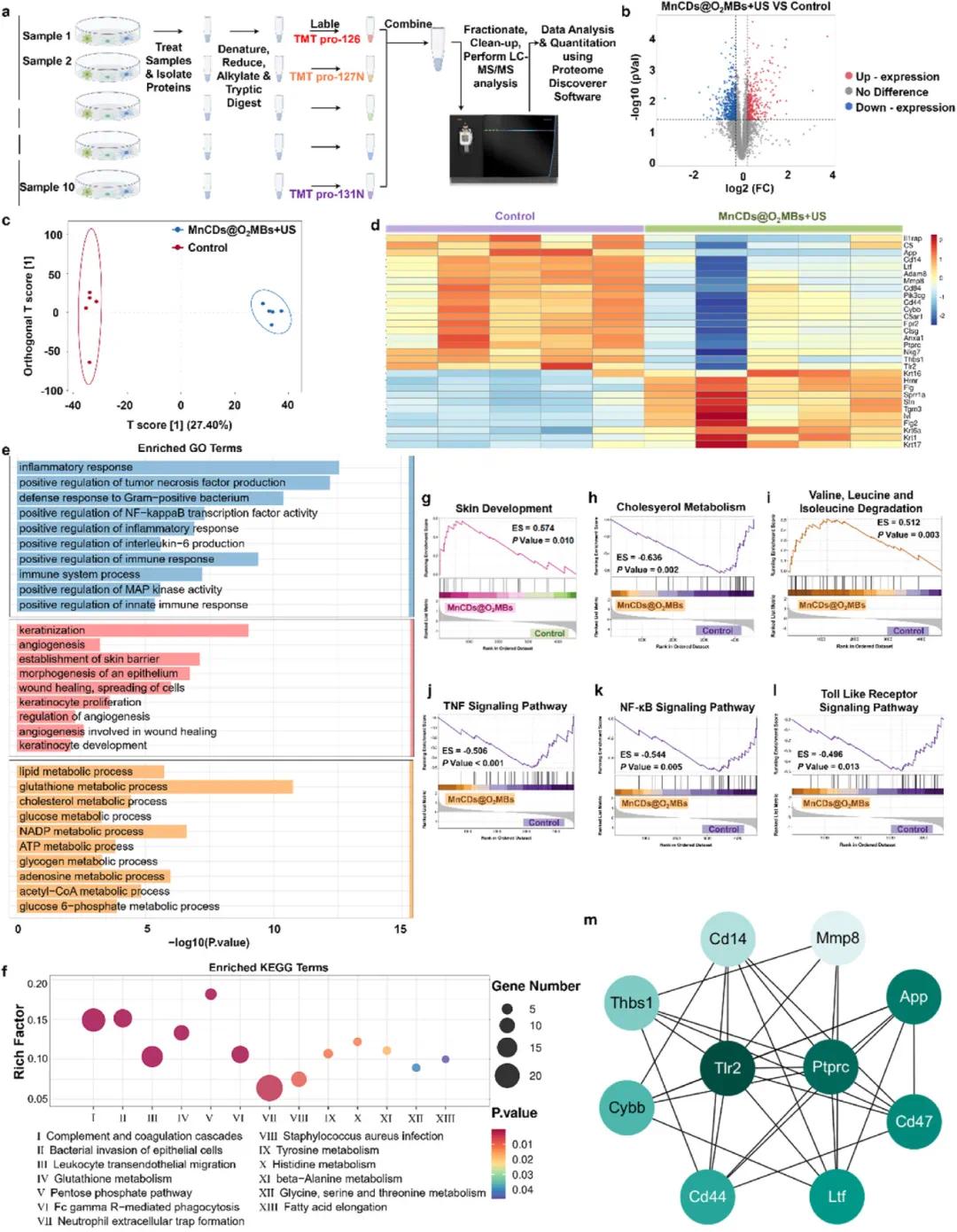
图7. 双氧自供应SDT放大抗生素治疗时伤口修复的蛋白质变化。(a)蛋白质组学测量的示意图及工作流程;(b)双氧自供应SDT放大空化效应与对照组(未经治疗的糖尿病伤口组织)中蛋白质丰度的差异,以火山图表示;(c)基于蛋白质表达水平的所有样本的正交偏最小二乘判别分析(OPLS-DA);(d)MNCD@O2MB介导的SDT和对照组治疗的糖尿病伤口组织的热图,与未经治疗的糖尿病伤口组织相关;(e)差异表达蛋白(DEP)的生物学过程注释;(f)KEGG富集分析散点图;(g–l)基于GO注释和KEGG通路的GSEA分析;(m)通过Cytoscape插件CytoHubba测量的前10个中心基因的PPI网络,颜色深浅表示由MCC算法排名的指数
(7)体内巨噬细胞极化和炎症调节
超声图像(Fig. 8a)展示了不同处理组在第4天、第8天和第16天的B模式和多普勒模式下的肉芽组织血流情况,显示出MnCDs@O₂MBs+US组在早期即表现出显著的血管生成,并在整个实验过程中保持较高的血流面积比例(Fig. 8b)。免疫组化染色图像(Fig. 8c)显示了各组别在第4天、第8天和第16天肉芽组织中CD31表达情况,标尺为100 μm,对照组和仅US处理组显示出较少的CD31阳性细胞,而在MnCDs@O₂MBs+US组中,CD31阳性细胞显著增加,表明其促进了血管生成,对应的统计数据(Fig. 8d)进一步证实了这一点。此外,酶联免疫吸附测定(ELISA)检测结果显示,MnCDs@O₂MBs+US组中促炎因子TNF-α(Fig. 8e)、IL-1β(Fig. 8f)和抗炎因子IL-6的浓度变化。具体来说,MnCDs@O₂MBs+US组中TNF-α和IL-1β的水平显著低于对照组和其他处理组,而IL-6水平则显著升高(Fig. 8g),这表明该处理方式有效地抑制了系统性炎症反应,同时增强了抗炎反应,有助于创建一个更有利的伤口愈合微环境。
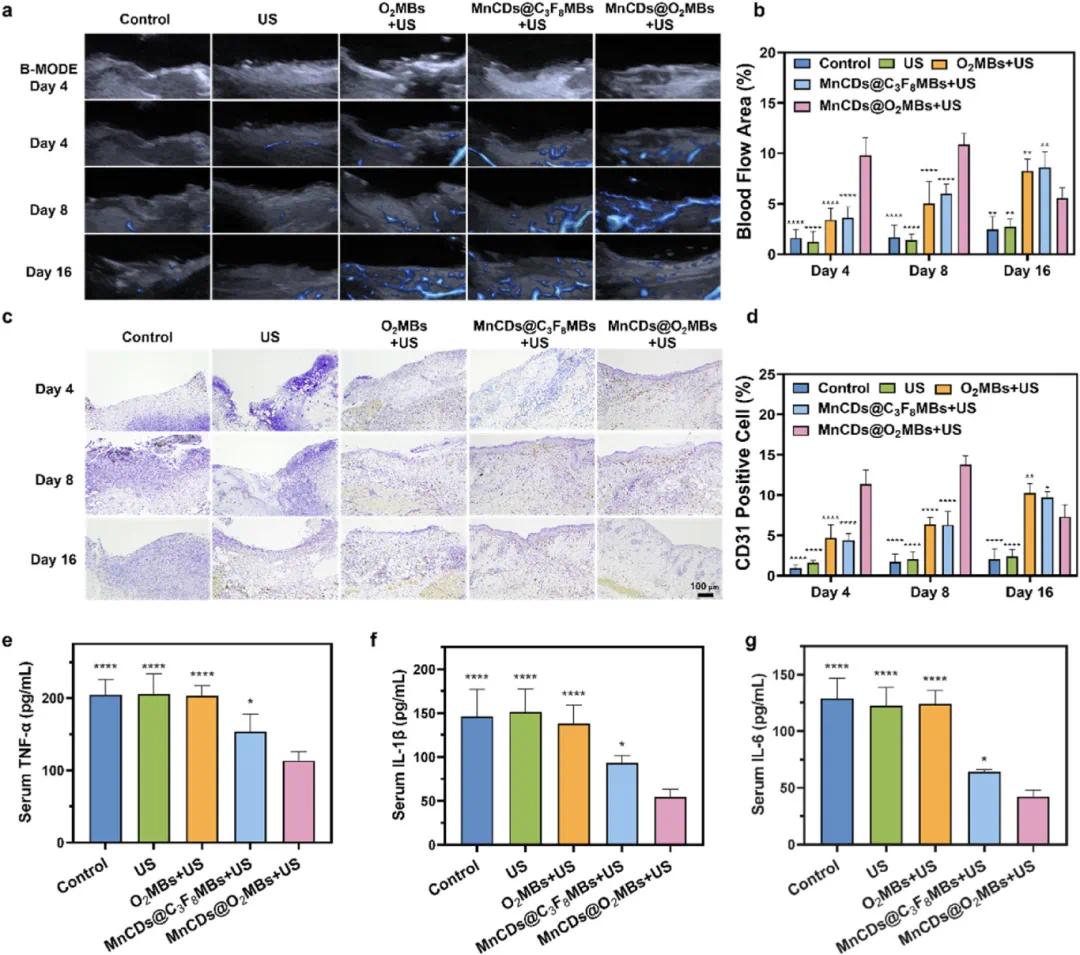
图8. MNCD@O2MB介导的伤口愈合的血管重建和抗炎功效。(a)第4天的B模式超声图像和第4、8、16天肉芽组织的多普勒成像图;(b)超声图像的血流面积比的相应统计数据;(c)第4、8、16天肉芽组织中CD31免疫组织化学染色的显微照片,比例尺:100 μm;(d)CD31阳性细胞百分比的相应统计数据;(e)通过ELISA测定的TNF-α血清浓度;(f)通过ELISA测定的IL-1β血清浓度;(g)通过ELISA测定的IL-6血清浓度
该治疗方案通过增强活性氧(ROS)生成、改善局部缺氧环境、促进血管重建和调节炎症反应,有效清除了细菌生物膜并加速了伤口愈合过程。实验结果表明,MnCDs@O₂MBs不仅显著提高了抗菌效果,还促进了新生血管形成,并降低了系统性炎症反应,为解决慢性伤口感染问题提供了新的策略和技术支持。这些发现为其在临床应用中的潜力奠定了基础,并展示了其在复杂伤口管理中的广泛应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

