
干眼症(DED)是一种常见的多因素眼科疾病,主要表现为泪液数量或质量异常,导致泪膜不稳定和眼表损伤。目前的治疗方法包括人工泪液、抗炎药物和免疫抑制剂等,但这些方法存在局限性,如人工泪液只能暂时缓解症状,糖皮质激素类药物可能引发青光眼和白内障等副作用。近年来,研究发现氧化应激是干眼症发生和发展的重要因素,因此开发能够清除活性氧(ROS)的新型药物成为研究热点。

针对上述问题,苏州大学刘庄教授团队联合苏州大学附属第四医院张晓峰教授团队开发了一种基于过氧化氢酶(CAT)的新型眼药水配方,通过壳聚糖(CS)和半胱氨酸(Cys)修饰形成CS-Cys/CAT纳米复合物。该纳米复合物能够通过静电相互作用自组装,并与泪膜黏液层中的半胱氨酸形成二硫键,从而显著延长CAT在眼表的保留时间,有效清除ROS,抑制炎症和细胞损伤。实验表明,CS-Cys/CAT眼药水在干眼症小鼠和兔子模型中表现出优异的疗效,且优于临床常用的环孢素和地塞米松。这种新型纳米制剂具有良好的生物相容性,有望成为一种安全有效的干眼症治疗药物。相关研究在2025年3月23日以“Eye-Drop Nano-Formulation of Catalase Self-Assembled with Thiolated Chitosan for Effective Treatment of Dry Eye Disease”为题发表于《Advanced materials》 (DOI: 10.1002/adma.202415353)上。
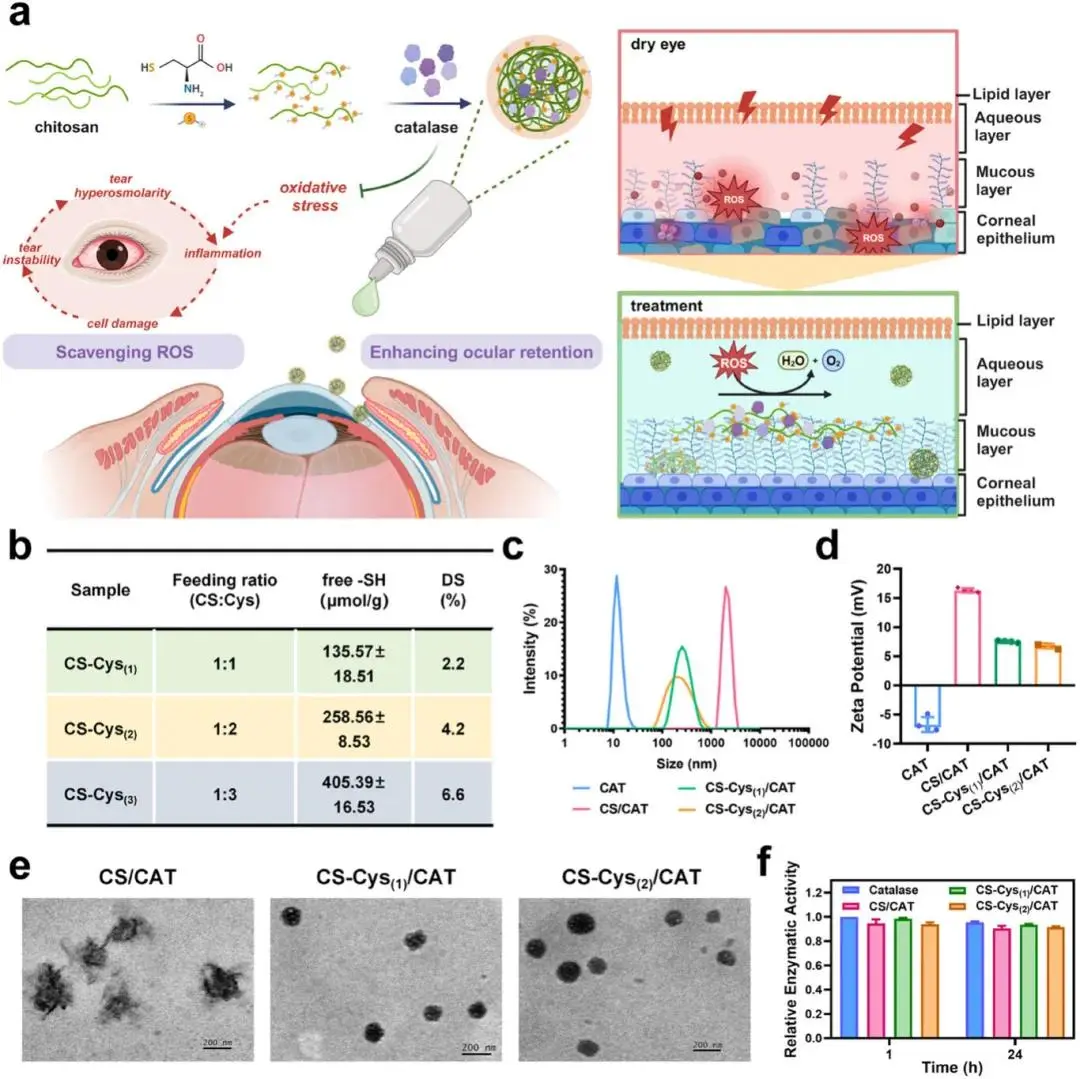
图1. CS-Cys/CAT 纳米复合物的合成与表征。(a)用于治疗干眼症的 CS-Cys/CAT 滴眼液示意图;(b)合成的 CS-Cys 的游离巯基含量和取代度;(c)以 1:1 的重量比混合不同取代度的 CS-Cys 和过氧化氢酶制备的 CS-Cys/CAT 纳米复合物的尺寸分布;(d)zeta 电位;(e)CS/CAT、CS-Cys(1)/CAT 和 CS-Cys(2)/CAT 的 TEM 成像,其中 CS-Cys(或 CS)与 CAT 的比例为 1:1;(f)CS/CAT 和 CS-Cys/CAT 纳米复合物中过氧化氢酶的相对酶活性
(1)CS-Cys/CAT 纳米复合物的合成与表征
该研究开发了一种基于过氧化氢酶(Catalase, CAT)的新型干眼症治疗药物,通过壳聚糖(Chitosan, CS)和半胱氨酸(Cysteine, Cys)修饰形成CS-Cys/CAT纳米复合物。CS-Cys通过酰胺反应合成,实验制备了三种不同投料比(1:1、1:2、1:3)的CS-Cys样品,其取代度分别为2.2%、4.2%和6.6%(图1b)。通过核磁共振和傅里叶变换红外光谱验证了半胱氨酸的成功接枝。CS-Cys(1)和CS-Cys(2)与CAT以1:1的重量比混合,通过静电和疏水相互作用自组装形成纳米复合物。动态激光光散射(DLS)结果显示,CS-Cys(1)/CAT和CS-Cys(2)/CAT的平均粒径分别为192 nm和223 nm,远小于未修饰的CS/CAT(1565 nm,图1c)。透射电子显微镜(TEM)观察显示,CS-Cys/CAT具有均匀的球形结构,而CS/CAT结构松散且形状不规则(图1e)。此外,CS-Cys/CAT纳米复合物在15天内保持稳定,且在氮气保护下可稳定一个月。重要的是,与CAT的结合对过氧化氢酶活性影响甚微(图1f)。
(2)CS-Cys/CAT纳米复合物的角膜前粘附和ROS清除能力
为了延长过氧化氢酶(CAT)在眼表的保留时间,研究者制备了不同比例的CS-Cys与CAT的纳米复合物,并通过小鼠实验筛选出最佳配方。实验结果表明,CS-Cys(2)与CAT形成的纳米复合物(CS-Cys(2)/Cy5.5-CAT)在角膜前段的保留能力最强(图2a, b),推测是由于其更高的巯基密度。进一步优化配方发现,当CS-Cys与CAT的重量比为1:1和2:1时,能够形成均匀粒径的纳米颗粒(图2c),并且CS-Cys/Cy5.5-CAT(1:1)在角膜表面的保留能力更强(图2e, f)。因此,选择CS-Cys:CAT重量比为1:1的配方用于后续研究。该配方的纳米复合物在角膜表面的保留时间长达12小时(图2g, h),且在干眼症小鼠模型中也表现出良好的黏附效果。研究还通过实验验证了CS-Cys/CAT纳米复合物与泪膜黏液层中丰富的半胱氨酸残基之间形成的共价二硫键是其长期保留的关键(图2i, j, k)。此外,CS-Cys/CAT纳米复合物在人角膜上皮细胞中能够有效抵抗高渗透压培养基诱导的氧化应激。
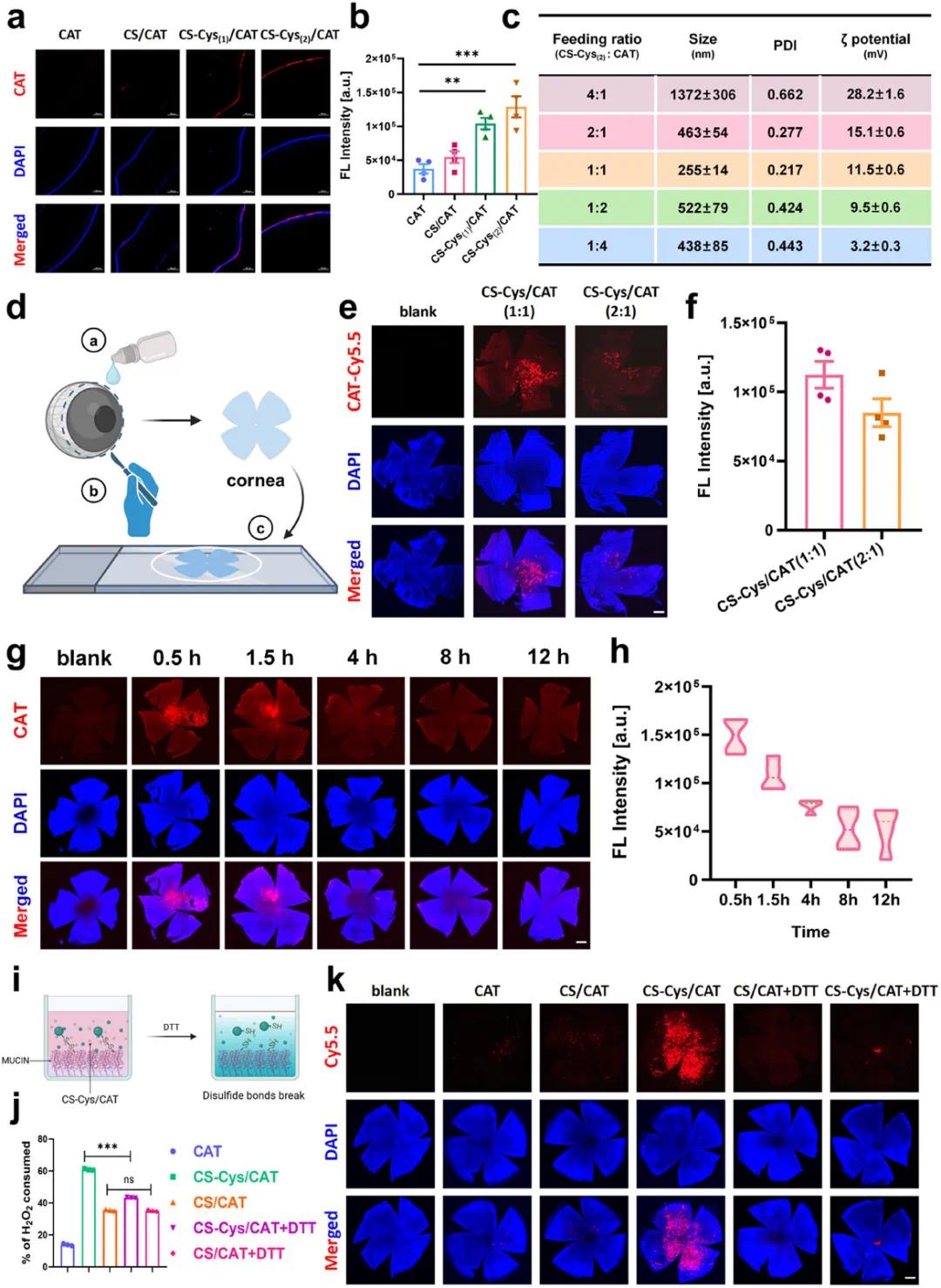
图2. CS-Cys/CAT纳米复合物增强的角膜前滞留能力。(a)应用不同纳米复合物2小时后小鼠眼球的共聚焦图像;(b)利用ImageJ软件对(a)中滞留在角膜表面的Cy5.5荧光强度进行半定量分析;(c)CS-Cys和过氧化氢酶的进料比不同,范围从4:1到1:4(w/w),CS-Cys/CAT纳米复合物的尺寸分布、PDI和zeta电位。这里使用的CS-Cys取代度为4.2%;(d)说明用于验证局部滴眼剂施用CS-Cys/CAT纳米复合物的角膜滞留效果的实验程序;(e)应用不同进料比的CS-Cys/Cy5.5-CAT 2小时后小鼠角膜平装标本的共聚焦图像;(f)利用ImageJ软件对(e)中小鼠角膜上残留的Cy5.5荧光进行半定量分析;(g)应用CS-Cys/Cy5.5-CAT纳米复合物后在不同时间点收集的角膜平装标本的Cy5.5荧光的共聚焦图像;(h)对(g)中Cy5.5荧光的半定量分析;(i)验证CS-Cys/CAT纳米粒子粘附于粘蛋白时二硫键形成的实验装置说明;(j)不同样品中消耗的过氧化氢含量的百分比,反映了粘附于粘蛋白表面的CAT的量;(k)经不同处理(含或不含DTT)的角膜平装标本的Cy5.5荧光共聚焦图像
(3)CS-Cys/CAT 滴眼液用于治疗苯扎氯铵 (BAK) 诱发的 DED 小鼠模型
鉴于ROS在干眼症(DED)发病机制中的重要作用,以及CS-Cys/CAT纳米复合物增强的角膜黏附能力,研究人员测试了其对苯扎氯铵(BAK)诱导的干眼症小鼠模型的治疗效果。BAK能够破坏角膜上皮细胞层的紧密连接,导致泪膜稳定性受损、眼表炎症和角膜上皮细胞损伤等干眼症症状。实验中,0.2% BAK眼药水连续滴入小鼠眼表7天后,小鼠泪液分泌显著减少,角膜荧光素钠染色评分显著增加,表明干眼症模型成功建立。随后,实验人员将小鼠分为五组,分别给予PBS、CAT、CS-Cys、CS-Cys/CAT和环孢素眼药水治疗(图3a)。结果显示,CS-Cys/CAT眼药水在愈合角膜上皮缺陷(图3b, c)和恢复泪液分泌(图3d)方面表现出色,优于环孢素和其他对照组。组织形态学评估显示,CS-Cys/CAT治疗显著改善了角膜结构和形态(图3e),恢复了受损的角膜上皮细胞紧密连接。此外,CS-Cys/CAT眼药水还显著改善了泪腺的结构,使其接近健康状态(图3f),并显著增加了结膜杯状细胞的数量,恢复到健康小鼠的90%(图3g)。这些结果表明,CS-Cys/CAT眼药水不仅能够清除ROS(图3h, i),抑制细胞凋亡(图3j, k),还能显著降低角膜中促炎细胞因子TNF-α、IL-1β和MMP-9的水平(图3l-o),从而通过多重机制有效治疗干眼症。
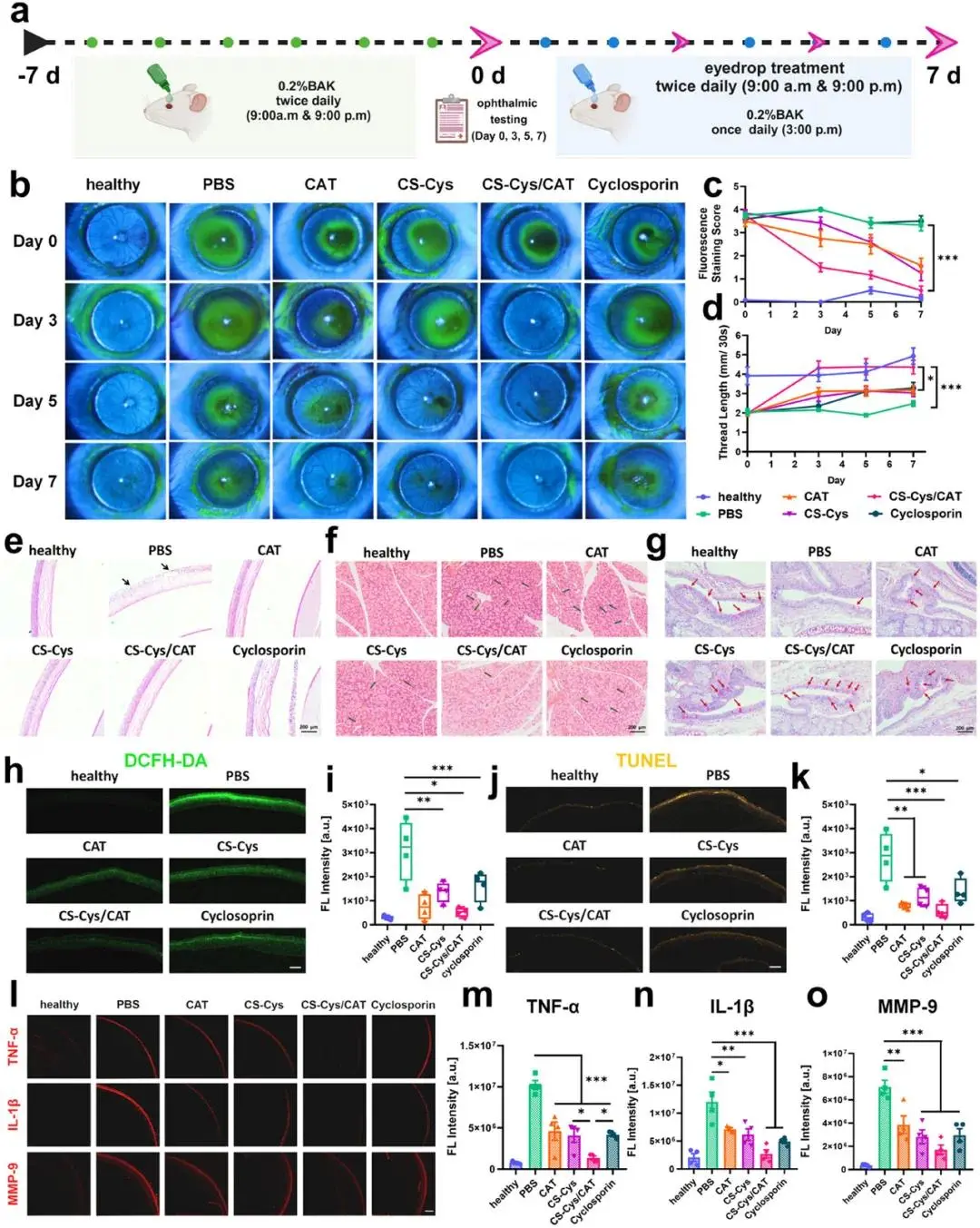
图3. 局部施用CS-Cys/CAT治疗小鼠模型中的BAK诱导干眼症。(a)BAK诱导干眼症模型的建立和治疗实验的设计示意图。实验组包括:i)PBS眼药水,ii)CAT眼药水,iii)CS-Cys眼药水,iv)CS-Cys/CAT眼药水和v)环孢菌素眼药水;(b)代表性荧光素钠染色图像(用钴蓝滤光片拍摄时呈绿色);(c)荧光素钠染色的相应染色分数;(d)在整个七天的治疗过程中用不同眼药水治疗的小鼠用湿润的苯酚线长度测试的泪液量;(e)小鼠角膜的代表性H&E染色图像;(f)泪腺的代表性H&E染色图像。绿色箭头:泪腺组织内淋巴细胞浸润及结构紊乱;(g)结膜杯状细胞PAS染色代表性图像。红色箭头:杯状细胞;(h)小鼠DED接受7天不同疗法后角膜组织DCFH-DA染色代表性共聚焦图像;(i)对(h)的半定量分析结果;(j)小鼠DED接受7天不同疗法后角膜组织Tunel染色代表性共聚焦图像;(k)对(j)的半定量分析结果;(l)通过对用不同眼药水治疗的小鼠的角膜上皮层进行免疫荧光染色来评估炎症因子TNF-α、IL-1β和MMP-9;(m)通过ImageJ软件对角膜上皮层中的TNF-α荧光强度进行半定量分析;(n)通过ImageJ软件对角膜上皮层中的IL-1β荧光强度进行半定量分析;(o)通过ImageJ软件对角膜上皮层中的MMP-9荧光强度进行半定量分析
(4)CS-Cys/CAT 滴眼液治疗氢溴酸东莨菪碱 (SH) 诱发的 DED 小鼠模型
干眼症(DED)病因多样,临床上分为蒸发过强型干眼和泪液缺乏型干眼。为了验证CS-Cys/CAT纳米复合物在泪液缺乏型干眼中的疗效,研究人员建立了东莨菪碱(SH)诱导的小鼠干眼模型。东莨菪碱通过阻断胆碱能受体抑制副交感神经兴奋,显著减少泪液分泌,从而引发干眼症状。通过给小鼠皮下注射0.5 mg/0.2 mL的东莨菪碱溶液,每天四次,连续七天,成功建立了泪液缺乏型干眼模型。小鼠表现出典型的干眼症状,泪液分泌量从4.19±0.103 mm降至1.52±0.038 mm,角膜荧光素钠染色评分从0.23±0.056升至2.67±0.119。随后,研究人员将小鼠分组,采用与BAK模型相同的给药方法进行治疗(图4a),并在第0、3、5、7天进行泪液分泌测试和眼科检查。结果显示,CS-Cys/CAT眼药水在东莨菪碱诱导的干眼模型中表现出与BAK模型中相似的快速疗效,能够显著促进受损角膜上皮的恢复(图4b, c),并快速稳定地增加泪液分泌(图4d),效果优于环孢素。治疗过程中,所有治疗组小鼠的眼内压均保持在正常范围内,表明这些眼药水未对小鼠眼睛造成额外不良影响。治疗结束后,研究人员对小鼠眼球和泪腺进行切片,进行ROS和TUNEL检测(图4e-h)。结果表明,与自由CAT、CS-Cys或环孢素相比,CS-Cys/CAT眼药水显著降低了角膜上皮细胞的氧化应激水平,并有效抑制了细胞凋亡(图4i)。此外,CS-Cys/CAT处理的小鼠泪腺结构恢复最为显著,腺泡大小均匀,排列整齐(图4j)。这些结果表明,CS-Cys/CAT眼药水在泪液缺乏型干眼模型中也表现出色,通过抑制眼表氧化应激和细胞凋亡,促进角膜上皮和泪腺的恢复,从而缓解干眼症状。
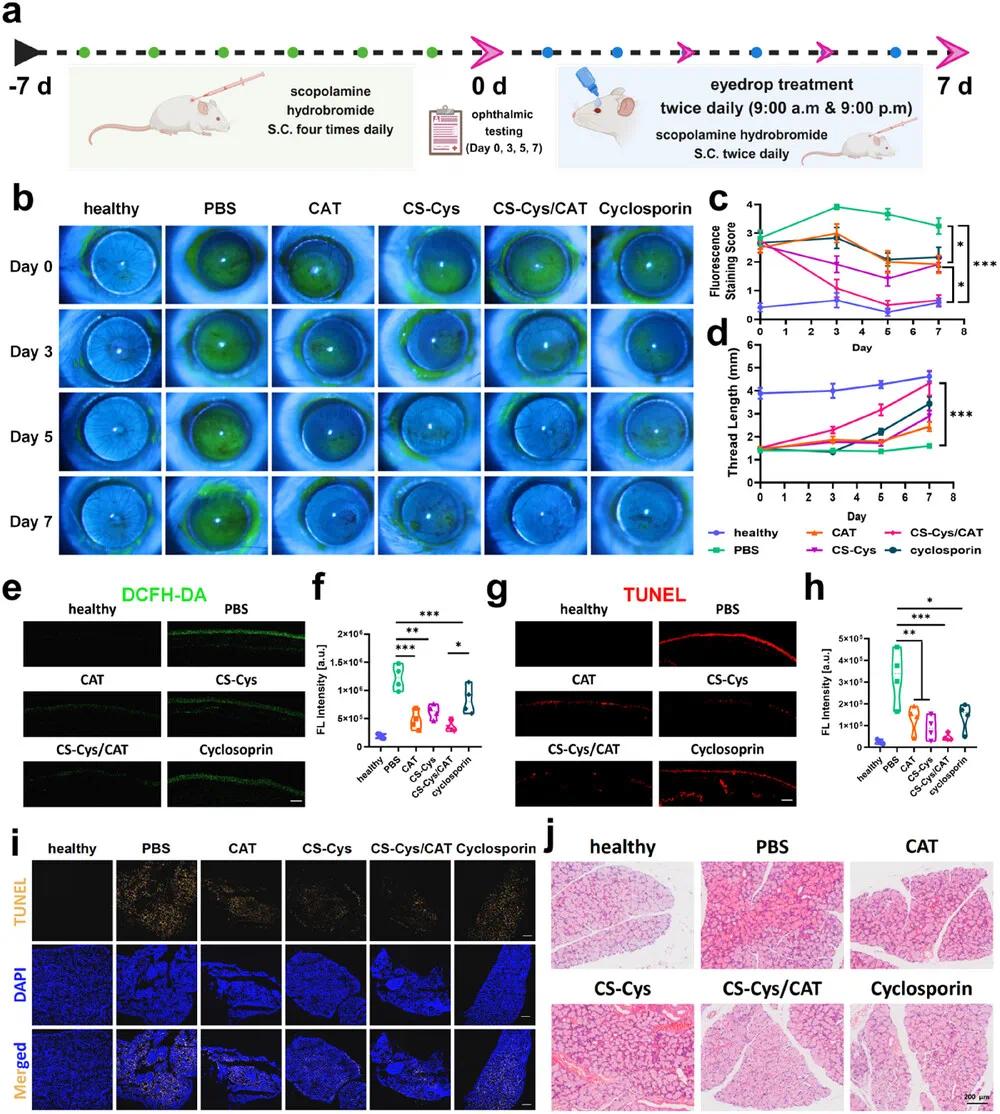
图4. 局部施用CS-Cys/CAT治疗小鼠模型中SH诱导的干眼症。(a)SH诱导的干眼症模型的建立和治疗实验的设计示意图。实验组包括:i)PBS眼药水,ii)CAT眼药水,iii)CS-Cys眼药水,iv)CS-Cys/CAT眼药水和v)环孢菌素眼药水;(b)代表性荧光素钠染色图像(用钴蓝滤光片拍摄时呈绿色);(c)荧光素钠染色的相应分数;(d)在整个七天的治疗过程中用不同眼药水治疗的小鼠用湿润苯酚线长度测试的泪液量;(e)DCFH-DA染色的代表性共聚焦图像;(f)对小鼠在接受七天的不同干眼症(DED)治疗后角膜组织的半定量分析;(g)小鼠接受DED七天不同疗法后角膜组织的Tunel染色代表性共聚焦图像;(h)对(g)的半定量分析;(i)小鼠接受DED七天不同疗法后泪腺的Tunel染色代表性共聚焦图像;(j)小鼠接受DED七天不同疗法后泪腺的H&E染色图像
(5)临床剂量优化及与药物疗效比较
为了优化CS-Cys/CAT眼药水的剂量并评估其疗效,研究人员在BAK诱导的干眼症小鼠模型中进行了实验(图5a)。小鼠每天两次局部滴入不同浓度的CS-Cys/CAT眼药水(1.5、0.5和0.15 mg/mL),所有样品中CS-Cys与CAT的比例均为1:1。结果显示,在治疗的第2天,所有浓度的CS-Cys/CAT均能迅速恢复角膜表面,且三种浓度之间无显著差异(图5b, c)。到第7天,所有处理组的角膜荧光素钠染色评分均恢复到健康水平,泪液分泌量也达到正常水平(图5d)。这表明即使在很低的浓度(0.15 mg/mL)下,CS-Cys/CAT也能持续高效地清除ROS,显示出抗氧化酶疗法的独特优势。此外,研究人员将CS-Cys/CAT眼药水的疗效与其他几种临床上使用的或处于临床开发阶段的干眼症药物进行了比较,包括全氟丁基戊烷+环孢素(SHR8028)、全氟己基辛烷(NOV03)、Reproxalap(ADX629)和地塞米松(图5e)。结果显示,在治疗的第3天,CS-Cys/CAT眼药水在促进受损角膜上皮恢复(图5f, g)和泪液分泌增加(图5h)方面均显著优于其他药物,泪液分泌量在3天内从2.17±0.133 mm增加到4.28±0.501 mm。这些结果表明,CS-Cys/CAT眼药水作为一种抗氧化酶疗法,在治疗干眼症方面具有显著优势,优于现有的其他机制的药物。
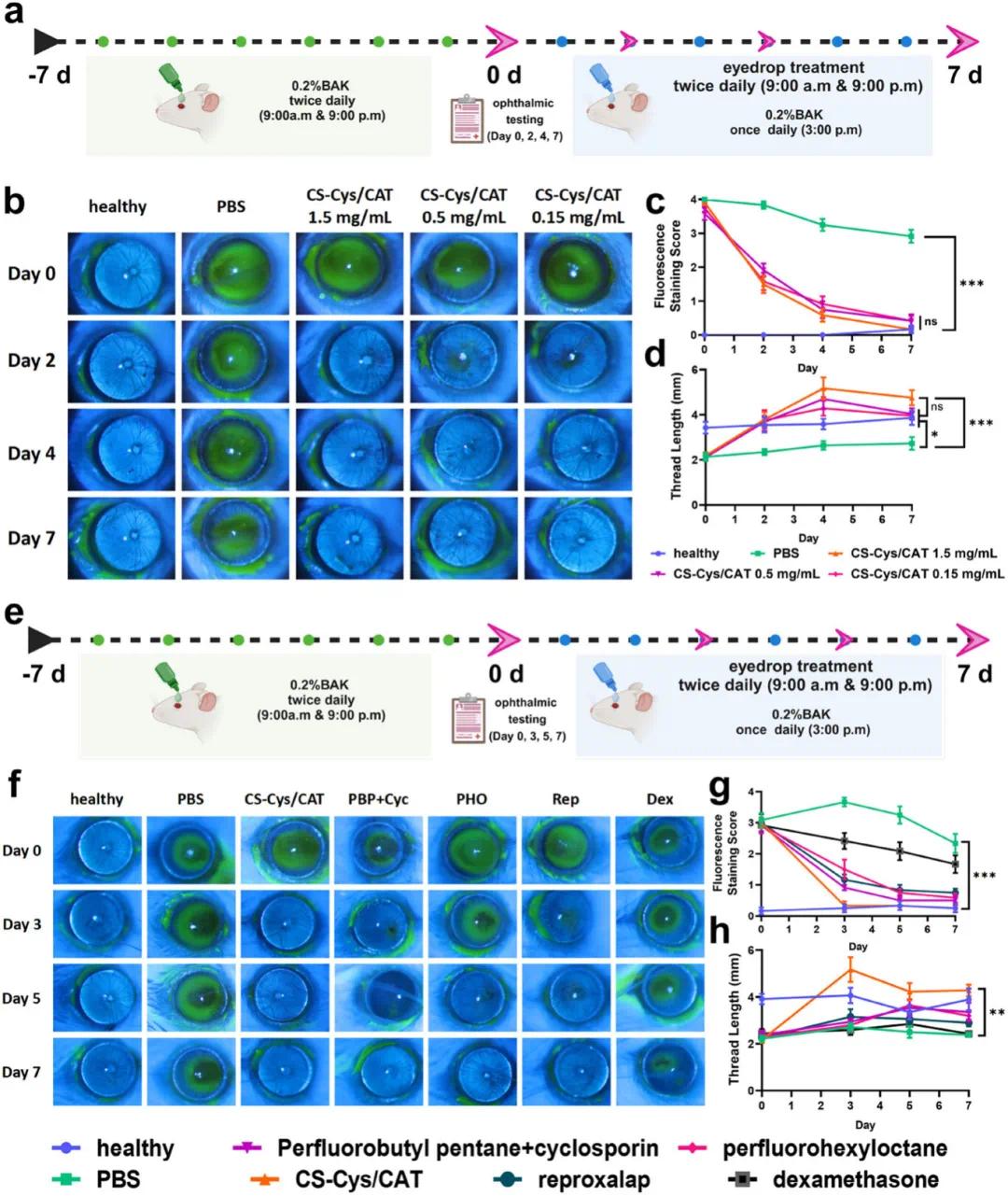
图5. CS-Cys/CAT滴眼液临床开发中的剂量优化及与药物的疗效比较。(a)CS-Cys/CAT滴眼液剂量优化实验设计示意图。实验组包括PBS滴眼液和不同浓度(CAT:1.5、0.5和0.15 mg mL⁻¹)的CS-Cys/CAT滴眼液;(b)代表性荧光素钠染色图像(用钴蓝滤光片拍摄时呈绿色);(c)荧光素钠染色相应的染色分数;(d)在整个7天的治疗过程中用不同滴眼液治疗的小鼠用湿润的苯酚线长度测试的泪液量;(e)治疗实验设计示意图,用于比较CS-Cys/CAT滴眼液与临床开发药物的疗效;(f)代表性荧光素钠染色图像(用钴蓝滤光片拍摄时为绿色);(g)荧光素钠染色的相应染色评分;(h)在整个7天治疗过程中用不同滴眼液治疗的小鼠用湿润的苯酚线长度测试的泪液量
(6)CS-Cys/CAT滴眼液对兔干眼症模型的治疗作用
为了验证CS-Cys/CAT在大体积眼中的治疗效果,研究人员在新西兰白兔中通过连续14天滴入2%阿托品建立了干眼症(DED)模型。模型建立后,研究人员将兔子分为三组,分别给予PBS、CS-Cys/CAT(0.15 mg/mL CS-Cys和CAT)和环孢素眼药水治疗(图6a)。在治疗期间,兔子每天额外滴入一次2%阿托品以延缓自身恢复。结果显示,CS-Cys/CAT和环孢素均显著增加了泪液分泌,但CS-Cys/CAT的恢复速度更快,仅需3天即可恢复到正常水平,而环孢素需要10-14天(图6c)。在角膜荧光素钠染色评分方面,CS-Cys/CAT显著降低,表明其在促进角膜上皮修复方面优于环孢素(图6b, d)。活体角膜共聚焦显微镜成像显示,CS-Cys/CAT治疗显著减少了角膜上皮中的活化炎症细胞(图6e-i),且角膜基质和内皮层细胞形态恢复正常。此外,CS-Cys/CAT在抑制角膜氧化应激和防止角膜上皮细胞凋亡方面表现出更强的效果(图6j-m)。

图6. 局部使用CS-Cys/CAT治疗阿托品诱发的兔干眼症模型。(a)兔干眼症模型建立及治疗实验设计示意图。实验组包括:i)PBS滴眼液,ii)CS-Cys/CAT滴眼液和iii)环孢菌素滴眼液;(b)代表性荧光素钠染色图像;(c)相应的染色评分;(d)在整个14天的治疗过程中用不同疗法治疗的干眼症(DED)兔子的泪液测试条测试的泪液量;(e)代表性健康兔子中央角膜的上皮细胞层、基质细胞层和内皮细胞层的体内角膜共聚焦显微镜图像;(f–h)治疗前后不同时间点家兔中央角膜上皮细胞层(f)、基质细胞层(g)和内皮细胞层(h)的代表性体内角膜共聚焦显微镜图像。所有显微照片的比例相同;(i)(f)中家兔中央角膜上皮细胞层每单位面积炎症细胞数量的定量统计;炎症细胞表示为小、圆、明亮的高反射细胞。请注意,在健康家兔的角膜上皮层中未发现炎症细胞(e);(j)用不同滴眼液治疗的家兔角膜组织TUNEL染色的代表性共聚焦图像;(k)通过Image J软件获得的角膜上皮层TUNEL荧光半定量分析;(l)用不同滴眼液治疗的兔子角膜组织DCFH-DA染色的代表性共聚焦图像;(m)通过Image J软件获得的角膜上皮层DCFH-DA荧光半定量分析
(7)CS-Cys/CAT 滴眼液的安全性评估
为了评估CS-Cys/CAT眼药水的安全性,研究人员在健康小鼠中进行了为期一个月的长期给药实验。小鼠每天两次滴入PBS或CS-Cys/CAT眼药水(5 µL/眼,CS-Cys:1.5 mg/mL,CAT:1.5 mg/mL)。在给药期间,每3天测量一次小鼠的眼内压(IOP)和体重,使用裂隙灯检查角膜和角膜缘的状态、角膜荧光素钠染色和前房透明度,并在第7、14、21和28天使用光学相干断层扫描(OCT)拍摄角膜厚度。实验结束时,收集小鼠眼球和泪腺组织进行H&E染色。结果显示,CS-Cys/CAT组和PBS组小鼠的角膜状态无显著差异(图7a),且两组小鼠的角膜荧光素钠染色结果均为阴性,前房透明度高,表明CS-Cys/CAT眼药水未引起显著的眼部刺激。OCT成像进一步显示,经过4周的CS-Cys/CAT眼药水给药后,角膜厚度无显著变化(图7b, c)。此外,小鼠的体重和IOP值在整个给药期间均保持在正常范围内(图7d, e),表明CS-Cys/CAT眼药水的长期使用是安全的。视网膜的OCT成像结果也显示,小鼠视网膜的厚度和结构与PBS组无显著差异。眼底和荧光素眼底血管造影(FFA)成像结果也表明,CS-Cys/CAT眼药水未引起眼底炎症。H&E染色再次显示,小鼠角膜完整,上皮细胞排列紧密,泪腺结构良好,腺泡大小均匀,排列整齐,形态正常(图7f)。最后,为了评估CS-Cys/CAT眼药水的潜在系统毒性,研究人员收集了小鼠的心脏、肝脏、脾脏、肺和肾脏等主要器官进行H&E染色,并收集血液样本进行血清生化分析。结果显示,与PBS处理的小鼠相比,CS-Cys/CAT处理的小鼠主要器官切片未观察到显著变化,血液学分析结果也与PBS组无显著差异。这些实验结果表明,CS-Cys/CAT眼药水具有优异的生物相容性和安全性,局部对治疗眼无毒性副作用,全身对机体也无毒性影响。
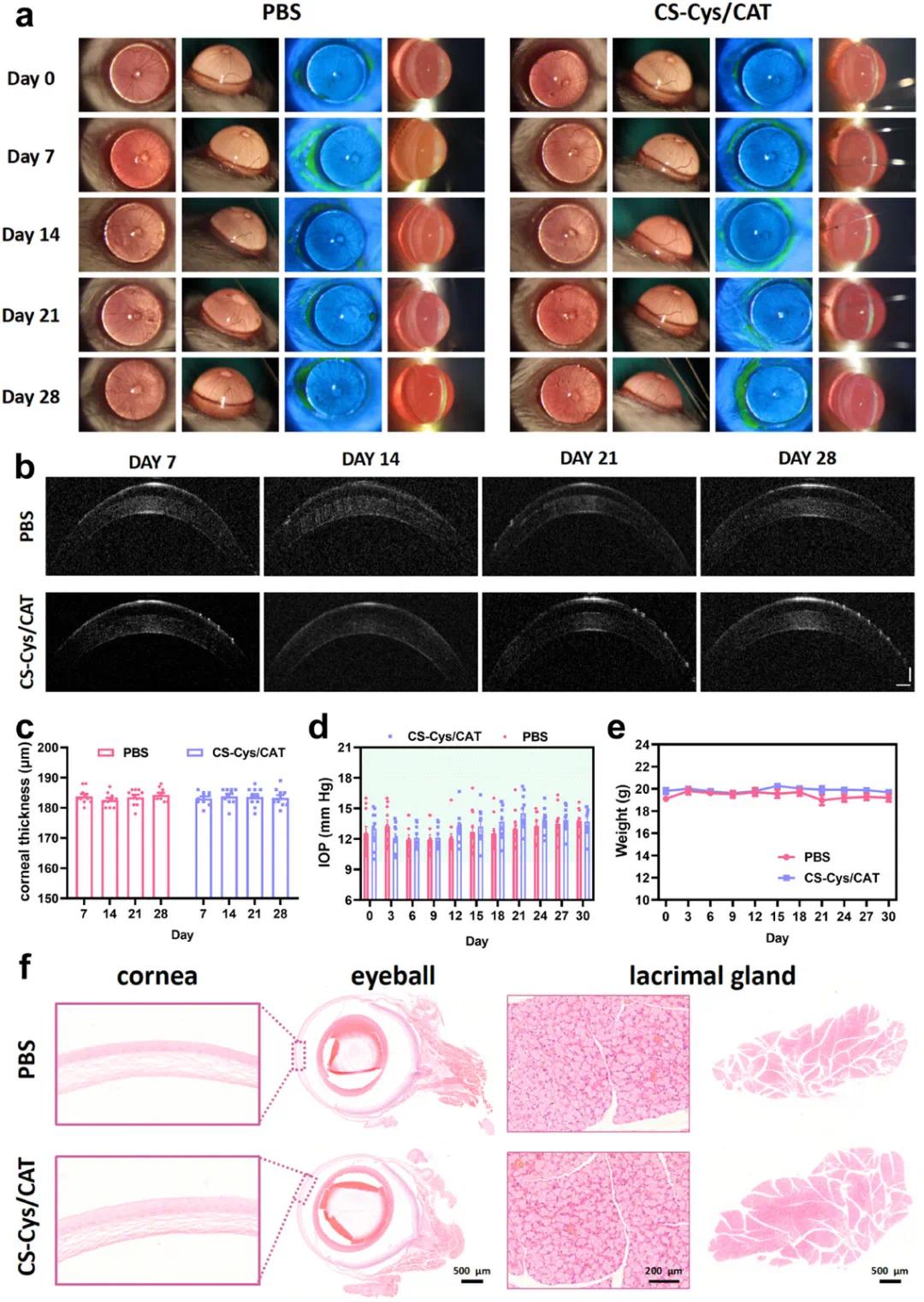
图7. CS-Cys/CAT 纳米复合物的安全性评估。(a)使用 i)宽光束照明、ii)荧光素染色和 iii)裂隙光束照明对 PBS 或 CS-Cys/CAT 眼药水治疗小鼠眼睛长达 28 天的代表性裂隙灯照片;(b)用 PBS 或 CS-Cys/CAT 眼药水连续治疗长达 28 天的小鼠角膜的代表性 OCT 图像;(c)根据 OCT 图像对角膜厚度进行统计分析;(d)用 PBS 或 CS-Cys/CAT 眼药水治疗 30 天的小鼠的眼压记录;(e)用 PBS 或 CS-Cys/CAT 眼药水治疗 30 天的小鼠的体重记录;(f)不同组小鼠眼睛和泪腺的代表性 H&E 染色切片
随着生活方式改变,干眼症发病率上升,严重者可致角膜上皮损伤和结膜上皮角化。目前干眼症药物研发仍以恢复泪膜稳定性和抗炎为重点,但临床缺乏有效药物,现有治疗存在局限性,如保水性不足、作用缓慢,长期使用可能引发青光眼、白内障等并发症。因此,研究人员开发了CS-Cys/CAT滴眼液,利用天然抗氧化酶过氧化氢酶清除氧化应激,抑制炎症和细胞损伤。通过半胱氨酸修饰的壳聚糖与CAT形成纳米复合物,利用二硫键实现CAT在角膜表面的长期滞留,高效清除局部ROS。
研究团队在蒸发过度型和分泌不足型干眼症小鼠模型以及更接近人眼体积的干眼症兔子模型中验证了CS-Cys/CAT滴眼液的疗效。结果显示,该滴眼液在促进泪液产生和修复受损角膜上皮方面优于环孢素、地塞米松及正在临床试验中的新型药物,且连续使用一个月对动物非常安全。未来,该团队计划在更接近干眼症慢性发作的模型中进一步测试这种纳米配方,并在大型动物中进行严格的安全性研究。
研究表明,CS-Cys/CAT滴眼液通过持续清除眼表ROS,有效阻止干眼症进展。与现有药物相比,其清除ROS的策略在防止组织损伤、逆转泪膜微环境失衡和打破炎症恶性循环方面具有独特优势。此外,该滴眼液采用生物相容性和可生物降解的成分,具有临床转化潜力,还可用于治疗其他眼部炎症或局部黏膜炎症性疾病。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

