
研究背景:
牙周炎是全球第六大常见疾病,主要表现为牙周附着丧失和牙槽骨吸收,若不加以治疗或治疗不当,会导致牙齿松动甚至脱落,是成人牙齿脱落的主要原因。牙周炎的发生发展与局部细菌堆积密切相关,因此控制牙周细菌负荷至关重要。由于牙齿和牙周袋的解剖结构复杂,仅靠机械方法难以彻底清除细菌,局部应用抗菌剂成为控制牙周细菌负荷的重要辅助手段。然而,牙周袋是一个动态液体微环境,龈沟液分泌和唾液渗入不断发生,导致目前的牙周局部抗菌制剂容易迅速流失,影响治疗效果。

针对上述问题,四川大学华西口腔医院李继遥教授、梁坤能副教授、杨佼佼副研究员团队研究开发了一种基于单宁酸 - 丝素蛋白 - 盐酸米诺环素(TA-SF-MCH,TSM)的湿粘附抗菌水凝胶系统,通过动态席夫碱反应和氢键作用构建稳定网络结构,实现了米诺环素的持续释放(长达 28 天),同时利用多酚结构的湿粘附特性增强在牙周组织的滞留能力。实验证实 TSM 对牙龈卟啉单胞菌和具核梭杆菌等主要牙周致病菌具有高效抑制作用,显著减少局部细菌负荷并抑制牙槽骨破坏,为牙周感染的局部治疗提供了新型解决方案。相关研究以“A mussel-inspired wet-adhesive prolonged-acting antibacterial hydrogels for the treatment of periodontitis”为题于2025年3月5日发表在《Chemical Engineering Journal》上(DOI:10.1016/j.cej.2025.161262)。

研究示意图
(1)TSM 的制备
为应对牙周组织动态液体微环境(DLM)并增强长效抗菌效果,我们基于单宁酸(TA)的多酚结构构建了一种湿粘附抗菌牙周局部药物递送系统(PLAP)TSM(图 1A)。通过 SF 的酰胺键与 TA 的酚羟基形成的氢键,将丝素蛋白(SF)整合到 TA 平台中,构建了稳定的 β- 折叠 TA-SF(TS)网络。通过 MCH 的氨基与自然氧化 TA 的羰基之间的动态席夫碱反应,将盐酸米诺环素(MCH)引入 TS 网络。这两种反应均可在非活化、温和的水性条件下进行,便于 TSM 在口腔中的应用。TSM 通过溶胀和扩散实现 MCH 的持续释放(图 1B),并通过湿粘附能力延长局部滞留时间,从而抑制牙周炎进展(图 1C)。
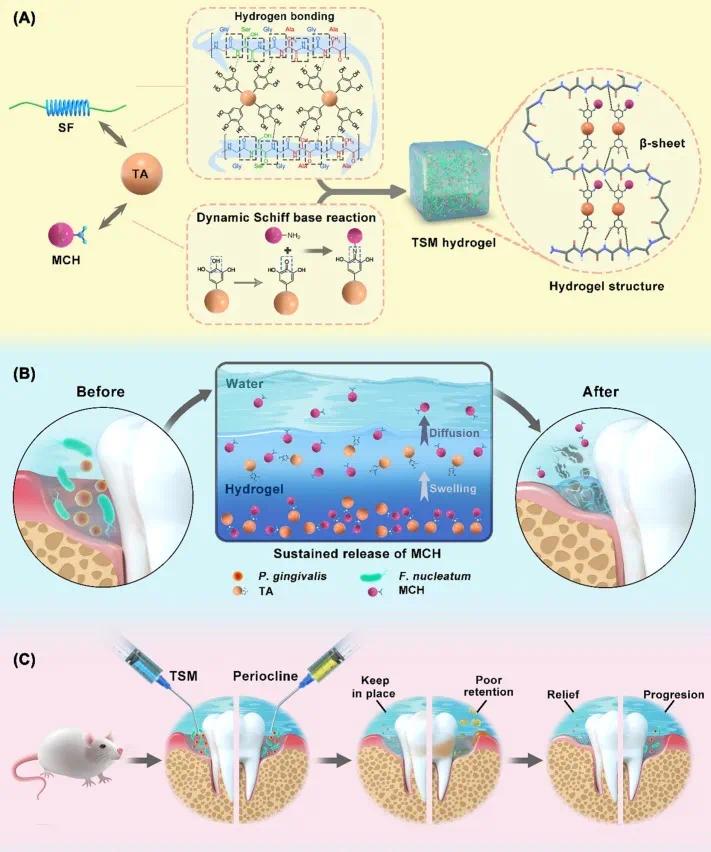
图1 用于牙周炎长效抗菌治疗的TSM水凝胶示意图。(A)TSM通过TA与SF之间的氢键以及TA与MCH之间的动态席夫碱反应构建;(B)TSM通过溶胀和扩散实现MCH的持续释放,发挥长期抗菌作用;(C)TSM通过湿粘附能力延长局部滞留时间并可持续释放MCH,从而抑制牙周炎进展并减少牙周组织破坏
(2)TSM 的表征
TSM 具备柔韧可塑性水凝胶特质(图 2A)。鉴于 MCH 自发荧光特性,运用 CLSM 观察新鲜 TSM 凝胶内 MCH 含量与分布,其三维重建图像见图 2B。荧光强度(FI)随 MCH 含量上升而增强,且四种 TSM 水凝胶 FI 均匀,说明 MCH 在水凝胶中分散均匀。所有 TSM 水凝胶均呈多孔结构:TS 疏松、孔径大且不规则;MCH 含量增加时,TSM 水凝胶更致密,孔径小、分布均匀且形状规则(图 2C)。SEM 与 Cryo-SEM 检测结果与 CLSM 观察一致,均显示 TSM 水凝胶多孔结构。EDS 显示 TSM2 凝胶含 C、N、O、Cl 元素,均匀分布(图 2D)。 BET 比表面积与孔径分析结果(图 2E)表明,TSM2 平均孔径(4.8213 nm)小于 TS(5.3144 nm),比表面积略大于 TS,与 CLSM 观察相符。 经 FTIR、XPS、XRD 分析 TSM 化学结构。FTIR 结果(图 2G)显示,TSM 各组红外吸收峰与 TS 组一致,表明 MCH 负载未显著影响 TS 的 β - 折叠凝胶网络结构。XPS C 1s 光谱(图 2F)表明 MCH 成功负载及载药量。XRD 结果(图 2H)显示 TSM 水凝胶体系呈无定形态。

图2 TSM2水凝胶的表征。(A)新鲜制备的TSM2水凝胶的照片;(B)新鲜制备的TSM2水凝胶的共聚焦激光扫描显微镜(CLSM)图像;(C)新鲜制备的TSM2水凝胶的冷冻电子显微镜(Cryo-EM)图像;(D)冻干TSM2水凝胶的能谱分析(EDS)元素分布映射图;(E)冻干TSM2水凝胶的比表面积及孔径分析(BET);(F)TSM2水凝胶的X射线光电子能谱(XPS)C 1s光谱;(G)TSM2水凝胶的傅里叶变换红外光谱(FTIR);(H)TSM2水凝胶的X射线衍射(XRD)图谱
(3)TSM 的湿粘附相关性能
经动态频率扫描、动态应变扫描及交替阶跃应变扫描研究 TSM 的粘弹性、机械强度与自修复能力(图 3A),其为具粘弹性的高粘度液体水凝胶,有机械强度和自修复能力,能在牙周微环境保持稳定网络结构。搭接剪切试验(图 3B)显示,TSM - 釉质界面剪切强度高于TS(p<0.05),在去离子水和羊血中分别为 3.94±0.07 kPa、8.73±1.32 kPa;TSM - 猪皮界面在去离子水和羊血中的剪切强度分别为 2.32±0.25 kPa、1.25±0.19 kPa。拉伸试验(图 3C)表明,TSM - 釉质界面拉伸强度随 MCH 载药量波动,在去离子水和羊血中分别达 50.08±3.22 kPa、103.27±5.94 kPa;TSM - 猪皮界面中 TSM2 最优,拉伸强度分别为 10.84±1.87 kPa、13.55±2.50 kPa。爆破压力测试(图 3D)显示,TSM - 釉质界面爆破压力高于 TS,TSM2 在猪皮界面的爆破压力达 31.2±4.7 kPa。适量 MCH 能增强粘附性能,过量则破坏界面结合,TSM2 在模拟界面和液体环境有最优湿粘附能力。 FTIR 结果(图 3E)显示,HAP 在多处呈现特征峰,TA 在特定波数处有特征吸收,TA 吸附后的 HAP 出现宽峰及新峰,表明去质子化羧酸根与钙离子配位作用是 TA 吸附 HAP 主要机制。拉曼光谱(图 3F)显示,HAP 呈现磷酸根特征峰,TA-HAP 在特定波数范围出现新峰,进一步证实吸附作用。 因粘蛋白是唾液中最丰富的大分子,用粘蛋白溶液模拟牙周软组织。TA - 粘蛋白混合液在 280 nm 处吸光度显著增加(图 3G),可能源于 TA 的共轭粘附作用。时间依赖性 UV-vis 分析(图 3H)表明 TA 与粘蛋白快速结合并形成稳定复合物。
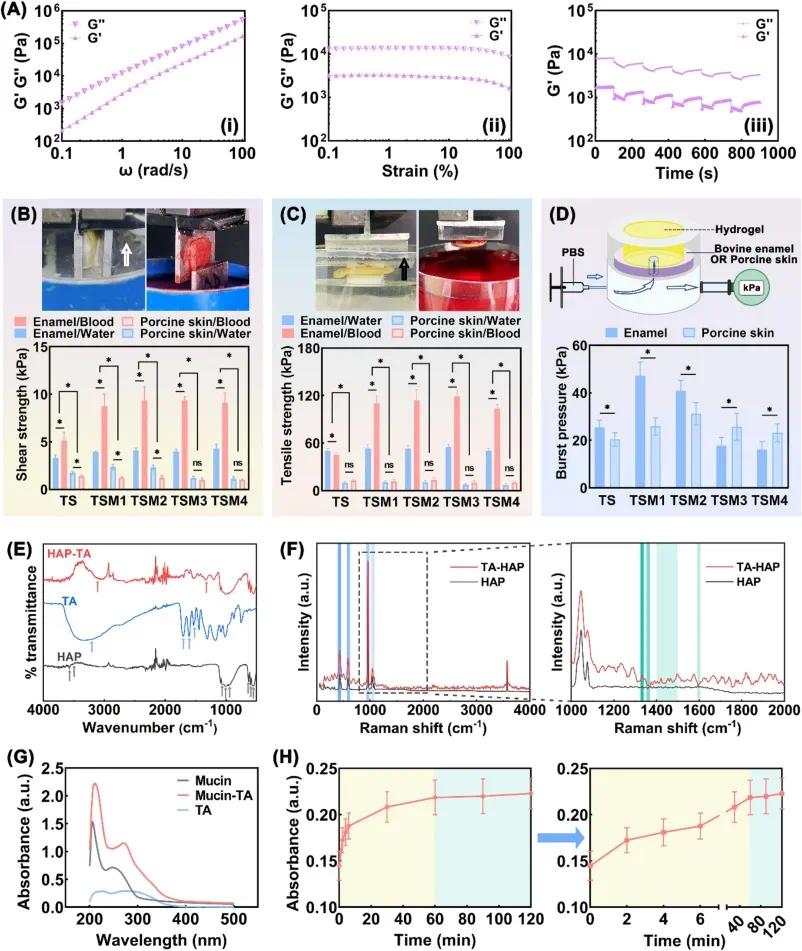
图3 TSM水凝胶的湿粘附相关性能。(A)TSM2水凝胶的流变行为;(B)不同TSM水凝胶的搭接剪切强度;(C)不同MCH负载量的TSM水凝胶在拉伸试验中的最大分离力;(D)不同MCH负载量的TSM水凝胶的爆破压力;(E)TA吸附羟基磷灰石(HAP)的傅里叶变换红外光谱(FTIR);(F)TA吸附HAP的拉曼光谱;(G)TA-粘蛋白混合物的紫外-可见光谱;(H)TA-粘蛋白混合物的紫外-可见吸光度随时间变化曲线
(4)TSM 湿粘附性能的作用机制
通过分子模拟探究水凝胶与胶原相互作用,构建五个模拟系统(N1~N5),经 100 ns 全原子分子动力学模拟和 MM/PBSA 方法计算结合自由能(图 4A)。氢键分析(图 4B)显示,N1、N2 系统中 TA 与 SF 通过大量氢键稳定,氢键对维持水凝胶网络、奠定湿粘附基础至关重要,且 MCH 加载和溶剂变化对 TA、SF 与胶原间非特异性氢键无显著影响,与 TSM 在体内稳定且粘附口腔软组织的现象相符。为深入探究分子间相互作用,放大分子间界面,以棍状模型展示形成相互作用的残基细节(图 4C~4E)。
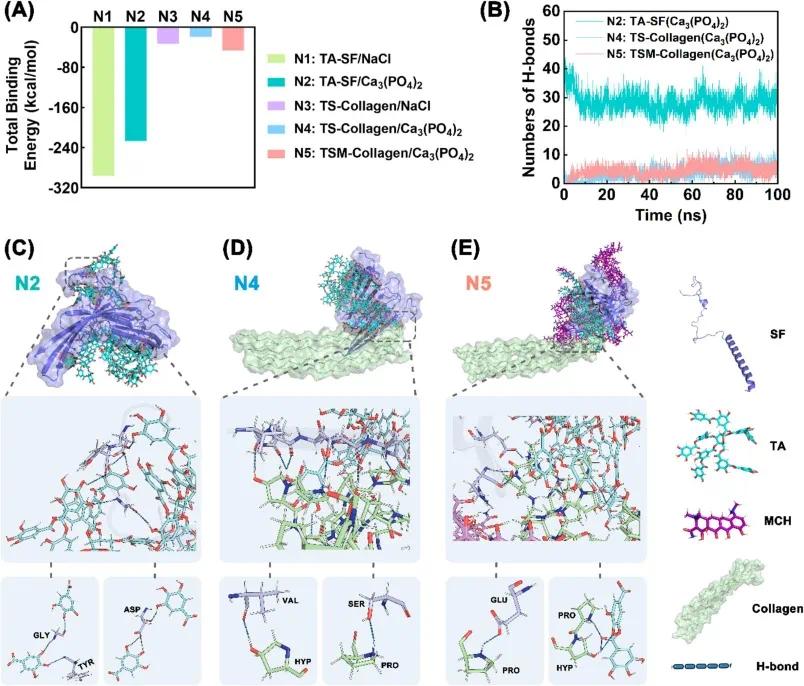
图4 TA(单宁酸)、SF(丝素蛋白)和MCH(甲壳素)在磷酸钙溶剂中的相互作用。(A)N1-N5系统的结合自由能;(B)N2、N4和N5系统的氢键总数;(C-E)N2、N4和N5系统中氢键的代表性快照
图5 标记形成的水桥,以展现水分子在湿粘附中的贡献。 综上,氢键在维持水凝胶网络中起关键作用,为湿粘附奠定基础。MCH 引入和不同溶剂对 TA、SF 和胶原蛋白间非特异性氢键无显著影响,与 TSM 水凝胶在体内保持稳定结构并牢固粘附于口腔软组织的现象一致。
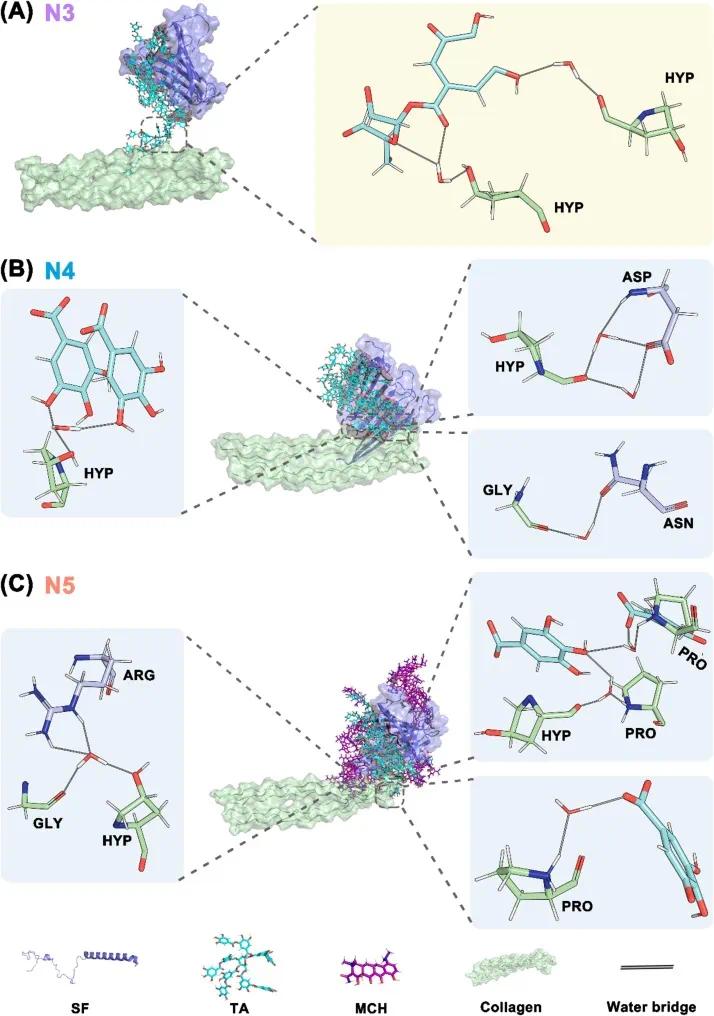
图5 TS-胶原蛋白和TSM-胶原蛋白相互作用中形成的水桥代表性快照。(A)在N3系统中,水桥形成于TA的氧原子与胶原蛋白中HYP的羟基氧原子之间(左);以及TA的氧原子与HYP的羰基氧原子之间(右);(B)在N4系统中,水桥形成于TA的氧原子与胶原蛋白中HYP的羟基氧原子之间(左);SF中ASN残基的氧原子与胶原蛋白中GLY的氧原子之间(右上);SF中ASP残基氨基的氢原子与胶原蛋白中HYP残基的氧原子之间(右下);(C)在N5系统中,水桥形成于SF中ARG残基的氢原子与胶原蛋白中GLY残基的氧原子之间,以及SF中ARG残基氨基的氢原子与胶原蛋白中HYP残基的氧原子之间(左);TA的氧原子与胶原蛋白中PRO残基的氢原子之间(右上);TA的氧原子与胶原蛋白中PRO残基的氢原子之间(右下)
(5)TSM 的长效抗菌性能
与水凝胶共培养 48 小时后,P. gingivalis 和 F. nucleatum 菌悬液照片(图 6 )显示,TS 组菌悬液浑浊,TSM 组保持澄清,与菌悬液光密度值(OD)一致(图 6B、6D),表明 TSM 具有优异抗菌活性,而 TS 无明显抑菌作用。P. gingivalis 生长曲线(图 6F)显示,对照组在 20 小时左右进入对数生长期,40 小时达平台期,而 TSM 各组均未观察到对数生长期。TS 组的 CFU 值略低于对照组,TSM1 和 TSM2 组的 CFU 值显著降低(p<0.05),TSM3 和 TSM4 组未检测到菌落(图 6C、6E)。抑菌圈实验(图 6A)显示,TS 周围无明显抑菌圈,TSM 组抑菌圈直径随 MCH 载药量增加而增大(TSM1:54.10±4.74 mm;TSM4:73.11±3.54 mm)。扫描电镜结果(图 6G)显示,TS 表面可见大量球形细菌聚集,而 TSM 组细菌数量显著减少,出现大量破裂菌体。 TS 本身无法抑制细菌增殖,甚至可能因 SF 提供的蛋白质营养和多孔网络结构而促进生长,且 TA 的邻苯三酚基团可能促进细菌粘附。而 TSM 通过 MCH 的抗菌作用和 TA 酚羟基被部分占据减少细菌粘附,从而增强抗菌效果。基于上述结果,初步筛选 TSM2 进行后续实验。
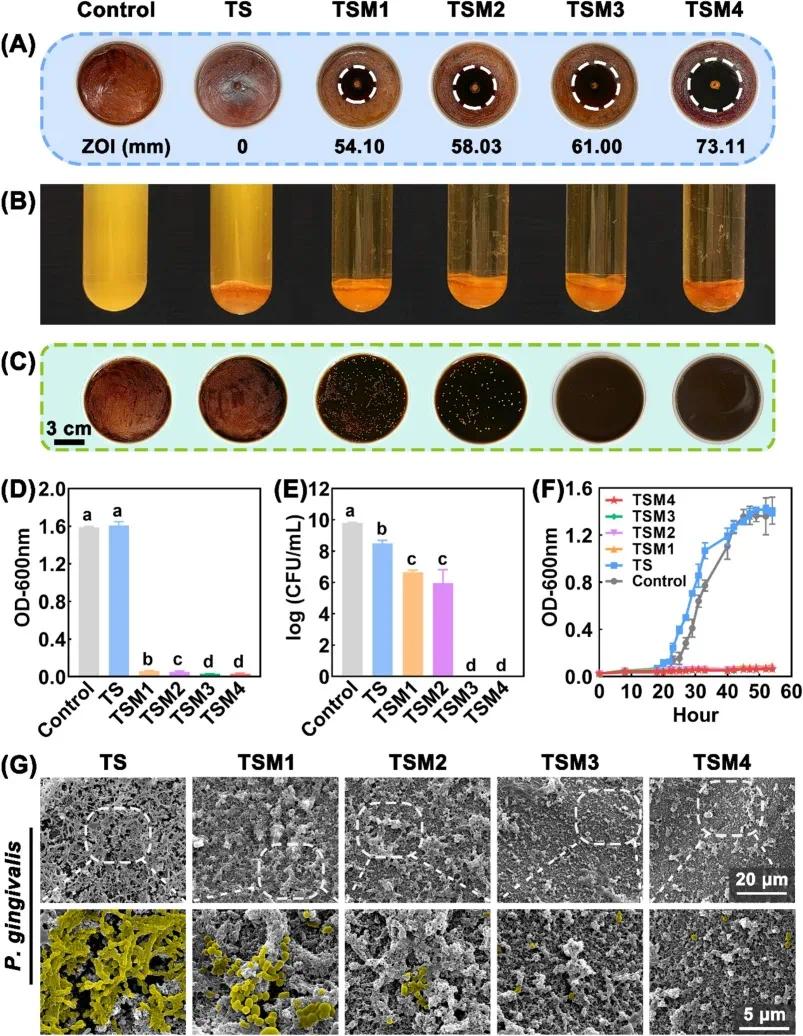
图6 TSM水凝胶对牙龈卟啉单胞菌(P. gingivalis)的体外抗菌活性。(A)共培养48小时后TSM水凝胶的抑菌圈(白色虚线圆圈标记);(B)与TSM水凝胶共培养48小时后菌悬液的照片;(C)与TSM水凝胶共培养48小时后牙龈卟啉单胞菌的菌落图像;(D)牙龈卟啉单胞菌与TSM水凝胶共培养48小时后菌悬液的最终光密度值(OD);(E)48小时后牙龈卟啉单胞菌的菌落形成单位计数(CFU);(F)牙龈卟啉单胞菌的生长曲线;(G)牙龈卟啉单胞菌形态与数量的扫描电子显微镜(SEM)图像
(6)TSM 的药物缓释与长效抗菌性能
MCH 释放曲线显示(图 7A),无论介质更换频率如何,TSM 均可实现 MCH 持续释放 28 天,且累积释放量随更换频率增加而显著提高。降解实验显示(图 7B-D),在蛋白酶 XIV 溶液中 TSM2 完全降解,而在 PBS 和 I 型胶原酶溶液中质量保持稳定,表明其结构可抵抗牙周水性环境和致病菌酶的干扰。综上,TSM 通过稳定的网络结构抵抗液体冲刷,结合扩散 - 溶胀协同释药机制,实现了 MCH 的缓慢均匀释放,在复杂牙周环境中保持有效药物浓度,显著抑制细菌增殖并减少牙槽骨破坏,为牙周炎的长期治疗提供了新策略。
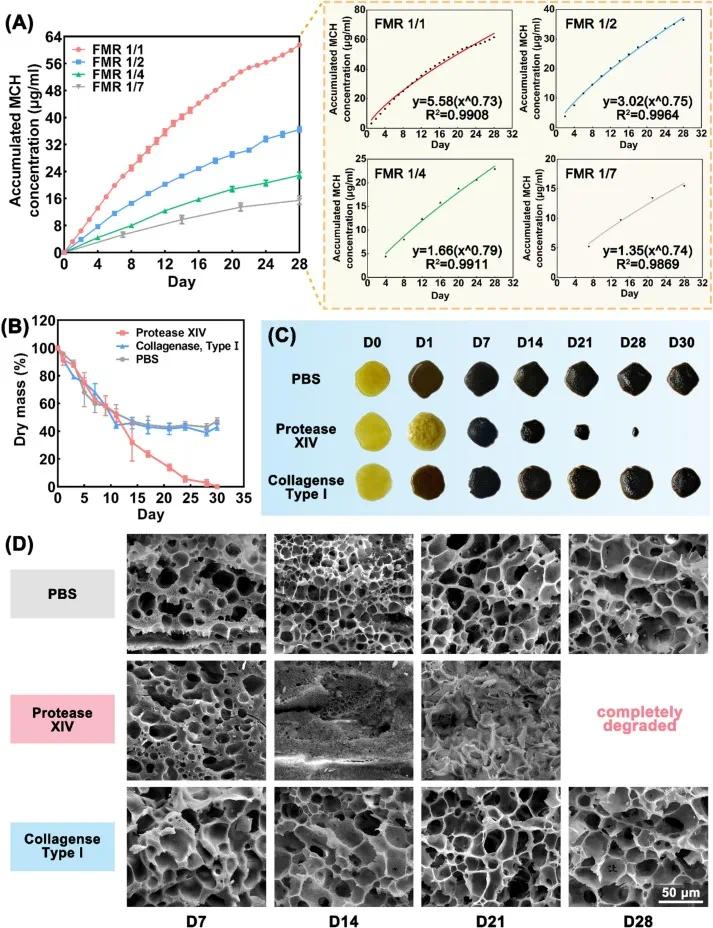
图7 TSM2水凝胶的药物释放与降解行为。(A)TSM2水凝胶的累积MCH释放曲线及其非线性拟合方程(FMR1/1:每天更换介质;FMR1/2:每2天更换介质;FMR1/4:每4天更换介质;FMR1/7:每7天更换介质);(B)TSM2水凝胶在不同溶液中的降解动力学曲线(蛋白酶XIV组、Ⅰ型胶原酶组、PBS对照组);(C)TSM2水凝胶在不同水环境下(PBS、蛋白酶XIV、Ⅰ型胶原酶)的宏观形态变化(D0-D30);(D)TSM2水凝胶在不同溶液中降解过程的扫描电子显微镜(SEM)图像
(7)TSM 治疗牙周炎的体内疗效
采用丝线结扎联合牙龈卟啉单胞菌(P. gingivalis)接种的方法建立大鼠牙周炎模型(图 8A)。通过 Micro CT 三维重建(图 8D)和组织学染色(图 9A-B)评估 TSM 的治疗效果。结果显示,TSM 组的牙龈卟啉单胞菌负荷显著低于生理盐水组(图 8E),牙槽骨吸收(CEJ-ABC)减少至 0.618±0.058 mm,骨体积分数(BV/TV)维持在 40.90±6.43%,优于 Periocline 组(图 8F-G)。
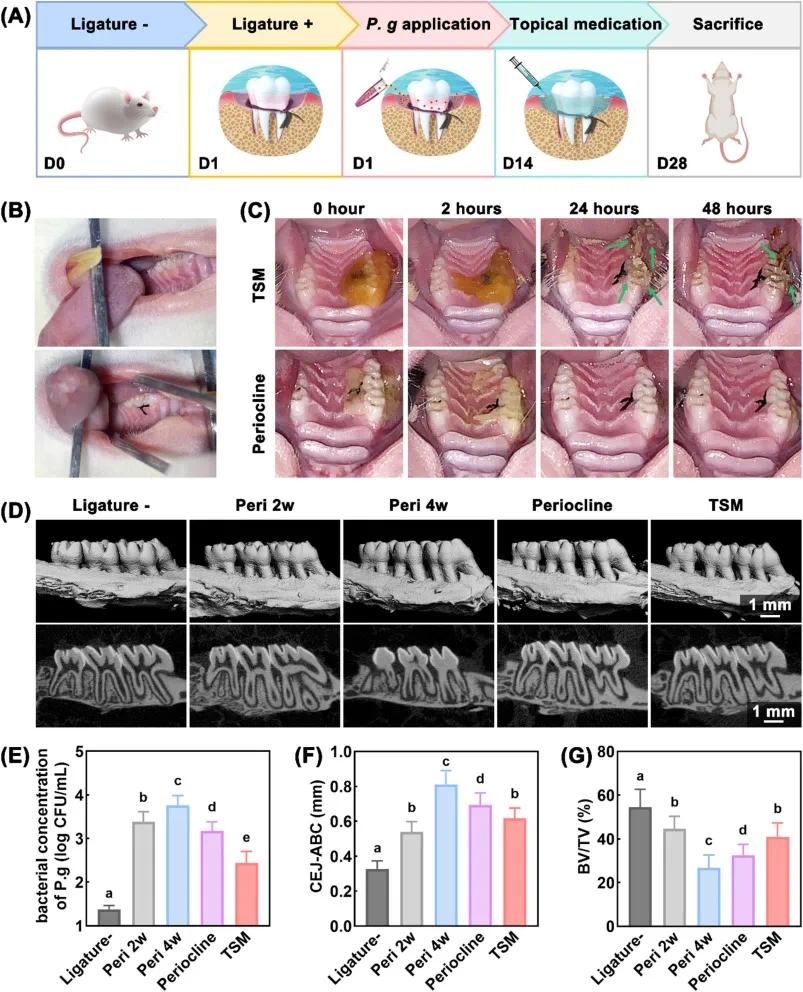
图8 TSM治疗牙周炎的体内疗效。(A)模型构建与治疗流程示意图;(B)丝线结扎前后手术区域的照片;(C)TSM2水凝胶在48小时内的体内牙周粘附情况;(D)第28天大鼠上颌牙槽骨的Micro CT三维重建及二维图像;(E)牙周组织中牙龈卟啉单胞菌负荷的qPCR结果;(F)CEJ-ABC(釉牙骨质界至牙槽嵴顶距离)的定量分析;(G)BV/TV(骨体积分数)的定量分析(均值±标准差,n=5)
H&E 染色显示 TSM 组牙槽嵴高度明显高于对照组,炎症细胞浸润减少;Masson 染色显示 TSM 组牙周膜纤维排列更致密,胶原沉积更完整(图 9)。免疫组化结果表明 TSM 显著降低 IL-1β、IL-6 和 TNF-α 的表达,证实其抗炎效果。TSM 通过长效抗菌和湿粘附特性,有效抑制细菌增殖和炎症反应,减少牙槽骨破坏,治疗效果优于临床药物 Periocline。
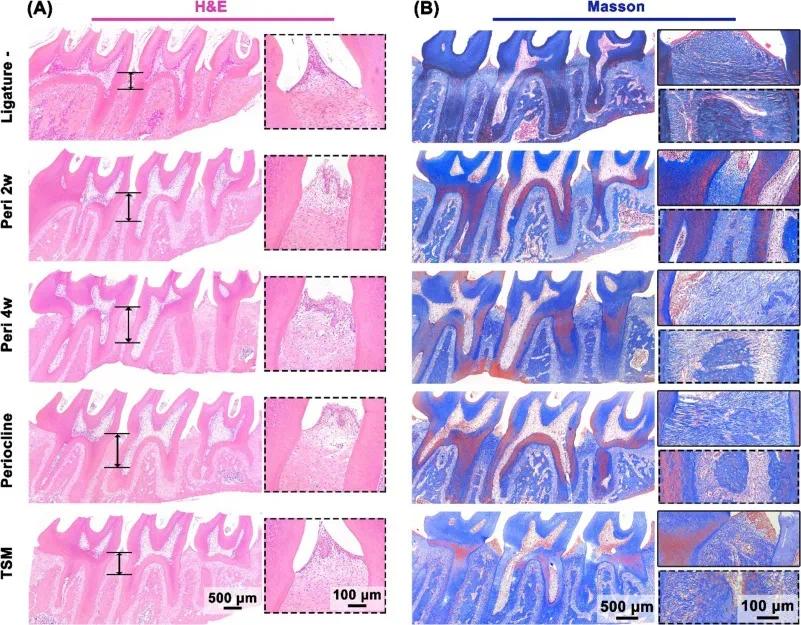
图9 大鼠上颌牙槽骨切片的组织学染色结果。(A)H&E染色显示各组牙槽骨高度及牙龈炎症程度(黑色虚线框示炎症区域);(B)Masson染色显示牙周膜纤维排列和胶原沉积情况(红色:胶原纤维;蓝色:细胞核)
该研究成功制备了一种湿黏附抗菌药物递送系统TSM,其在牙周微环境中具有湿黏附能力,并能持续释放米诺环素盐酸盐(MCH)。TSM对主要牙周病原体展现出长效抗菌活性,并在体内对牙周炎显示出卓越的治疗效果。 作为一种极具潜力的牙周局部用药,TSM对于控制牙周感染和改善临床预后具有重要意义。然而,该研究仍存在一些局限性,例如储存不当,易发生氧化和脱水。这给新鲜水凝胶的保存和储存带来了挑战,可能影响其临床转化,需要进一步研究以解决这些问题。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

