
胶质母细胞瘤(GBM)是中枢神经系统中最常见且最具侵袭性的恶性脑肿瘤,目前的标准治疗手段包括手术切除、放疗和替莫唑胺化疗,但患者的中位生存期仅为12-18个月,5年生存率低于5%。其治疗面临诸多挑战,包括肿瘤的异质性、快速复发、血脑屏障(BBB)限制药物递送,以及肿瘤微环境的缺氧状态导致的治疗抵抗。

针对上述问题,华东师范大学徐志爱教授团队开发了一种基于双层微针(MN)系统的创新治疗策略,用于时空可控的蛋白质降解和联合治疗GBM。该系统外层包含酸敏感的PROTAC纳米颗粒,可在肿瘤酸性环境中特异性释放并降解溴结构域蛋白4(BRD4);内层则包含自氧合的BSA-MnO₂纳米颗粒,用于持续释放氧气以缓解肿瘤缺氧并增强光动力疗法(PDT)的效果。通过近红外光激活光敏剂,产生单线态氧(¹O₂),进一步激活PROTAC并实现精准的肿瘤治疗(图1)。这种局部递药平台能够绕过血脑屏障,减少系统性毒性,同时通过联合光动力疗法和蛋白质降解策略,显著抑制GBM肿瘤生长,为脑肿瘤治疗提供了新的思路。相关研究在2025年3月3日以 “ Self-Oxygenating PROTAC Microneedle for Spatiotemporally-Confined Protein Degradation and Enhanced Glioblastoma Therapy ”为题发表于《Advanced materials》 (DOI: 10.1002/adma.202411869)上。
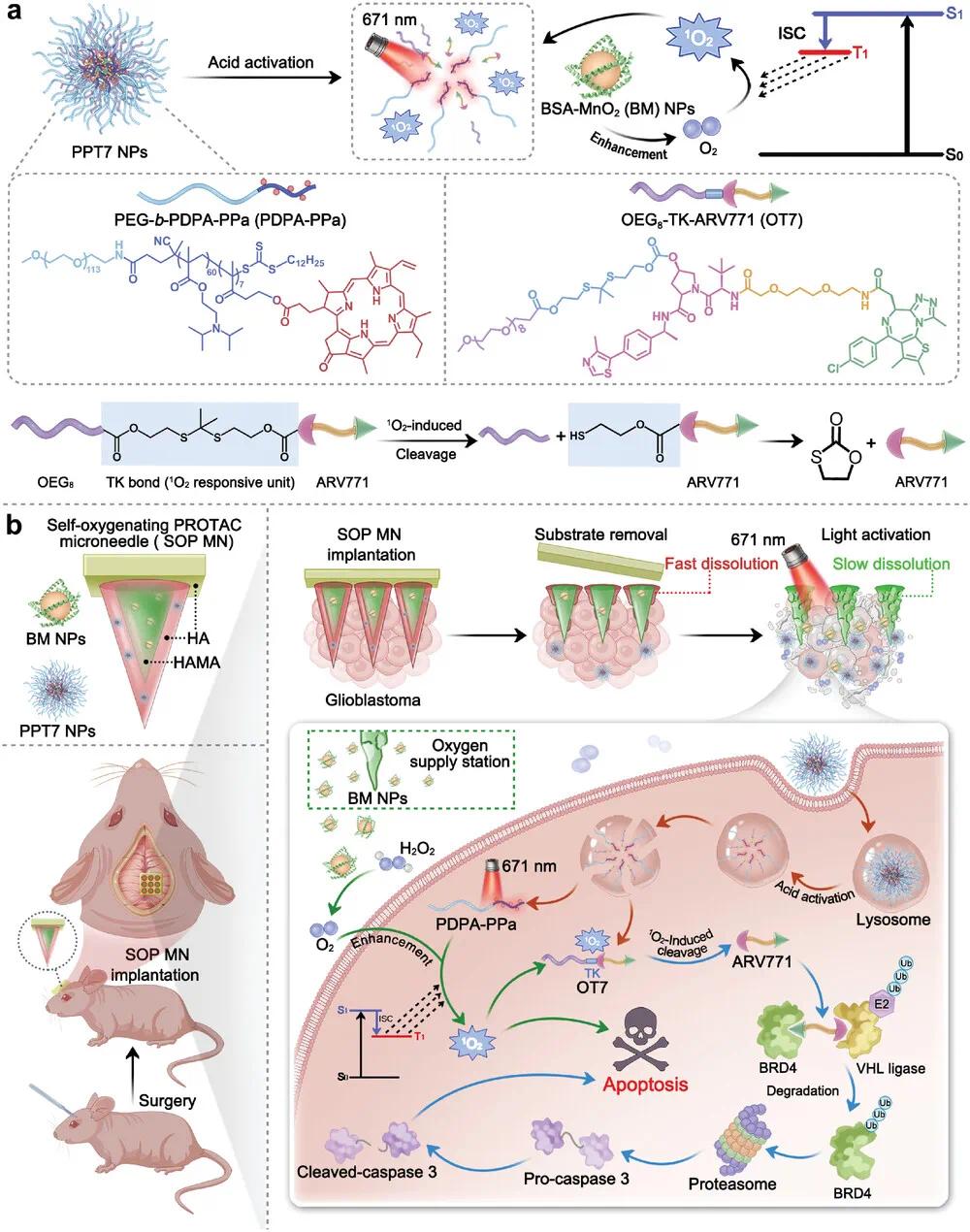
图1. 自氧合PROTAC微针平台用于原位蛋白质降解和增强GBM治疗
(1)酸光双激活PROTAC纳米粒子和自氧化BM纳米粒子的工程化
该研究开发了一种酸激活和光响应型的PROTAC纳米颗粒(PPT7 NPs),用于精准肿瘤靶向治疗。通过合成光响应型BRD4靶向PROTAC前药OT7,并验证其光响应能力(图2b、c)。PPT7 NPs在中性pH(7.4)下粒径约35 nm,呈球形且分布较窄(PDI < 0.2),在酸性环境(pH 6.0)下解离(图2d、e)。荧光实验表明,PPT7 NPs在pH 7.4时荧光微弱,而在pH ≤ 6.4时显著增强,模拟内质网酸性微环境(图2f、h)。此外,PPT7 NPs在酸性条件下显著增强光动力活性,1O₂生成量在pH 6.0时为pH 7.4时的5倍(图2g)。为解决肿瘤缺氧问题,研究开发了BSA包覆的二氧化锰纳米颗粒(BM NPs),增强II型光动力治疗(PDT)激活的PROTAC效果(图2i、j)。BM NPs在酸性条件下催化H₂O₂分解产生氧气,氧气生成量是中性条件的3.0倍,并显著增加1O₂和ARV771的释放量(图2l、m)。这些结果表明,PPT7 NPs和BM NPs在酸性条件下协同作用,有效增强肿瘤靶向治疗效果。
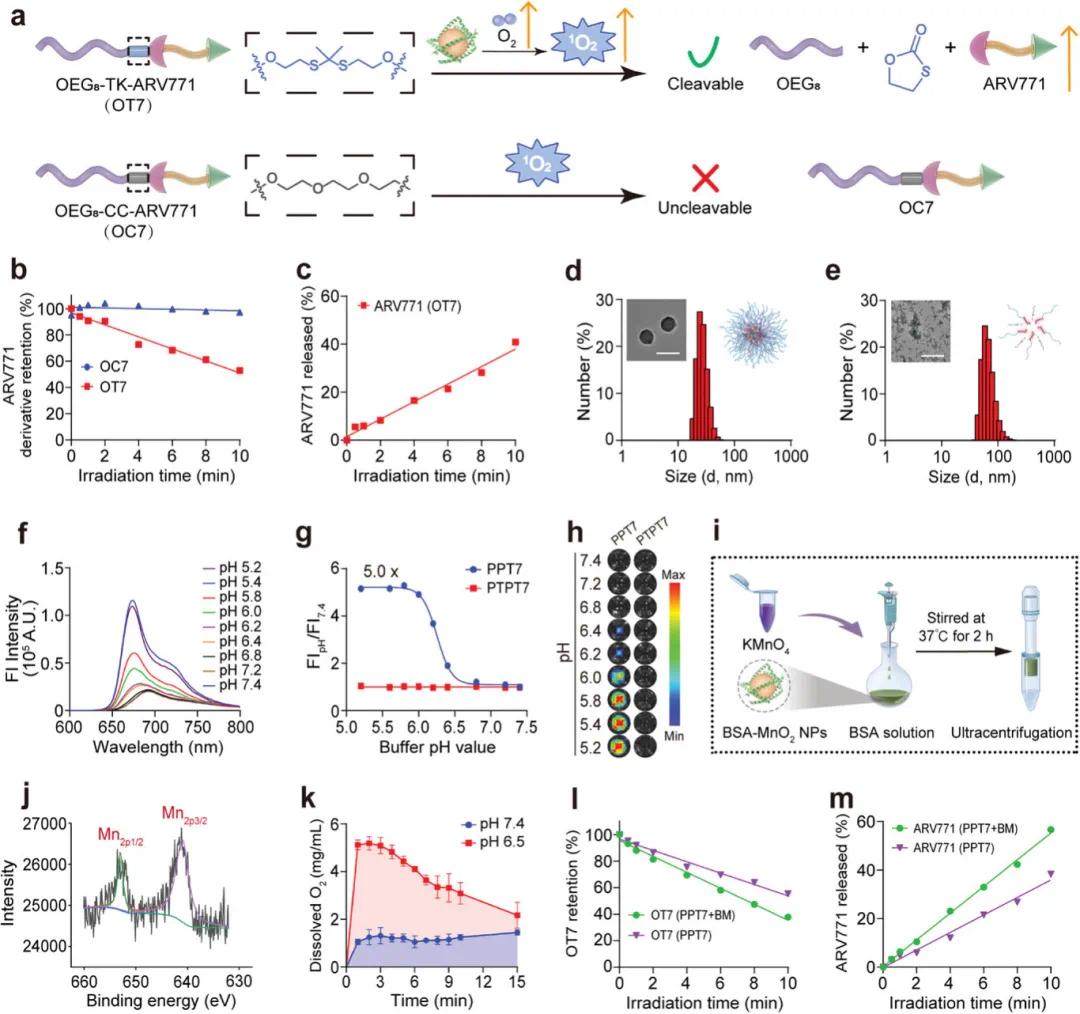
图2 酸和光双激活PROTAC纳米粒子和自氧合BM纳米粒子的工程设计。(a)¹O₂触发PROTAC前药激活的示意图;(b)HPLC确定的OC7和OT7激活度与激光辐照时间的关系;(c)HPLC定量ARV771从OT7释放的百分比与激光辐照时间的关系;(d)pH 7.4时PPT7 NPs的代表性DLS数据和TEM图像;(e)pH 6.0时PPT7 NPs的代表性DLS数据和TEM图像;(f)不同pH缓冲溶液中PPT7 NPs的荧光曲线;(g)与对照PTPT7 NPs相比,不同pH值下PPT7 NPs的酸激活光动力活性;(h)不同pH值下PPT7 NP悬浮液的酸激活荧光图像;(i)BM NPs制造示意图;(j)BM NPs的X射线光电子能谱;(k)pH值为7.4或6.5时,与H₂O₂混合的BM NP溶液中溶解的O₂量;(l)在不同光照射时间下通过HPLC定量测定PPT7 + BM组和PPT7组中OT₇的百分比;(m)在不同光照射时间下通过HPLC定量测定PPT7 NPs和PPT7 + BM NPs中ARV771的释放百分比
(2)PPT7 NPs的细胞摄取、酸触发激活及与BM NPs的协同作用
本研究通过实验验证了酸激活和光响应型PROTAC纳米颗粒(PPT7 NPs)在胶质瘤细胞系U87-MG中的摄取、酸触发的细胞内激活能力以及与自供氧型BM纳米颗粒(BM NPs)的协同作用。流式细胞术(FCM)显示PPT7 NPs在3小时孵育时具有显著的细胞摄取能力(图3a)。共聚焦显微镜(CLSM)成像表明PPT7 NPs与内吞囊泡共定位良好,而酸不敏感的PTPT7 NPs未观察到荧光信号,证实了PPT7 NPs的酸触发解离和荧光激活依赖于细胞内酸性环境(图3b)。在酸性细胞内环境中,PPT7 NPs恢复光活性,并在671 nm激光照射下增加单线态氧(1O₂)的生成,触发ARV771的释放用于BRD4降解(图3c)。BM NPs通过增加氧气生成显著增强了PPT7 NPs的1O₂生成效率,提高了光动力治疗(PDT)效果(图3d)。在缺氧条件下,PPT7 NPs的光诱导BRD4降解能力得到验证,且BM NPs进一步增强了这一效果(图3e)。PPT7 NPs与激光照射的组合显著激活了caspase-3蛋白,诱导细胞凋亡,而BM NPs的加入进一步增强了这种激活(图3f)。细胞实验表明,PPT7 NPs在光照下显著抑制了U87-MG细胞的增殖,而PTPT7 NPs无明显细胞毒性(图3g)。BM NPs与PPT7 NPs联合使用时,通过缓解缺氧进一步增强了细胞毒性,降低了半抑制浓度(IC₅₀)(图3h)。这些结果表明,PPT7 NPs具有酸和光双重激活特性,能够实现时空可控的蛋白降解和抗肿瘤效果,而BM NPs通过增强氧气供应显著提升了PDT和BRD4降解的协同治疗效果。
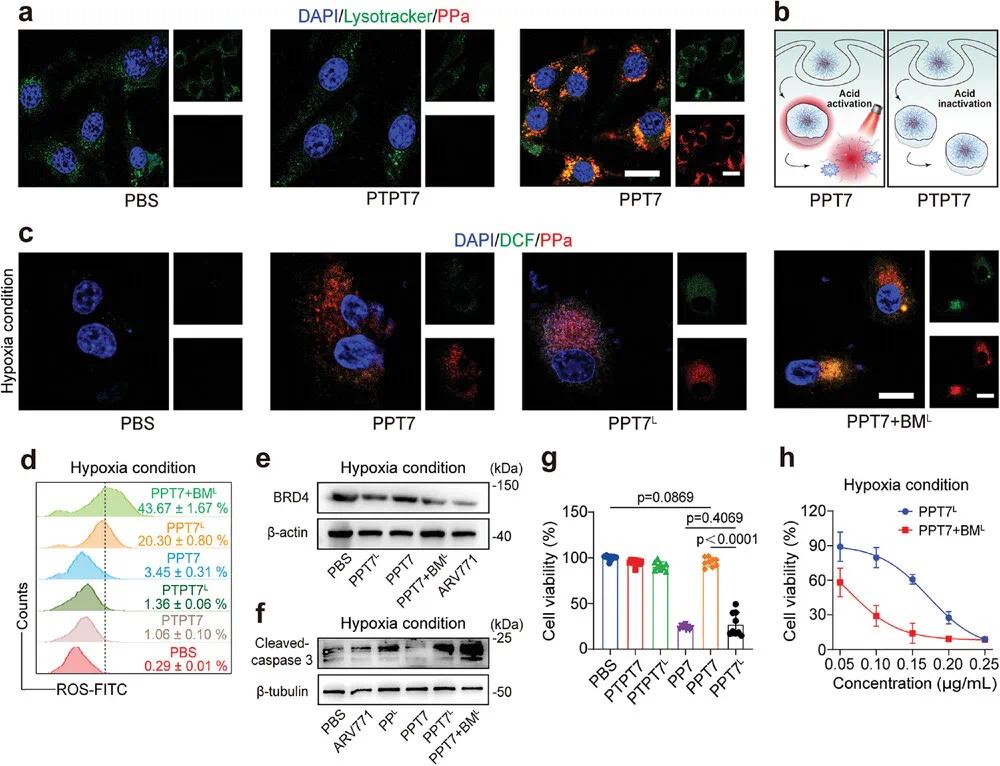
图3 双激活PROTAC纳米粒子在体外显示出增强的细胞摄取和靶向的BRD4降解特征。(a)CLSM检查孵育12小时后PPT7 NPs的细胞内分布;(b)U87-MG细胞对酸敏感的PPT7 NPs的摄取以及酸激活后的PDT激活示意图;(c)CLSM检查激光照射PPT7 NPs产生的¹O₂以及与BM NPs共孵育时产生的更多¹O₂;(d)FCM检测不同组的¹O₂生成百分比;对PPT7和BM NPs的组合进行蛋白质印迹分析,激光照射诱导U87-MG细胞中的(e)BRD4降解和(f)caspase-3活化;(g)激光照射后的PPT7 NPs可有效抑制U87-MG细胞的增殖;(h)BM NPs增强了PPT7 NPs对U87-MG细胞的细胞毒性
(3)自供氧型PROTAC微针(SOP MN)的设计与功能验证
研究人员针对血脑屏障(BBB)在胶质母细胞瘤(GBM)治疗中的挑战,设计了一种双层、可降解调节的自供氧型PROTAC微针(SOP MN),用于区域限制性递送PPT7 NPs和BM NPs以治疗GBM(图4a)。研究中使用透明质酸(HA)作为外层材料,实现PPT7 NPs的快速释放,以促进其在肿瘤细胞内的酸性激活;内层则采用HA的甲基丙烯酰化衍生物(HAMA),用于持续释放BM NPs作为“供氧站”。SOP MN具有规则的圆锥形结构,高度为800 µm,直径为300 µm,针尖宽度约为10 µm,足以穿透皮肤和软脑组织(图4b-d)。其机械性能测试显示,单层HA微针具有良好的机械强度(每针约1.18 N),足以穿透脑组织(图4e)。通过H&E染色进一步验证了SOP MN的穿透能力(图4f)。为了研究PPT7 NPs和BM NPs在SOP MN内的分布,研究者在外层HA中加载绿色荧光染料DiO,在内层HAMA中加载红色荧光染料DiI,结果显示两种纳米颗粒在微针中分层分布(图4g)。此外,通过检测PPa和5-氨基荧光素(5-AF)的荧光强度,验证了SOP MN的双层设计能够调节药物释放:外层HA微针在5分钟内快速释放80%的PDPA@PPa NPs,而内层HAMA微针则在12小时内缓慢释放约40%的BM-5-AF NPs(图4h)。体内实验进一步证实了SOP MN的分层释放特性:外层在5分钟内快速释放PPT7 NPs,内层则在6小时内持续释放BM NPs(图4i)。这种设计实现了PPT7 NPs的快速酸性激活和BM NPs的持续供氧,为GBM治疗提供了一种高效的局部递送策略。
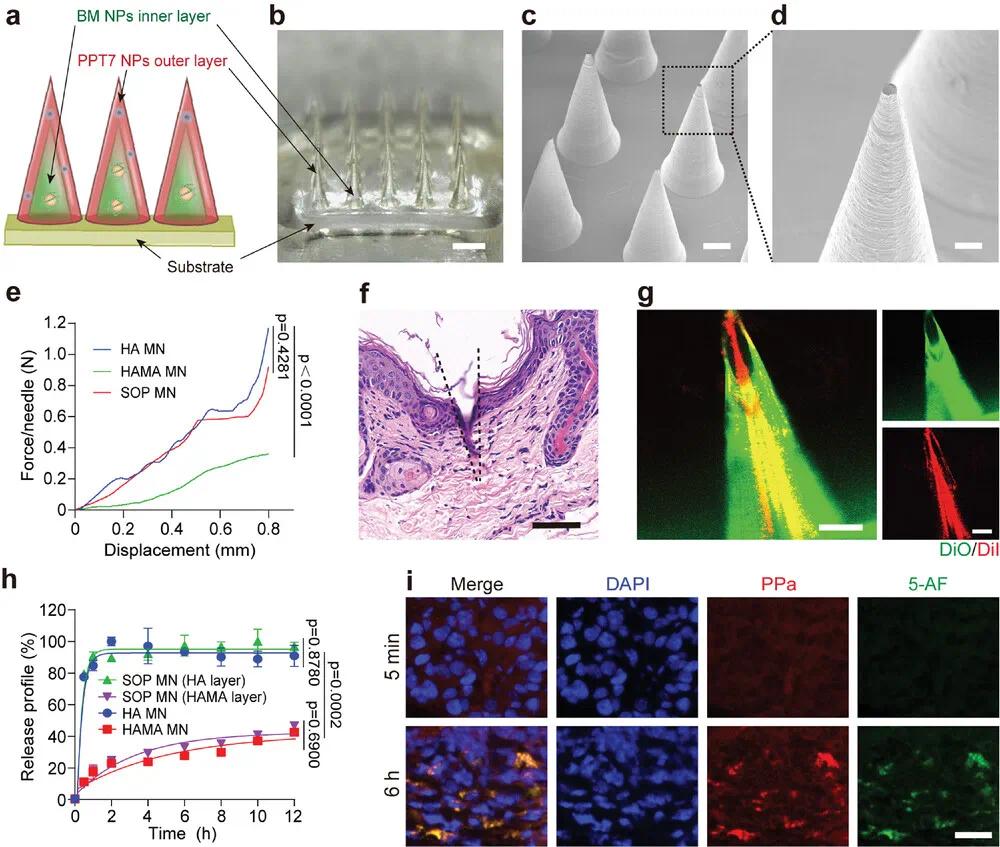
图4 设计自氧合PROTAC微针以实现PROTAC纳米粒子和BM纳米粒子的差异释放。(a)SOP MN示意图,包括嵌入PPT7 NPs的外层、包含BM NPs的内层和空白基底;(b)SOP MN的光学显微镜图像;(c,d)SOP MN的SEM图像;(e)SOP MN、单层HA MN和单层HAMA MN的机械性能;(f)用SOP MN刺穿皮肤的H&E染色;(g)外层装载DiO、内核装载DiI的SOP MN的代表性共聚焦图像;(h)SOP MN(外层为PDPA@PPa、内核为BM-5-AF)、PDPA@PPa HA MN和BM-5-AF HAMA MN在PBS溶液中的体外释放曲线;(i)进行统计分析;(j)肿瘤成像显示MN应用后5分钟和6小时PPT7 NPs和BM NPs的释放存在差异
(4)SOP MN的体内治疗效果及机制研究
研究人员通过皮下GBM肿瘤模型评估了自供氧型PROTAC微针(SOP MN)的体内治疗效果。实验中,通过切除覆盖肿瘤的皮肤后植入微针并缝合伤口(图5a, b),SOP MN直接作用于肿瘤部位,实现区域限制性药物控释。肿瘤仅接受一次671 nm激光照射,随后监测肿瘤生长12天。结果显示,激光照射的PPT7 MN组(PPT7 MNL)抑制肿瘤生长约60%,而SOP MN联合激光组(SOP MNL)的肿瘤抑制率高达86%,且生存时间最长(图5c-e, f),表明BM NPs显著增强了PROTAC和PDT的联合治疗效果。H&E染色显示PPT7 MNL组和SOP MNL组的肿瘤细胞凋亡程度显著高于其他组(图5h),免疫组化(IHC)分析进一步表明PPT7 MNL组显著降低了BRD4蛋白水平(降低4.0倍),并增加了裂解型caspase-3的表达(增加4.3倍)(图5i, j, l, m),这一结果通过Western blot进一步验证(图5o)。此外,SOP MNL组相比PPT7 MNL组进一步降低了BRD4水平(降低2.8倍),并增加了裂解型caspase-3的表达(图5i, j, l, m),表明BM NPs通过缓解缺氧显著增强了PDT效果,并促进了ARV771的释放以降解BRD4。缺氧诱导因子α(HIF-α)在PP + BM MNL组和SOP MNL组中显著降低(降低3.1倍和3.0倍)(图5k, n),这一结果通过Western blot进一步确认(图5p)。实验期间,小鼠体重无显著变化(图5g),且主要器官未观察到明显的组织病理学损伤,表明SOP MN在体内具有良好的生物安全性。
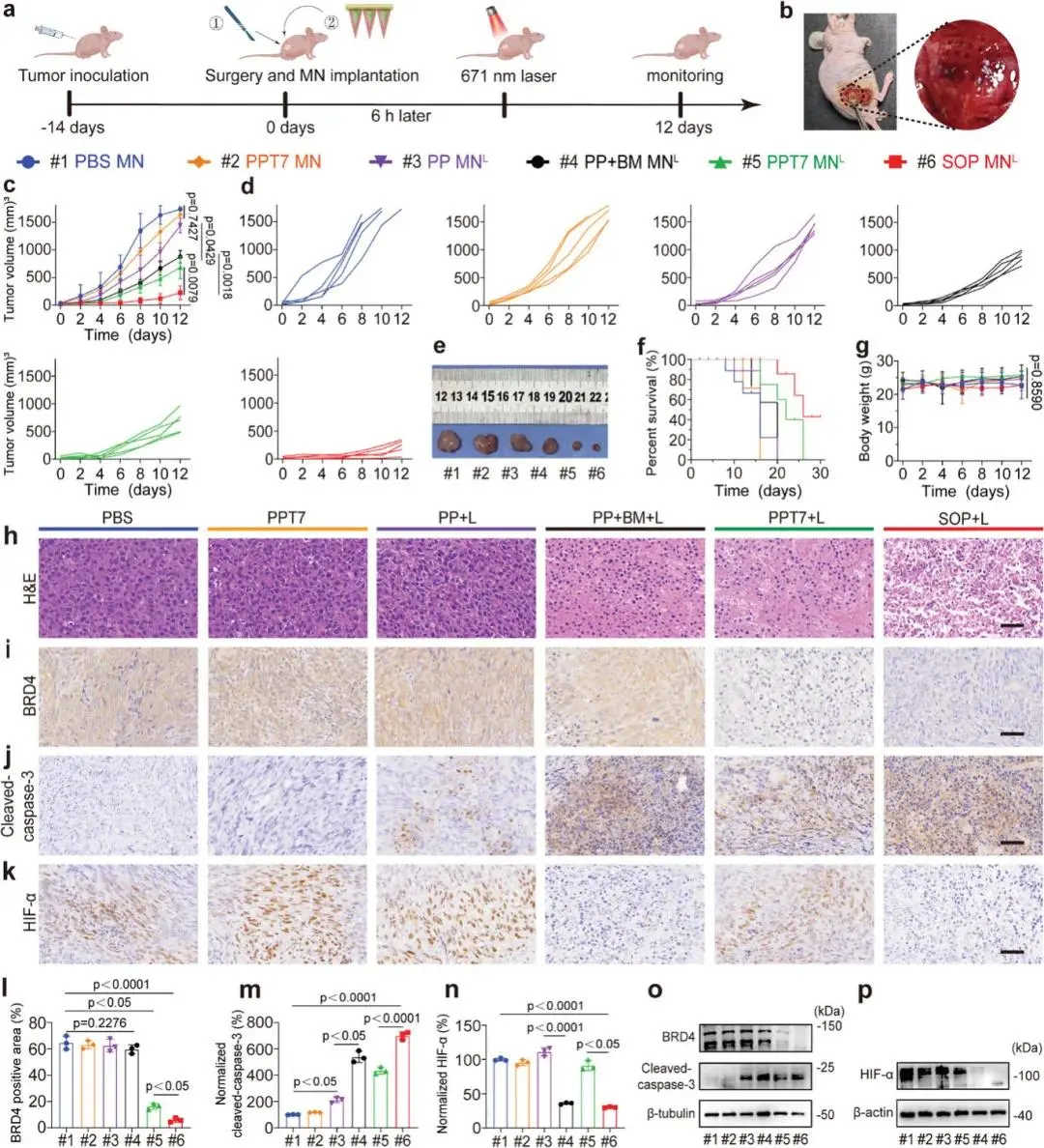
图5 自氧合PROTAC微针在体内消退皮下胶质母细胞瘤。(a)治疗方案;(b)SOP MN治疗肿瘤的手术植入示意图;(c)不同治疗组的U87-MG肿瘤的个体肿瘤生长曲线和(d)相对生长曲线,(c)的统计分析采用双侧非配对t检验;(e)在接受不同治疗后第12天从小鼠身上解剖的U87-MG肿瘤照片;(f)实验期间荷瘤小鼠的生存曲线和(g)体重变化,(g)的统计分析采用单因素方差分析和Brown-Forsythe检验;(h)治疗后12天对肿瘤切片进行H&E染色;IHC分析肿瘤组织中的(i)BRD4、(j)cleaved-caspase-3和(k)HIF-α表达;IHC半定量分析肿瘤切片中的(l)BRD4、(m)cleaved-caspase-3和(n)HIF-α表达,(l-n)的统计分析采用双侧非配对t检验;对肿瘤裂解物中的(o)BRD4、cleaved caspase-3表达和(p)HIF-α进行蛋白质印迹分析
(5)SOP MN在原位GBM模型中的区域限制性释药与抗肿瘤效果
为了进一步验证自供氧型PROTAC微针(SOP MN)的区域限制性药物释放性能和抗肿瘤效果,研究者利用原位胶质母细胞瘤(GBM)小鼠模型进行了实验。在植入U87-MG-Luc细胞后的第五天,小鼠头骨被手术暴露,SOP MN被精准插入肿瘤部位,以实现纳米颗粒在GBM区域的局部释放(图6a, b)。这种方法使PPT7 NPs和BM NPs能够绕过血脑屏障(BBB)。生物发光成像、半定量分析以及脑切片的H&E染色显示,SOP MN联合激光组(SOP MNL)显著减少了肿瘤体积,与PBS MN组相比差异显著(图6c-f),且两只小鼠的GBM肿瘤被完全消除。生存曲线表明,SOP MNL组显著延长了GBM荷瘤小鼠的生存时间(图6g)。机制分析显示,SOP MNL组的肿瘤细胞凋亡比例显著高于PBS MN组(图6j),且Western blot和免疫组化(IHC)分析表明,SOP MNL组在体内将BRD4降低了2.8倍,裂解型caspase-3的表达增加了3.8倍(图6i, k, m, n),表明PDT和BRD4降解通过激活裂解型caspase-3介导的凋亡抑制了肿瘤生长。此外,HIF-α表达量降低了3.7倍(图6l, n),表明BM NPs通过缓解肿瘤缺氧增强了PDT效果并促进了ARV771的释放。实验期间,小鼠体重变化不大(图6h),且SOP MNL组小鼠未表现出显著的行为异常,表明SOP MN具有良好的生物安全性。综上所述,SOP MN实现了纳米颗粒的时空限制性释放,绕过了BBB,并通过精准下调BRD4和上调裂解型caspase-3有效抑制了肿瘤生长,同时BM NPs的参与进一步增强了对原位脑肿瘤的治疗效果。
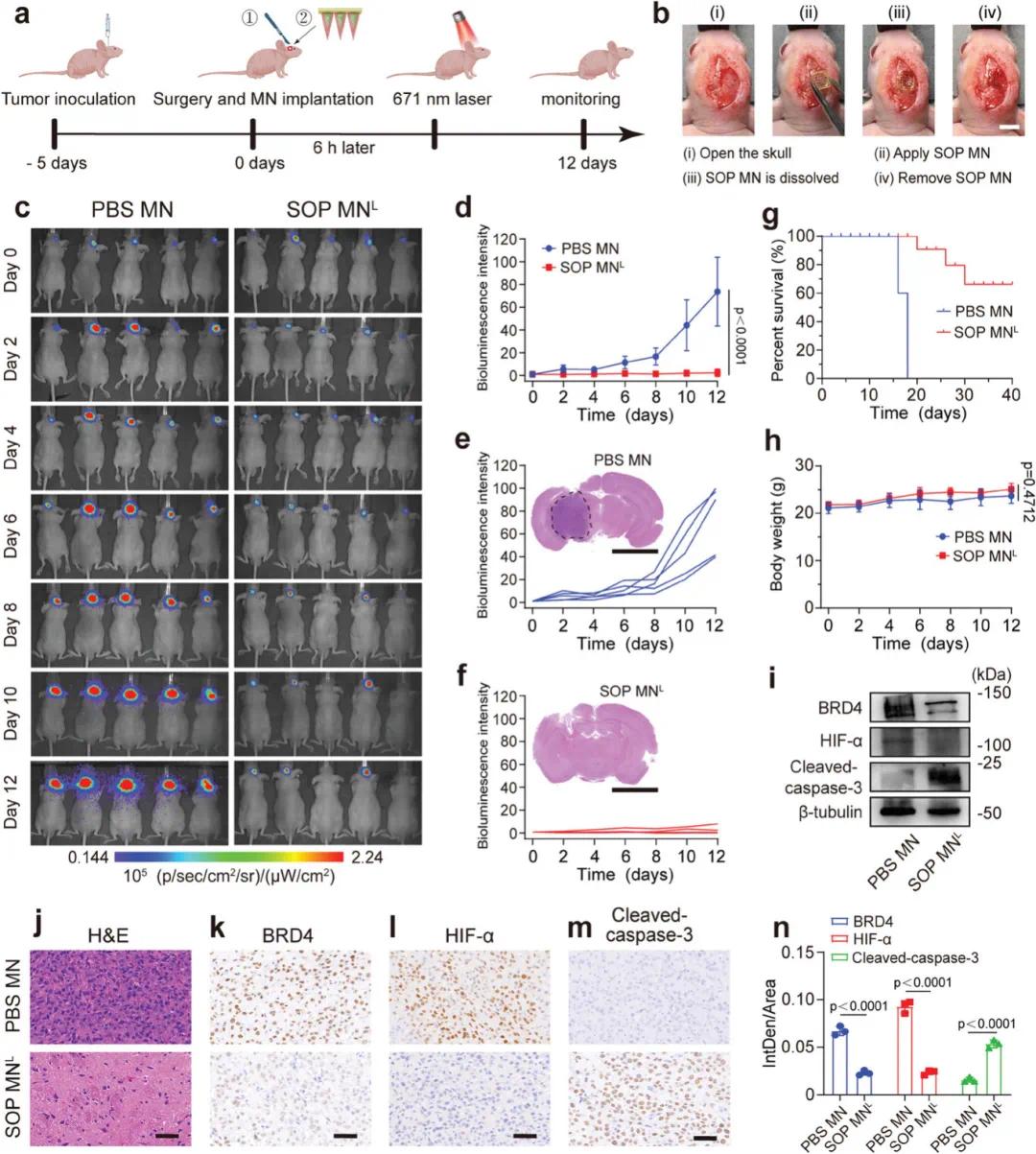
图6 自氧合PROTAC微针有效抑制体内原位胶质母细胞瘤生长。(a)治疗方案;(b)SOP MN手术植入用于原位治疗肿瘤的数码照片,SOP MN被植入肿瘤部位并在5分钟后取出;(c)用PBS和SOP MN L治疗的小鼠的生物发光成像;(d-f)通过体内生物发光成像分析不同治疗组的U87-MG肿瘤模型中荧光素酶活性的总通量量化,(d)的统计分析通过双侧非配对t检验进行;(g)生存曲线和(h)实验期间荷瘤小鼠的体重变化,(h)的统计分析采用双侧非配对t检验;(i)肿瘤裂解物中BRD4、HIF-α和活化caspase-3表达的Western blot分析;(j)治疗后12天的肿瘤切片的H&E染色;(k)BRD4、(l)HIF-α和(m)cleaved-caspase-3在肿瘤组织中的表达的IHC分析;(n)IHC肿瘤切片中BRD4、HIF-α和cleaved-caspase-3表达的半定量分析,(n)的统计分析采用双侧非配对t检验
为解决血脑屏障(BBB)、肿瘤缺氧及PROTAC在正常组织中的非特异性蛋白降解等问题,研究人员开发了一种自供氧型PROTAC微针(SOP MN)。该微针结合时空可控的BRD4降解和光动力治疗(PDT),用于突破BBB并增强胶质母细胞瘤(GBM)的治疗效果。
SOP MN采用双层设计:外层快速释放PPT7 NPs以实现酸性激活的PDT,内层持续释放BM NPs以缓解肿瘤缺氧并增强治疗效果。通过激光照射,SOP MN实现了精准的时空控制,减少了系统毒性,同时提高了BRD4降解和PDT的协同抗肿瘤效果。实验表明,SOP MN成功绕过BBB,显著抑制了肿瘤生长,并延长了荷瘤小鼠的生存时间。该微针平台为精准肿瘤治疗提供了新策略,并为突破生理屏障的脑部疾病治疗提供了广阔的应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

