
微针(MNs)作为一种尖锐且微创的药物和传感器递送平台,能够将药物和传感器递送至多种目标组织。微针与先进材料、电子设备以及各种控制系统相结合,在药物递送、生物传感和智能治疗系统中产生了许多应用,其在研究中的使用及其临床转化正在迅速扩展。
微针的类型通常根据针的结构分为实心微针、涂层微针、多孔微针和中空微针。多孔微针包含类似通道的、相互连通的纳米或微米级孔隙,通过毛细作用可以高效地运输液体。然而,所有现有的多孔微针都包含通常在大小和方向上随机分布的孔隙,呈现出非连通或半连通的多孔结构,导致许多死端和封闭区域,从而限制了药物递送的装载效率和液体提取的采样效率。理想的多孔微针微观结构应在大小和方向上可控,以增强毛细力以实现目标运输,这可以从自然界中的各向异性多级多孔结构(如木材木质部)中获得启发。

针对上述问题,香港城市大学徐臣杰教授和香港浸会大学Dr. Ka Loon Allen CHEUNG聚焦于微针(MN)装置的设计优化,特别是微针尖端微观结构的改进。受木材木质部各向异性多孔结构启发,采用单向冷冻铸造技术开发了具有类似结构的各向异性多孔微针(APC-MNs)。通过调节聚合物浓度和冷冻温度,可精确控制孔径大小。这种微针能快速从尖端向基底吸收液体,用于泪液采样,且在干眼症和糖尿病大鼠模型中表现出色。同时,其从基底向尖端的快速吸收特性可实现无需设备的药物加载,包括小分子、脂质纳米颗粒和细胞。在黑色素瘤和胸膜间皮瘤小鼠模型中,通过APC-MNs递送的γδ T细胞展现了显著的抗肿瘤效果,为过继细胞治疗提供了新途径。该文章于2025年03月06日以《Microneedles with an anisotropic porous microstructure facilitate the transdermal delivery of small molecules, lipid nanoparticles, and T cells》为题发表于《Matter》(DOI:10.1016/j.matt.2025.102038)。
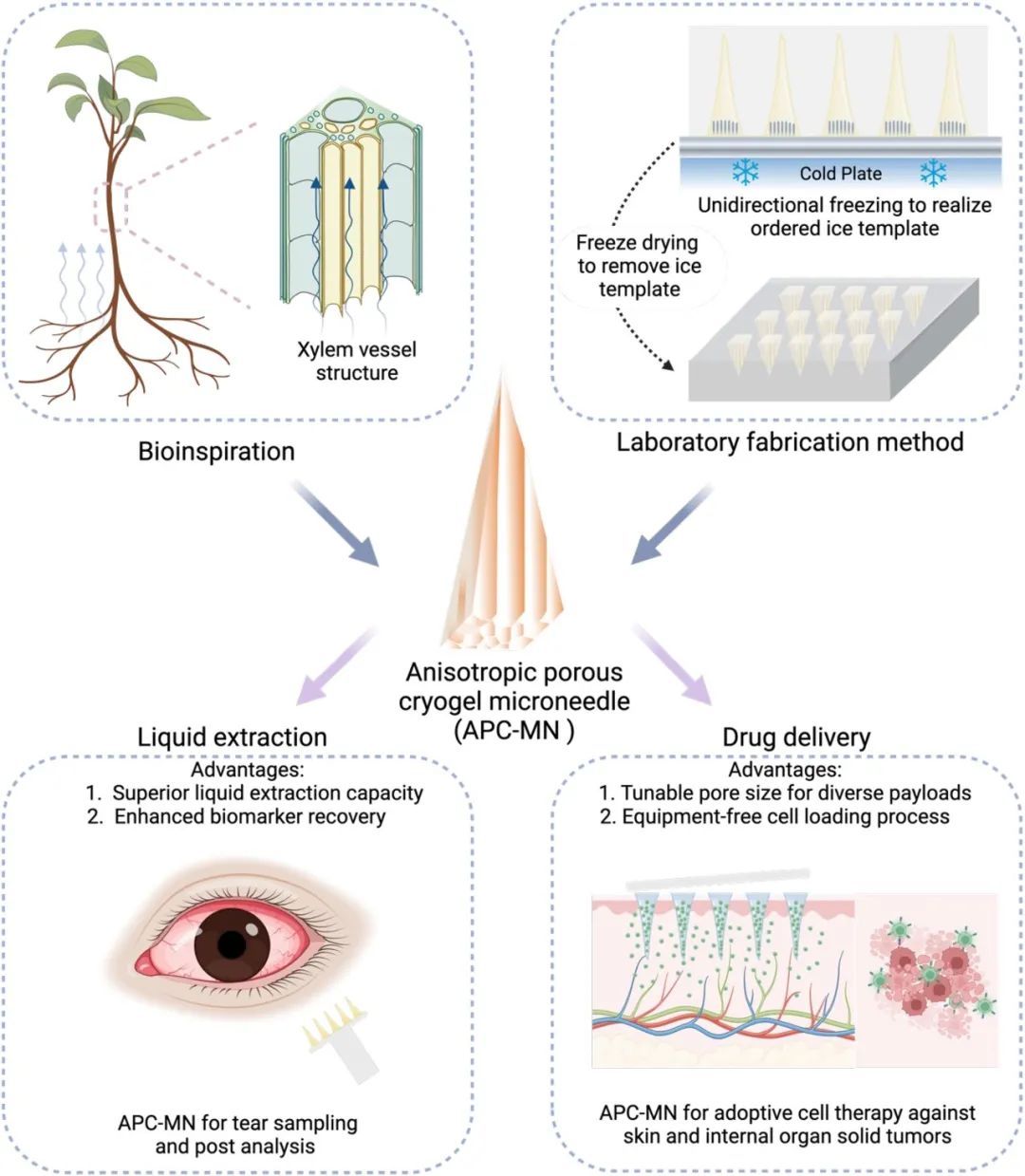
图1 具有各向异性多孔结构的 MN 示意图
(1)APC-MNs的各向异性多孔结构
本研究采用冰模板法制造出类似木材木质部结构的微针,与传统随机孔隙多孔微针不同。研究者在PDMS微针模具中填充预聚物溶液,通过单向冷冻铸造模拟木质部各向异性管道结构(图2A)。具体操作是将模具铝箔覆盖后置于冷却浴平台,铝箔朝下形成温度梯度,使冰晶定向生长(图2B)。后续经过冷冻凝胶化、冰晶融化和冷冻干燥,制成APC-MNs。同时,还制造了IPC-MNs、LH-MNs和SH-MNs作为对照。
通过SEM和冷冻切片成像观察微针内部结构。APC-MNs和IPC-MNs因先冷冻,冰晶生长较大,形成相互连通的多孔结构(图2C);而LH-MNs因交联在冷冻前进行,冰晶生长受限,孔隙相对孤立。APC-MNs尖端横截面具有均匀多孔结构,而SH-MNs尖端实心(图2D)。APC-MNs纵截面光学图像显示均匀垂直对齐通道,SEM图像也证实其独特的各向异性多孔结构,且与IPC-MNs相比,对齐通道更清晰,表明冰晶在尖端孔洞中垂直生长。这主要是因为PDMS模具和聚合物前驱体的热导率相似。然而,当微针模具的热导率低于或高于聚合物前驱体时,冰晶会分别向尖端壁或尖端中心生长。

图2 APC-MN、IPC-MN、LH-MN 和 SH-MN 的结构特征。(A)木材(凤凰木)图像和代表性 SEM 图像,显示木材木质部组织的结构;(B)APC-MN 制造过程中温度梯度下冰晶生长的图示;(C)代表性 SEM 图像,展示 APC-MN、IPC-MN、LH-MN 和 SH-MN 的横截面视图;(D)APC-MN 的纵向和横向视图;(E)代表性荧光图像显示 Cy3 染色的 APC-MN、IPC-MN 和 LH-MN 的纵向视图
(2)APC-MN 孔径的调节
本研究采用冰模板法制造出类似木材木质部结构的微针,通过调节聚合物浓度和冷冻温度来控制孔径大小。实验中使用了不同浓度的聚合物(2.5 wt%、5 wt% 和 7.5 wt%)和不同的冷冻温度(-196°C、-80°C和-20°C),发现孔径随着聚合物浓度的增加而减小,随着冷冻温度的降低而减小。当液体从尖端向基底被吸收时,APC-MNs可以作为生物流体采样工具,其中APC7.5-MNs在液体提取方面表现最佳(图3A、3B、3C)。当液体从基底向尖端被吸收时,这些微针可用于药物加载和递送,且在-20°C下制备的APC-MNs更适合用于治疗剂的递送(图3D、3E、3F)。为了增强APC-MNs的机械性能,研究者在加载药物溶液后对APC-MNs进行冷冻处理,得到APC-冷冻微针(APC-cryoMNs),其展现出足够的压缩力以穿透皮肤(图3G、3H和图3I)。这些结果表明,APC-MNs在液体吸收方面表现出双向能力,适用于液体提取和药物加载。

图3 APC-MN 的体外表征。(A)示意图显示了 APC-MN 尖端的液体吸收情况;(B)染料 Cy3 溶液流过 APC7.5-MNs、IPC7.5-MNs、LH7.5-MNs 和 SH7.5-MNs,比例尺为 500 μm;(C)APC7.5-MNs、IPC7.5-MNs、LH7.5-MNs 和 SH7.5-MNs 的液体吸收率的量化;(D)示意图显示了药物从背衬中装入 APC-MN;(E)APC5-MN 和 IPC5-MN 尖端细胞渗透的代表性图像,包括 hMSC、3T3 细胞、C2C12 细胞、B16 细胞、DC 和 γδT 细胞,比例尺为 300 μm;(F)量化 APC5-MN 和 IPC5-MN 尖端的细胞穿透深度;(G)APC-cryoMN 制造过程;(H)带有手柄的脱模 APC-cryoMN 的形态;(I)cryoMN(纯低温介质)、APC2.5-cryoMN、APC5-cryoMN、APC7.5-cryoMN 以 0.5 mm/s 的速度进行压缩试验,虚线表示压缩力为 5.8 N,可以穿透皮层;(J)APC5-cryoMN 处理和未处理的猪皮肤的组织学 H&E 染色图像
(3)APC-MN 用于泪液生物标志物的提取和分析
本研究中,研究者验证了APC-MNs在液体提取和药物加载方面的潜力。在液体提取方面,APC5-MNs在液体吸收效率和FITC-葡聚糖回收率之间达到了平衡。研究者从APC5-MNs中提取了包括葡萄糖和干扰素-γ在内的泪液生物标志物,并与泪液试纸、人造纤维拭子和棉拭子的生物标志物回收率进行了比较。结果表明,除了棉拭子外,所有装置回收的葡萄糖量均接近100%(图4A)。在IFN-γ的回收中,只有APC-MNs实现了89.7% ± 13.8%的回收率,而其他工具仍有部分IFN-γ残留(图4B)。为了评估APC5-MNs用于眼部应用的安全性,研究者测试了其机械性能,并选择实心水凝胶微针(SH-MNs)作为对照组。在剪切力测试中,APC5-MNs所需的剪切力显著小于SH-MNs,表明APC5-MNs更柔软(图4C)。当APC5-MNs的上加载表面湿润时,其柔软度进一步增加。在压缩测试中,小于2毫牛(mN)的力就足以使湿润的APC5-MN尖端弯曲(图4D)。在相同的力下,APC5-MNs被按压在离体猪角膜上时,并未对角膜造成物理损伤,与未经处理的角膜相似,而SH-MNs则对角膜层造成了明显的损伤(图4E)。这些数据表明,APC5-MNs在泪液提取过程中对眼睛的风险显著降低。接下来,研究者使用APC5-MNs从干眼症和糖尿病大鼠模型中提取泪液(图4F)。结果显示,在3分钟内,APC5-MNs从大鼠中提取的泪液量比商业泪液试纸更多,且提取相同体积泪液的速度是泪液试纸的两倍(图4G)。此外,从APC5-MNs提取的泪液中检测到的IFN-γ含量高于商业泪液试纸提取的泪液(图4H)。当APC5-MNs用于从正常和糖尿病大鼠中收集泪液时,检测到的葡萄糖水平存在显著差异,糖尿病大鼠泪液中的葡萄糖含量显著高于正常大鼠(图4I)。这些结果表明,APC5-MNs能够比商业泪液试纸提取更多的泪液,并且保留更少的提取生物标志物。
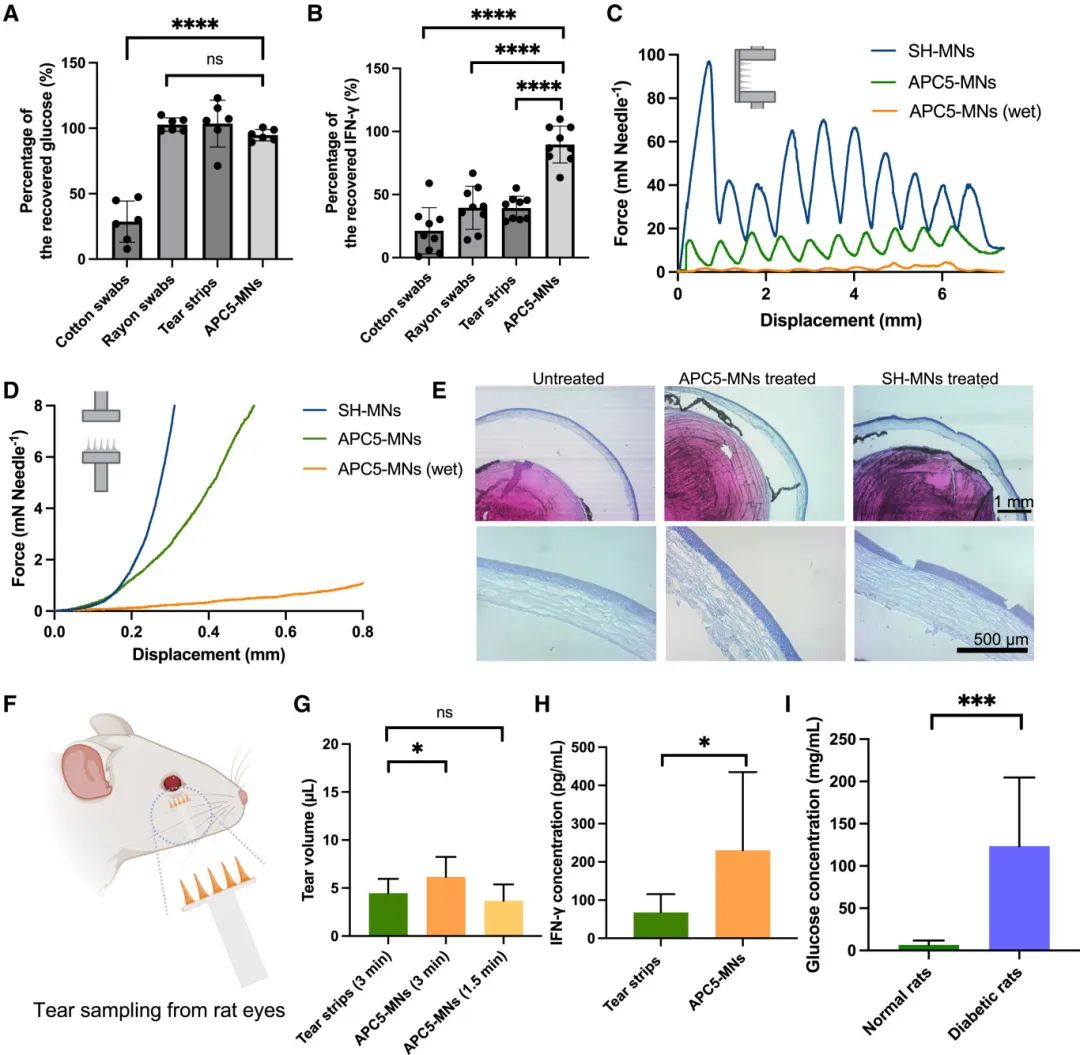
图4 用于泪液提取和后续分析的 APC5-MN。(A)从棉签、人造丝拭子、市售撕条和 APC5-MN 中回收葡萄糖;(B)从棉签、人造丝拭子、市售撕条和 APC5-MN 中回收 IFN-γ;(C)具有湿式称重传感器表面的 SH-MN、APC-MN 的剪切试验;(D)具有湿式称重传感器表面的 SH-MN、APC-MN 的压缩试验;(E)用 APC-MN 和 SH-MN 在每针 0.05 N 的力下处理的小鼠眼的 H&E 染色图像;(F)大鼠泪液采样图;(G)用 APC-MN 和泪条从干眼症大鼠身上提取的泪液量;(H)用 APC-MN 提取的干眼症大鼠泪液和泪条中的 IFN-γ 水平;(I)用 APC-MN 从正常和糖尿病大鼠的眼睛中收集的泪液中的葡萄糖水平
(4)APC-MNs用于γδ T细胞加载
本研究中,研究者探索了在-20°C下制备的APC5-MNs在经皮递送γδ T细胞方面的应用潜力。通过将细胞悬液添加到APC5-MNs的基底上并进行冷冻处理,制备了加载γδ T细胞的APC5-冷冻微针(APC5-cryoMNs)。具体步骤包括将悬浮在冷冻介质中的γδ T细胞添加到APC5-MNs的基底上,冷冻介质配方为含有2.5%(体积比)DMSO和100 mM蔗糖的PBS。细胞悬液被吸收进APC5-MNs的尖端后,在装有APC5-MNs的PDMS模具的基底上额外添加含10 wt%透明质酸(HA)或10 wt%聚乙烯醇(PVA)的PBS溶液,以解决脱模问题(图5A)。经过在-80°C下冷冻24小时并脱模后,得到APC5-cryoMNs。当APC5-cryoMNs被置于PBS中时,微针尖端会立即从微针支架上脱离,其各向异性多孔结构清晰可见(图5B)。经过染色后可以观察到尖端内的γδ T细胞(图5C),这表明在APC5-cryoMNs融化后,γδ T细胞可以保留在尖端内。
研究者使用活/死细胞染色法比较了在两种冷冻配方中保存的γδ T细胞的活性。与传统的含有10% DMSO和90%胎牛血清(FBS)的冷冻配方相比,含有2.5% DMSO和100 mM蔗糖的PBS配方中的细胞活性较低(49.3% ± 0.8%),但这种配方解决了与FBS相关的潜在问题,并确保了冷冻微针的机械强度(图5D和5E)。测试结果显示,从APC5-cryoMNs中回收的细胞活性(48.4%)与在冷冻管中使用相同配方的细胞活性相似,表明APC-MNs对细胞活性没有负面影响(图5F)。此外,在液氮中冷冻保存1个月后,从APC-MNs中解冻的γδ T细胞中仍有98.8% ± 1.1%表达Vδ2 T细胞受体(TCR),与原代细胞相似(图5G)。
含有γδ T细胞的APC5-cryoMNs被储存在液氮(-196°C)中。取出并在室温下放置时,霜会立即形成,冰到水的相变在1分钟内发生。使用热成像记录了从-40°C到40°C的温度变化,发现当放置在支架上或贴在人手指上时,APC5-cryoMNs的尖端温度在短时间内迅速升高。为了尽量减少冰晶对加载细胞造成的损伤,应在温度低于-30°C时(即在29秒内)使用APC5-cryoMNs,这可以最大限度地减少细胞损伤并保持尖端的强度。
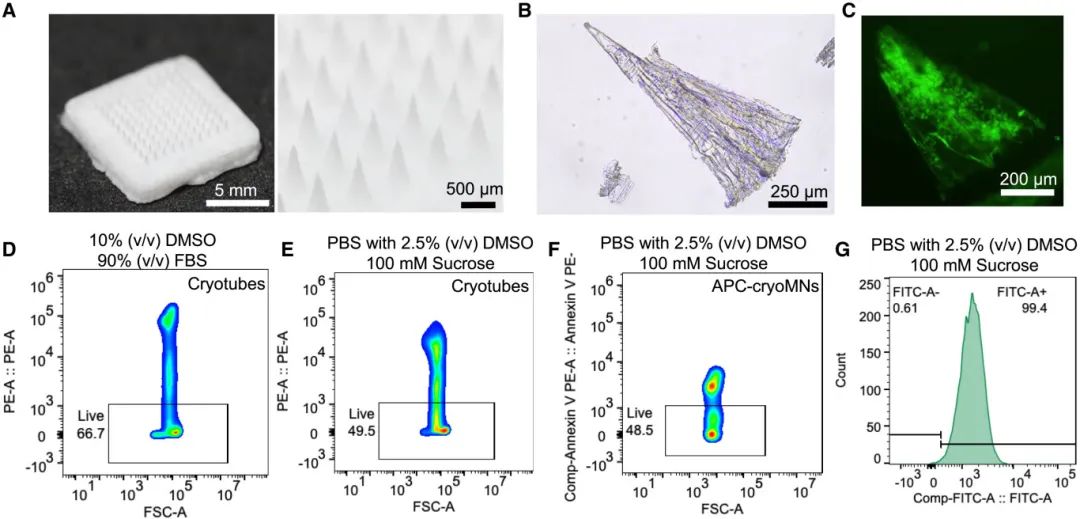
图5 载有γδT 细胞的APC-cryoMN 的表征。(A)APC-cryoMN 的形态,其 MN 尖端由含有 2.5% DMSO + 100 mM 蔗糖的 PBS 组成,其底部由含有 10 wt% PVA 的 PBS 组成;(B)APC-cryoMN 在 PBS 中解冻后呈现各向异性多孔结构;(C)解冻后分离的载细胞 APC-cryoMN 尖端;(D)在含有 10% (v/v) DMSO 和 90% (v/v) FBS 的低温培养基中冷冻保存的 γδT 细胞的活力;(E)在含有 2.5% (v/v) DMSO 和 100 mM 蔗糖的 PBS 的低温培养基中冷冻保存的 γδT 细胞的活力;(F)在 APC-cryoMN 中冷冻保存的 γδT 细胞的活力;(G)在液氮中储存 1 个月后从 APC-cryoMN 中回收的 Vδ2⁺ 细胞的百分比
(5)Vδ2 T细胞从皮肤向胸膜肿瘤的迁移测试
本研究测试了通过APC5-cryoMNs递送Vδ2 T细胞治疗胸膜肿瘤的效果,并与静脉注射进行了对比。在MSTO-luc荷瘤小鼠模型中,研究者在肿瘤注射后的第3天使用加载了Vδ2 T细胞的APC5-cryoMNs进行治疗,并设置PBS静脉注射和Vδ2 T细胞静脉注射作为对照组。结果发现,APC5-cryoMN处理组在皮肤中显示出与Vδ2 TCR信号对应的绿色荧光信号,表明Vδ2 T细胞能够进入皮肤(图6B)。进一步分析显示,在静脉注射组和APC5-cryoMN组中,注射后第1天在脾脏和肺中均检测到CD3⁺Vδ2⁺细胞,但APC5-cryoMN组在肺和肝脏中的CD3⁺Vδ2⁺细胞数量变化趋势与静脉注射组不同,且在肿瘤中,两组的CD3⁺Vδ2⁺细胞数量从第1天到第4天均增加(图6C)。这些结果表明,通过APC5-cryoMNs递送的Vδ2 T细胞能够从皮肤迁移到内脏器官肿瘤。
在治疗效果方面,研究者比较了通过静脉注射和APC5-cryoMNs递送Vδ2 T细胞的疗效。在第3天和/或第6天给予一剂或两剂Vδ2 T细胞后,通过检测肿瘤中荧光素酶活性的成像结果显示,单剂量的Vδ2 T细胞通过静脉注射或APC5-cryoMNs递送后,肿瘤生长分别减少了约16.4%和14.7%(图6D)。两剂Vδ2 T细胞通过静脉注射或APC5-cryoMNs递送后,肿瘤生长分别减少了约58.6%和62%,而PBS对照组未观察到类似的减少。此外,通过APC5-cryoMNs递送Vδ2 T细胞时,小鼠的生存期略有增加(2天)(图6E)。这些结果表明,通过皮肤递送的Vδ2 T细胞能够有效抑制内脏器官肿瘤的生长,且APC5-cryoMNs递送的疗效与全身递送Vδ2 T细胞治疗间皮瘤的效果相似。
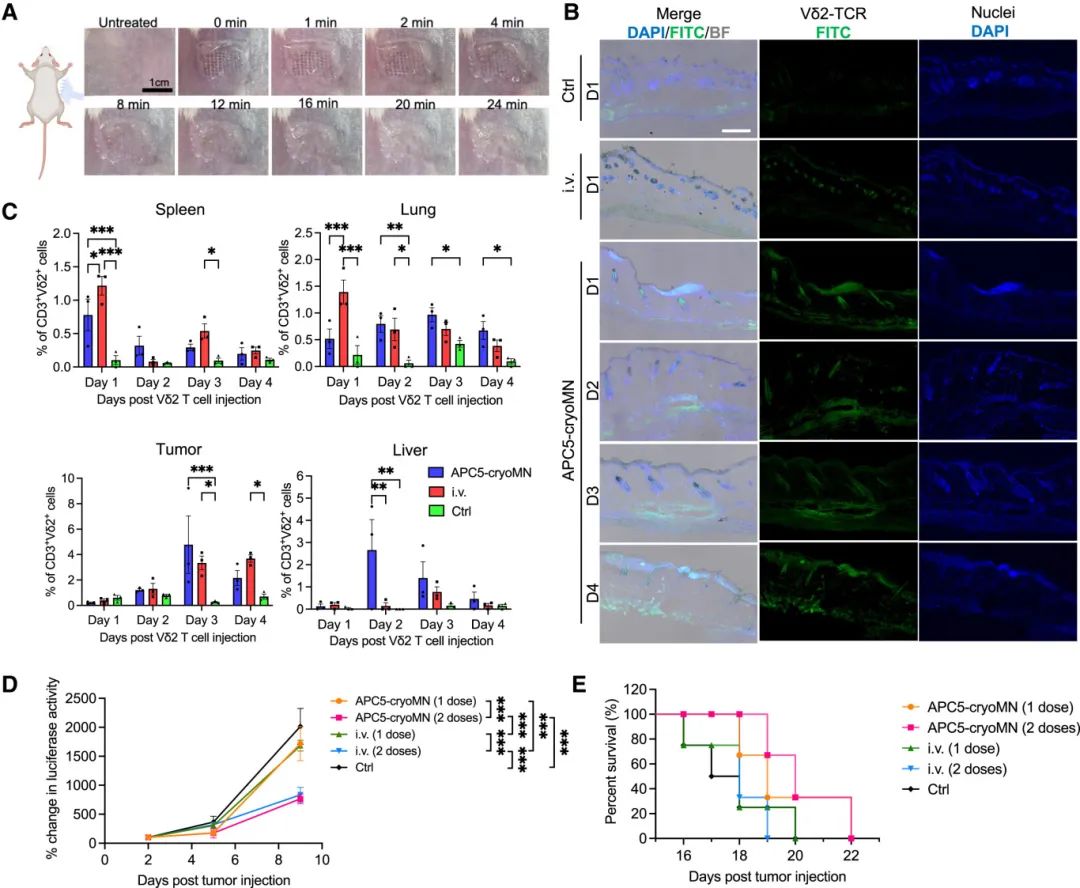
图6 APC5-cryoMN 介导的递送增强间皮瘤小鼠的 γδT 细胞浸润。(A)APC5-cryoMN 应用于小鼠后部皮肤;(B)皮肤中 CD3⁺Vδ2⁺ 细胞的代表性免疫染色图像,比例尺为 200 μm;(C)流式细胞术分析脾脏、肺脏、肿瘤和肝脏中 CD3⁺Vδ2⁺ 细胞的频率;(D)通过比较不同治疗组中随时间推移的荧光素酶活性与 MSTO-luc 肿瘤注射后第 2 天的活性来测量肿瘤生长情况,每组包含 3-4 只小鼠;(E)Kaplan-Meier 图显示不同治疗组 MSTO-luc 小鼠随时间的生存情况
本研究受木材木质部各向异性多孔结构启发,采用单向冷冻铸造技术开发了具有类似结构的各向异性多孔微针(APC-MNs),用于生物流体采样和药物递送。通过调节聚合物浓度和冷冻温度,可精确控制孔径大小,以适应不同药物和生物标志物的运输需求。 APC-MNs能快速从尖端向基底吸收液体,用于泪液采样,且在湿润环境下柔软性增强,避免对眼表造成损伤。利用各向异性多孔结构,实现无需设备的药物加载,包括大分子、脂质纳米颗粒和细胞。加载γδ T细胞的APC5-冷冻微针(APC5-cryoMNs)能从皮肤迁移到内脏器官肿瘤,显示出与静脉注射相当的疗效,为过继细胞治疗提供新途径。本研究为生物流体采样和药物递送提供了高效、微创的新工具,为过继细胞治疗开辟了新途径,具有重要的临床应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

