
背景介绍:
支气管肺发育不良(BPD)是影响早产儿的一种慢性肺部疾病,其特征为肺组织炎症和肺泡及血管发育失调。婴儿期接触高氧环境、机械通气导致的容积伤以及感染等不良因素,可能会对患儿的肺部健康造成长期影响,增加他们成年后发展成慢性阻塞性肺病(COPD)等呼吸系统疾病的风险。
BPD和COPD这两种疾病均表现为肺组织退化、中性粒细胞浸润以及肺功能降低。此外,它们都伴随着肺部微生物组分的变化,特别是硬壁菌门细菌的减少。尽管如此,肺部细菌与疾病发展具体机制之间的联系尚未完全明确。

近期研究提出了一个假设,即BPD小鼠模型中乙酰化脯氨酸-甘氨酸-脯氨酸(Ac-PGP)信号通路和中性粒细胞活性可能增强。通过功能性增强和减弱实验,研究人员发现Ac-PGP在BPD的发展中扮演着关键角色。因此,研究测试了一种基于活性乳酸菌株的吸入式活体生物治疗产品(LBP),在BPD和COPD的体外和体内模型中,这种基于乳酸菌的LBP显示出改善肺结构和功能、减少中性粒细胞浸润以及降低多种促炎标志物的效果。
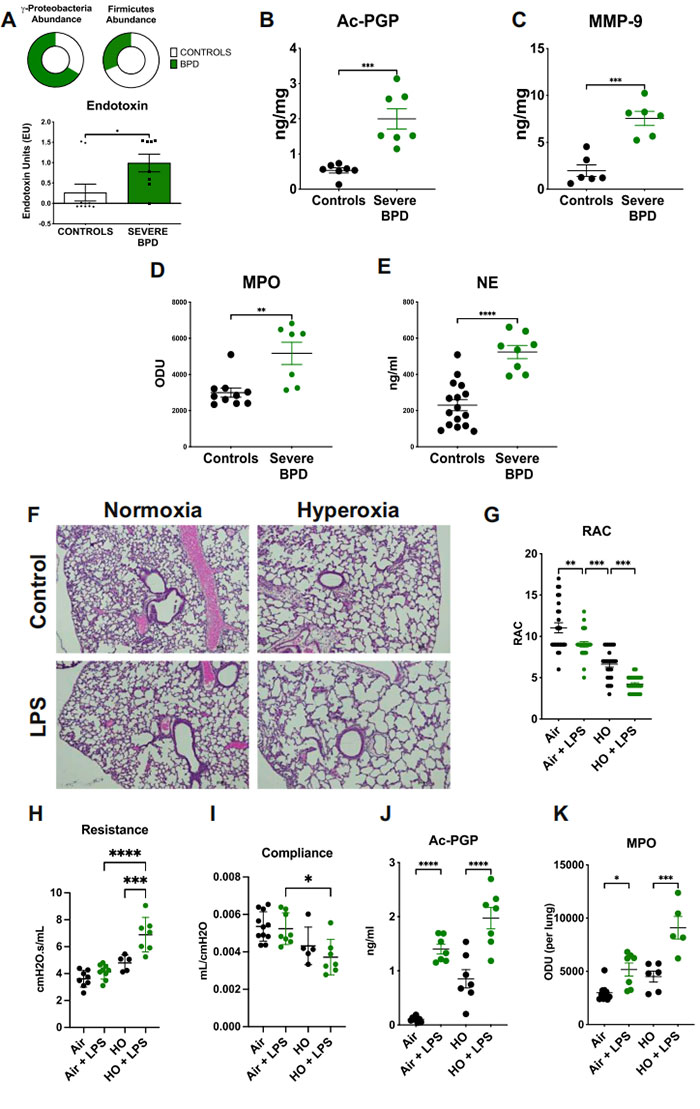
图1 严重的 BPD 以乳酸菌减少、变形菌增加和通过 MMP-9/Ac-PGP 途径介导的中性粒细胞浸润为特征
A 与对照组相比,严重 BPD 婴儿的变形菌增加,硬壁菌减少,并且通过 16s 微生物组测序测量的内毒素水平升高(P = 0.0284)(数据来自参考文献 12)。严重 BPD 婴儿的 B Ac-PGP(P = 0.0003)、C MMP-9(P = 0.0002)、D MPO(P = 0.0023;对照组 N = 10,BPD N = 7 样本)和 E NE 蛋白(P < 0.0001;对照组 N = 16,BPD N = 8 样本)在他们的气管抽吸物中的浓度更高。未配对 t 检验。Ac-PGP 通过串联质谱测量;MMP-9、MPO 和 NE 通过 ELISA 测量。对照组 N = 7,BPD N = 7 样本。小鼠从 PN3 到 PN14 暴露于高氧(HO),在 PN3、6、9 和 12 上给予 LPS,并在 PN14 处死。
F 暴露于 HO + LPS 的小鼠表现出严重的肺泡发育不良和简化。收获的肺组织切片在苏木精和伊红(H&E)染色后以 4 倍放大拍摄。G LPS 小鼠的放射肺泡计数(RAC)减少。N = 24 样本。肺功能恶化,通过 H 气道阻力(增加)(空气 N = 7,空气+LPS N = 8,HO N = 5,HO + LPS N = 7 小鼠)和 I 顺应性(减少)在 HO + LPS 小鼠中测量(空气 N = 10,空气+LPS N = 8,HO N = 5,HO + LPS N = 7 小鼠)。暴露于 LPS 的小鼠在支气管肺泡灌洗液(BAL)中 J Ac-PGP(空气 N = 8,其他组 N = 7 小鼠)和 K MPO 的浓度更高(空气 N = 10,空气 + LPS N = 7,HO N = 6,HO + LPS N = 5 小鼠)。单向 ANOVA,Tukey 的多重比较测试。条代表中位数 ± 四分位数范围。
*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
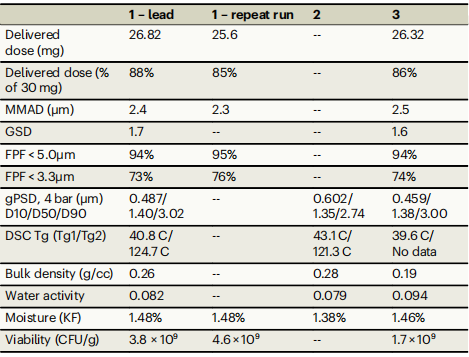
三种喷雾干燥粉末配方的气溶胶和物理特性
- MMAD:中值质量空气动力学直径(Median Mass Aerodynamic Diameter)
- GSD:几何尺寸分布(Geometric Size Distribution)
- FPF:细颗粒分数(Fine Particle Fraction)
- gPSD:几何颗粒尺寸(Geometric Particle Size)
- DSC:差示扫描量热法(Differential Scanning Colorimetry)
- Tg:玻璃化转变温度(Glass Transition Temperature)
- KF:卡尔费休法(Karl Fischer)
- CFU:菌落形成单位(Colony Forming Units)
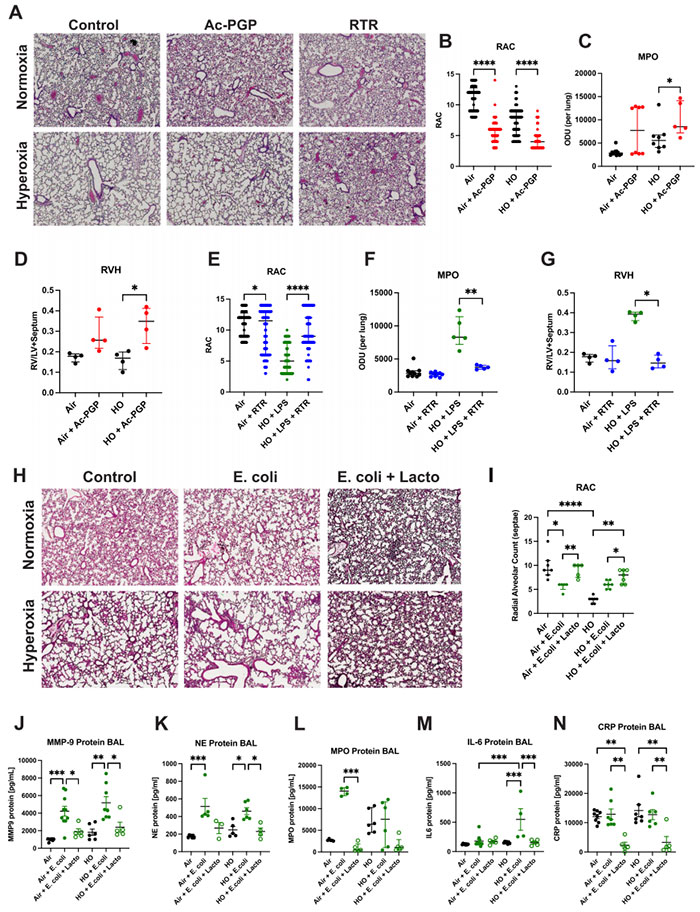
图2 Ac-PGP 驱动组织损伤,乳酸菌 LBP 减少中性粒细胞炎症
Ac-PGP 和 LPS 与高氧 (HO) 结合暴露各自导致了严重的肺泡发育不良和简化。
A 使用 RTR (精氨酸-苏氨酸-精氨酸) 治疗改善了肺泡结构。H&E 染色,4倍放大。
B 给予 Ac-PGP 或 LPS 后 RAC 减少(N = 120 样本)。
C 在 HO 中 Ac-PGP 暴露使 MPO 表达增加(P = 0.0451;空气 N = 11, 空气 + Ac-PGP N = 8, HO N = 8, HO+Ac-PGP N = 5 小鼠)。
D 在 Ac-PGP + HO 小鼠中右心室肥大 (RVH) 增加(P = 0.028;N = 4 小鼠)。
E 给予 RTR 治疗后 RAC 改善。N = 120 样本。
F 在 LPS + HO 暴露后 MPO 表达增加,RTR 治疗后减少(P = 0.0079;空气 N = 10, 空气 + RTR N = 9, HO N = 5, HO + LPS + RTR N = 5 小鼠)。
G 在 LPS + HO 小鼠中使用 RTR 治疗后 RVH 减少(P = 0.0187;N = 4 小鼠)。Mann–Whitney U 检验,Kruskal–Wallis, Dunn’s 多重比较测试。
H 高氧加剧了经鼻内暴露于大肠杆菌的小鼠肺泡简化,而经气管 LBP 治疗改善了 E. coli + HO 小鼠的组织结构。H&E 染色,4倍放大。
I 在 HO + E. coli 暴露后 RAC 减少,LBP 治疗后恢复正常。空气 N = 7, 空气 + E. coli N = 5, 空气 + E. coli + Lacto N = 5, HO 组 N = 5 小鼠各。
J BAL 中 MMP-9, K NE, L MPO, M IL-6, 和 N CRP 在 LBP 治疗后减少。单向 ANOVA, Tukey’s 多重比较测试。空气 N = 7, 空气 + E. coliN = 10, 空气 + E. coli + Lacto N = 5, HO N = 6, HO + E. coli N = 8, HO + E. coli + Lacto N = 5 小鼠。条代表中位数 ± 四分位数范围。*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
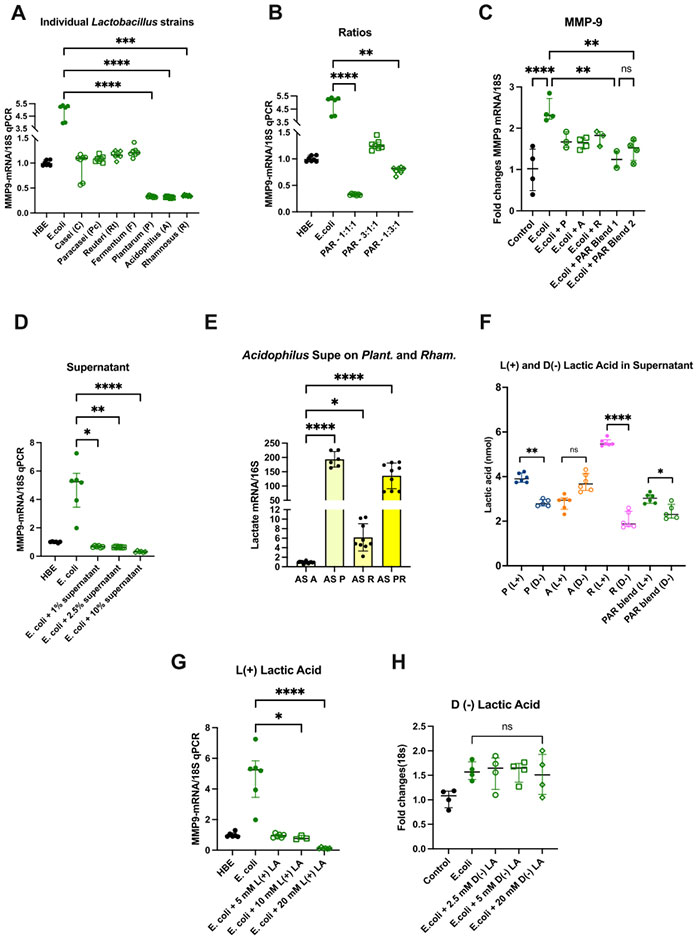
图3 乳酸菌混合物通过 L (+) 乳酸产生减少中性粒细胞炎症
A 单独的菌株 L. plantarum (P)、L. acidophilus (A) 和 L. rhamnosus (R) 比单独的 L. casei、L. paracasei、L. reuteri 和 L. fermentum 菌株以及没有乳酸菌处理的仅 E. coli 暴露相比,更能减少 MMP-9 表达。N = 7。
B 不同比例的混合 P、A 和 R 在不同程度上减少 MMP-9。N = 7 孔。
C 在减少有毒刺激暴露的体外人支气管上皮 (HBE) 模型中,P、A 和 R 的混合物比单独的菌株更有效地减少 MMP-9。N = 4 孔。
D 乳酸菌混合物培养上清液在增加的浓度下减少 MMP-9 表达。N = 6。
E 单独的活性乳酸菌菌株与其他三种混合物菌株的上清液共转染。L. acidophilus 上清液与活的 A、P、R 和 PR 混合物培养,增加了 P 和 PR 混合物的乳酸基因表达(作为代表性示例显示)。AS A N = 13, AS P N = 6, AS R N = 9, AS PR N = 9 孔。
F 乳酸菌菌株单独和作为混合物产生更多的 L (+) 乳酸而不是 D (+) 乳酸。N = 6 孔。
G L (+) 乳酸减少暴露于 E. coli 的 HBE 细胞中的 MMP-9 表达 (N = 6 孔),而 H D (−) 乳酸则不减少 (N = 4 孔)。
Kruskal–Wallis 检验,Dunn’s 多重比较。细胞培养进行三次重复。条代表中位数 ± 四分位数范围。
*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
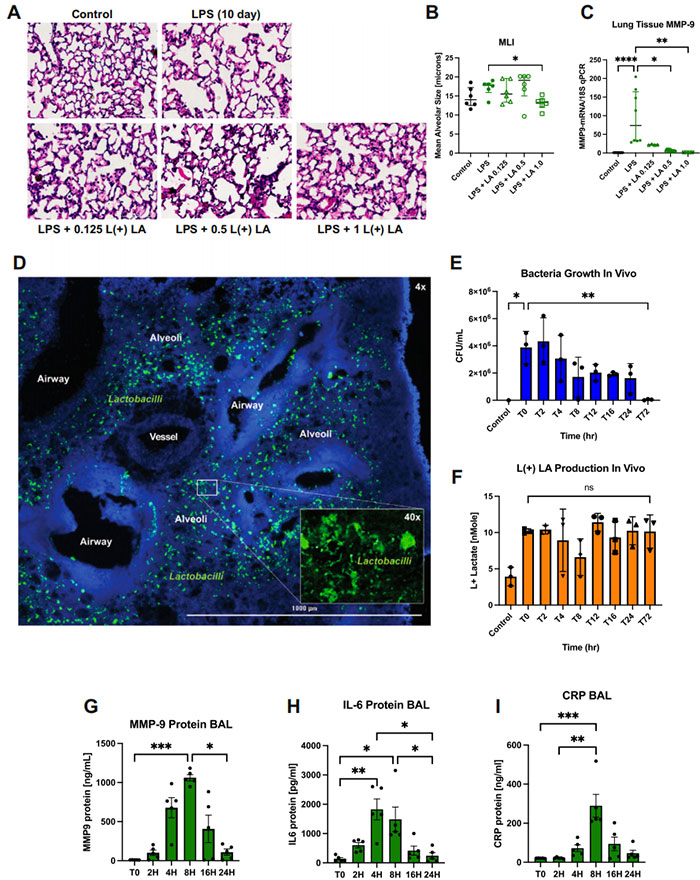
图4 L (+) 乳酸减少 MMP-9 并在体内由乳酸菌产生
通过气管内给药的方式,将 L (+) 乳酸给予经 LPS 处理 10 天的小鼠。
A 肺组织学图像显示 LPS 损伤后的肺泡简化,以及 LA 治疗后的轻微恢复。H&E 染色,4倍放大。
B 给予每只小鼠 1 ug/g 体重的 L (+) LA 治疗后,MLI 减少(P = 0.0152;N = 6 小鼠)。
C 通过气管内给予 L (+) 乳酸治疗后,肺组织 MMP-9 表达减少(对照 N = 10, LPS N = 8, LA 0.125 N = 4, LA 0.5 N = 12, LA 1.0 N = 4 小鼠)。
D 健康小鼠经气管接种乳酸菌 LBP 后 3 小时,乳酸菌(绿色)定位到肺上皮。DAPI 蓝色。4倍放大,插图为 40倍放大。N = 5。
E 健康小鼠经气管接种 LBP 至肺部,通过减少菌落数显示细菌的逐渐清除超过 72 小时。
F 健康小鼠经气管接种 LBP 至肺部,显示 L (+) 乳酸产生增加,并通过 72 小时后剂量持续效果。L(+) LA 通过乳酸比色法测量。每个时间点 N = 3 小鼠。
G–I 炎症生物标志物 MMP-9、CRP 和 IL-6 在 LBP 剂量后 4–8 小时升高,并在 16–24 小时恢复到基线水平。每个时间点 N = 5 小鼠。
Mann–Whitney U 检验和 Kruskal–Wallis, Dunn’s 多重比较。条代表中位数 ± 四分位数范围。
*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
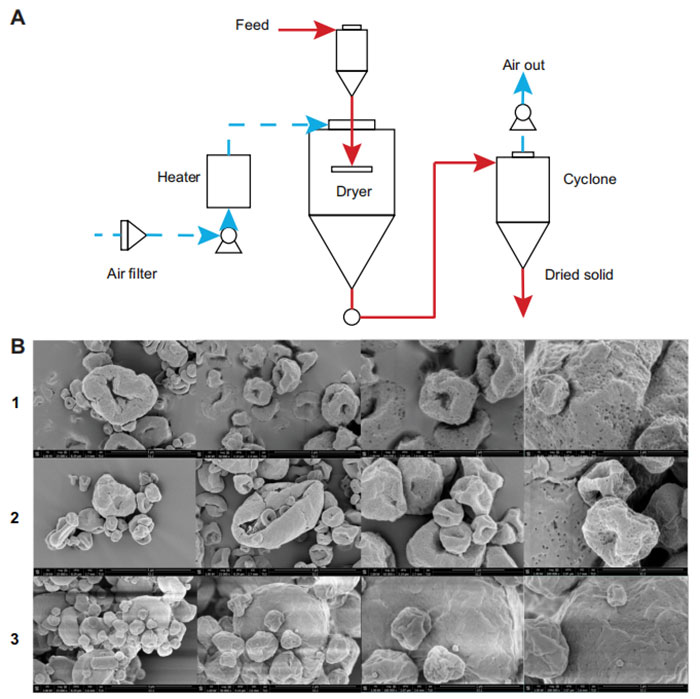
图5 喷雾干燥产生含有活性细菌的小流动性粉末颗粒
A 用于将乳酸菌干燥成小流动性粉末颗粒的喷雾干燥过程的示意图。
B 干燥后三种配方粉末颗粒的扫描电子显微镜 (SEM) 图像。从每个样品中获取了 25,000、50,000 和 100,000 倍放大的图像(从左到右)。
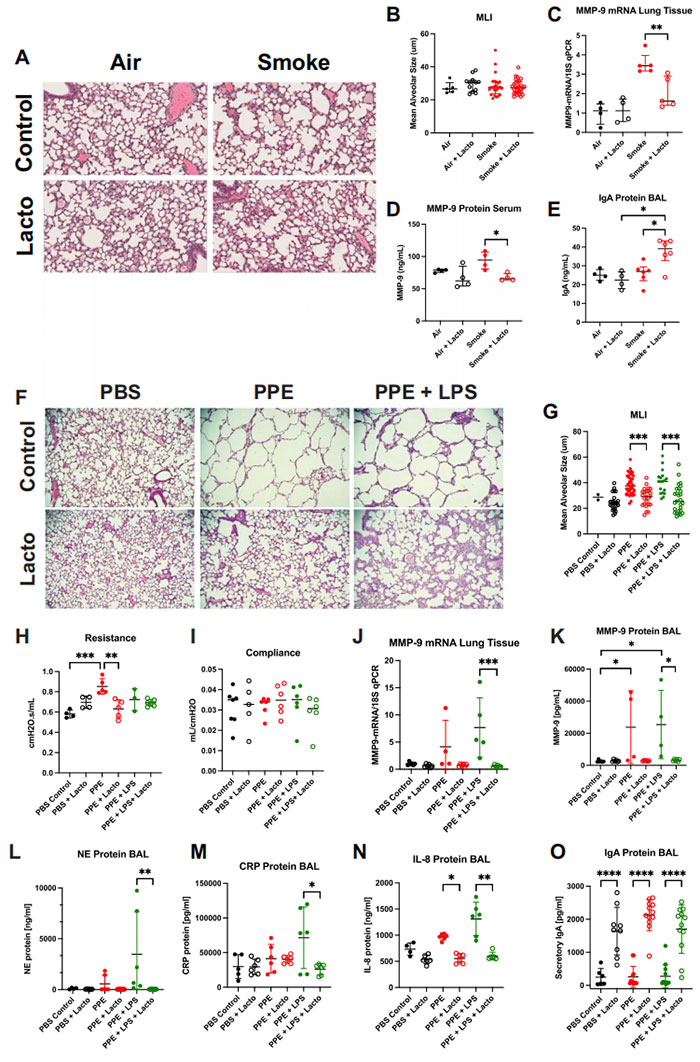
图6 基于乳酸菌的活体生物治疗产品 (LBP) 改善慢性阻塞性肺病 (COPD) 小鼠模型中的炎症生物标志物及肺结构和功能
小鼠暴露于香烟烟雾中1个月,并经气管内给予乳酸菌 LBP (Lacto) 治疗。
A 肺组织学图像(H&E 染色,40倍放大)通过 (B) 平均线性截距 (MLI) 测量,显示1个月烟雾暴露后肺泡结构没有显著恶化。测量值:空气 N = 5, 空气 + Lacto N = 11, 烟雾 N = 23, 烟雾 + Lacto N = 27 样本。暴露于烟雾并接受 Lacto 治疗的小鼠在 (C) 肺组织 MMP-9 表达 (空气 N = 4, 烟雾 N = 5 小鼠),D 血清 MMP-9 蛋白水平 (空气 N = 4, 烟雾 N = 5 小鼠),以及 E 支气管肺泡灌洗液 (BAL) IgA 蛋白水平 (空气 N = 4, 烟雾 N = 6 小鼠) 方面显示出改善。小鼠暴露于经气管内给予的猪胰弹性蛋白酶 (PPE) 和 LPS,导致显著的肺泡发育不良和简化。
F 肺组织学图像(H&E 染色,4倍放大)显示,在损伤期间吸入 Lacto LBP 减少了组织损伤。G 在 PPE 和 PPE + LPS 暴露组中,给予 Lacto LBP 治疗后 MLI 得到改善。
H 肺功能通过增加的阻力测量,在暴露于 PPE 后恶化,在接受 Lacto LBP 治疗后改善。
I 通过顺应性测量的肺功能在各组之间没有显著变化。
J 肺组织中 MMP-9 表达在 PPE + LPS 暴露后增加,在接受 Lacto LBP 治疗后减少。
K 在 PPE 和 PPE + LPS 暴露后 BAL 中的 MMP-9 蛋白增加,在接受 PPE + LPS 小鼠的 Lacto LBP 治疗后减少。
L 在 PPE + LPS 小鼠中,Lacto LBP 治疗后 BAL 中的 NE 蛋白减少。
M 在 PPE + LPS 暴露后 BAL 中的 CRP 蛋白增加,在接受 Lacto LBP 治疗后减少。
N 在 PPE 和 PPE + LPS 小鼠中,Lacto LBP 治疗后 BAL 中的 IL-8 蛋白减少。
O 在对照、PPE 和 PPE + LPS 小鼠中,Lacto LBP 治疗后 BAL 中的 IgA 蛋白增加(改善)。N = 12 小鼠(6 雄/6 雌)。
Kruskal–Wallis 检验,Dunn’s 多重比较。条代表中位数 ± 四分位数范围。
*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
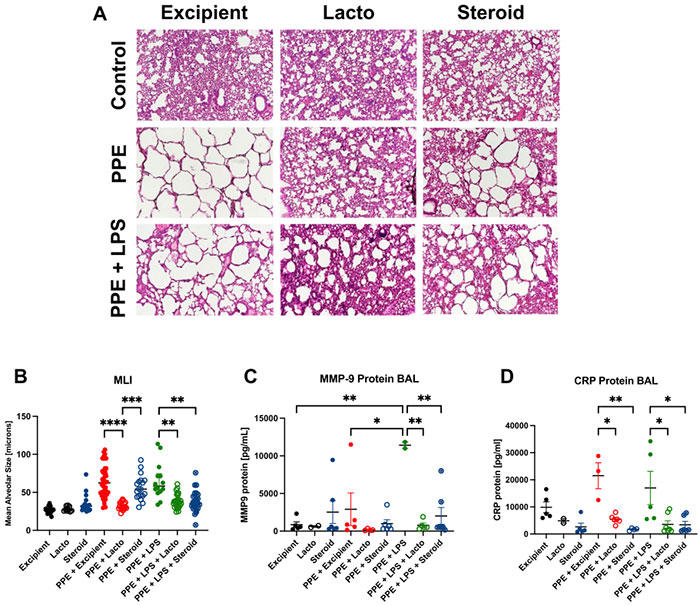
图7 小鼠通过气管内给予 PPE 和 LPS 来建立肺气肿和细菌驱动的炎症
A 肺组织学图像(H&E 染色,4倍放大)显示,在损伤建立后2周给予 Lacto LBP 治疗,减少了炎症并改善了组织结构。损伤后给予类固醇治疗减少了炎症。
B PPE 和 PPE + LPS 暴露均增加了平均肺泡大小,而 Lacto LBP 治疗显著减少了(改善了)它。类固醇氟替卡松(FF)也显著减少了 MLI,但在 PPE 组中不如 Lacto LBP 显著。测量值:辅料 N = 16, Lacto N = 8, 类固醇 N = 18, PPE + 辅料 N = 44, PPE + Lacto N = 18, PPE + 类固醇 N = 18, PPE + LPS N = 13, PPE + LPS + Lacto N = 24, PPE + LPS + 类固醇 N = 23 样本。
C 在减少暴露于 PPE + LPS 的小鼠 BAL 中的 MMP-9 蛋白方面,Lacto LBP 的效果优于类固醇。
D 在减少暴露于 PPE 和 PPE + LPS 的小鼠 BAL 中的 CRP 蛋白方面,Lacto LBP 的效果与类固醇相当。辅料 N = 5, Lacto N = 2, 类固醇 N = 3, PPE + 辅料 N = 3, PPE + Lacto N = 6, PPE + 类固醇 N = 4, PPE + LPS N = 5, PPE + LPS + Lacto N = 7, PPE + LPS + 类固醇 N = 6 小鼠。Kruskal–Wallis 检验,Dunn’s 多重比较。条代表中位数 ± 四分位数范围。*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
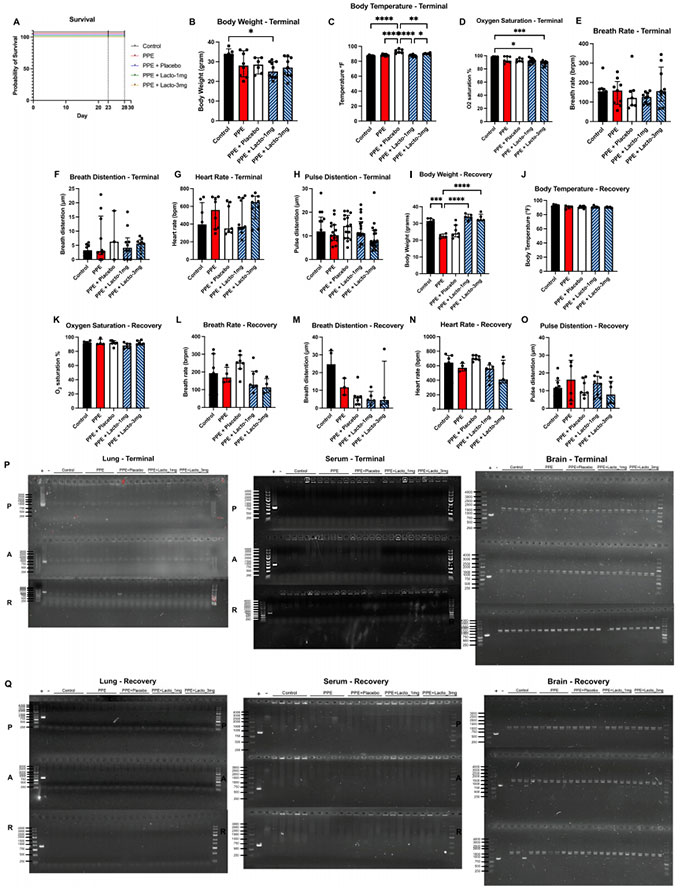
图8 吸入式基于乳酸菌的活体生物治疗产品 (LBP) 在 PPE 小鼠模型中显示出良好的安全性和生物分布特性
A 在生物分布研究中,所有小鼠在第 23 天(终点牺牲)和第 28 天(恢复牺牲)均存活。为了可见性,生存曲线进行了偏移。
在 B–H 终点牺牲小鼠和 I–O 恢复牺牲小鼠中,体重、体温、血氧饱和度、呼吸频率、呼吸膨胀、心率和脉搏膨胀在 LBP 给药 2 周后仍保持在正常范围内。
P 来自 PCR 的代表性凝胶显示终点牺牲组织肺、血清和大脑中没有 LBP 乳酸菌株的存在。
Q 来自 PCR 的代表性凝胶显示恢复牺牲组织肺、血清和大脑中没有 LBP 乳酸菌株的存在。PBS 和 PPE 对照每组 N = 10;PPE + 安慰剂,LBP 1 mg,LBP 3 mg 每组 N = 15 小鼠。Kruskal–Wallis 检验,Dunn’s 多重比较。条代表中位数 ± 四分位数范围。*P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001。
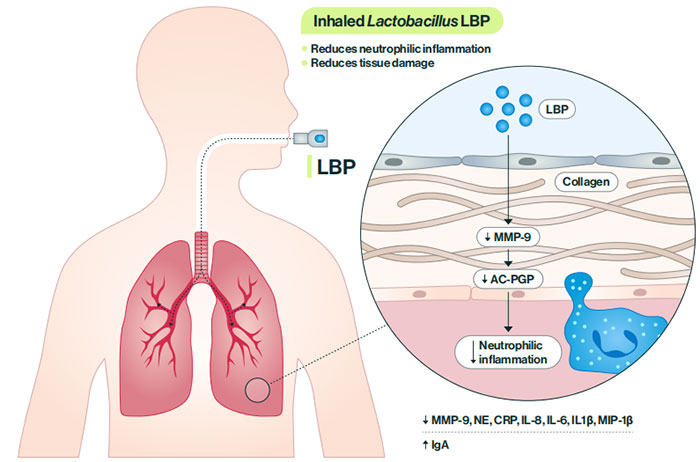
图9 吸入式乳酸菌 LBP 工作原理的示意图
粒子工程创新促进了乳酸菌 LBP 直接进入肺部,帮助减少炎症和恢复肺组织。吸入的 LBP 释放抗炎代谢物,减少 MMP-9 和 Ac-PGP 表达以及下游的中性粒细胞炎症。其他炎症生物标志物减少,保护性 IgA 增加。
原文链接:https://doi.org/10.1038/s41467-024-51169-0
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

