
树突状细胞(DCs)在启动和协调针对癌症的适应性免疫反应中起着关键作用,但其功能通常受限于抗原递送。为了实现有效的抗原递送和疫苗接种,疫苗需要首先积聚在淋巴结(LNs)中,在那里进行抗原呈递和免疫反应,随后被DCs摄取以处理抗原并刺激抗肿瘤免疫反应。因此,近年来的研究重点在于开发增强抗原递送至淋巴结和DCs的纳米疫苗,以诱发强大的免疫反应。尽管DCs靶向策略被认为是理想的,但并非所有DCs都表达靶标受体,且DCs上这些受体的表达存在异质性,从而降低了抗原递送的有效性,并可能引发免疫相关的不良事件。因此,需要识别可靠的DC受体并开发创新的疫苗接种策略,以改善免疫效果。

针对上述问题,四川大学华西医院米鹏教授团队从树突状细胞(DCs)的代谢问题上寻找突破口,结合糖酵解对DCs的生存和免疫功能的重要性,以及Glut-1作为葡萄糖转运蛋白,可以上调DC激活过程,是抗原递送和免疫治疗的潜在靶点,成功开发了一种用于靶向树突状细胞(DCs)葡萄糖基化纳米疫苗(GluOVANPs和GluNeoNVs),以提高抗原递送和增强免疫反应。GluOVANPs通过靶向DCs递送卵清蛋白,显著提高了对B16黑色素瘤的免疫应答和记忆T细胞反应,而GluNeoNVs则通过递送新抗原,诱发了对MC38结肠肿瘤的特异性免疫反应。研究结果表明,Glut-1是一个有效的靶点,靶向该分子的纳米疫苗能够显著增强癌症免疫治疗的效果。该文章于2024年8月30日以《Glucosylated Nanovaccines for Dendritic Cell-Targeted Antigen Delivery and Amplified Cancer Immunotherapy》为题发表于《ACS Nano》(DOI:10.1021/acsnano.4c0905)。
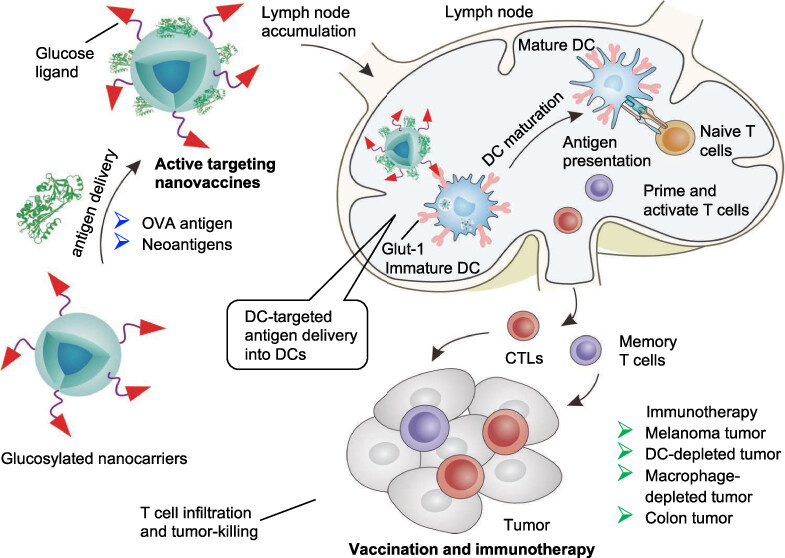
图1. 糖基化纳米疫苗DC靶向抗原递送精准肿瘤免疫治疗方案示意图:针对DC上Glut-1的糖基化纳米疫苗可以递送常规抗原和肿瘤特异性新抗原,从而触发DC成熟,并刺激强大的适应性免疫反应和记忆T细胞,用于癌症免疫治疗。
(1) Glut-1在人和动物DC细胞上表达
研究表明,Glut-1在健康供体和动物的树突状细胞(DCs)上高表达,并且在DC激活过程中表达水平上调(图2b-d)。通过共聚焦激光扫描显微镜(CLSM)、Western blot(WB)和流式细胞术分析,确认了Glut-1在DCs上的高表达,并且其在DC暴露于不同刺激因子(如TNF-α、IL-6、LPS)时的表达显著增加。与流式细胞术检测的巨噬细胞、单核细胞、中性粒细胞、B细胞和T细胞等腹股沟LNs的其他免疫细胞相比,Glut-1 (Glut-1/Control)在dc上的相对表达量最高(图2e),这表明Glut-1是一个有效的DC靶向标记物,为高特异性抗原递送提供了有力的支持。Glut-1的上调也提示通过多次接种疫苗可能增强免疫反应。
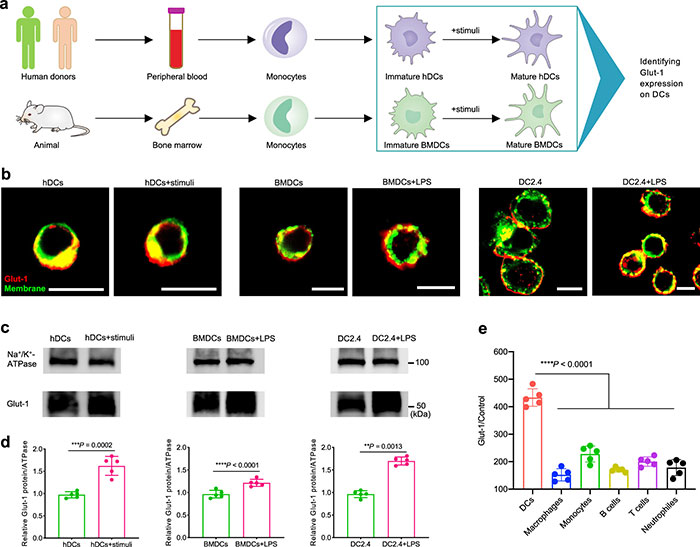
图2. Glut-1在人和动物DC上的表达。(a)从人类供体和动物中获得用于Glut-1鉴定的未成熟和成熟hdl-c和bmdc的方法;(b−d)代表性的CLSM图像(b)和WB分析(c, d)显示,在有/没有刺激的情况下,hDCs、BMDCs和DC2.4细胞上稳定表达Glut-1;(e)有代表性的流式细胞术结果显示,与LNs中其他免疫细胞相比,Glut-1在DC上的相对表达量最高。
(2) GluOVANPs靶向DC递送抗原并触发DC激活
为了在树突状细胞(DCs)上靶向Glut-1进行抗原递送,该研究使用卵清蛋白(OVA)作为常规抗原,通过生物矿化方法制备了糖基化卵清蛋白纳米疫苗(GluOVANPs),作为活性靶向疫苗,与不含葡萄糖配体的OVA负载纳米疫苗(OVANPs)进行了对比(图3a)。GluOVANPs由用于磁共振成像(MRI)的纳米晶氧化钆(Gd2O3)核和用于激活DCs的OVA抗原壳组成。动态光散射(DLS)和透射电镜(TEM)测量结果显示(图3b-c),OVANPs和GluOVANPs均为单分散球形,直径分别为21 nm和28 nm。这些纳米疫苗的直径小于100 nm,具备亲水性和负电荷特性,有助于其在大量淋巴结(LNs)中迁移并定位于树突状细胞,从而促进免疫反应。其他表征结果证明了纳米疫苗的合成以及良好的生物相容性。在被细胞摄取能力检测中,GluOVANPs被摄取量是OVANPs的7倍(图3d-e)。使用Glut-1抑制剂根皮素阻断BMDCs上的Glut-1,结果表明GluOVANPs的摄取量显著下降,与阻断组相当(图3f)。此外,与OVANPs和OVA相比,GluOVANPs表现出更大的内体逃逸(图3g),表明糖基化改进了OVA抗原的细胞内递送。这种增强的细胞内递送有助于提高抗原对CD8+ T细胞的递呈,从而刺激更强的免疫反应。结果如图3h-i所示,不同处理后,GluOVANPs诱导的BMDCs和DC2.4细胞成熟率和细胞表面SIINFEKL肽量显著高于OVA和OVANPs,显示出更有效的抗原交叉呈递。同时,GluOVANPs促进了BMDCs和DC2.4细胞中促炎细胞因子TNF-α和IL-12p70的分泌,这证实了GluOVANPs可以触发强烈的DC激活,显著改善抗原递送和免疫应答,增强免疫治疗。
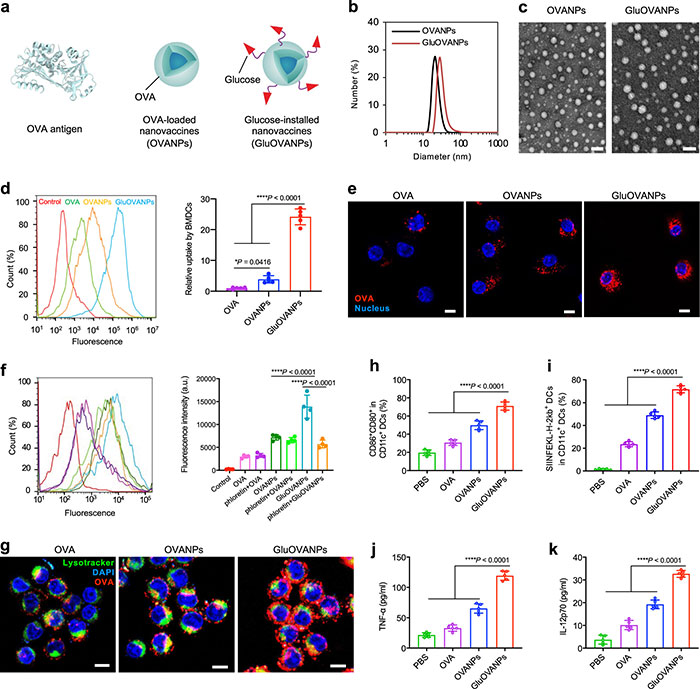
图3. 用于体外DC靶向抗原递送的GluOVANPs纳米疫苗的制备。(a)示意图显示OVA抗原、OVANPs和GluOVANPs,葡萄糖(红色三角形)被偶联到OVA壳上;(b)DLS图显示OVANPs和GluOVANPs是单分散的;(c)OVANPs和GluOVANPs的TEM图像,比例尺为100 nm;(d)通过流式细胞术测量暴露于Cy5标记的OVA、OVANPs或GluOVANPs后24小时BMDCs对疫苗的相对细胞摄取;(e)BMDCs摄取Cy5标记的OVA、OVANPs和GluOVANPs的代表性CLSM图像(红色:OVA;蓝色:核);(f)代表性流式细胞术结果显示,经根皮素阻断或不阻断Glut-1处理的BMDCs对疫苗的细胞摄取(30分钟),然后暴露于Cy5标记的OVA、OVANPs或GluOVANPs 6小时;(g)Cy5标记的疫苗胞浆递送至DC的代表性CLSM图像;(h−k)PBS、OVA、OVANPs和GluOVANPs处理的BMDCs体外DC成熟(h)和OVA抗原交叉呈递效果(i),以及TNF-α(j)和IL-12p70(k)的分泌
(3)GluOVANPs的体内LN积累
纳米疫苗通过将抗原递送到树突状细胞(DC),并在引流淋巴结(LNs)中触发CD8+ T细胞反应,以实现有效接种。接种OVANPs和GluOVANPs的小鼠腹股沟LNs的对比度增强,表明疫苗在LNs中的迁移(图4a-b)。同时,GluOVANPs的迁移量明显高于其他处理组(图4c-g)。免疫荧光成像显示,从GluOVANPs组和OVANPs组切除的LNs更大且含有更多的DC,较OVA组更多。另外,GluOVANPs能深入渗透到LNs中(图4h),并广泛与DC相互作用。
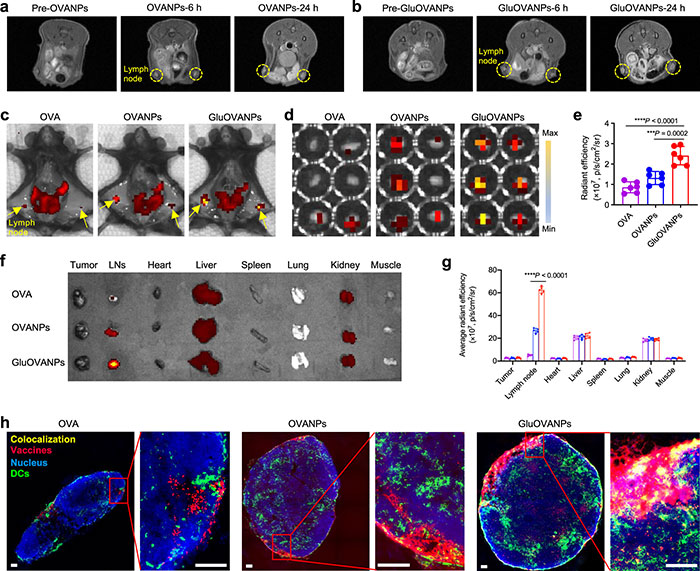
图4. GluOVANPs将抗原传递给LNs。(a, b)接种后腹股沟LNs(黄色圆圈)累积OVANPs(a)和GluOVANPs(b)的MR图像;(c−e)接种24小时后小鼠(c)和腹股沟LNs(d)中Cy5标记的OVA、OVANPs和GluOVANPs的IVIS图像显示,GluOVANPs在LNs中的积累最高(e);(f、g)代表性IVIS图像显示Cy5标记的OVA、OVANPs和GluOVANPs在LNs、肿瘤和主要器官中的生物分布(f),GluOVANPs在LNs中的积累最高;(h)腹股沟LN切片的代表性荧光图像显示GluOVANPs(红色)与DCs(绿色)明显共定位(黄色)
(4)GluOVANPs将抗原传递到LNs中的DC并在体内引发强烈的免疫反应
为了研究体内树突状细胞(DC)的靶向行为,免疫标记和流式细胞术分析表明C57BL/6小鼠淋巴结(LNs)中的DC表达Glut-1(图5a),结果表明GluOVANPs能够靶向这些细胞,并且被DC摄取的量显著高于其他处理组(图5b)。进一步分析表明,与其他疫苗(如OVANPs)和免疫细胞(如巨噬细胞)相比,GluOVANPs在DC的细胞摄取水平高达76.50%(图5c),说明糖基化的纳米疫苗能显著改善抗原在LNs中的递送(图5c)。此外,与PBS、OVA和OVANPs相比,GluOVANPs接种小鼠在LNs中表达CD86+CD80+ CD11c+成熟DC的百分比和CD11c+SIINFEKL-H-2Kb+抗原交叉表达DC的百分比最高(图5d-g)。GluOVANPs接种小鼠的脾细胞中分泌IFN-γ的CD8+ T细胞百分比和血液中IFN-γ的水平也显著高于OVA和OVANPs接种小鼠(图5h-i)。经过三次免疫后,GluOVANPs在脾脏中产生的中枢记忆T细胞(TCM)和效应记忆T细胞(TEM)数量最多(图5j-k),显示出强烈的全身免疫反应和免疫记忆,这对肿瘤的免疫治疗非常重要。
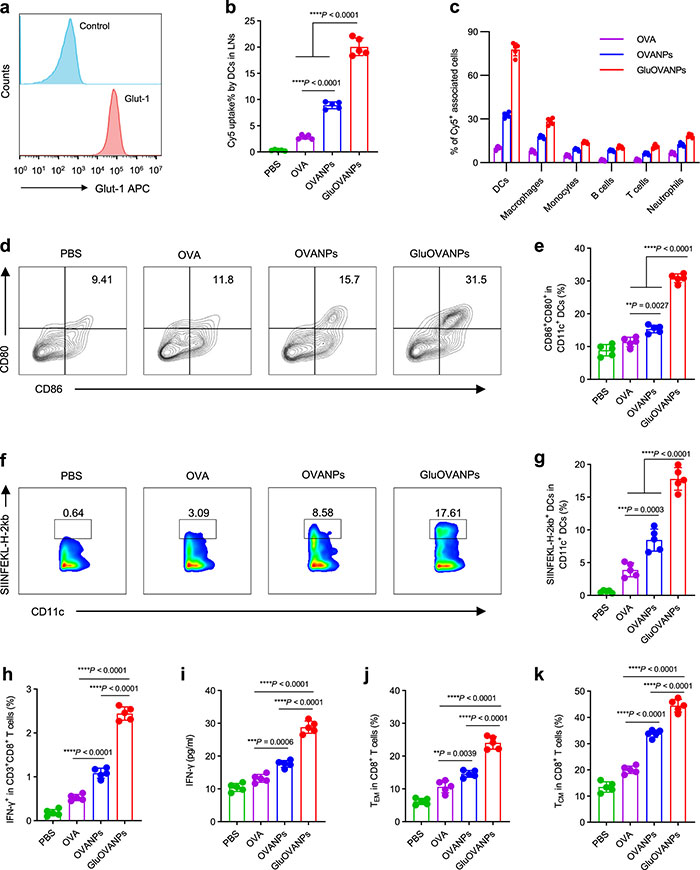
图5. GluOVANPs将抗原传递给LNs中的DC,在体内引发强烈的免疫反应。(a)代表性流式细胞术直方图显示Glut-1在LNs的DC上表达;(b)细胞内DC摄取的Cy5标记的OVA、OVANPs和GluOVANPs的定量测定,DC用抗CD11c-FITC标记;(c)B细胞、T细胞、DC细胞、单核细胞、中性粒细胞和巨噬细胞对Cy5标记的OVA、OVANPs和GluOVANPs的相对细胞摄取;(d, e)代表性流式细胞术直方图(d)和结果(e)显示,接种后GluOVANPs诱导DC成熟的比例最高;(f, g)代表性流式细胞术直方图(f)和结果(g)显示,GluOVANPs在免疫后的LNs中诱导抗原交叉呈递DC的比例最高;(h)免疫后再刺激脾细胞中分泌IFN-γ的CD8+ T细胞百分比;(i)免疫后小鼠血清IFN-γ水平;(j, k)三次免疫后第7天脾脏(CD3+CD8+门控)中TEM(j)和TCM(k)的百分比
(5)GluOVANPs在体内预防和抑制黑色素瘤
按照图6a的时间线和处理流程,包括小鼠的免疫时间和肿瘤接种时间,建立动物模型。结果如图6b-d所示,GluOVANPs处理组肿瘤生长速度最低,存活率最高,其他处理组小鼠均死亡。进一步评估根除已建立肿瘤的免疫治疗效果,结果表明,与Montanide ISA-51+Poly(I:C)+OVA或OVA免疫的动物相比,OVANPs和GluOVANPs免疫的动物肿瘤生长速度更低,存活时间更长(图6f-g)。尤其接种GluOVANPs的小鼠肿瘤明显更小,47天存活率(66.7%)更高(图6h)。这些结果表明,接种GluOVANPs可以有效地消融现有肿瘤,延长体内生存期。
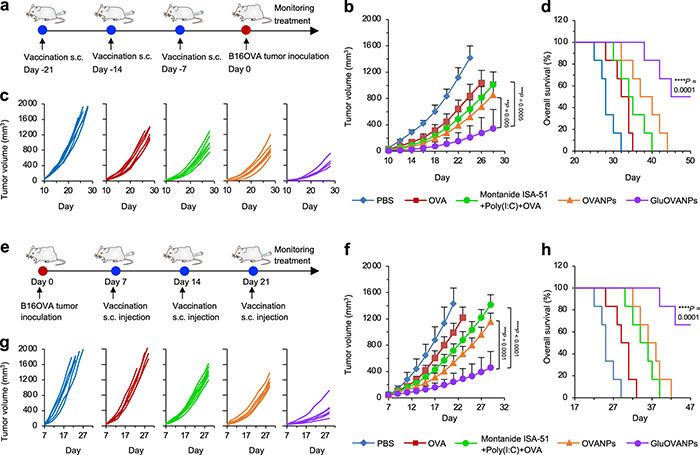
图6. GluOVANPs在体内预防和抑制黑色素瘤肿瘤生长。(a)预防B16OVA肿瘤的疫苗接种计划;(b−d)B16OVA黑色素瘤肿瘤的平均(b)和个体(c)肿瘤生长曲线,以及不同处理后免疫小鼠的生存曲线(d);(e)治疗B16OVA肿瘤的疫苗接种计划;(f−h)接种OVA、Montanide ISA-51+Poly(I:C)+OVA、OVANPs或GluOVANPs免疫小鼠的B16OVA肿瘤平均(f)和个体(g)肿瘤生长曲线和存活曲线(h)
(6)GluOVANPs在巨噬细胞缺失和DC缺失动物模型中的免疫治疗评价
在巨噬细胞缺失小鼠模型中,GluOVANPs与OVANPs的免疫治疗效果和在未进行巨噬细胞缺失相似,表明巨噬细胞的缺失对疫苗的治疗效果影响较小。然而,在DC缺失小鼠模型中,无论是GluOVANPs还是其他疫苗,其治疗效果几乎完全丧失。这表明GluOVANPs主要通过作用于树突状细胞(DC)发挥其治疗作用(图7)。因此,DC是GluOVANPs及其他类似疫苗实现有效治疗的关键细胞类型。
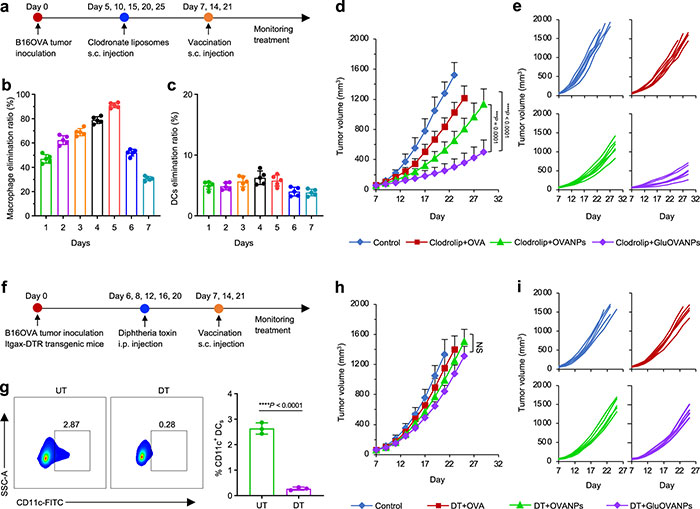
图7. GluOVANPs用于巨噬细胞缺失和DC缺失动物模型中黑色素瘤的体内免疫治疗。(a)免疫治疗巨噬细胞缺失小鼠B16OVA肿瘤的疫苗接种方案;(b, c)第0天一次性皮下注射氯膦酸脂质体后巨噬细胞(b)和DC(c)的消除率;(d, e)分别免疫OVA、OVANPs或GluOVANPs后巨噬细胞缺失小鼠B16OVA肿瘤的平均(d)和个体(e)肿瘤生长曲线;(f)在DC缺失的Itgax-DTR转基因小鼠中治疗已建立的B16OVA肿瘤的疫苗接种方案;(g)腹腔注射DT对DCs的消耗,未治疗的小鼠作为对照;(h, i)分别免疫OVA、OVANPs或GluOVANPs后DC缺失小鼠B16OVA肿瘤的平均(h)和个体(i)肿瘤生长曲线
(7)GluNeoNVs用于肿瘤免疫治疗
该研究利用GluNeoNVs递送新抗原Adpgk,并与传统纳米疫苗(neonv)进行比较(图8a)。结果显示,GluNeoNVs(gluneonv)在肿瘤引流LNs中的积累明显高于其他疫苗,表明其在转移到LNs时最为有效(图8d)。不同疫苗处理后小鼠肿瘤的生长速度,结果表明neonv和gluneonv组的肿瘤生长速度较低,其中gluneonv组的肿瘤明显更小(图8f-g)。免疫分析进一步确认,GluNeoNVs能够显著增加分泌IFN-γ的CD8+ T细胞数量,增强了对肿瘤的免疫反应。这些结果表明,GluNeoNVs在新抗原递送和肿瘤免疫治疗中具有较好的应用前景。
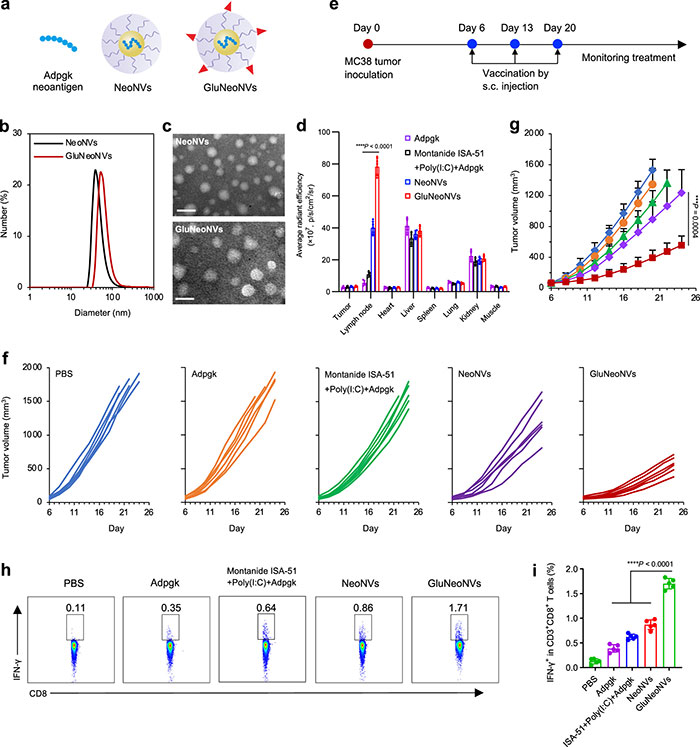
图8. 新抗原递送GluNeoNVs用于结肠肿瘤的免疫治疗。(a)示意图显示新抗原(Adpgk)、NeoNV和GluNeoNV,葡萄糖(红色三角形)被偶联到纳米疫苗的PEG外壳上;(b, c)DLS(b)和TEM(c)图像显示,NeoNV和GluNeoNV是单分散的,比例尺为50 nm;(d)Cy5标记Adpgk、Montanide+Poly(I:C)+Adpgk、NeoNV和GluNeoNV生物分布的定量结果;(e)治疗MC38结肠肿瘤的疫苗接种计划;(f, g)新抗原疫苗免疫小鼠MC38结肠肿瘤的平均(g)和个体(f)肿瘤生长曲线;(h, i)接种新抗原疫苗后脾脏中分泌IFN-γ的CD8+ T细胞的流式细胞术图(h)和定量测量(i)
研究小结:
该团队开发了一种多功能糖基化纳米疫苗方法,通过靶向动物和人类树突状细胞(DC)上高表达的Glut-1,实现了有效的抗原递送。与裸抗原和无糖基配体的常规纳米疫苗相比,这种糖基化纳米疫苗引发了更强的免疫应答,显著提高了抗肿瘤效果和生存率。研究表明,Glut-1是一个可靠的抗原递送靶点,因为它在各种类型的DC上广泛表达并且在DC激活过程中上调。有效的抗原递送能够增强免疫反应,尤其是在肿瘤治疗中表现出良好的效果。体内实验进一步验证了糖基化纳米疫苗通过DC的高选择性和有效性,为DC靶向抗原递送和免疫治疗提供了一个实用的方法。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

