
研究背景:
创伤性脑损伤(TBI)是全球致死致残的主要疾病,其继发性损伤导致的恶劣病理微环境与神经再生能力低下,严重制约了现有干细胞、生物材料等疗法的效果。神经干细胞(NSC)移植虽被视为再生医学的重要方向,却面临三大核心瓶颈:急性炎症风暴抑制移植细胞存活、病理微环境阻碍功能整合、以及NSC分化机制不明缺乏精准调控。传统生物材料支架仅能被动支持,无法主动调控免疫微环境与电生理信号,难以满足神经-免疫协同修复的需求。因此,开发集免疫调控、电刺激与干细胞支持于一体的多功能平台,成为突破TBI治疗瓶颈的迫切需求。

针对上述难题,北京基础医学研究所周瑾、王常勇团队与山东大学刘宏教授合作,设计了一种自供能、可降解的“免疫压电转导器”(ACHP)。该器件通过聚多巴胺(PDA)涂层清除ROS并诱导小胶质细胞M2抗炎极化,重塑损伤区免疫微环境;同时利用各向异性纳米纤维素压电骨架在超声激发下产生2–4 V无线局域电刺激,经PI3K-Akt通路精准促进NSC分化为功能性神经元并增强突触形成。这种“免疫调控-电刺激-干细胞支持”三模态协同策略,在TBI大鼠模型中使损伤面积缩小超60%、学习记忆能力恢复超60%,为脑部创伤的微创高效治疗提供了可临床转化的新范式。该研究于2025年10月以《Neuroimmune Microenvironment Reprogramming via Immuno‐piezoelectric Transducers for Synergistic Stem Cell Therapy in Traumatic Brain Injury》为题发表于《Advanced Materials》(DOI: 10.1002/adma.202512810)。
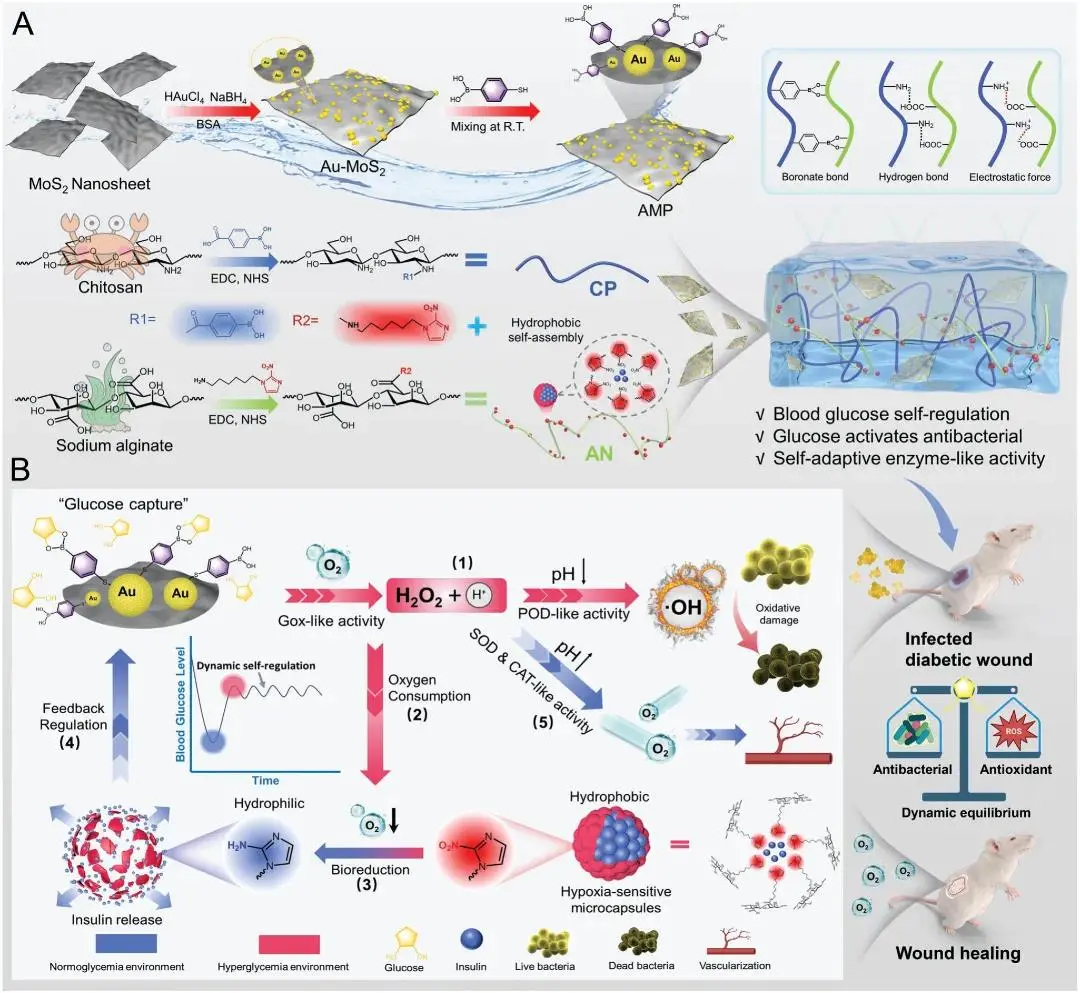
图1 用于神经分化和再生的免疫压电换能器的示意图。免疫压电换能器由各向异性压电纳米纤维素、抗炎 PDA 涂层和 NSCs 组成,通过外部可编程超声激活,产生无线电刺激信号,促进 NSCs 的分化和发育。其抗炎特性改善了受损的免疫微环境,提高了 NSCs 对 TBI 的治疗效果
(1)免疫压电换能器的构造和表征
图2A流程所示,将滤纸溶于LiOH/尿素低温体系得2 wt%纤维素溶液,按ECH/AGU摩尔比1.5交联后预拉伸120%,再经1 wt% H₂SO₄定型,得到各向异性纤维素水凝胶ACH;随后浸泡于2 mg mL-1多巴胺-Tris(pH 8.8)2 h,原位聚合55 nm PDA层,得ACHP。SEM(图2B、C)显示ACH表面沿拉伸方向形成取向纳米纤维;EDS元素分布(图2D)证实C、O、N均匀共存。拉伸曲线(图2E)记录ACH断裂应变49.6%、模量4.2 kPa,PDA修饰后断裂应变回升至67%,100次10–20%循环后残余强度>90%(图2F)。FTIR(图2G)3346、1147、1017 cm⁻¹峰强度下降,XPS(图2H–J)出现398.5、399.7、401.3 eV氮信号,证实PDA与纤维素形成C–N、氢键及π–π交联。XRD(图2K)20.6°峰增强,DSC(图2L)熔融焓升至99.89 J g-1,SAXS(图2M)90°方位出现尖锐赤道条纹,表明预拉伸120%使纤维素(110)/(200)晶面取向度最高,后续实验均固定该参数。
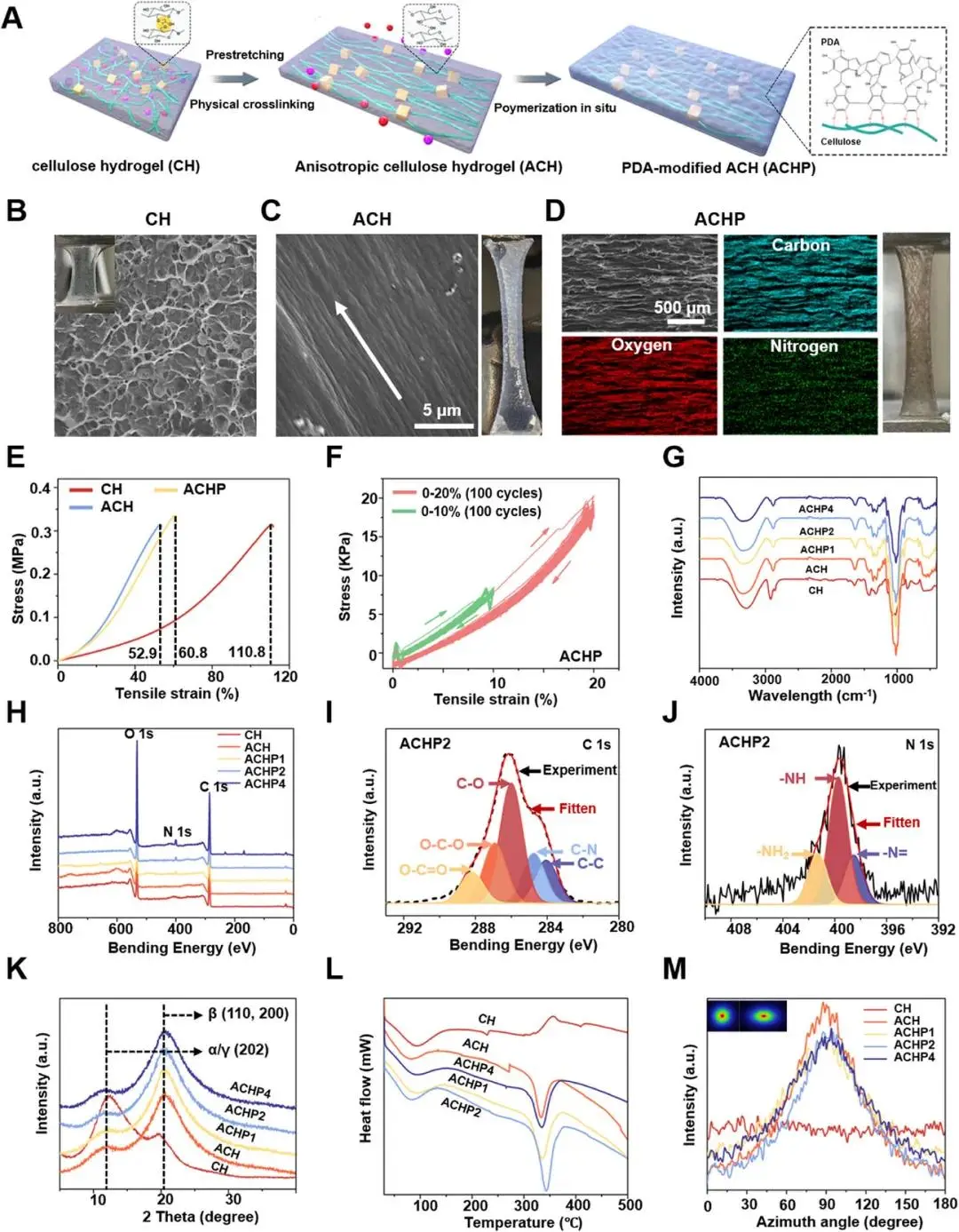
图2 免疫压电水凝胶表征:(a)各向异性凝胶制备示意图;(b)CH多孔SEM图;(c)ACH取向纤维SEM,箭头示方向;(d)ACHP的C、O、N元素分布;(e)应力-应变曲线;(f)ACHP循环疲劳;(g)FTIR;(h)XPS全谱;(i-j)ACHP的C1s、N1s峰;(k)XRD;(l)DSC;(m)SAXS方位积分强度,内插2D图显示ACH赤道条纹各向异性
(2)PDA 增强 ACH 的压电性能、稳定性及其机理
在20 kHz、400 W超声激发下,CH、ACH、ACHP输出开路电压分别为0.5 V、1 V、1.5 V(图3A)。PFM相位-振幅图像(图3B)与±10 V蝴蝶曲线(图3C)显示ACHP滞后面积最大,局部压电响应最高。XRD β相峰拟合表明ACH经120%拉伸后β相比例提高至CH的3倍,而PDA修饰未显著改变晶相比例。紫外-可见漫反射测得ACHP带隙由3.48 eV降至1.7 eV,VB-XPS给出其导带−0.95 eV、价带0.75 eV,均高于ACH(−2.22 eV/1.26 eV),促进超声生载流子分离(图3E、F)。CV曲线(图3G)中ACHP出现两对可逆氧化还原峰,积分面积显著增大,表明PDA的醌-酚羟基提供电荷储存与快速传输通道;7 d连续超声后ACHP输出电压保持率>95%,而ACH降至60%(图3H)。d33测试显示ACH 3.7 pC N⁻¹,ACHP进一步提高至4.8 pC N⁻¹(图3I)。水下超声强度0–600 W线性调控ACHP输出2–4 V无线脉冲,400 W时峰值约2.5 V(图3J);大鼠颅骨内植入后在2 W cm⁻²、1 MHz超声下记录到约0.4 V稳定信号(图3K)。
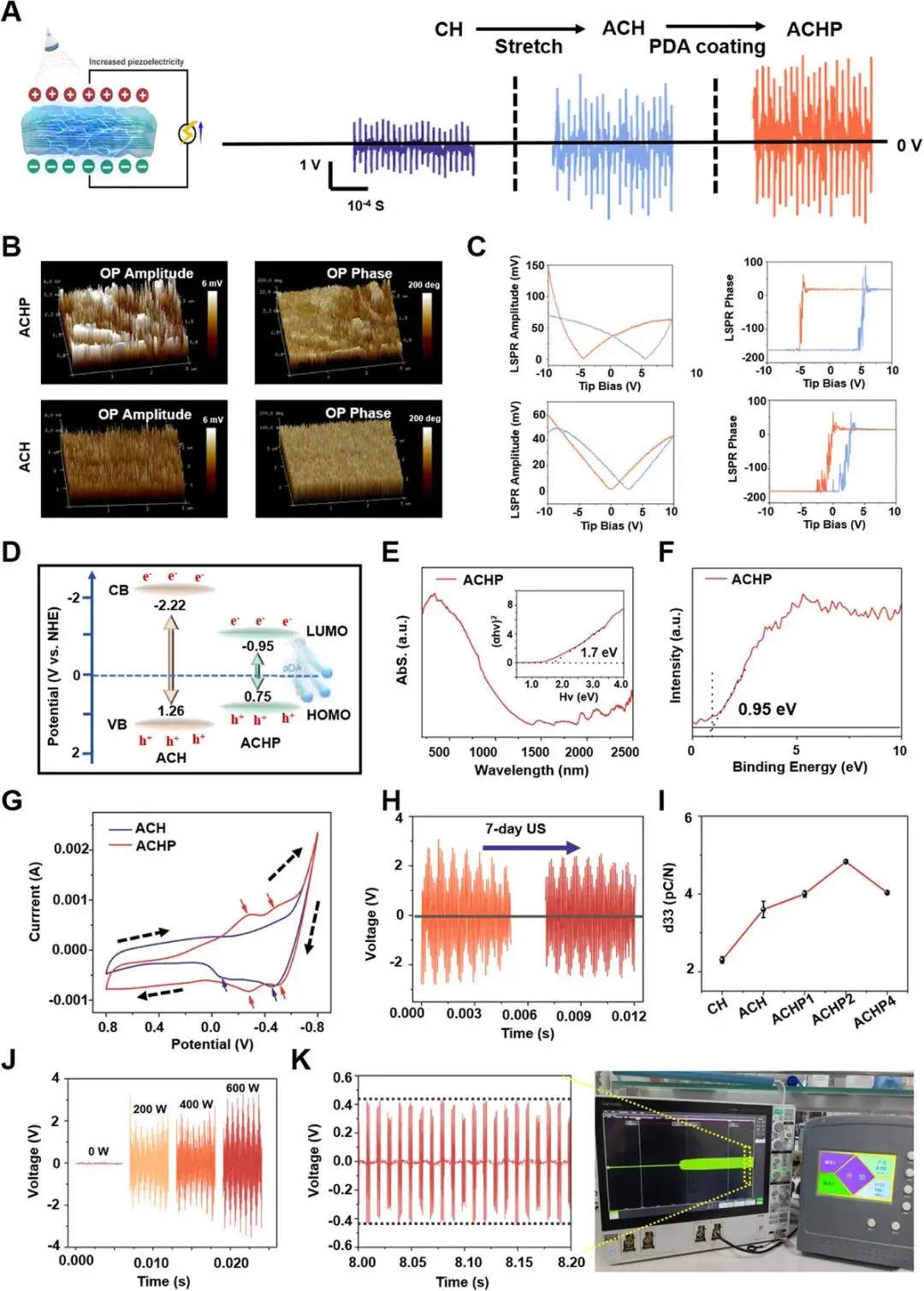
图3 PDA提升ACH压电性能与稳定性:(a)超声激发下CH、ACH、ACHP开路电压依次约0.5、1、1.5 V;(b)PFM相位-振幅图;(c)±10 V蝴蝶曲线示ACHP滞后最大;(d)PDA增强机制示意;(e)UV-Vis漫反射;(f)VB-XPS;(g)CV氧化还原峰;(h)7 d连续超声后ACHP输出保持>95%;(i)d33由3.7 pC N⁻¹升至4.8 pC N⁻¹;(j)超声功率0–600 W线性调控输出2–4 V,400 W时约2.5 V;(k)大鼠颅内植入2 W cm⁻²超声实时输出约0.4 V
(3)免疫压电换能器的抗氧化和抗炎特性
DPPH与ABTS实验(图4A、B)显示10 mg mL⁻¹ ACHP自由基清除率约80%,显著高于CH与ACH;超声处理1 d与3 d后ACHP提取液ABTS清除能力持续上升,表明PDA组分为主要抗氧化来源(图4C)。200 μM H₂O₂刺激神经元3 d后,DHE与DCFH-DA荧光(图4D–F)在ACHP组分别下降约65%与60%,验证体外ROS清除效果。qRT-PCR(图4G、H)显示LPS激活的BV2小胶质细胞经ACHP处理后IL-1β与IL-6 mRNA表达下调>50%。免疫荧光(图4I;图S15)定量表明ACHP表面CD16/32(M1)信号减弱,CD206(M2)信号增强,M2比例与单独PDA涂层对照相当,证实PDA驱动小胶质细胞向抗炎表型极化。
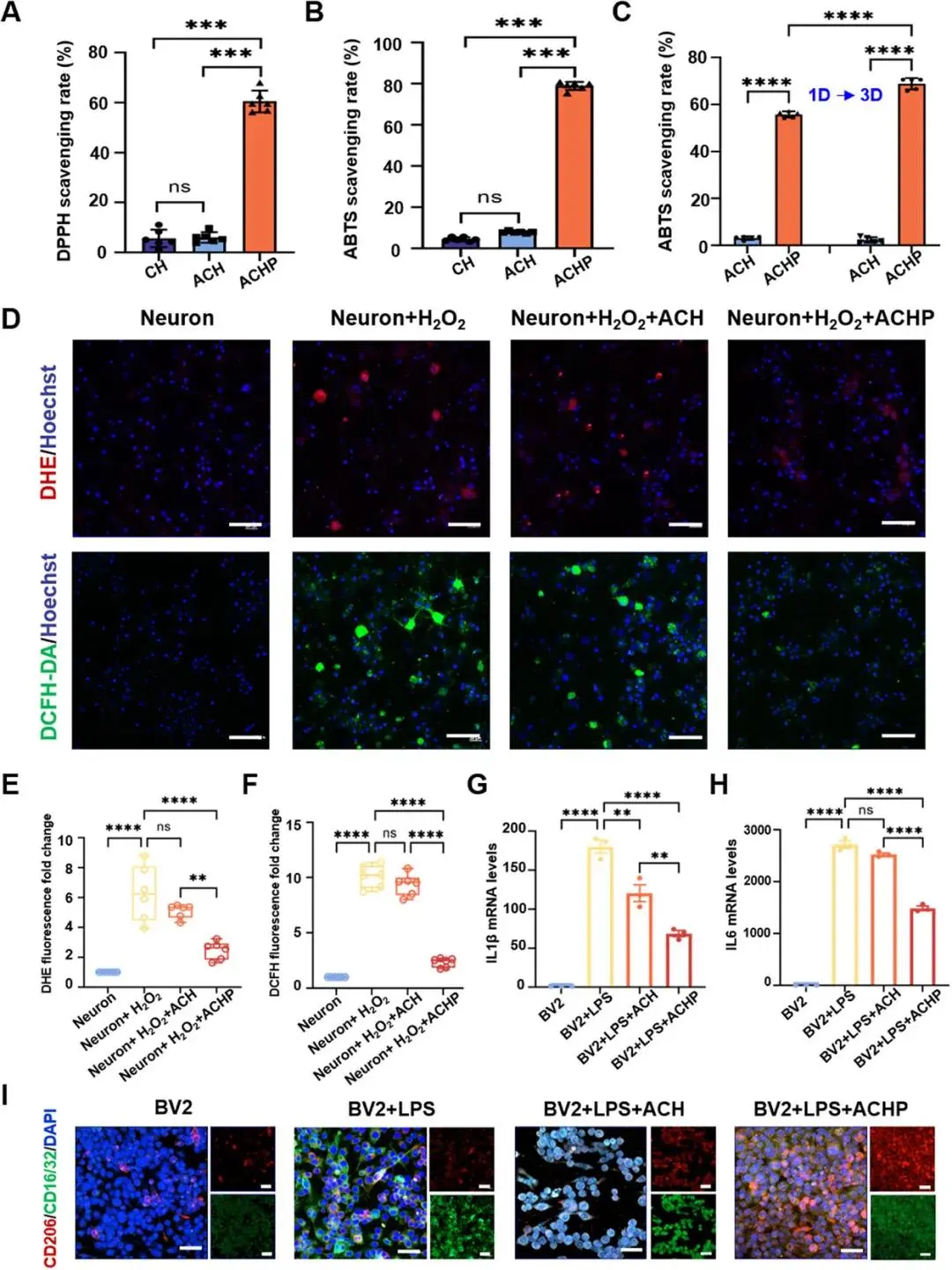
图4 双模水凝胶体外抗氧化与抗炎:(a-b)DPPH/ABTS测ROS清除率,10 mg mL⁻¹ ACHP达80%;(c)超声1-3 d提取液ABTS活性持续;(d)H₂O₂氧化模型,ACHP使DHE、DCFH-DA荧光显著降低,标尺50 µm;(e-f)定量ROS水平;(g-h)qRT-PCR示LPS刺激后IL-1β、IL-6 mRNA下调;(i)免疫荧光示CD206⁺ M2极化增加、CD16/32⁺ M1减少
(4)压电换能器通过 PI3K-Akt 信号通路促进 NSCs 的分化和发育
图5A所示,NSCs接种后第0天换分化培养基并施加400 W超声(20 kHz,每日2次,7天)。免疫荧光显示,第7天ACHP组MAP2阳性率显著高于NSC与ACH组,第14天Neun阳性率继续保持最高(图5B)。亚型标记结果,第7天ACHP组VGAT(GABA能)与VGLUT1(谷氨酸能)荧光强度均显著上升,第14天VGLUT1进一步升高而VGAT下降,提示向兴奋性神经元倾斜(图5C)。Tuj1重构与Sholl分析(图5D-F)表明ACHP组轴突长度≈360 μm,最大分支数37,分别为ACH的3.6倍和2.5倍。F-actin/Phalloidin共染(图5G-I)显示ACHP组树突棘密度2.43 ± 0.9/10 μm,双倍于ACH组。RNA-seq K-means聚类(图5J)与Venn图(图5K)显示ACHP-vs-NSC差异基因25个,显著富集“PI3K-Akt信号通路”、“神经活性配体-受体相互作用”等(图5M)。上调基因包括TNC、CACNA1B、Gabbr2、CALB1(图5L)。加入PI3K-Akt/mTOR双抑制剂BEZ235后,Tuj1与MAP2表达显著下降(图5N),Akt抑制剂P529特异性降低MAP2,证实PI3K-Akt为电刺激促分化的必要通路。
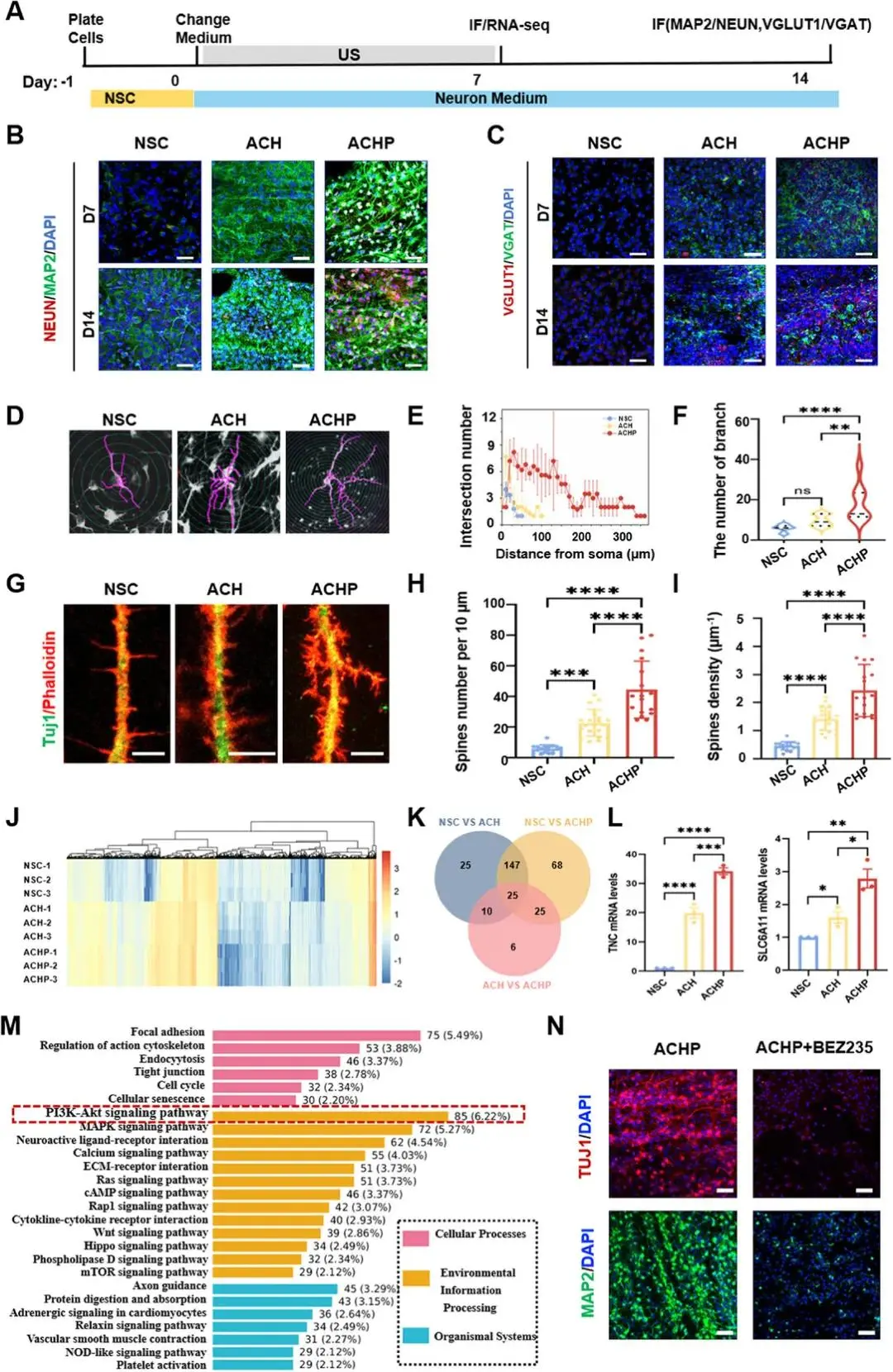
图5 NSC分化与机制:A) 实验时程:-1 d接种,0 d换神经元培养基,超声刺激至7 d,7/14 d取样;B-C) 7/14 d免疫荧光:ACHP组Neun、MAP2、VGLUT1表达最高,VGAT降低,标尺50 µm;D-F) Neurolucida重建示ACHP神经元轴突长度≈360 µm、分支37,Sholl复杂度最高;G-I) 7 d Tuj1/Phalloidin显示ACHP树突棘密度2.43±0.9/10 µm,翻倍于对照,标尺5 µm;J-L) RNA-seq K-means聚类、Venn与差异基因热图显示ACHP上调神经分化基因(TNC、CACNA1B等);M) KEGG富集“PI3K-Akt”等通路;N) BEZ235抑制PI3K-Akt后Tuj1、MAP2表达下降
(5)免疫压电换能器在体内抑制炎症并促进 NSC 分化
图6A时间线显示,TBI建模24 h后于伤腔注入4×10⁵ GFP-NSC,随后贴附ACHP并连续7 d给予2 W cm⁻²、1 MHz超声;3 d与28 d取材。Cy5.5标记证实PDA可在脑组织内扩散。3 d DHE染色显示TBI、NSC、NACH组ROS荧光强度维持高位,NACHP组降至最低(图6B)。JC-1/CD206双标显示NACHP组JC-1红/绿聚集体比值升高,CD206⁺ M2型小胶质细胞数量显著增加(图6C)。ELISA测得NACHP组IL-10、IL-4含量分别比NACH组提高1.8倍与2.1倍(图6D、E)。Iba1/GFAP免疫荧光显示NACHP组3 d时活化小胶质细胞与星形胶质细胞突起长度均显著缩短。28 d MAP2/Neun染色显示NACHP组GFP⁺/MAP2⁺与GFP⁺/Neun⁺细胞比例分别为NSC组的2.4倍与2.6倍(图6G–I)。
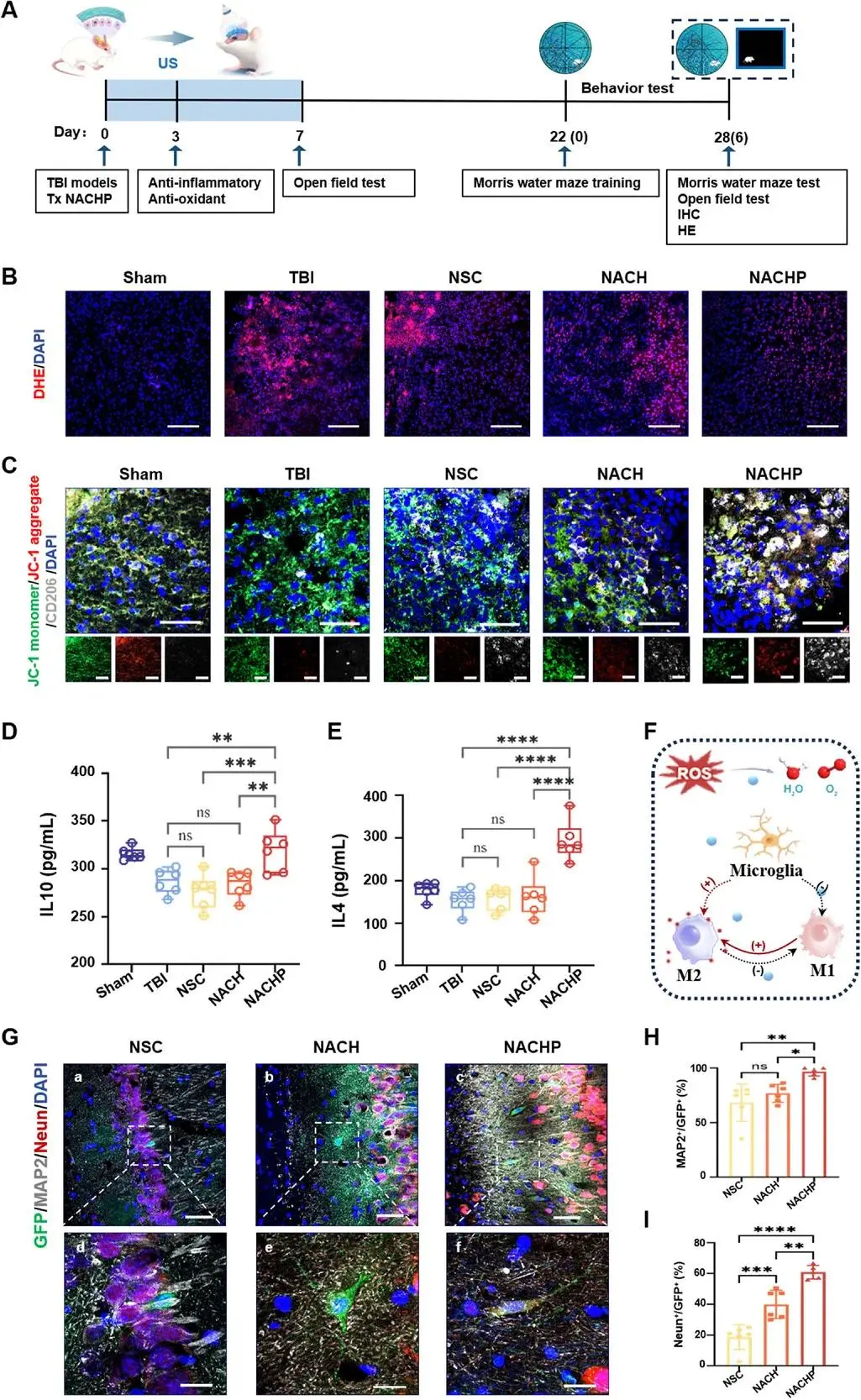
图6 免疫压电转导器改善TBI早期免疫微环境并促进外源NSC向神经元分化:(a)实验时间线示意TBI建模、NSC移植、NACH/NACHP治疗及行为学评估,Day1-7超声刺激;(b)DHE染色显示NACHP组ROS水平最低,标尺100 µm;(c)JC-1红/绿比与CD206共标表明NACHP提高M2型小胶质细胞线粒体膜电位,标尺50 µm;(d-e)ELISA测脑组织IL-10、IL-4浓度,NACHP组显著升高,n=6;(f)无线免疫调控压电转导器改善微环境示意;(g)28 d损伤周边MAP2/Neun免疫荧光示NACHP新生神经元最多,标尺50/20 µm;(h-i)MAP2⁺/GFP+与Neun⁺/GFP⁺定量均显示NACHP组较NSC、NACH显著提高,n=6
(6)带有 NSC 的免疫压电换能器可改善 TBI 结构、功能和行为
术后28 d脑片H&E(图7A)显示NACHP组损伤空洞面积最小,依次为TBI>NSC>NACH>NACHP≈Sham。SYN/PSD95免疫荧光(图7B)定量表明NACHP组突触前、后蛋白阳性率分别提高2.1倍与1.9倍。全细胞 patch-clamp(图7C)记录到NACHP组10个GFP+移植细胞中有3个可诱发电位、1个检测到EPSC,其余组无反应。mNSS运动评分(图7D)在14 d内NACHP组下降最快,28 d时接近Sham水平。开场实验(图7E、F)中心区域移动距离NACHP组于28 d恢复至Sham的92%,显著高于TBI、NSC及NACH组。Morris水迷宫(图7G-L)5 d训练中NACHP组逃逸潜伏期缩短最显著;第6天无平台探测显示其目标象限停留时间、穿越平台次数及路径效率均提高≥2倍,记忆功能恢复≥60%。主要脏器H&E未见异常,证实材料体内安全性。
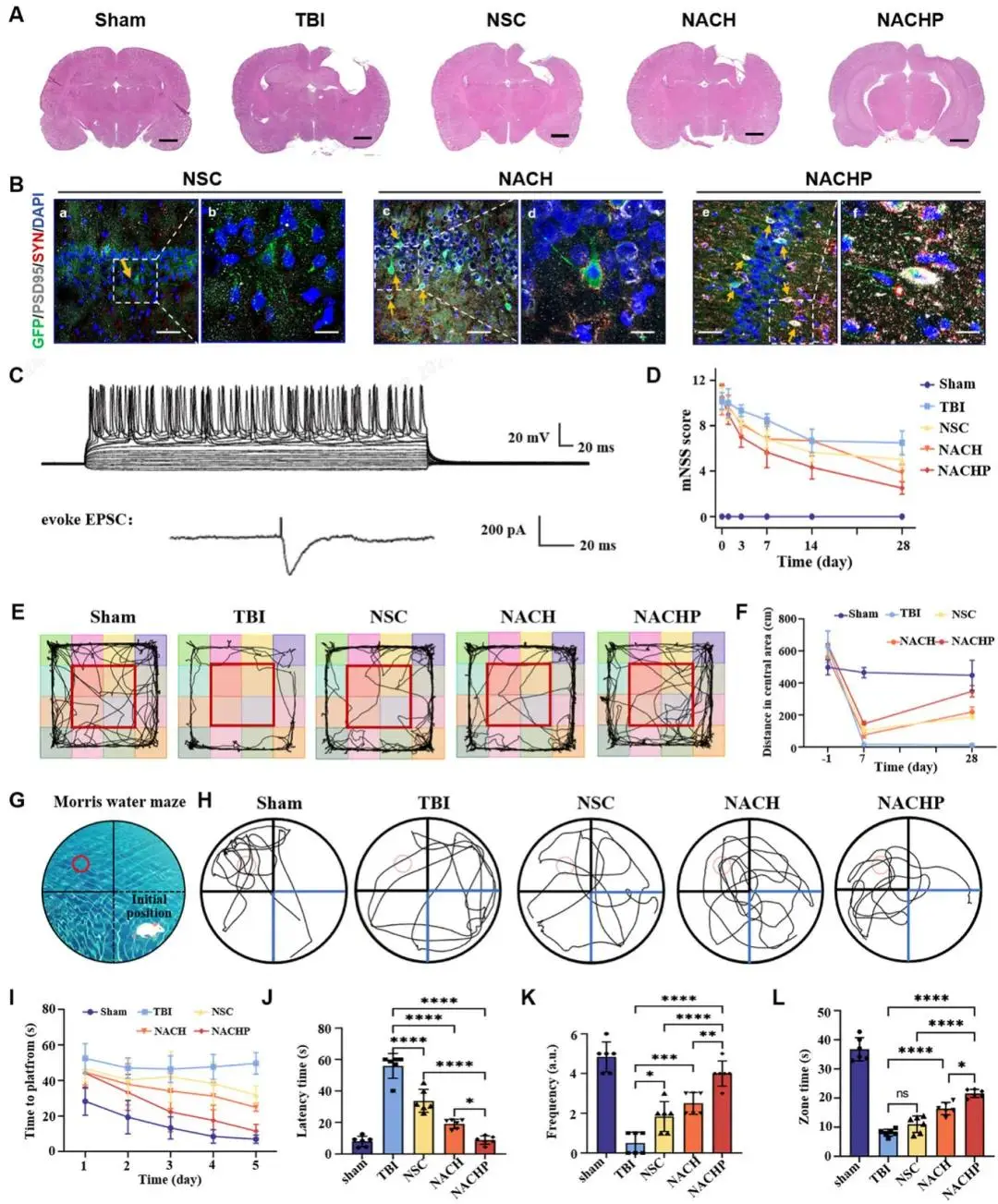
图7 NACHP促进TBI大鼠结构、功能与行为恢复:(a)H&E冠状脑片示NACHP组空洞最小,标尺1000 µm;(b)28 d SYN/PSD95免疫荧光示NACHP突触蛋白表达最高,标尺50/20 µm;(c)patch-clamp记录移植细胞动作电位与EPSC;(d)14 d mNSS评分NACHP下降最快;(e-f)开场中心移动距离28 d恢复至Sham 92%;(g)水迷宫示意图;(h)游泳轨迹显示NACHP路径最短;(i)5 d平台潜伏期显著缩短;(j-l)第6天探查测试潜伏期减半、穿越频次与目标象限停留时间均增≥2倍,记忆恢复≥60%,n=6,*P<0.05,**P<0.01,***P<0.001,****P<0.0001
该研究构建了一种基于纳米纤维素骨架、表面原位聚合聚多巴胺(PDA)的可降解免疫-压电转导器(ACHP),通过20 kHz超声触发实现2–4 V无线局域电刺激,协同PDA清除ROS并诱导小胶质细胞M2型极化,形成"免疫-电信号"双向调控。体外实验表明,ACHP显著激活PI3K-Akt通路,使神经干细胞(NSCs)向谷氨酸能与GABA能神经元分化率提升2倍以上,轴突长度增至360 µm,树突棘密度翻倍。在大鼠创伤性脑损伤(TBI)模型中,ACHP贴附损伤区28天后,空洞面积缩小超60%,突触蛋白SYN/PSD95表达提高2倍,移植细胞功能成熟并记录到动作电位与兴奋性突触后电流(EPSC);神经功能缺损评分(mNSS)、自发探索行为及Morris水迷宫记忆指标恢复至正常水平90%以上,同时显著促进组织上皮化与血管生成。该策略通过自供能、可降解及多模态协同机制,为慢性脑损伤提供了一种微创高效的再生修复新途径。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

